DCE-MRI定量参数对前列腺癌内分泌治疗的疗效评价
2017-11-28顾伟光赵文露杨毅沈钧康钱林清武江芬
顾伟光, 赵文露, 杨毅, 沈钧康, 钱林清,武江芬
·腹部影像学·
DCE-MRI定量参数对前列腺癌内分泌治疗的疗效评价
顾伟光, 赵文露, 杨毅, 沈钧康, 钱林清,武江芬
目的回顾性分析前列腺癌(PCa)内分泌治疗前后DCE-MRI定量参数的变化,探讨DCE-MRI定量参数作为分析指标在用于PCa内分泌治疗后疗效监测的价值。方法收集经病理学证实的33例PCa患者的临床和影像资料。测量定量参数:转运常数(Ktrans)、血管外细胞外间隙体积百分数(Ve)和速率常数(Kep)在内分泌治疗前后癌区的各参数值和血清PSA水平,对前后间参数变化的差异作统计学分析,并探讨DCE-MRI定量参数变化与PSA值变化之间的相关性。结果治疗前癌区的Ktrans(3.2502±1.46)×10-3min-1、Kep(2.3341±1.59)×10-3min-1、Ve 1.1.7475±0.87、PSA (59.9054±37.15)μg/L,治疗后癌区的Ktrans(2.1873±1.19)×10-3min-1、Kep(1.0325±0.68)×10-3min-1、Ve 2.0512±0.75、PSA (2.4831±3.93)μg/L;,其中癌区Ktrans、Kep值、PSA值在治疗前后间的差异均有统计学意义(Plt;0.05),而Ve在治疗前后间的差异没有统计学意义(Pgt;0.05)。Spearman相关分析显示癌区治疗前后DCE-MRI的参数变化与PSA值变化无相关性(Pgt;0.05)。结论DCE-MRI的定量参数Ktrans、Kep在PCa内分泌治疗后发生变化,可用于临床PCa内分泌治疗的疗效监测,可作为临床PCa疗效检测指标PSA的补充。
前列腺肿瘤; 扩散加权成像; 磁共振成像; 动态增强; 内分泌治疗
前列腺癌(prostate cancer,PCa)是常见的男性泌尿生殖系统恶性肿瘤。PCa内分泌治疗后的疗效评估监测尤为重要。PSA是疗效判断的重要指标,但不是特异性标记物 ,且不能完全反映治疗后肿瘤组织学和生物学变化[1]。因此,在PCa患者长期随访中,PSA需联合其他检查,以提高对肿瘤的监测效能。动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)检查反映的是肿瘤的血管特征。本研究的目的是通过回顾性分析前列腺癌在内分泌治疗前后DCE-MRI定量参数的变化及其与PSA值变化的相关性,评价DCE-MRI定量参数对PCa内分泌治疗疗效监测与评估的价值。
材料与方法
1.病例资料
搜集2010年5月-2015年2月苏州大学附属第二医院的PCa患者的病例资料。入组标准:病例经穿刺活检病理证实为PCa;仅用内分泌进行治疗,并经临床确认治疗有效;治疗前后均行常规MRI检查和PSA检测,且两种检查时间间隔不超过4周。排除标准:临床治疗无效;缺乏前后完整PSA监测数据,两种检查间隔时间大于4周。最终入组33例患者,年龄57~86岁,平均72岁。临床症状:血尿28例,关节疼痛11例,尿频、尿急30例,无明显不适3例。
2.临床内分泌治疗方法及疗效评价标准
前列腺癌内分泌治疗方法主要为抗雄激素治疗,包括雄激素受体拮抗剂和/或促性腺激素释放激素类似物,以达到血清睾酮去势水平标准的治疗。入组的33例PCa患者均选择内分泌抗雄激素治疗,治疗药物包括:①抑那通(Enantone),3.75 mg皮下注射,每28天注射一次,终身注射治疗;②氟他胺(Flutamide):口服片剂,250 mg/次,3次/天。药物治疗的副作用有性欲减退、阳痿、乳腺发育女性化、睾丸萎缩、恶心呕吐、发热潮红、肝功能损伤等。抗雄激素治疗后复发者同时加用抗肿瘤药物多西他赛和强的松进行治疗。
根据中国泌尿外科疾病诊断治疗指南(2014版),临床常用PCa内分泌治疗的疗效评价标准:①治疗后血清PSA存在不同程度的下降,提示治疗有效;②B超、CT或MRI提示前列腺体积缩小或无增大;核素骨扫描提示转移灶缩小,或核素浓聚程度降低,提示病情稳定或好转;③临床症状改善,提示治疗有效。反之判定PCa复发进展,应该具备以下条件:①血清睾酮水平达去势程度(lt;1.7 nmol/L);②间隔1周,连续三次PSA值上升,较治疗后的最低值升高gt;50%的视为去势抵抗性前列腺癌(castrate-resistant prostate cancer,CRPC),即生化复发。
3.血清PSA值检测方法
采用Bayer ACS180 PLUS全自动化学发光免疫分析仪双抗体夹心磁微粒化学发光法进行检测。
4.MRI检查
采用Philips intera achieva 1.5T双梯度超导型全身MR成像系统,敏感度编码心脏阵列线圈(SENSE)为接收线圈。检查前一天肠道准备,防止直肠内气体对MRI成像产生影响。行MRI检查前嘱患者排空膀胱,以降低尿液流动的影响和磁敏感效应对检查的干扰。T1WI/T2WI扫描参数:前列腺横轴面、矢状面和冠状面TSE-T2WI,扫描范围包括整个前列腺和精囊。盆腔大范围横轴面T1WI、横轴面抑脂T2WI-SPAIR,从髂血管分叉扫描至盆底。DCE-MRI扫描参数:采用3D-T1FFE-WATS序列进行检查,定位与横轴面T2WI保持一致,扫描参数:TR 9.9 ms,TE 5.0 ms,层厚5.2 mm,层间距-2.6 mm,NSA1次,视野400 mm×400 mm,矩阵224×256,扫描范围包括整个前列腺。采用Ulrich高压注射器进行静脉团注对比剂马根维显(0.2 mmol/kg,注射流率2.5 mL/s,对比剂注入前、后分别注入20 mL生理盐水。总扫描时间4~5 min,每期扫描时间10~12 s)。
5.数据采集及图像分析
入组病例MRI资料均采用血流动力学定量分析软件Omni Kinetics进行后处理,计算出定量参数,各参数值均为系统软件自动测出:①Ktrans(转运常数),代表单位时间内每单位体积组织中从血液进入EES的对比剂量,由单位体积的血液流量、管壁渗透性及毛细血管的表面积决定,单位为min-1。②Ve(血管外细胞外间隙体积百分数),代表单位体积组织内EES的体积,取值0~1。③Kep(速率常数):代表单位时间内由EES进入血管的对比剂量,单位为min-1。由两名从事临床前列腺MRI诊断的医师进行分析,在前列腺横轴面显示病灶的最大层面观察病灶T2WI、DWI及DCE-MRI信号特点,结合病理穿刺的部位,参照Hötker等[2]的方法选择兴趣区(ROI)。在DCE-MRI图像上绘制ROIs,尽量避开坏死区域、囊变、出血、钙化、尿道、膀胱、精囊腺、血管神经束等结构,ROIs面积视病灶的大小而定。在治疗后2~29个月(平均8.5个月)用同样方法测量癌区的定量参数,病灶尽量选择在同一层面。本研究搜集癌区定量参数33个。
6.统计分析
采用SPSS 22.0统计学软件进行资料录入分析,所有计量资料采用平均值±标准差进行描述。PCa癌区内分泌治疗前后DCE-MRI各参数变化的比较采用配对样本t检验,以Plt;0.05为差异有统计学意义。对治疗前后癌区定量参数变化与PSA变化的相关性采用Spearman相关性检验。
结果
1.PCa治疗前后MRI表现
PCa内分泌治疗前癌灶T2WI均呈低信号改变,33例PCa病灶增强后均有不同程度强化,表现为早期明显强化(图1)。治疗有效患者的定量参数伪彩图显示渗透性减低(图2)。
2.癌区治疗前后DCE-MRI参数变化
前列腺癌区的Ktrans值、Kep值在治疗后较治疗前减低,且差异有统计学意义(Plt;0.05);而Ve在治疗后较治疗前增加,但差异无统计学意义(Pgt;0.05)。PSA值治疗后较治疗前减低,差异有统计学意义(Plt;0.0001),见表1。Spearman相关性分析显示,治疗前后定量参数变化与PSA值变化间无相关性(Pgt;0.05),见表2。
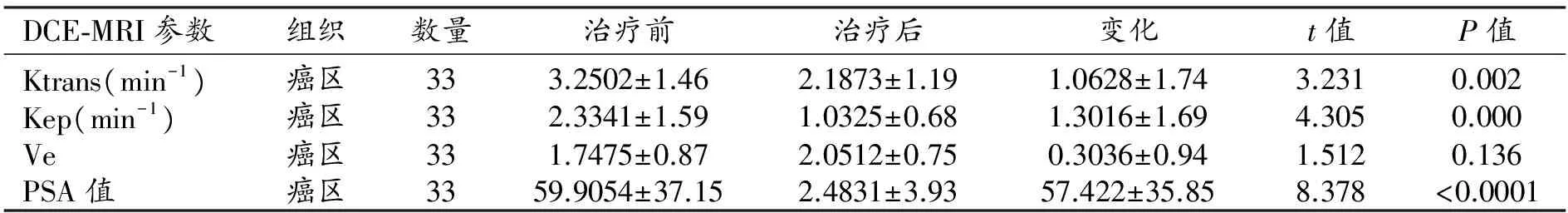
表1 癌区治疗前后DCE-MRI参数变化的统计学分析
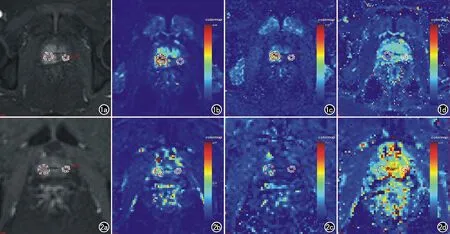
图1 男,82岁,前列腺腺癌,治疗前血清总PSA值13.3ug/L。a)动态增强示中央腺体右侧癌区呈明显强化; b) Ktrans图,测量定量参数Ktrans为2.877×10-3min-1; c) Kep图,测量定量参数Kep为4.914×10-3min-1; d) Ve图,测量Ve为0.590。图2 男,82岁,前列腺腺癌,治疗后血清总PSA值4.65ug/L。治疗后癌区的渗透性较前减低。a) 动态增强示中央腺体右侧癌区强化程度较治疗前减低; b) Ktrans图,测量定量参数Ktrans为2.069×10-3min-1,较治疗前减低; c) Kep图,测量定量参数Kep为1.493×10-3min-1,较治疗前减低; d) Ve图,测量Ve为1.667,较治疗前增高。
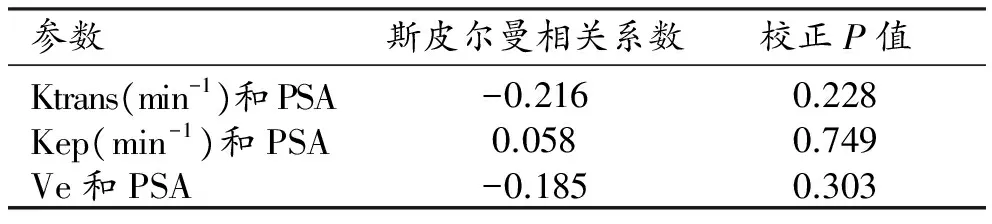
参数斯皮尔曼相关系数校正P值Ktrans(min-1)和PSA-0.2160.228Kep(min-1)和PSA0.0580.749Ve和PSA-0.1850.303
讨论
1.PSA在PCa内分泌治疗疗效评价中的作用
PCa的内分泌治疗主要是通过降低体内雄激素水平和抑制雄激素的作用,从而达到抑制PCa细胞生长,致使癌细胞凋亡的目的。PSA是由前列腺腺泡和导管上皮细胞分泌的一种丝氨酸蛋白酶,仍是疗效评估的重要临床指标。但是Small等[1]研究显示PSA测定不能完全评估PCa经过激素替代治疗或放疗后的疗效。PSA并不是PCa的特异性标记物,约20%PCa患者在肿瘤发生临床进展时,检测出的PSA水平在正常范围内[3]。虽然PSA在PCa的诊断、复发评估及疗效监测方面有重要意义,但仅靠PSA监测评估PCa疗效存在一定的局限性和片面性。
2.PCa内分泌治疗前后DCE-MRI定量参数分析
PCa的生长、浸润和转移均依赖于肿瘤血管形成,肿瘤的微血管在形态上主要表现为:血管粗细不均、扭曲、不规则分布及广泛吻合的血管网形成;毛细血管壁肌层和基底膜缺乏不完整、内皮细胞之间的间隙增大,导致了PCa肿瘤血管的通透性增加。DCE-MRI定量参数用于评价肿瘤生理特性,是以肿瘤内微血管密度(MVD)及血管通透性变化为基础,利用药物动力学模型进行数学分析得出灌注参数,从微血管密度变化及血管通透性方面评价PCa组织的血流灌注特征[4],如:Ktrans、Ve、Kep等,有文献[5-6]研究显示肿瘤组织DCE-MRI定量参数Ktrans、Kep、Ve值高于前列腺非癌区。本研究治疗后癌区的定量参数Ktrans从治疗前的(3.2502±1.46)min-1降至(2.1873±1.19)min-1,Kep值从治疗前的(2.3341±1.59)min-1降至(1.0325±0.68)min-1, Ktrans和Kep在治疗前后差异均具有统计学意义(P=0.002、0.000);而Ve差异无统计学意义(P=0.136)。文献研究[2,7]显示治疗前后癌区的Ktrans值显著降低,前后差异具有统计学意义。
内分泌治疗后,PCa瘤体内微血管生成受到抑制,引起血管收缩、毛细血管变性和内皮细胞死亡,加深了PCa细胞的缺氧程度,导致Ktrans值降低。Barrett等[7]研究显示PCa经过ADT治疗前后定量参数Kep的差异有统计学意义(Plt;0.05),显示可用Kep预测治疗反应。同样Zwick等[8]的研究结果显示Ktrans和Kep在抗肿瘤血管生成的疗效评价方面有较高的应用潜能。PCa细胞学和动物模型研究表明[9],抗雄激素治疗后,体内雄激素水平的降低可引起血管内皮生长因子的下降,并导致肿瘤细胞死亡、肿瘤血管退化,同时有效的抗雄激素治疗还可以降低PCa组织的血流量和氧合作用[10],使肿瘤乏氧程度加重,在细胞水平使细胞核收缩、细胞空泡形成,细胞凋亡和坏死[11],从而起到有效的抗肿瘤血管生成作用。因此,基于DCE-MRI的技术原理,DCE-MRI参数可以用于反映PCa内分泌治疗后的抗肿瘤血管效应。目前关于Ve在PCa内分泌治疗的疗效评价方面的研究报告较少,Huang等[12]研究显示PCa内分泌治疗后肿瘤细胞发生坏死、崩解,导致癌组织微环境中细胞外间隙增加,引起癌灶的Ve值增大,本研究结果显示PCa内分泌治疗后虽然Ve值均有增加,但是治疗前后间的差异无统计学意义。目前Ve在肿瘤疗效评价中的价值存在较大争论,汪晓红等[13]认为Ve值在乳腺癌疗效评估中价值不大,由于治疗过程中肿瘤周围出现不同程度水肿导致Ve值变化不稳定。
3.PCa内分泌治疗后DCE-MRI的参数变化与PSA值变化的相关性
DCE-MRI是反映肿瘤血管生成的替代性生物学标志物,相对于PSA可以提供更丰富的有价值的信息。Padhani等[10]研究发现PCa患者经治疗后Ktrans值的减低与PSA减低趋势呈正相关,而与体积的变化呈弱相关。Barrett等[7]研究显示PCa经ADT治疗后DCE-MRI参数随着PSA的变化而发生相应的变化,Kep与PSA具有显著相关性,显示用Kep预测ADT的治疗反应具有可行性。本研究对DCE-MRI参数变化与PSA变化间进行Spearman相关分析,结果显示两者间无相关性(Pgt;0.05),分析原因可能与以下因素有关:本研究的样本量不足; 测量时人为主观因素的影响导致数据准确性产生的偏差。
4.不足和展望
首先,本研究的样本量有限,尤其是符合入组条件的DCE-MRI检测的PCa仅33例,无法进行分类研究,如根据肿瘤Gleason评分进行分类等;其次,本研究是回顾性研究,没有考虑到MRI检查方案及其参数对研究的影响,对研究结果可能产生偏差。因此本研究结果需要进一步深入研究来验证,在今后的工作中将完善研究方案,进行前瞻性研究,积累病例增加样本量,以MRI引导/定位下的穿刺活检病理为参考标准,以提高研究可信度。
本研究结果表明,DCE-MRI定量参数Ktrans和Kep值可作为PCa内分泌治疗后疗效监测的指标,可以作为临床PCa疗效检测指标PSA的补充,具有潜在的临床应用价值;而Ve值在PCa疗效评估中的作用还有待进一步研究。
[1] Small EJ,Roach M.Prostate-specific antigen in prostate cancer:a case study in the development of a tumor marker to monitor recurrence and assess response[J].Semin Oncol,2002,29(3):264-273.
[2] Hötker AM,Mazaheri Y,Zheng J,et al.Prostate Cancer:assessing the effects of androgen-deprivation therapy using quantitative diffusion-weighted and dynamic contrast-enhanced MRI[J].Eur Radiol,2015,25(9):2665-2672.
[3] Kwak C,Jeong SJ,Park MS,et al.Prognostic significance of the nadir prostate specific antigen level after hormone therapy for prostate cancer[J].J Urol,2002,168(3):995-1000.
[4] O'Connor JP,Jackson A,Parker GJ,et al.DCE-MRI biomarkers in the clinical evaluation of antiangiogenic and vascular disrupting agents[J].Br J Cancer,2007,96(2):189-195.
[5] 景国东,汪剑,陈录广,等.3.0T动态增强MRI在前列腺癌诊断中的价值[J].放射学实践,2014,29(5):482-486.
[6] 刘会佳,赵娓娓,任芳,等.3.0T动态增强磁共振对前列腺癌的定量分析研究[J].放射学实践,2014,29(5):477-481.
[7] Barrett T,Gill AB,Kataoka MY,et al.DCE and DW MRI in monitoring response to androgen deprivation therapy in patients with prostate cancer:a feasibility study[J].Magn Reson Med,2012,67(3):778-785.
[8] Zwick S,Strecker R,Kiselev V,et al.Assessment of vascular remodeling under antiangiogenic therapy using DCE-MRI and vessel size imaging[J].J Magn Reson Imaging,2009,29(5):1125-1133.
[9] Jain RK,Safabakhsh N,Sckell A,et al.Endothelial cell death,angiogenesis,and microvascular function after castration in an androgen-dependent tumor:role of vascular endothelial growth factor[J].Proc Natl Acad Sci,1998,95(18):10820-10825.
[10] Padhani AR,MacVicar AD,Gapinski CJ,et al.Effects of androgen deprivation on prostatic morphology and vascular permeability evaluated with mr imaging[J].Radiology,2001,218(2):365-374.
[12] Huang B,Wong CS,Whitcher B,et al.Dynamic contrast-enhanced magnetic resonance imaging for characterising nasopharyngeal carcinoma:comparison of semiquantitative and quantitative parameters and correlation with tumour stage[J].Eur Radiol,2013,23(6):1495-1502.
[13] 汪晓红,李瑞敏,彭卫军.磁共振功能成像在乳腺癌新辅助化疗早期疗效评价中的应用[J].磁共振成像,2011,3(2):172-176.
TheevaluationofDCE-MRIquantitativeparametersontheefficacyofendocrinetherapyinprostatecancer
GU Wei-guang,ZHAO Wen-lu,YANG Yi,et al.
Department of Radiology,Suzhou Wuzhong People's Hospital,Jiangsu 215004,China
Objective:The quantitative parameters of DCE-MRI before and after endocrine therapy were retrospectively analyzed,aiming to evaluate the value of these parameters considered as an index of analysis to monitor the endocrine therapy effect to prostate cancer (PCa),and to explore the correlation between the parameters with serum PSA level.MethodsThe clinical and imaging data of 33 patients with pathologically confirmed PCa were collected.The parameters such as Ktrans,Ve and Kep and the serum PSA level were measured and obtained before and after endocrine therapy.The difference between the parameters before and after was analyzed for statistical analysis.ResultsBefore treatment,Ktrans value in the cancer area was (3.2502±1.46)×10-3min-1,Kep=(2.3341±1.59)×10-3min-1,and Ve=1.1.7475±0.87.PSA was (59.9054±37.15)μg/L.After treatment,Ktrans=(2.1873±1.19)×10-3min-1,Kep=(1.0325±0.68)×10-3min-1,Ve=2.0512±0.75,PSA=(2.4831±3.93)μg/L;The difference of Ktrans,Kep and PSA was statistically significant (Plt;0.05),but the difference of Ve had no significant statistical difference (Pgt;0.05).Spearman correlation analysis showed that there was no significant correlation between DCE-MRI parameters and PSA values before and after treatment (Pgt;0.05).ConclusionThe changes of quantitative parameters of DCE-MRI Ktrans,Kep in PCa after endocrine therapycan be used as a clinical index and supplement to serum PSA level for evaluating clinical endocrine therapy efficacy in prostate carcinoma for efficacy evaluation.
Prostate neoplasms; Diffusion weighted imaging; Magnetic resonance imaging; Dynamic enhancement; Endocrine therapy
215128 江苏,苏州市吴中人民医院(顾伟光、钱林清);215004 江苏,苏州大学附属第二医院(赵文露、杨毅、沈钧康);211100 南京,通用电气医疗集团(武江芬)(武江芬)
顾伟光(1981-),男,江苏盐城人,硕士,主治医师,主要从事泌尿系统影像诊断工作。
苏州市科技局科技发展计划项目(SYS201475)
赵文露,E-mail:15599016119@163.com
R445.2; R737.25
A
1000-0313(2017)11-1187-04
10.13609/j.cnki.1000-0313.2017.11.019
2017-01-16)