Fe掺杂A-TiO2在溴甲酚绿中的可见光催化活性及动力学
2017-11-28张一兵冯永青谢丽丽张素霞李素云
张一兵, 冯永青,谢丽丽,张素霞,李素云
(1.上饶师范学院化学与环境科学学院,江西 上饶 334001; 2.江西省塑料制备成型重点实验室,江西 上饶 334001)
Fe掺杂A-TiO2在溴甲酚绿中的可见光催化活性及动力学
张一兵1,2, 冯永青1,谢丽丽1,张素霞1,李素云1
(1.上饶师范学院化学与环境科学学院,江西 上饶 334001; 2.江西省塑料制备成型重点实验室,江西 上饶 334001)
以FeCl3·6H2O为Fe源,采用水热法制备了Fe掺杂锐钛型TiO2(A-TiO2)光催化剂。以溴甲酚绿为降解对象,考察溴甲酚绿的初始浓度、催化剂用量、掺Fe量等因素对自制催化剂可见光催化降解反应的动力学方程的影响。结果表明:在40 W白炽灯照射下,当溴甲酚绿初始浓度为10 mg/L(pH=7)、催化剂的用量为0.6 g/L、掺Fe量为4%(摩尔分数)、室温下反应时间为3 h时,溴甲酚绿的降解率最大为76.05%。溴甲酚绿光催化降解曲线符合一级反应动力学方程,于上述最佳条件下其表观反应速率常数k达到最大值,为0.389 7 h-1。
Fe掺杂A-TiO2;可见光;光催化降解;溴甲酚绿;动力学
染料作为一种精细化工产品,存在于我们生活的方方面面,给我们的生活带来了很大的方便。但是染料生产过程中排放的废水,由于表现为高浓度、高色度、高COD和BOD,很难将其降解,给环境尤其是水资源带来了巨大的威胁[1-2]。溴甲酚绿,学名3,3′,5,5′-四溴间甲酚磺酰酞,主要用于指示剂、染料,是一种典型的难降解的有机污染物。传统的染料污水处理方法有物理法、化学法、生物法等。物理方法只将有机物污染物转移,而没有把染料分子真正分解,并不能实现真正意义上的去除污染物;化学或生物方法也不能高效地降解它们,因为这些物质分子中含有多个苯环,结构稳定难以降解,且当前使用的生物、化学等降解方法成本高,推广受限[3]。
自从1972年报道了在受辐照的TiO2上能发生水的氧化还原反应并释放出氢气和大量能量以来,利用TiO2作为光催化剂催化降解水中污染物受到广泛的关注[4-13]。TiO2是一种无毒高效的催化剂,它以价廉、性能稳定、可循环利用而受到青睐,是一种理想的光催化剂。不足的是,TiO2是宽带半导体,只有在紫外光下(占太阳光3%~4%)才有催化活性,即,它不能有效利用占太阳光中绝大多数的可见光。另外,由于紫外光的使用对环境和操作者有危害,故充分利用可见光照射实现其催化效能意义重大。为了扩展TiO2的响应波长,掺杂改性成为近年来的关注热点[4-7,10-13],但有关TiO2光催化降解有机污染物的动力学研究相对较少[5-7]。本研究以FeCl3·6H2O为Fe源,采用水热法制备Fe掺杂锐钛型TiO2(A-TiO2)光催化剂,以溴甲酚绿为降解对象,探讨其可见光催化过程的动力学行为。
1 实验设计
1.1 主要仪器和试剂
UV-1201紫外可见分光光度计(上海普天分析仪器有限公司);X射线衍射(X-ray diffraction,XRD)(Dmax/2500,Rigaku,Japan);溴甲酚绿和FeCl3·6H2O均为分析纯(中国上海试剂一厂);水为二次蒸馏水;其他试剂均为分析纯。
1.2 掺Fe A-TiO2的制备
以FeCl3·6H2O为Fe源,参照文献[8]采用水热法制备掺Fe的A-TiO2,并用XRD表征以确保产物晶型是锐钛型。
1.3 光催化实验方法
把一定量溴甲酚绿固体粉末溶于水(用少量乙醇助溶)配成一定浓度的溴甲酚绿溶液,以95%乙醇作参比在其最大吸收波长616 nm处,测定甲苯溶液的初始吸光度。用可见分光光度计测定溶液的最初吸光度,准确移取该浓度的溴甲酚绿溶液50 mL到一干燥、洁净的200 mL烧杯中,加入一定量的自制A-TiO2粉末(掺Fe),密封杯口后置于室温下的自制暗箱中,磁力搅拌下用40 W白炽灯照射,反应一定时间后取出少许反应液离心过滤后检测溶液的吸光度,并通过以下公式计算溴甲酚绿的降解率:
(1)
式中:D为溴甲酚绿的降解率;At为溶液的吸光度;A0为苯溶液的初始吸光度。
2 结果与讨论
2.1 XRD物相分析
图1为自制的掺Fe量4%(摩尔分数,下同)的TiO2晶体粉末的XRD图。分析图1可知,衍射图谱中出现了各晶面的特征衍射峰,其2θ主要为25.41°、38.01°、48.01°、54.71°、63.11°处的特征衍射峰,分别对应于A-TiO2晶体(101)、(004)、(200)、(105)和(204)晶面,说明本研究所制备的TiO2粉末晶体均属锐钛矿型,即为A-TiO2。各衍射峰峰形尖锐,说明产物粉体结晶度高。图1没有出现氧化铁的特征衍射峰,可能是掺Fe量极少或很好地分散而难以检测到,或因晶体中的掺Fe量少,Fe3+替代Ti4+进入TiO2晶格中了。
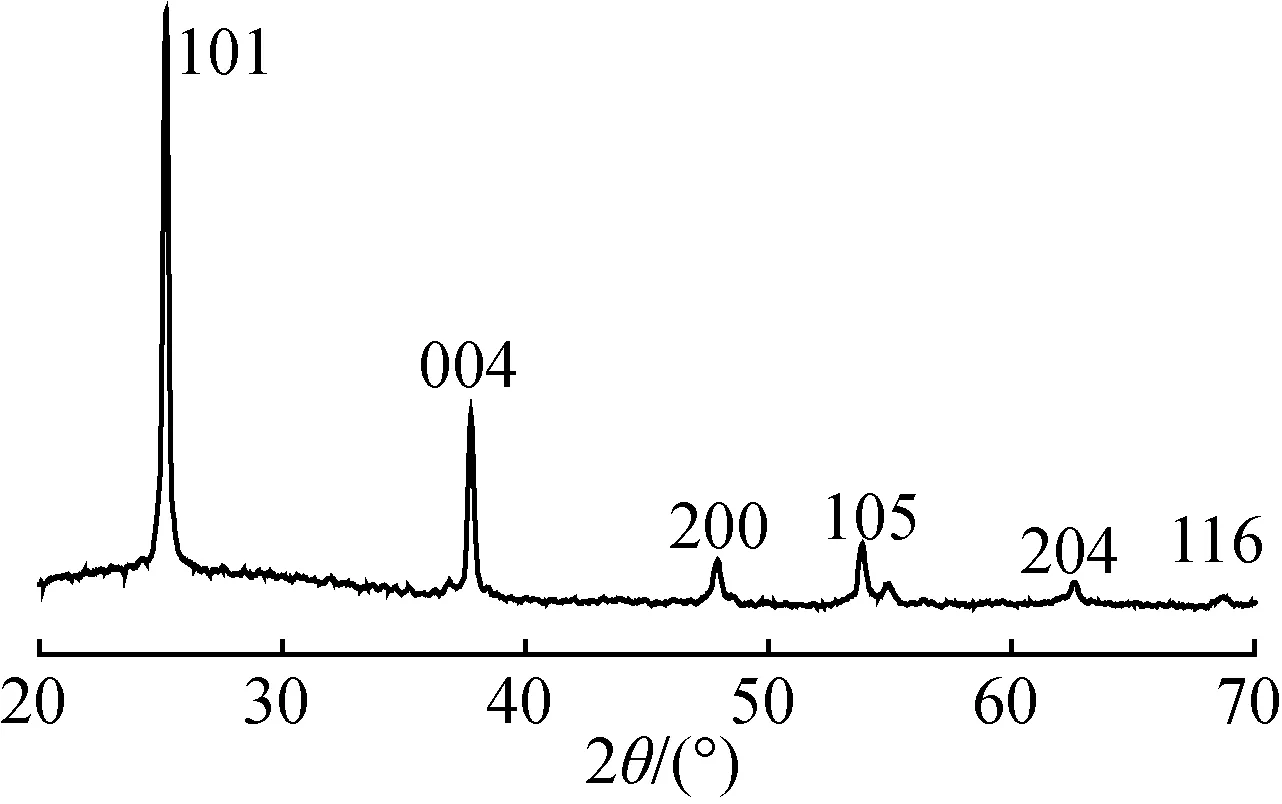
图1 自制的掺Fe量4% TiO2粉末的XRD图
2.2 溴甲酚绿溶液最大吸收波长的确定
图2是波长600~625 nm范围内对一定浓度的溴甲酚绿溶液的吸光度光谱扫描结果,从图2可以发现,在波长等于616 nm时, 溴甲酚绿溶液的吸光度最高,为0.334,因此,后续的实验中都把波长调到616 nm。
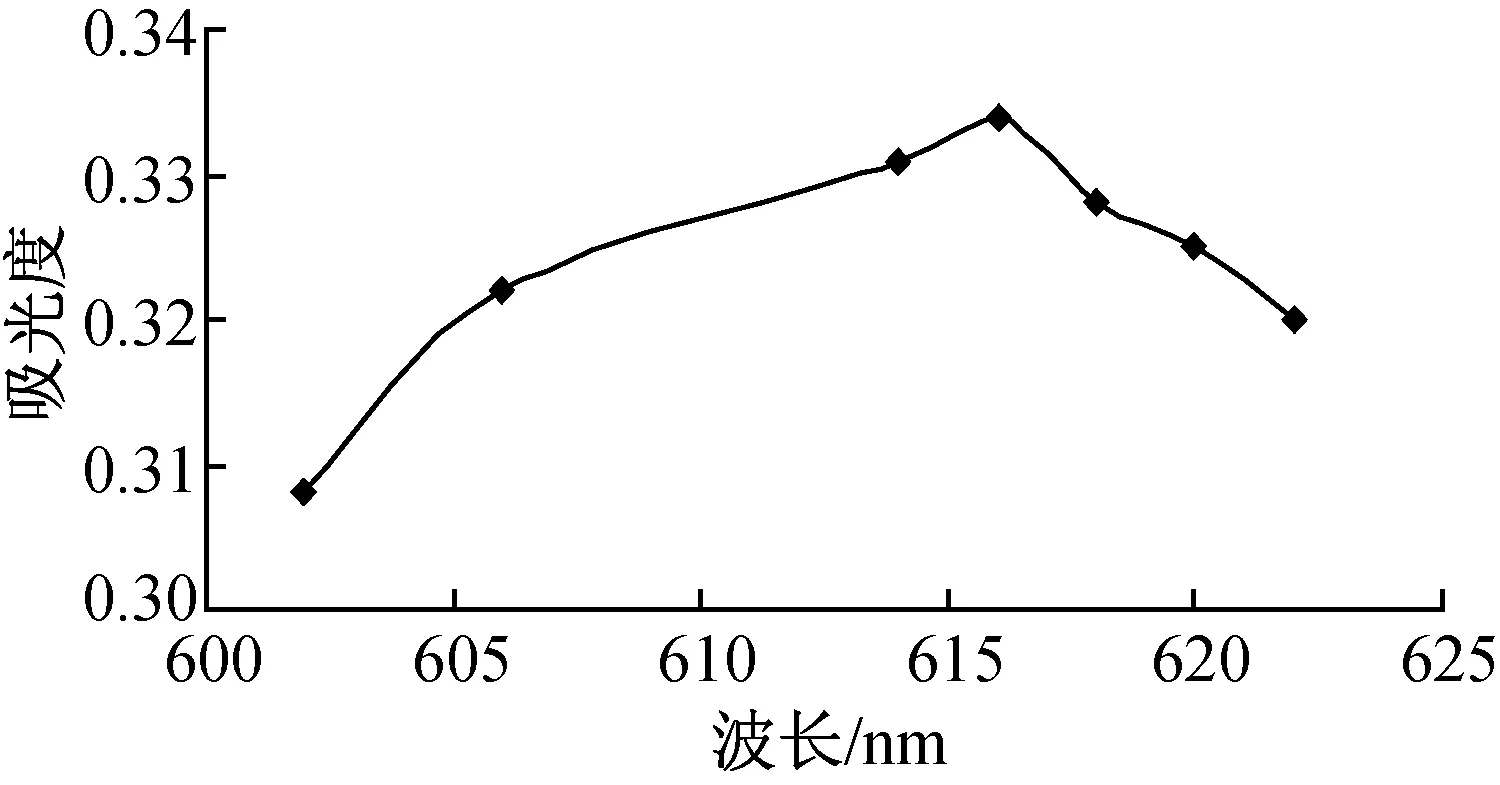
图2 溴甲酚绿溶液吸光度扫描结果
2.3 不同溴甲酚绿初始浓度下的反应动力学
溴甲酚绿溶液的初始质量浓度ρ0分别为2、5、10、15、18 mg/L,pH值为7,自制掺Fe量为4%的催化剂质量浓度为0.6 g/L,室温磁力搅拌下可见光照(40 W白炽灯,下同)3 h的条件下,图3为溴甲酚绿在不同初始浓度下光催化降解曲线,可见ln(ρ0/ρt)~t间存在良好的线性关系,溴甲酚绿溶液的可见光催化降解速率与时间符合一级动力学规律,直线的斜率就是表观反应速率常数k。不同初始浓度下溴甲酚绿的动力学方程及参数见表1。
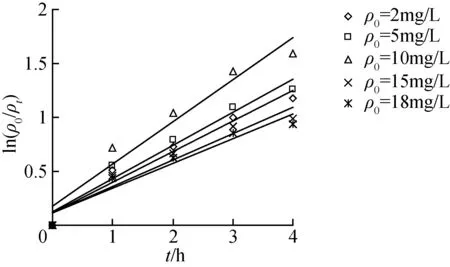
图3 溴甲酚绿在不同初始质量浓度下光催化降解曲线

ρ0/(mg·L-1)动力学方程k/h-1R2t1/2/h25101518y=0.2847x+0.1128y=0.3064x+0.1259y=0.3897x+0.1782y=0.2437x+0.1197y=0.2296x+0.11090.28470.30640.38970.24370.22960.96050.95640.94440.93410.93692.432.261.782.843.02
注:t1/2是降解反应的半衰期,t1/2=0.693/k。
图4为溴甲酚绿的初始光降解速率r0与ρ0关系,可见k和D随着溴甲酚绿初始浓度的增大逐渐增大,当ρ0=10 mg/L时,k和D达到最大,分别为0.389 7 h-1和76.05%,溴甲酚绿的初始浓度继续增大,k和D均变小。
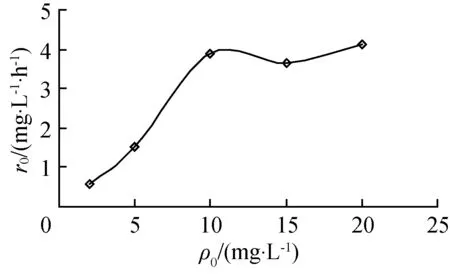
图4 初始光降解速率与初始质量浓度的关系
由于催化剂表面上的光生电子e-和空穴h+的复合较快(低于10-9s内完成),而载流子被俘获的速率相对较慢(一般在10-8~10-7s),故只有吸附在催化剂表面的有机污染物才有可能发生反应[8]。然而当催化剂用量一定则其表面积就一定,即其吸附容量是恒定值。因此反应开始时,随着ρ0的增大溴甲酚绿在A-TiO2催化剂表面上的吸附量增大,增加了催化降解的机会,k、D随之增大;当ρ0增加至一定值时,吸附呈饱和状态,k、D值达到最大;继续加大ρ0,过量的溴甲酚绿因在A-TiO2晶体表面的吸附,减少了反应所产生TiO2的活性中心,加上生成的中间产物的吸附竞争,均导致活性部位减少,导致k、D减小或光催化剂失活[10]。
2.4 不同催化剂用量的反应动力学
溴甲酚绿溶液的初始浓度ρ0为10 mg/L,pH值为7,以自制掺Fe量为4%的A-TiO2为催化剂,其用量m分别为0.2、0.4、0.6、0.8、1.0 g/L,室温磁力搅拌下可见光照3 h的条件下,光催化降解曲线见图5。可见ln(ρ0/ρt)~t间存在良好的线性关系,溴甲酚绿溶液的可见光催化降解速率与时间符合一级动力学规律。溴甲酚绿在不同催化剂用量下动力学方程及参数见表2。

图5 溴甲酚绿在不同催化剂用量下光催化降解曲线
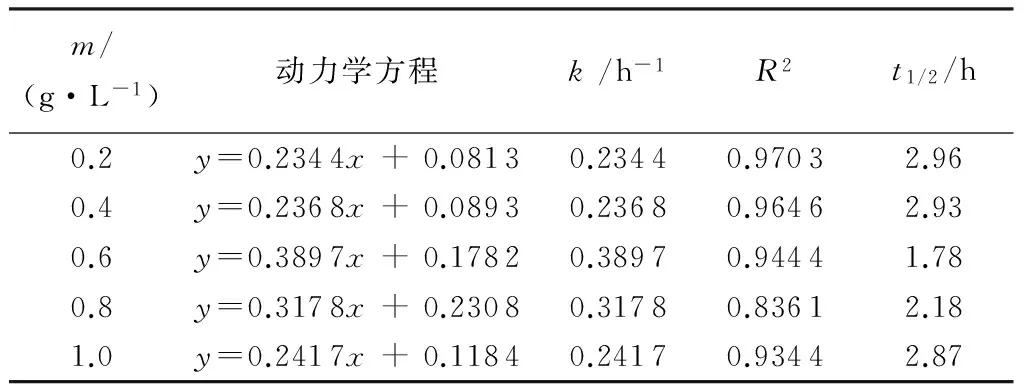
m/(g·L-1)动力学方程k/h-1R2t1/2/h0.20.40.60.81.0y=0.2344x+0.0813y=0.2368x+0.0893y=0.3897x+0.1782y=0.3178x+0.2308y=0.2417x+0.11840.23440.23680.38970.31780.24170.97030.96460.94440.83610.93442.962.931.782.182.87
由图5和表2可见,当催化剂用量为0.2~0.6 g/L,溴甲酚绿的k和D随着催化剂用量的增加而增加,当m=0.6 g/L时均达到最大值,分别为0.389 7 h-1和76.05%;当催化剂用量超过0.6 g/L时,k和D却反而下降。原因是适当增加催化剂用量能增加电子e--空穴h+对的生成数量,同时也增加降解物与掺Fe A-TiO2颗粒表面的接触概率,故k和D能增大;当催化剂用量过大时,过量A-TiO2粉末颗粒使得溶液浑浊度加大,造成光散射、光路堵塞等现象,阻碍反应体系对光的吸收效率,造成k、D减小[11];另外,过量使用催化剂会导致粉末团聚,降低A-TiO2表面活性点位对降解物及可见光的吸附,结果减少电子e--空穴h+对和光生·OH的数量,降低光催化降解效率,同时因浪费催化剂,增加了成本[11]。
2.5 不同掺Fe量下的反应动力学
溴甲酚绿溶液的初始浓度为10 mg/L,pH值为7,掺Fe量χ分别为0、0.8%、1.4%、4%、6%、7%的A-TiO2用量m均为0.6 g/L,室温磁力搅拌下可见光照3 h的条件下,溴甲酚绿在不同掺Fe量下的光催化降解曲线见图6。由图6可见ln(ρ0/ρt)~t间存在良好的线性关系,溴甲酚绿溶液的可见光催化降解速率与时间符合一级动力学规律。溴甲酚绿在不同掺Fe量下动力学方程及参数见表3。
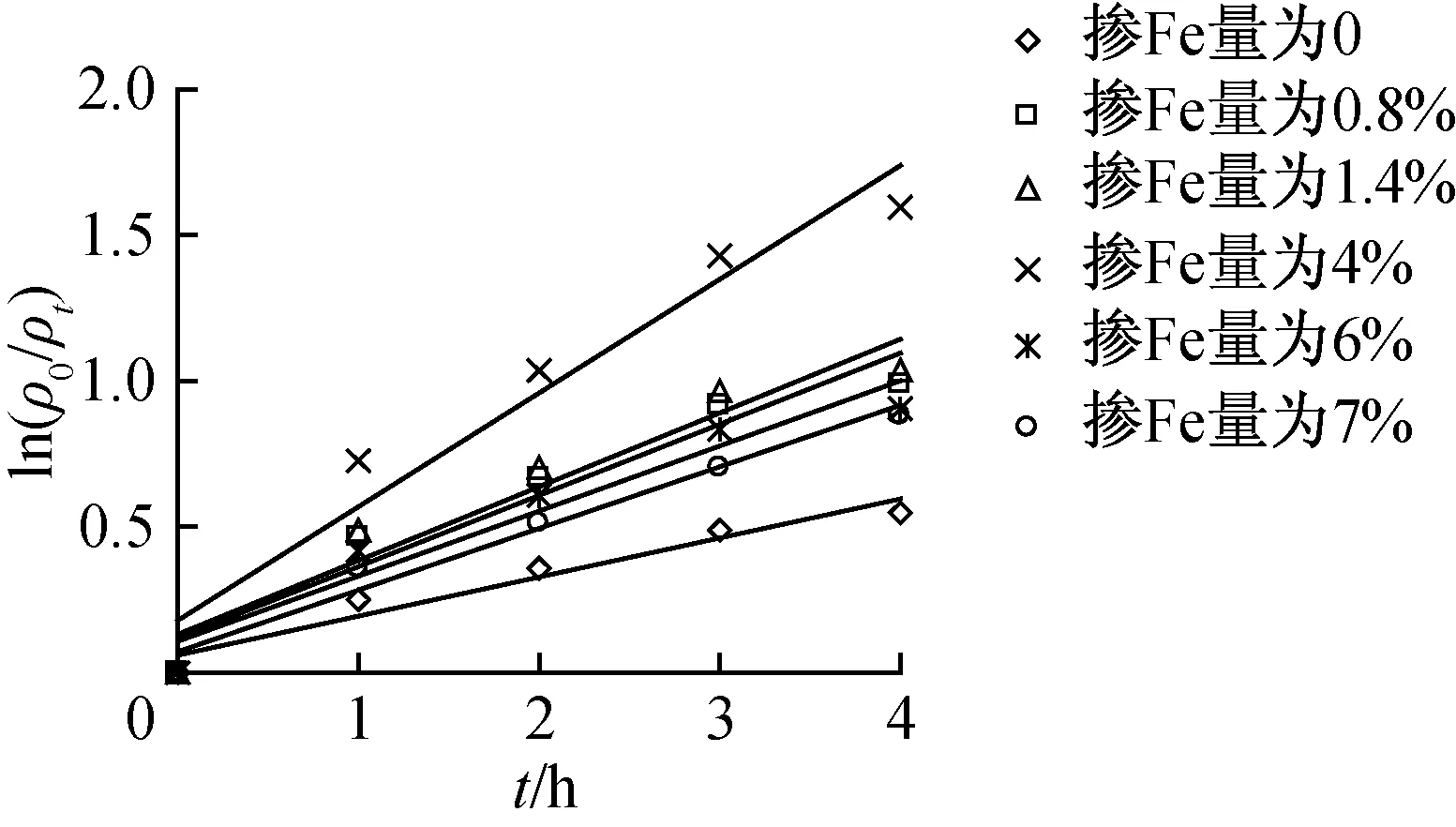
图6 溴甲酚绿在不同掺Fe量下的光催化降解曲线
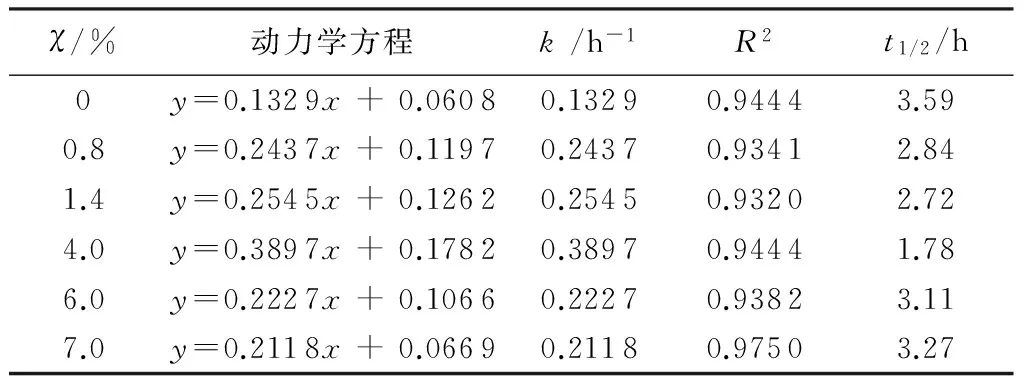
χ/%动力学方程k/h-1R2t1/2/h00.81.44.06.07.0y=0.1329x+0.0608y=0.2437x+0.1197y=0.2545x+0.1262y=0.3897x+0.1782y=0.2227x+0.1066y=0.2118x+0.06690.13290.24370.25450.38970.22270.21180.94440.93410.93200.94440.93820.97503.592.842.721.783.113.27
由图6和表3可见,掺Fe能提高A-Ti02粉末光催化效率。当掺Fe量为0~4%时,随着掺Fe量的增加,溴甲酚绿的k和D增加;当掺杂量4%时,k和D分别为0.389 7 h-1和76.05%,均为最大值;继续增加掺Fe量,k和D却逐渐降低。花朵等[11]认为金属离子存在一个最佳掺杂量,当掺Fe量低于最佳值时,A-Ti02粉末晶体中俘获载流子的陷阱相应少,此时催化效率随掺Fe量的增加而增加;当掺Fe量高于最佳值时,增加掺Fe量会减小陷阱间的平均距离,电子e--空穴h+的复合速度呈指数级增长。此外过高的掺Fe量,多余的Fe会以氧化物形式沉积在A-Ti02晶体表面上,充当电子e--穴h+的复合中心,造成光催化效率性能下降[12-13]。本研究表明最佳掺Fe量为4%。
3 结 论
a. 以FeCl3·6H2O为Fe源,用水热法自制了Fe掺杂TiO2粉末,XRD表征确认为锐钛型。用自制Fe掺杂A-TiO2可见光催化降解溴甲酚绿最佳条件为:溴甲酚绿初始浓度为10 mg/L、催化剂用量为0.6 g/L,pH值为7、掺Fe量为4%(摩尔分数)、室温搅拌下于暗箱中用40 W白炽灯照射3 h,溴甲酚绿的降解率最大为76.05%。
b. Fe掺杂A-TiO2可见光催化降解溴甲酚绿反应为一级动力学反应,符合Langmuir-Hinshelwood规律,在上述最佳条件下,其表观反应速率常数达到最大值,为0.389 7 h-1。
[1]董丽丽.有机染料废水处理的新技术研究[J].云南环境科学,2002,21(3):49-51.(DONG Lili.Research on new technology of organic dyestuff waste water treatment [J].Yunnan Environmental Science,2002,21(3):49-51.(in Chinese))
[2]宋筱,朱翩翩,陈盼,等.磁性Fe3O4/碳纳米管复合材料光催化处理刚果红染料废水[J].水资源保护,2015,31(5):77-81.(SONG Xiao,ZHU Pianpian,CHEN Pan,et al.Study on photocatalytic removal of Congo Red dye wastewater using magnetic Fe3O4/Carbon nanotubes composite[J].Water Resources Protection,2015,31(5):77-81.(in Chinese))
[3]许凤秀,冯光建,刘素文,等.TiO2降解有机染料废水的研究进展[J].硅酸盐通报,2008,27(5):991-995.(XU Fengxiu,FENG Guangjian,LIU Suwen,et al.Advances in degradation of the dyestuffs waste water with TiO2[J].Bulletin of the Chinese Ceramic Society,2008,27(5):991-995.(in Chinese))
[4]刘少友,冯庆革,唐文华,等.S、Al掺杂TiO2纳米材料的固相合成及其可见光降解性能[J].无机化学学报,2011,27(4):673-681.(LIU Shaoyou,FENG Qingge,TANG Wenhua,et al.S and Al doped TiO2nanomaterials:synthesis via solid-state reaction and visible light degradation performance [J].Chinese Journal of Inorganic Chemistry,2011,27(4):673-681.(in Chinese))
[5]郑旭煦,於煌,殷钟意,等.N掺杂纳米TiO2在4-氯苯酚中的可见光催化活性及动力学研究[J].材料工程,2008,60(10):39-42.(ZHENG Xuxu,YU Huang,YIN Zhongyi,et al.Catalytic activity and kinetic equation of nitrogen-doped TiO2nanoparticle for 4-chlorophenol under visible light [J].Journal of Materials Engineering,2008,60(10):39-42.(in Chinese))
[6]暴勇超,李小丽,刘娟,等.Ti02-SnO2纳米粒子超声波光催化降解尤丽特蓝的动力学研究[J].太阳能学报,2010,31(3):286-290.(BAO Yongchao,LI Xiaoli,LIU Juan,et al.Study on kinetics of TiO2-SnO2nanoparticles sono-photocatalytic degradation of solvent blue[J].Acta Energiae Solaris Sinica,2010,31(3):286-290.(in Chinese))
[7]LIU Y,CHEN X,LI J,et al.Photocatalytic degradation of azodyes by nitrogen-doped TiO2nanocatalysts[J].Chemosphere,2005,61(1):11-18.
[8]张一兵.锐钛矿型TiO2微米球的制备表征 [J].材料科学与工程学报,2010,28(6):916-919.(ZHANG Yibing.Preparation and characterization of anatase TiO2microspheres by hydrothermal reaction[J].Journal of Materials Science and Engineering,2010,28(6):916-919.(in Chinese))
[9]李青松,高乃云,马晓雁,等.TiO2光催化降解水中内分泌干扰物17β-雌二醇[J].环境科学,2007,28(1):120-125.(LI Qingsong,GAO Naiyun,MA Xiaoyan,et al.Photocatalytic endocrine disruptor 17β-estradiol(E2)in drinking water by nanotitanium suspended system [J].Environmental Science,2007,28(1):120-125.(in Chinese))
[10]程玉红,周婷,何璇,等.纳米锐钛矿TiO2及负载金催化剂的制备与催化性能[J].材料导报B,2012,26(7):25-28.(CHENG Yuhong,ZHOU Ting,HE Xuan,et al.Preparation and catalytic performance of nano-anatase titania and supported gold catalysts[J].Materials Review B,2012,26(7):25-285.(in Chinese))
[11]ALHAKIMI G,STUDNICKI L H,AL G M.Photocatalytic destruction of potassium hydrogen phthalate using TiO2and sunlight [J].Photochemical Photobiology A,2003,154(2/3):219-228.
[12]花朵,施春红,袁蓉芳,等.金属掺杂对纳米管TiO2光催化性能的影响[J].功能材料,2013,21(44):3163-3167.(HUA Duo,SHI Chunhong,YUAN Rongfang,et al.Effect of metal ion-doping on photo catalytic activity of TiO2nanotubes[J].Journal of Functional Materials,2013,21(44):3163-3167.(in Chinese))
[13]彭峰,任艳群.TiO2-SnO2复合纳米膜的制备及其光催化降解甲苯的活性[J].催化学报,2003,24(4):243-247.(PENG Feng,REN Yanqun.Preparation of nano-TiO2-SnO2composite film and its photocatalytic activity for toluene degradation [J].Chinese Journal of Catalysis,2003,24(4):243-247.(in Chinese))
VisiblelightcatalyticactivityandkineticsofFe-dopedA-TiO2inbromocresolgreen
ZHANGYibing1,2,FENGYongqing1,XIELili1,ZHANGSuxia1,LISuyun1
(1.SchoolofChemistryandEnvironmentalScience,ShangraoNormalUniversity,Shangrao334001,China; 2.JiangxiKeyLaboratoryofPlasticsPreparationandMolding,Shangrao334001,China)
Fe-doped anatase TiO2(A-TiO2) photocatalyst was prepared through a hydrothermal procedure by using FeCl3·6H2O as the iron source. With bromocresol green taken as degradation target, the bromocresol green’s initial concentration, TiO2dosage, amount of iron-doped were investigated for their effects on kinetic equation of catalytic degradation reaction by visible light of self made catalyst. The results showed that the degradation rate 76.05% of bromocresol green was the maximum figure under the following optimal conditions: bromocresol green’s initial concentrationρ010 mg/L (pH=7), catalyst dosagem0.6 g/L, amount of iron-doped 4 % (molar fraction), and irradiated by 40 W filament lamp fort=3 h at room temperature. The photocatalytic degradation curve of bromocresol green conformed to the first-order reaction kinetic equation. Under the above optimum conditions, the observed reaction rate constant K achieved the maximum value of 0.389 7 h-1.
Fe-doped A-TiO2; visible light; photocatalytic degradation; bromocresol green; kinetics
10.3880/j.issn.1004-6933.2017.06.13
教育部第四批高等学校特色专业建设点资助项目(TS11524);江西省精品课程资助项目(赣教高字〔2011〕74号);江西省精品资源共享课资助项目(赣教高字〔2015〕79号)
张一兵(1963—),男,教授,硕士,主要从事无机化学与无机材料研究。E-mail:srxbzyb@163.com
X703.1
A
1004-6933(2017)06-0087-05
2016-11-28 编辑:王 芳)
