伪狂犬病及其根除:美国经历的回顾—PRV控制方面的早期尝试、疫苗及诊断方法
2017-11-28译校张淼洁刘祥张倩杨文欢中国动物疫病预防控制中心
译校│张淼洁 刘祥 张倩 杨文欢(中国动物疫病预防控制中心)
伪狂犬病及其根除:美国经历的回顾—PRV控制方面的早期尝试、疫苗及诊断方法
译校│张淼洁 刘祥 张倩 杨文欢(中国动物疫病预防控制中心)

一、PRV控制的早期尝试
1.检疫隔离。伪狂犬病毒(PRV)的暴发给美国爱荷华州、印第安纳州和伊利诺伊州两个相邻的大型猪群造成了重大损失。这促使伊利诺伊州在1975年初成立特别工作组,并呼吁召开全国性的PRV研讨会。PRV研讨会于1975年春季在牲畜保护学会(现为美国国家畜牧业学会)年会之前召开,会议地点设在伊利诺伊州皮奥里亚市。与会人员报告,从伊利诺伊州牲畜屠宰加工厂采集的6200份血样中,有139份血样的PRV检测结果呈阳性,阳性率为2%。这139份血样来自43个猪群。共有150~200名猪肉生产商、兽医和监管官员参与了该次研讨会。会上,猪肉生产商要求对发现的PRV感染猪群进行检疫隔离。伊州州级兽医Paul Doby博士提醒来自其他州的监管官员,应注意隔离检疫带来的相关问题(尤其是缺乏解除检疫的方法)。
伊利诺伊州猪肉生产商协会理事会于次日召开会议,呼吁开展PRV检疫工作。Paul Doby博士宣布将启动检疫隔离项目。此外,伊利诺伊州的猪肉集团请求牲畜保护学会成立PRV常务委员会。这一请求于次日获得牲畜保护学会理事会的批准。
2. 抗血清现场试验。
(1)伊利诺伊州。为制定措施以减少PRV所造成的损失,伊利诺伊州农业部门和对生猪行业感兴趣的人士采取了若干项行动,其中有一项行动是由伊利诺伊大学兽医学院提出的。该项行动基于这样的设想:将从感染猪群采集的超免疫抗血清注射到出生时间不超过2天的仔猪体内,可防止仔猪感染PRV。伊利诺伊大学兽医学院为相关项目制定了一套方案。若能筹集到资金,伊利诺伊州官员计划探索建立PRV超免疫抗血清库,提供可能的治疗方法以减少PRV损失。
该项研究由伊利诺伊州猪肉生产商协会资助(25000美元)。协会与伊州卡里市的一家实验室签订了一份收集和处理血清的合同。该项研究利用来自伊州比尔兹敦市某个感染猪群的12头母猪生产血清。
这一抗血清项目最终生产出了50升PRV超免疫抗血清。项目人员根据伊利诺伊大学兽医学院制定的方案开展现场试验:同一窝猪有一半以皮下方式注射5毫升超免疫抗血清,另一半作为空白对照。伊利诺伊州农业厅人员花费大量时间与生猪感染群的畜主共同开展抗血清试验和隔离、分配、注射、收集数据、制表等工作。该项研究证实,注射超免疫抗血清使猪的死亡率降低近28%,但在经济上缺乏可行性。
(2)爱荷华州。抗血清在PRV暴发时仍能发挥作用,因此被视为抗击PRV的一种手段。作为猪瘟抗血清来源的猪通常曾接触过PRV(PRV以非临床形式普遍存在于猪群中)。这一事实使得关于抗血清功效的现场报告更加合乎逻辑。
早期尝试生产抗血清期间,伊利诺伊大学通过注射活病毒(3~4次)使母猪具备超免疫性,然后将母猪麻醉并抽血。通过简单的凝血和离心操作获得血清。若干家生产商为伊利诺伊大学开展的研究提供了少量资金。这些生产商的设施被作为试验现场。PRV暴发期间,在新生猪免疫处理方面开展的早期尝试并未取得显著的成功。一位经验丰富的疫苗公司代表指出,一半的猪注射血清、另一半作为空白对照可能导致对照组出现病毒复制和排出现象,进而导致注射超免血清猪体内的抗血清失去防护作用。这一意见获得了项目人员的认可。不久之后,研究证实,如果同一窝的所有猪均注射抗血清(或者采取更好的做法——若干个相邻猪窝的所有猪均注射抗血清),抗血清将发挥非常好的防护作用。
抗血清被证明是一种有效的预防性物质,但它最终并未投入使用。导致这一结果至少有两个原因:商业公司追求开发和生产过程的经济性,一般将重点放在疫苗开发活动上;批准这种可能含有外来病毒的产品会引发广泛的担忧,且这种产品缺乏实用的消毒方法。
二、疫苗诊断方法及其许可
1.历史。20世纪70年代初,兽医学诊断专家利用当时可用的试验手段,通过剖检、镜检、病毒分离和组织荧光抗体试验检测活病毒。
随着PRV的扩散,通过生物控制和诊断试验检测抗原和抗体(特别是以诊断、监管和根除为目的快速测试大量血清标本)成为一项迫切的需求。血清病毒中和试验是当时惟一可开展的血清学试验。该项试验从开始到结束,需要3天的时间。
血清学试验的首次改良是利用96孔板将血清病毒中和试验微型化。这次改良产生了一项金标准——微量滴定血清病毒中和试验。该试验被认为拥有良好的敏感性和特异性,且能够利用倍比稀释方法对抗体进行量化。但是,该试验同样需要消耗大量的时间和人力,特别是需要通过显微镜对多次反应进行观察。限制了每天可测试的样本数量。
下一项重大改良是爱德士实验室有限公司(缅因州,韦斯特布鲁克)于1986年获得批准的筛选试验——ELISA(HerdChek®Anti-PRV)。ELISA用于从大量血清标本中筛选PRV抗体,在推出之后不久就取代了血清病毒中和试验。ELISA可大大缩短试验时间,大幅提升实验室的处理能力,因为它不需要对血清标本进行滴定,反应速度快,试验结果通过机器读取和解释。
随着PRV疫苗被开发并广泛用于猪群,人们需要将接种PRV疫苗的猪与感染PRV的猪区分开。血清病毒中和试验和ELISA都可以检测PRV抗体,但无法区分疫苗抗体和野毒感染抗体。诊断专家和监管官员最初尝试根据血清病毒中和试验的抗体滴度将接种疫苗的生猪与感染生猪区分开。这种尝试所基于的假设是,相比接种疫苗,感染野毒能产生更强烈的体液反应。该方法将抗体滴度≤(1∶16)视为接种疫苗的结果,而不是感染的结果。但是,在任一生物系统中,不同猪(尤其是多次接种疫苗的猪)的抗体反应会呈现差异。这意味着,许多动物和畜群会被误判为感染或未感染。该方法在临床上多少能发挥一些作用,但不能作为监管决策(例如关于生猪跨州运输和其他监管问题的决策)的依据。
随着PRV在美国猪群中的持续扩散,生物控制成为首要的需求。诺登实验室(内布拉斯加州,林肯)于1977年批准了首个常规弱毒活疫苗和灭活PRV疫苗。总体而言,PRV弱毒活疫苗之所以得到广泛的应用,是因为它的免疫反应和所产生的防护作用优于灭活PRV疫苗。
PRV弱毒活疫苗和后续开发的二代基因缺失疫苗对于减少和防范PRV的临床症状十分有效。接种PRV弱毒活疫苗的猪后续感染PRV野毒株时,病毒较少侵入组织,且妊娠母猪未将病毒传播给胎猪。因此,该疫苗可防止流产。但是,接种PRV疫苗的猪感染PRV野毒株时至少排出成千的病毒,减少病毒的排出对于根除PRV至关重要。某些PRV弱毒活疫苗聚集在主要参与潜伏性感染的组织内(三叉神经节),进而阻断PRV野毒株通过重复感染实现潜伏的过程。
2. 疫苗和诊断方法的开发。私营企业曾针对猪群开发若干种基因缺失PRV疫苗。这些疫苗获得了动植物检疫署兽用生物制品中心的许可。首个基因缺失疫苗(含一套相应的血清学鉴别诊断试验)在“国家PRV根除项目”启动的前一年,即1988年获得许可。该疫苗毒株缺失糖蛋白基因gX(gG),由SyntroVet有限公司(堪萨斯州,雷那克萨)制造。该疫苗配套的ELISA血清学鉴别诊断试验(HerdChek®Anti-PRV-gpX)由爱德士实验室有限公司开发。多家生产商表示,这一名为“Marker Blue”的疫苗注射到北卡罗来纳州生猪密集区域的猪群体内后产生了高度的防护作用。一年之后,普强公司(密歇根州,卡拉马祖)获批了一种缺失gG基因的疫苗(Tolvid®)(配套相应的血清学鉴别诊断试验)。这两种疫苗都很有效,但诊断试验的敏感性不够理想。
表1列出了各类PRV疫苗、配套的鉴别诊断试验及其制造商和所采用的PRV毒株。
1990年,SyntroVet和IDEXX再次开展合作,推出了一种基于缺失糖蛋白基因gI(gE)的病毒开发出的新疫苗(SyntroVet PRV/Marker Gold®),含配套的ELISA血清学鉴别诊断试验(HerdChek®Anti-PRV-gl)。与首个基因缺失疫苗一样,Marker Gold在实践中表现出良好的功效。此外,血清学鉴别诊断试验的敏感性和特异性有显著提升。
另外两家生物制品公司也开发了缺失gE基因的疫苗。诺登实验室的PR-Vac®疫苗缺失天然gE基因。收购诺登实验室的史克必成公司于1990年开发并推出了一种血清学鉴别诊断试验——Clin- Ease-PRV®。勃林格殷格翰公司的PRV疫苗BioCeutic®与IDEXX开发的HerdChek®Anti-PRV-gI配套血清学鉴别诊断试验一起获得许可。
PR-Vac和PRV/Marker Gold®是根除项目期间应用最广泛的PRV疫苗。同时,IDEXX开发的HerdChek®Anti-PRV-gI ELISA试验方法成为确定生猪或猪群是否接种PRV疫苗、是否感染PRV的“标准”血清学鉴别试验。Tolvid疫苗非常有效,但配套的gG血清学鉴别诊断试验缺乏敏感性,对其使用造成了限制。此外,由于行业当时呈现明显的gE基因缺失技术标准化的趋势,缺失gG基因对Tolvid疫苗而言是一种缺点。在猪群中同时使用gG基因缺失疫苗和gE基因缺失疫苗会造成混淆,因为接种gG基因缺失疫苗的生猪会产生gE抗体,进而导致gE血清试验期间接种疫苗的猪群被错误地认定为感染猪群。反过来,利用gG ELISA对接种gE基因缺失疫苗的种猪进行试验时,也会产生错误的诊断结果。因此,PRV根除项目要想获得成功,必须为所有PRV疫苗确立统一的基因缺失标准。如果行业未能就PRV疫苗缺失哪种基因达成共识,将无法开展血清检测。对基因缺失疫苗进行标准化(至少删除表达gE的基因)的协议于1993年实施。
为检测PRV抗体,行业开发了其他若干种血清学试验方法。微粒浓缩荧光免疫分析和自动化乳胶凝集试验是两种在高通量诊断实验室得到广泛应用的方法。与ELISA类似,这两种试验以自动化方式开展,仅耗时2个小时,具有良好的敏感性和特异性。某些实验室持续将自动化乳胶凝集试验用于筛选PRV抗体。生物制品制造商还开发了补体结合、免疫扩散、对流免疫电泳、间接免疫荧光等其他若干种血清学试验方法,但都存在敏感性有限、耗时过长或难以实施的问题。
2005年11月3日,兽用生物制品中心批准了IDEXX基于gII(gB)糖蛋白开发的新型阻断式ELISA-PRV筛选试验方法。据报道,该试验的敏感性和特异性高达99.5%,已经取代了HerdChek Anti-PRV筛选试验。
PRV根除项目的成功很大程度上要归功于开发出高效PRV疫苗和配套血清学鉴别诊断试验方法的科学家和诊断专家。如果没有这些技术,这一项目根本不会存在。
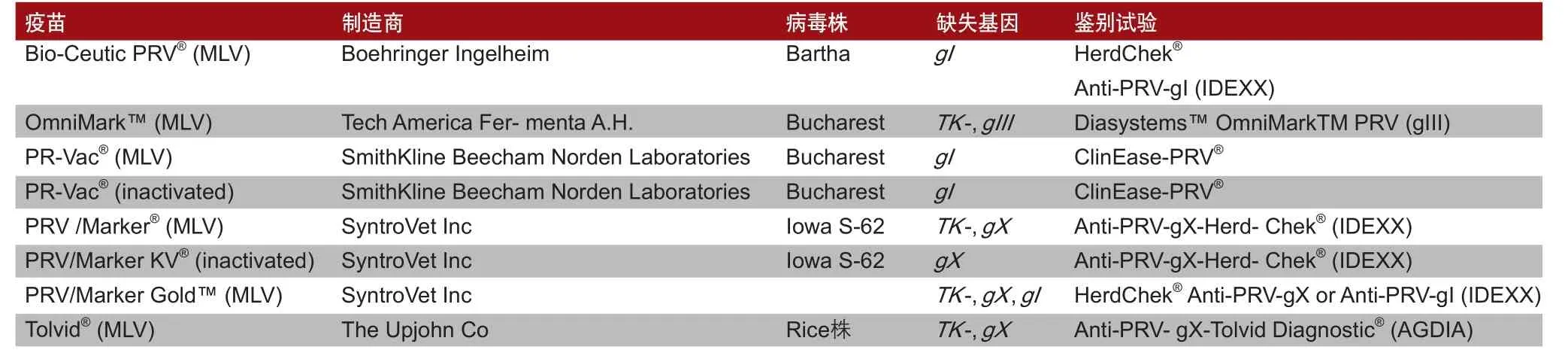
表1 PRV疫苗和伴随诊断鉴别试验
3.技术的实际应用。对于从事生猪药物工作的兽医而言,将鉴别试验投入实际应用是一项高难度的教学和辅导活动。首先,兽医们必须学习关于鉴别试验为什么具备可行性的基础理论。其次,他们必须让生产商相信这一新的测试理念是有效的。以往的经验表明,当前使用的大多数疫苗可有效防止生猪的临床疾病。
在疫苗的研究、开发和专利申请领域,科学家和动物卫生企业之间存在激烈的竞争。这种竞争促使多种基因缺失疫苗被批准并投放市场。开发这些疫苗的企业必须与开展动物诊断试验的企业合作,因为只有极少数的疫苗开发企业同时拥有生产经批准的疫苗和开发配套诊断试验所需的商业资产。
PRV根除活动初期,一些兽医在同一猪群中使用超过一种PRV疫苗。此外,某些PRV疫苗既不具备特异性,也未开发配套的试验方法。使用缺失不同基因的疫苗且未能充分保存记录的畜主发现,他们无法准确地解释试验结果,因而无法了解其猪群的状况。
最初,生产商和兽医期望试剂盒的敏感性和特异性达到100%。但是,实地条件下的经历表明,这一期望落空了。此外,不同系列的试剂盒的试验结果之间存在一些差异,而非特异性反应要在测试数千个样本之后才能观测到。当时,诊断专家、执业兽医和监管官员难以对造成试验结果冲突的众多原因进行分类。这些差异会造成一定的问题,少数生产商和兽医最初以此为由拒绝全面采用这一新技术。
4.小步前进。率先理解这一技术并将其成功运用于猪群净化方案的人士经常受到批评。这些人通常拥有自己的猪群,并利用自己的猪群来证明相关疫苗及配套诊断试验的效果。在学习过程中,很多人都有过“前进两步、后退一步”的经历。生猪行业的领导者通过召开论坛,对该技术应用的成败进行探讨。存在竞争关系的科学家和动物卫生公司的参与增加了这些讨论活动的复杂性。他们每个人都在鼓吹自己的技术优势。论坛的参与者定期汇报田间案例,并对其进行讨论。
关于成功案例的报告开始在生猪行业内传播,批评者甚至也开始注意到该技术在应用方面所取得的进展。随着试验技术的发展及各种试验方法的敏感性和特异性的提高,评估猪群净化方案的能力也有所提升。随着实践中应用数量的增加,这些产品开始证明哪些技术实现了疾病防控(疫苗)和实验准确性(诊断方法)的最佳结合。这些“优胜”的技术逐渐成为生猪行业的首选。
5.逐个完成。完成猪群净化活动的例子有很多。将完成此类活动所需的各个步骤整理成名为“猪群净化方案”的书面材料是一种普遍的做法。通过研究净化感染猪群的实例,可以更好地理解这一过程。
(1)初步联系。猪群的主治兽医联系疫苗公司的技术服务兽医前往某个PRV净化进度不如预期的猪群进行调查,并开展合作。
(2)现场访问。技术服务兽医和主治兽医审核验血结果和该猪群使用的PRV疫苗的品牌名称。
(3)分析。技术服务兽医和主治兽医确认,该猪群过去4年使用了两个品牌、缺失不同基因的PRV疫苗,其中一些年龄较大的生猪这两种疫苗都使用过;该猪群过去2年只使用了一种疫苗;尽管使用了疫苗,该猪群仍存在感染PRV的情况。
(4)养殖场访问。访问养殖场期间,技术服务兽医和主治兽医对畜主当前的操作方法进行观察。此外,他们还检查了疫苗接种记录和动物标识的完整性。
(5)初步行动计划。猪群管理人员识别出所有年龄大于2周岁的生猪,并在下一窝猪断奶之后将这些生猪出售,供宰杀。
(6)猪群重新接种疫苗。对整个猪群进行评估,确保所有生猪在过去90天均已接种疫苗。管理人员将没有标识的生猪出售,供宰杀。
(7)检测并挑选结果呈阴性的动物。对所有年龄小于2周岁、大于3个月的生猪进行检测,以确定野毒感染的血清学状况。如果某一猪只的测试结果呈阳性,该猪只将被尽快出售,供宰杀。血清反应呈阳性的猪只不会被用来交配。管理人员采取较为激进的措施清除曾注射两种不同品牌的基因缺失疫苗、感染PRV以及年龄较大的猪只。
(8)隔离。技术服务兽医和主治兽医建议,将年龄较大的猪只与年龄较小的猪只隔离。
(9)选择并使用同一品牌的疫苗。技术服务兽医和主治兽医提倡利用缺失同一种基因的疫苗产品继续开展疫苗接种工作。此外,这些咨询人员还建议,每90天对所有猪只开展一次疫苗接种工作,以尽量提高免疫性、尽量减少病毒的排出量。
(10)跟踪计划。在开展猪群净化90天后对年龄较小的猪只进行统计抽样,并在咨询人员的建议下开展分析工作,旨在更好地评估病毒在年龄较小、易受影响、接种疫苗的猪只之间的传播情况。这种分析还被用于向畜主证实净化项目已取得的进展。
(11)评估。如统计样本对野毒抗体的反应呈阴性,猪群净化方案不作变更。如任一样本的血清反应呈阳性,咨询人员将对猪群净化方案进行二次评估,明确方案的缺点并进行相应调整。
(12)区域评估。技术服务兽医和主治兽医对区域内的猪群密度进行评估,以确定猪群接触来自相邻猪群的PRV的风险。地区监管官员也参与决策过程,并为地区风险评估提供协助。
(13)完成。PRV通常在猪群净化方案启动两年内被清除。
每个猪群都面临着一系列挑战。某些时候,管理方法必须接受评估并进行多次变更。养殖场的雇员必须就如何实施各猪群净化方案的各个步骤接受教育和辅导。畜主对成功实施猪群净化方案的积极性存在差异。一位成功的兽医能了解所有这些不断变化的挑战。
猪群有时会出现意想不到的问题。管理人员在评估和监督过程中发现许多令人瞠目结舌的事件,例如心怀不满的雇员将疫苗倒入粪池。分析发现,养殖场的自来水中含有高浓度的氯,用这些自来水清洗注射器导致弱毒活疫苗失去活性。这些事件使人们关注到所有细节的重要性。
此外,试验期间偶尔会发现某一猪群只有一头猪的试验结果呈阳性(又称“个例”)。 有时对处死的猪只进行组织分析,发现其并未感染PRV。类似的意料之外的结果很少出现,但提醒人们:不同猪只之间的生物差异性也需要纳入考虑范畴。
6.基因缺失疫苗和诊断试剂盒的许可。PRV疫苗和诊断试剂盒在美国是依据《病毒-血清-毒素法案》(1913)(1985年修订版)接受监管的兽用生物产品。该法案规定,出售无效、受污染、危险或有害的兽用生物制品属非法行为,在美国境内或从美国运输的兽用生物制品必须是在经批准的设施内按美国农业部法规制备的产品。将这些产品投放美国市场之前,企业必须为其生产设施获取“美国兽用生物制品公司许可证”,并为其生产的每一种产品获取“美国兽用生物产品许可证”。
(1)疫苗的通用许可要求。某一经批准的兽用生物制品公司如想为某个PRV弱毒活疫苗获取兽用生物产品生产许可证,必须向动植物检疫署兽用生物制品中心提交兽用生物产品许可证申请,并出示生产数据和支持性数据为产品申请提供支持。生产大纲是产品制造和试验所依据的具体方案。
申请企业必须根据生产大纲提供数据证明产品的纯度、安全性和功效。将主毒种作为疫苗生产所用的所有毒种的来源有助于保持生产活动的统一性。主毒种连续传代的限定次数为5次。兽用生物制品中心的人员负责确保主毒种、主细胞库、原代细胞、动物源性成分和最终产品根据标准试验程序接受测试。产品的免疫原性必须通过具有统计有效性的动物疫苗接种和攻毒试验(通常采用20头接种疫苗的生猪和5头对照组生猪)予以证明。疫苗接种必须在生产大纲规定的年龄最小的动物身上实施,并采用最低数量的抗原。产品应采用主毒种繁殖的最高代次的毒种生产。申请企业必须确定产品标签显示的各个成分的功效。具体的攻毒方法和作用确定保护力的标准随免疫原的变化而变化。每一系列产品被许可之前,兽用生物制品中心的人员还会要求测定产品的效价。
安全测试结合了一系列研究工作。产品一般以10倍剂量在动物宿主体内使用以接受评估。活疫苗产品必须进行特征化处理,以确定其是否有能力从宿主体内排出,进而传播至与宿主接触的动物体内。为了解遗传稳定性及实践中疫苗注入动物体内的预期结果,需开展直肠研究。
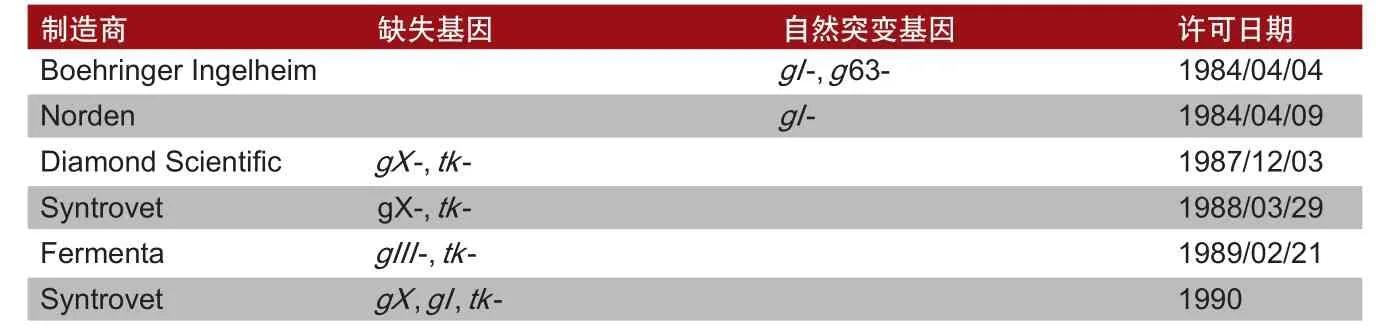
表2 获得许可的基因改造PRV疫苗
一旦实验室完成特征化研究,即可以获得额外的安全数据为目的开展田间试验。田间安全试验的设计目的是检测产品开发期间未观察到的意外反应。相关试验在动物宿主体内开展,分布在各类场所,使用大量易感的动物。试验动物应能代表拟使用相关产品的所有年龄阶层和饲养方法。
获得生产许可证的企业需在其经批准的设施内根据批准的生产大纲连续生产3个批次符合要求的产品,并将主毒种、主细胞库和这些批次产品的标本发送给兽用生物制品中心的实验室以接受许可前测试,以确认企业的试验结果。
申请企业满足所有要求(包括标签、宣传资料的审核和验收方面的要求)之后,兽用生物制品中心发放“美国兽用生物产品许可证”。
(2)基因缺失疫苗的其他要求。兽用生物制品中心认为,重组体衍生的弱毒活疫苗与常规方法生成的疫苗之间没有重大差异。因此,该中心认为现有法律法规适用于新型基因改造PRV疫苗,并要求这些疫苗满足上文描述的适用于常规疫苗的纯度、安全性和功效许可标准。但是,《国家环境政策法案》则要求,为这些基因改造活疫苗申请许可证的企业在疫苗被放行之前开展研究工作,评估这些疫苗对人类环境可能产生的所有影响。需开展的调查活动包括通过研究描述重组微生物的生物化学特性,评估其在体内外的遗传稳定性,检查其在宿主体内的组织嗜性或毒性是否有任何变化,评估其从宿主体内排出并扩散至靶宿主和非靶宿主的可能性,评估其在环境中持续生存的能力,检查其与类似的微生物野毒株进行重组的可能性。在产品投入现场试验或获得许可证之前,兽用生物制品中心的人员利用来自这些研究活动的数据,根据《国家环境政策法案》开展风险分析,为环境评估做准备。《国家环境政策法案》的程序还要求,该中心通过《联邦公报》公示其拟开展的所有重组体微生物许可。
针对首类基因改造疫苗(缺失PRV基因组中的两个基因),企业在获准开展田间试验之前必须满足《国家环境政策法案》的要求。为确定该基因对人类环境的安全性,企业需通过开展研究工作证明:
①基因改造PRV活疫苗病毒无毒性,完全有能力引发使生猪免于感染PRV的免疫反应,但无法诱导产生gG抗体。因此,感染生猪与接种疫苗的生猪之间存在血清学差异。②接种疫苗的生猪或哨兵动物的鼻拭子无法证明这种由重组体DNA技术产生的疫苗病毒发生了传播。③接种重组疫苗可减少野毒株的复制和排出现象。因此,这种疫苗可减少烈性病毒在环境中的传播。④缺失TK基因是疫苗病毒的一个稳定特性,这种缺失出现逆转的可能性基本为零。⑤PRV野毒株在自然界分布广泛,且不含致癌基因或致癌物质。由于不含任何新的遗传信息,病毒所产生的重组体不可能具有致癌性。⑥PRV野毒株对人类无致病性。缺失两个基因是重组体衍生的疫苗与PRV野毒株存在的惟一区别。因此,重组体衍生的疫苗也被认为对人类无致病性。⑦生产该疫苗的企业制备并进行特征化处理的主毒种与亲株的生物性质相同。向兽用生物制品中心提交的数据确立了用于制备实验疫苗的两个病毒库之间的相互关系。在此基础上,兽用生物制品中心确定重组体衍生的活病毒疫苗的田间试验不会对人类环境产生重大影响。
除评估整体安全性之外,现场研究还包括评估该疫苗对公猪的精子质量、母猪和幼年母猪的生殖能力及在自然环境下饲养的架子猪的感染率和长势的影响。现场研究结束且数据表明安全性符合要求之后,兽用生物制品中心在《联邦公报》发布第二份公告,并在环境评估中考虑预示该产品将获得许可证的田间试验结果。重组体后续衍生的PRV疫苗(见表2)的许可工作重复这一过程。通过选择天然突变的病毒开发出的疫苗以常规疫苗的身份获得许可。
(3)诊断方法通用许可要求。诊断产品的许可在申请、证明材料和程序方面与上文针对常规疫苗描述的内容一致,区别在于支持性数据必须涉及多项问题。诊断产品的数据必须证明产品的敏感性、特异性、耐用性、重复性、适用性及预测值。此类数据通过将新的诊断试验方法与当前的“金标准”进行对比来获得对高度特征化的参考标本(来自至少20只动物)进行测试,标本取自PRV测试结果呈阴性的动物(未被感染的动物)、PRV测试结果呈强阳性的动物、PRV测试结果呈弱阳性的动物、所产生的分析值在阈值周围的标本,对密切相关的抗原(可能是交叉反应性抗原)有反应的动物或接种疫苗的动物及只对多抗原反应性检测试剂盒中的某一个或某一组抗原有反应的动物。
(4)PRV诊断试验的审批。随着防止PRV扩散的生猪跨州流动法规的发布,经批准的PRV诊断试验被要求只在经批准的实验室内开展。因此,兽用生物制品中心批准某项PRV诊断试验方法并不会自动授权相关机构在生猪跨州流动的官方测试中采用该方法。除获得许可证之外,PRV诊断试验还需获得动植物检疫署国家兽医服务实验室人员的审批推荐,并获得动植物检疫署国家动物卫生项目中心的批准,动植物检疫署同时也是联邦负责发布《州-联邦-行业PRV根除项目标准》的机构。

表3 20世纪90年代中期获得许可的PRV鉴别试验方法
PRV诊断试验批准程序的设计目的是为该试验的潜在用户提供体验产品的机会,并使合作方能更可靠地确定疫苗产品能否按标签上描述的内容发挥作用,并在各类指定现场条件下和不同实验室内产生一致的、可再现的结果。为此,制造商负责开展田间试验,并将结果上报给美国兽医实验室诊断专家协会、美国动物卫生协会和国家兽医服务实验室。同时,制造商要向至少3个位于美国不同地区的实验室提供试剂盒,比对金标准测试参考标本和实地标本。国家兽医服务实验室、美国兽医实验室诊断专家协会与国家动物卫生项目中心、兽用生物制品中心共同审核这些实验室提供的与产品在PRV根除项目中的潜在用途有关的数据。如符合前述设计目的,相关试验方法将获得审批推荐,国家动物卫生项目中心将通过《联邦公报》发布公告告知利益相关方:该方法被批准用于经批准的PRV根除项目官方检测实验室。
PRV鉴别试验的批准程序还要求试验方法能将接种疫苗的生猪与感染野毒株的生猪区分开。此外,试验方法应:仅用于接种相关官方批准的基因改造疫苗的猪群;用于对猪群(而非单头生猪)进行诊断;在经国家兽医服务实验室批准的实验室实施。
首个PRV鉴别试验方法于1988年8月1日获得批准,并于1990年5月9日成为供PRV根除项目使用的“经批准的PRV鉴别试验方法”。截至20世纪90年代中期,已有5个PRV鉴别试剂盒获得许可,其中2个PRV鉴别试剂盒获得批准用于根除项目(见表3)。