辣椒素酯合成实验
2017-11-27段建利杨志刚
段建利, 杨志刚
(武汉大学 药学院, 湖北 武汉 430071)
辣椒素酯合成实验
段建利, 杨志刚
(武汉大学 药学院, 湖北 武汉 430071)
以6-溴己酸为起始原料,利用Wittig反应,制备以Z-8-甲基- 6-壬烯酸为主的产物,然后在NaNO2—HNO3的作用下,转化为以E-8-甲基- 6-壬烯酸为主的产物,经后处理得到E-8-甲基-6-壬烯酸。在酶催化作用下,E-8-甲基-6-壬烯酸选择性地与香草醛的醇羟基反应,得到辣椒素酯。实验过程让学生灵活应用知识、科学组合,更加贴近真实的药物研发过程,提高了学生的学习兴趣。
辣椒素酯; Wittig反应;酶催化
1 辣椒素酯
辣椒素酯类化合物是来源于辣椒属植物的一类化合物,其结构特点是不饱和脂肪酸通过酯键与香草醇的醇羟基连接。1989年,Yazawa等人发现,一种名为CH-19 Sweet的无辣味的辣椒品种中,仅含有少量的辣椒素类化合物,但含有大量的辣椒素类似物(capsaicinoid-like substances, CLS),根据Rf值的差异,将TLC上2个主要的斑点暂时命名为CLS-A和CLS-B。Yazawa等人猜测辣椒素类似物可能是辣椒素类化合物生物合成过程中的前体化合物[1]。1998年,Kobata等人从CLS-A中分离得到香草醇,从CLS-B中分离得到2个化合物,并进行结构确认,将这2个化合物命名为辣椒素酯(capsiate)和二氢辣椒素酯(dihydrocapsiate),并且用化学方法合成二氢辣椒素酯[2]。1999年,Kobata等人从CH-19 Sweet中分离得到另一种辣椒素酯类化合物,命名为降二氢辣椒素酯(nordihydrocapsiate)[3]。自然界中天然存在的辣椒素酯类化合物主要是辣椒素酯,虽然辣椒素酯来源于辣椒属植物,但并没有辛辣味,所以其药理活性受到广泛关注。图1为辣椒素酯类化合物的化学结构,图中1、2、3为编号。

图1 辣椒素酯类化合物的化学结构
已有文献报道,辣椒素酯类化合物具有抗氧化作用[4]、TRPV1 受体激活作用[5]、葡萄糖代谢增强作用[6]、抗肿瘤作用[7]、抗炎作用[8]、黏膜保护作用[9]、减肥作用[10-12]等药理活性。辣椒素酯的药理研究主要集中在减肥作用。因为新一代减肥药的辣椒碱在临床研究阶段呈现显著的剂量依赖关系,并因其自身辛辣味的制约,使人无法接受而遭到失败。因此,与辣椒碱具有相同药理用但不具有辛辣味的辣椒素酯在减肥中的应用受到研究人员的关注。
文献报道的辣椒素酯的合成方法主要有以下几种:(1)利用wittig反应制备顺式不饱和脂肪酸,然后进行烯烃的顺反转化,得到反式不饱和脂肪酸,再进一步与香草醇反应,得到辣椒素酯[13-14];(2)辣椒碱在酸性条件下发生醇解,得到不饱和脂肪酸甲酯,然后在脂肪酶的催化作用下,与香草醇反应制备辣椒素酯[15-16];(3)以香草醛为起始原料,经酚羟基保护和还原后得到酚羟基带有保护基的香草醇,进一步与反式不饱和脂肪酸反应,再脱保护,得到辣椒素酯[17]。
Wittig反应(见图2)是合成化学中非常有价值的一种合成方法,常用于从醛、酮直接合成烯烃。非稳定型的磷叶立德是一种强亲核试剂,能在温和条件下迅速与醛、酮反应,产物一般以顺式烯烃为主,并含有少量反式烯烃。图2中4—10为编号。
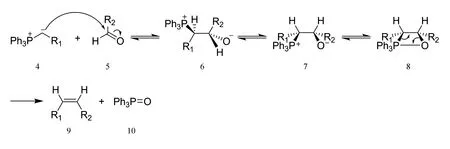
图2 Wittig反应机理
酶催化与化学催化相比,具有高效性、专一性、温和性等特点,而且反应过程中使用的溶剂量较少,酶可以回收使用,在工业中应用非常广泛。
因此,本实验利用Wittig反应制备辣椒素酯的不饱和脂肪酸部分,然后利用脂肪酶催化香草醇和不饱和脂肪酸的反应得到辣椒素酯。
2 实验原理
辣椒素酯的合成路线见图3(图中11—14和1为编号)。
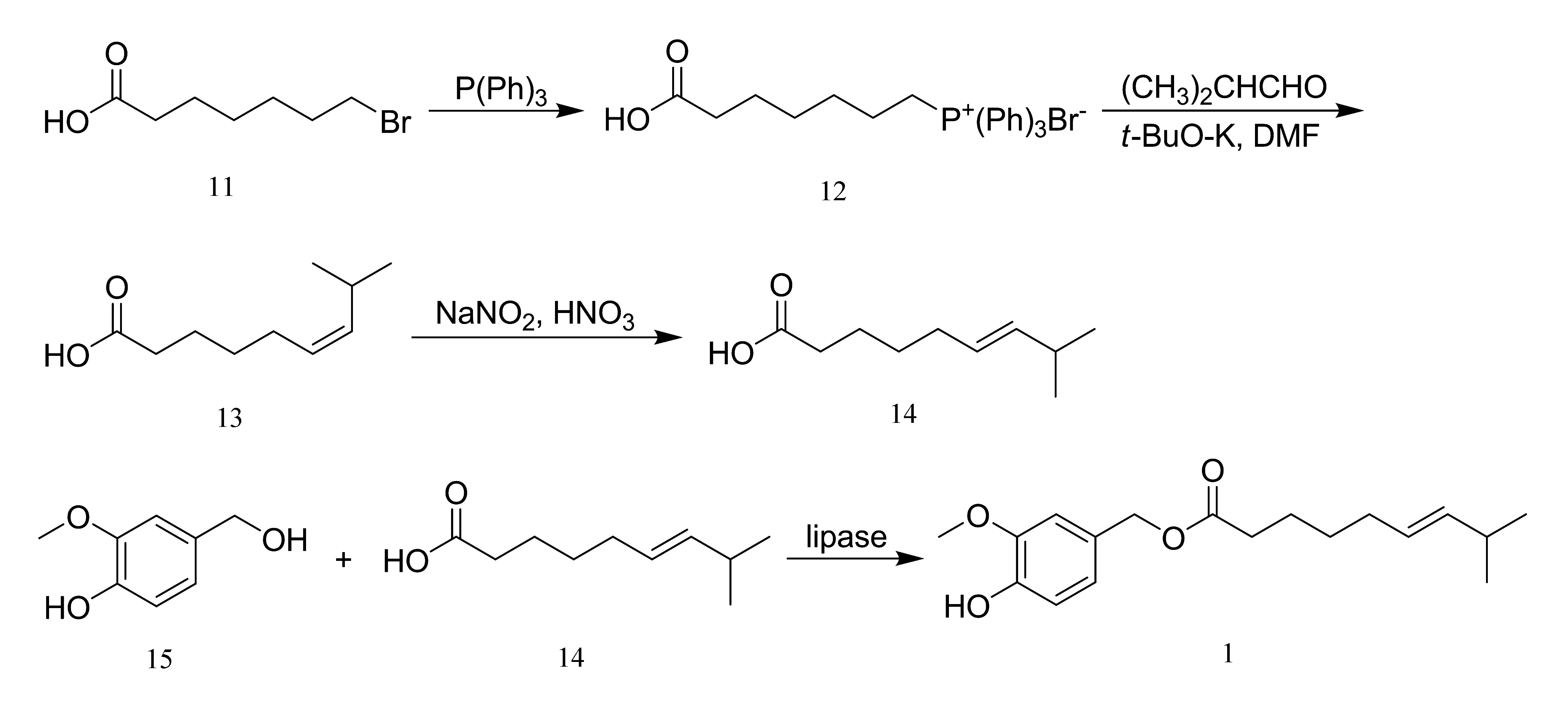
图3 辣椒素酯合成路线
本实验以6-溴己酸为起始原料,与三苯基膦反应,制得Wittig反应所需的磷叶立得;然后在叔丁醇钾的作用下与异丁醛反应,形成以Z-8 -甲基-6-壬烯酸为主的产物,再经过烯烃的顺反转化,得到E-8-甲基-6-壬烯酸;最后在酶的催化作用下,E-8-甲基-6-壬烯酸选择性地与香草醇的醇羟基反应,得到辣椒素酯。
3 仪器和试剂
仪器:电磁加热搅拌器(C-MAG HS 7,IKA©),液相色谱HPLC仪(LC-20AD,日本岛津),AV400(Bruker公司)核磁共振仪。
试剂:6-溴己酸,三苯基膦,乙腈,乙酸乙酯,石油醚,无水硫酸镁,N,N-二甲基甲酰胺,叔丁醇钾,异丁醛,盐酸,氯化钠,亚硝酸钠,硝酸,环己胺,氯仿,香草醇,Novozym435,均为分析纯。色谱级乙腈和三氟乙酸。
4 液相色谱仪检测条件
液相色谱仪:岛津SPD-20AD,色谱柱:月旭Polar-RP极性色谱柱(4.6×250 mm 2 μm),流动相:乙腈:0.1%三氟乙酸水溶液(体积比为60∶40),流速为1 mL/min,进样量为20 μL,样品运行时间为30 min。定量方法:面积归一化法。
5 实验内容
5.1 5-羧基戊基-三苯基溴化磷(图3中12)的合成
25 mL反应瓶中依次加入6-溴己酸(5.00 g,25.6 mmol),三苯基膦(6.71 g,25.6 mmol),乙腈(12 mL),加热至回流,TLC监测反应完全后停止反应;反应液冷却至室温,过滤,干燥,得到产物9.78 g,收率83.6%。产物不经处理,直接用于下步反应。
5.2 Z-8-甲基-6-壬烯酸(图3中13)的合成
100 mL反应瓶中依次加入5-羧基戊基-三苯基溴化磷(9.00 g,19.7 mmol),N,N-二甲基甲酰胺(30 mL),降温至-20 ℃;将叔丁醇钾(4.42 g,39.5 mmol)溶解在N,N-二甲基甲酰胺(30 mL)中,滴加至上述反应液中,滴毕后保温反应1 h,再升至室温反应2 h,反应体系再次降温至-20 ℃,滴加异丁醛(2.13 g,29.6 mmol),滴毕后升至室温反应;反应完毕后,稀盐酸调节pH至2~3,乙酸乙酯(30 mL×2)萃取,合并有机相;有机相水洗,干燥,浓缩,得到粗品11.2 g;粗品用石油醚洗涤,过滤。所得滤液经快速过柱纯化,得到产物1.70 g,收率50.9%。
核磁共振氢谱1H-NMR(CDCl3),化学位移δ:0.92(s,3H,CH3),0.94(s,3H,CH3),1.39(m,2H,CH2),1.64(m,2H,CH2),2.04(m,2H,CH2),2.35(m,2H,CH2),2.58(m,1H,CH),5.20(m,2H,CHCH)。
5.3 E-8-甲基-6-壬烯酸(图3中14)的合成
5 mL反应瓶中加入Z- 8 -甲基- 6-壬烯酸(1.30 g,7.6 mmol),降温至0 ℃;向上述反应瓶中依次加入2 mol/L亚硝酸钠溶液(0.8 mL)、6 mol/L硝酸溶液(0.5 mL),滴毕后升至70 ℃,保温反应4 h;然后降至室温,加水稀释,二氯甲烷萃取2次,合并有机相;有机相水洗,干燥,过滤,滤液旋干后经快速柱层析纯化,得到E-8-甲基-6-壬烯酸粗品1.00 g,收率76.9%。
将E-8-甲基-6-壬烯酸粗品(0.80 g,4.7 mmol)溶于二氯甲烷中,滴加乙二胺-二氯甲烷溶液,浓缩,稀盐酸酸化,得到E-8-甲基-6-壬烯酸0.30 g,收率37.5%。
HPLC纯度98%。1H-NMR(CDCl3),δ:0.94(s,3H,CH3),0.95(s,3H,CH3),1.39(m,2H,CH2),1.62(m,2H,CH2),1.98(m,2H,CH2),2.21(m,1H,CH),2.34(m,2H,CH2),5.34(m,2H,CHCH)。
5.4 辣椒素酯(图1中的1)的合成
5 mL反应瓶中依次加入香草醇(0.17 g,1.1 mmol),E-8-甲基- 6-壬烯酸(0.20 g,1.2 mmol),Novozym435(0.02 g),加热至50 ℃反应2 h;降至室温,加入石油醚,过滤,滤液经快速柱层析纯化,得到产物0.18 g,收率53.5%。
HPLC纯度93%。1H-NMR(CDCl3),δ:0.93(s,3H,CH3),0.95(s,3H,CH3),1.37(m,2H,CH2),1.62(m,2H,CH2),1.95(m,2H,CH2),2.19(m,1H,CH),2.32(m,2H,CH2),3.89 (s,3H,OCH3),5.02(s,2H,ArCH2),5.33(m,2H,CHCH),6.86(s,1H,ArH),6.88(s,2H,ArH)。
6 教学要求
(1) 预习要求:查阅参考文献,了解辣椒素酯的药理作用及其化学合成方法,了解Wittig反应过程中的注意事项,了解酶催化在药物合成中的应用,熟悉液相色谱仪的原理和操作方法。
(2) 实验结果要求:利用Wittig反应获取Z- 8 -甲基- 6-壬烯酸,并顺利完成烯烃的顺反转化,得到E- 8 -甲基- 6-壬烯酸,最终完成辣椒素酯的化学合成;根据液相色谱仪检测结果,用面积归一化法给出相关产物的液相检测结果;根据核磁结果,正确解析核磁谱图。
7 结语
如何将课堂上学到的知识灵活运用、科学组合,提高合成效率,优化合成路线,是药学专业学生所必须面对的一个实际问题。本实验将药物合成中经典的Wittig反应和酶催化相结合,完成辣椒素酯的化学合成。同时,通过液相色谱仪对中间体和辣椒素酯进行检测,达到控制产品质量的目标。此外,利用核磁谱图对中间体和辣椒素酯进行结构鉴定和分析。整个实验过程更加贴近真实的药物研发过程,提高了学生的学习兴趣,让学生对药物的研发过程有了一个初步的认识和了解。
References)
[1] Yazawa S, Suetome N, Okamoto K, et al. Content of Capsaicinoids and Capsaicinoid-like Substances in Fruit of Pepper (CapsicumannuumL.) Hybrids Made with ‘CH-19 Sweet’ as a Parent[J]. Journal of the Japanese Society for Horticultural Science, 1989, 58(3):601-607.
[2] Kobata K, Todo T, Yazawa S, et al. Novel Capsaicinoid-like Substances, Capsiate and Dihydrocapsiate, from the Fruits of a Nonpungent Cultivar, CH-19 Sweet, of Pepper (CapsicumannuumL.)[J]. Journal of Agricultural and food chemistry, 1998, 46(5):1695-1697.
[3] Kobata K, Sutoh K, Todo T, et al. Nordihydrocapsiate, a New Capsinoid from the Fruits of a Nonpungent Pepper,Capsicumannuum[J]. Journal of Natural Products, 1999, 62(2):335-336.
[4] Rosa A, Atzeri A, Deiana M, et al. Protective Effect of Vanilloids against Tert-butyl Hydroperoxide-induced Oxidative Stress in vero Cells Culture[J]. Journal of Agricultural and Food Chemistry, 2008, 56(10):3546-3553.
[5] Lida T, Moriyama T, Kobata K, et al. TRPV1 Activation and Induction of Nociceptive Response by a Non-pungent Capsaicin-like Compound,Capsiate[J]. Neuropharmacology,2003,44(7):958-967.
[6] Kwon D Y, Kim Y S, Ryu S Y, et al. Capsiate Improves Glucose Metabolism by Improving Insulin Sensitivity Better Than Capsaicin in Diabetic Rats[J]. The Journal of Nutritional Biochemistry, 2013, 24(6):1078-1085.
[7] Pyun B J, Choi S, Lee Y, et al. Capsiate, a Nonpungent Capsaicin-like Compound, Inhibits Angiogenesis and Vascular Permeability via a Direct Inhibition of Src Kinase Activity[J]. Cancer Research, 2008, 68(1):227-235.
[8] Lee J H, Lee Y S, Lee E J, et al. Capsiate Inhibits DNFB-Induced Atopic Dermatitis in NC/Nga Mice through Mast Cell and CD4+ T-Cell Inactivation[J]. Journal of Investigative Dermatology, 2015, 135(8):1977-1985.
[9] Li N S, Luo X J, Dai Z, et al. Beneficial Effects of Capsiate on Ethanol-induced Mucosal Injury in Rats are Related to Stimulation of Calcitonin Gene-related Peptide Release[J]. Planta Medica, 2012, 78(1):24-30.
[10] Ohnuki K, Haramizu S, Oki K, et al. Administration of Capsiate, a Nonpungent Capsaicin Analog, Promotes Energy Metabolism and Suppresses Body Fat Accumulation in Mice[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(12):2735-40.
[11] Faraut B, Giannesini B, Matarazzo V, et al. Capsiate Administration Results in an Uncoupling Protein-3 Downregulation, an Enhanced Muscle Oxidative Capacity and a Decreased Abdominal Fat Content in vivo[J]. International Journal of Obesity, 2009, 33(12):1348-1355.
[12] Haramizu S, Kawabata F, Ohnuki K, et al. Capsiate, a Non-pungent Capsaicin Analog, Reduces Body Fat without Weight Rebound like Swimming Exercise in Mice[J]. Biomedical Research, 2011, 32(4):279-284.
[13] 杨艳, 金永生, 董真秀, 等. 辣椒素和辣椒酯的合成[J]. 高等学校化学学报, 2007, 28(7):1310-1312.
[14] Appendino G, Minassi A, Daddario N, et al. Chemoselective Esterification of Phenolic Acids and Alcohols[J]. Organic Letters, 2002, 4(22):3839-3841.
[15] 董新荣, 刘仲华, 李雨虹, 等. 天然辣椒素酯的酶促合成与生物活性[J]. 天然产物研究与开发, 2009, 21(2):570-573.
[16] Kobata K, Kawaguchi M, Watanabe T. Enzymatic Synthesis of a Capsinoid by the Acylation of Vanillyl Alcohol with Fatty Acid Derivatives Catalyzed by Lipases[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(2):319-327.
[17] Barbero G F, Molinillo J M G, Varela R M, et al. Application of Hansch’s Model to Capsaicinoids and Capsinoids: A Study Using the Quantitative Structure-Activity Relationship. A Novel Method for the Synthesis of Capsinoids[J]. Journal of Agricultural and Food Chemistry, 2010, 58(6):3342-3349.
Experiment of synthesis of capsiate
Duan Jianli, Yang Zhigang
(School of Pharmacy, Wuhan University, Wuhan 430071, China)
By taking the 6-bromo acid as the starting material and by using the Wittig reaction, the product with the Z-8-methyl-6-azelaic acid as the main content is prepared. Then, under the action of NaNO2—HNO3, it is transformed into the product with E-8-methyl-6-azelaic acid as its main content, and after the treatment, the E-8-methyl-6-azelaic acid is obtained. Under the action of enzyme catalysis, the capsiate is obtained by the alcohol hydroxyl reaction of the E-8-methyl-6-azelaic acid and the vanillin. The experimental process allows the students to flexibly apply the knowledge, and make the scientific combination, which is closer to the real drug Ramp;D process, and improves the students’ interest in learning.
capsiate; Wittig reaction; enzyme catalysis
10.16791/j.cnki.sjg.2017.11.016
O6-33;TQ464.4
A
1002-4956(2017)11-0058-03
2017-05-08
国家自然科学基金项目(21402144);武汉大学教学研究项目(2017JG056)
段建利(1979—),男,湖北随州,博士,实验师,主要从事有机化学和药物化学实验教学.
