高精料对泌乳奶山羊瘤胃上皮氧化应激和胆固醇代谢的影响
2017-11-24耿雅丽田平罗燕文华灿枫陶诗煜田靖倪迎冬
耿雅丽,田平,罗燕文,华灿枫,陶诗煜,田靖,倪迎冬
(南京农业大学,农业部动物生理生化重点开放实验室,江苏 南京 210095)
高精料对泌乳奶山羊瘤胃上皮氧化应激和胆固醇代谢的影响
耿雅丽,田平,罗燕文,华灿枫,陶诗煜,田靖,倪迎冬*
(南京农业大学,农业部动物生理生化重点开放实验室,江苏 南京 210095)
为了研究长期或短期饲喂高精料日粮对泌乳期奶山羊瘤胃上皮组织氧化应激和胆固醇代谢的影响,实验选用17只健康的经产泌乳中期关中奶山羊,随机分为3组:饲喂低精料组(对照组,LC,n=5);长期饲喂高精料组(HL,n=7),19周饲喂期;短期饲喂高精料组(HS,n=5),4周饲喂期。实验结束后采集瘤胃组织,用PBS反复清洗,于液氮中速冻后置于-80 ℃冰箱保存。结果显示,与对照组相比,HL和HS组山羊瘤胃上皮组织中细胞周期相关基因CDK2和CDK4 mRNA表达水平显著升高(Plt;0.05),且HS组p-ERK1/2蛋白表达显著升高(Plt;0.05),但GPR41和GPR43蛋白表达无显著变化(Pgt;0.05);HL和HS组山羊瘤胃上皮组织促细胞凋亡基因Casepase9 mRNA表达显著升高(Plt;0.05),HS组抗凋亡Bcl-2/BaxmRNA表达比例呈下降趋势(0.05lt;Plt;0.1);HS组瘤胃上皮组织中抗氧化酶CAT和总抗氧化能力T-AOC显著升高(Plt;0.05),HL组CAT含量和SOD酶活性显著升高(Plt;0.05),但总抗氧化能力T-AOC无显著差异(Pgt;0.05);HS组瘤胃上皮组织中胆固醇含量下降达显著水平(Plt;0.05),且HL组呈下降趋势(0.05lt;Plt;0.1),胆固醇酰基转移酶ACAT1和ACAT2基因表达显著上调(Plt;0.05),HS组瘤胃上皮组织中胆固醇的含量与ACAT1和ACAT2 mRNA的表达呈显著的负强相关(P=0.0067,r=-0.8208;P=0.0100,r=-0.7980)。与对照组比较,HS和HL组瘤胃上皮组织中VFA转运相关基因AE2、DRA、NHE2、NHE3和νH+ATPasemRNA表达显著升高(Plt;0.05),NHE2蛋白表达升高但未达显著差异水平(Pgt;0.05)。与HL组相比,HS组山羊瘤胃上皮组织中总抗氧化能力T-AOC显著升高(Plt;0.05);且胆固醇含量显著下降(Plt;0.05)。以上结果说明,短期饲喂高精料日粮可加快泌乳期奶山羊瘤胃上皮组织的更新,提高组织总抗氧化能力;而长期饲喂高精料日粮未引起细胞增殖相关蛋白和总抗氧化能力的显著变化;饲喂高精料日粮可以加快瘤胃上皮组织对VFA的转运。此外,饲喂高精料日粮引起瘤胃上皮组织内胆固醇含量降低,胆固醇酰基转移酶基因表达的显著上调,提示其对瘤胃上皮组织更新的潜在影响。
高精料;瘤胃上皮;氧化应激;胆固醇;山羊
为提高反刍动物的生产性能,常给泌乳反刍动物饲喂高精料日粮来满足其高产乳的能量需求。然而,高精料日粮易引起瘤胃异常发酵,有害代谢产物蓄积,导致亚急性瘤胃酸中毒(subacute ruminal acids, SARA),甚至诱发乳房炎、蹄叶炎和子宫内膜炎等临床常见疾病[1]。瘤胃是反刍动物特有的器官,并且是反刍动物消化代谢和营养吸收最重要的场所之一。瘤胃上皮吸收瘤胃发酵产生的能量、营养物质,其生长发育情况直接影响反刍动物的生产性能[2]。在正常生理状态下,反刍动物瘤胃上皮组织产生自由基,同时也产生或从食物中直接获得抵抗自由基的抗氧化物质,以抵抗自由基对细胞的氧化损伤,抗氧化指标能反映瘤胃上皮组织自由基代谢的变化。G蛋白偶联受体是一种与三聚体G蛋白偶联的细胞表面受体。GPR41和GPR43是目前已知的两种特异性短链脂肪酸受体[3],在瘤胃上皮组织中广泛表达[4]。细胞外信号调节激酶(ERK)分为ERK1和ERK2,统称为ERK1/2。ERK1/2被激活后磷酸化进入细胞核作用于E1k-1,c-myc,c-fos,c-jun,ATF和AP-1等转录因子,促进与细胞增殖和分化相关基因的转录与表达。有研究显示,GPR41和43与ERK共同参与对细胞增殖、分化及发育的调节过程[5-6]。瘤胃发酵的主要产物是挥发性脂肪酸(volatile fatty acid, VFA),主要包括乙酸,丙酸和丁酸。VFAs经瘤胃上皮吸收可以满足反刍动物50%~70%的能量需要[7]。瘤胃内的VFA主要以自由扩散和载体转运的方式被吸收,在上皮细胞中介导VFA转运的载体主要包括钠氢交换蛋白(Na+/H+exchanger, NHE)、单羧酸转运蛋白(monocarboxylate transporter, MCT)和阴离子交换蛋白(anion exchanger protein, AE)等[8-9]。
胆固醇是细胞膜的重要组成成分,也是合成胆汁酸和多种甾醇类激素的前体,在动物机体中具有重要的生理功能。有研究发现,细胞内胆固醇或其代谢物与DNA合成激发有关,其合成途径中的许多产物也对维持细胞正常功能起十分重要的作用,包括膜结构与功能的完整性、细胞信号传导、某些蛋白质合成,以及细胞周期进程的调控等[10]。正常情况下细胞通过自身合成获得内源性胆固醇, 通过摄取低密度脂蛋白(low density lipoprotein, LDL)获取外源性胆固醇, 同时也不断向细胞外排出胆固醇, 使细胞胆固醇处于严格的动态平衡之中, 胆固醇过高或过低都将影响细胞的功能[11]。反刍动物瘤胃上皮细胞利用瘤胃内的VFAs合成胆固醇,避免了VFAs在瘤胃内的蓄积,降低瘤胃酸中毒的风险。已有研究表明,SARA易感牛和SARA耐受牛的瘤胃上皮吸收VFA的速率无明显差异,但与SARA易感牛相比,SARA耐受牛瘤胃上皮细胞胆固醇合成相关基因的表达水平显著升高[12],且胆固醇的含量与反刍动物瘤胃上皮组织的通透性、炎症及增殖密切相关[13-14]。
反刍动物饲喂高精料易使瘤胃内微生物菌群发生改变,瘤胃代谢紊乱,VFA总量增加,瘤胃液pH降低,脂多糖(lipopolysaccharide, LPS)含量升高等[15-16],这会导致瘤胃乳头变大数量增多,同时瘤胃上皮的转运功能也受影响。目前,有关高精料日粮对瘤胃上皮功能的影响研究多集中于短期实验,而长期饲喂的影响研究尚未见报道。因此本研究以泌乳期奶山羊为模型,旨在研究长期饲喂高精料对瘤胃上皮组织VFA转运和胆固醇代谢的影响及相关调节机制。
1 材料与方法
1.1试剂与仪器
试剂:TRIzol Reagent(购自上海英俊生物技术有限公司);SYBR Premix(购自Biotool公司)。
仪器:Ex TaqTM(购自Takara 公司);冷冻离心机(Allegra TM64R,BECKMAN COULTERTM,USA);组织匀浆器;PCR仪(STRATAGENE,USA);酶标仪(Synergy2,Biotek,USA);NanoDrop TM1000 (Thermo Scientific,USA)。
1.2试验动物与饲养
试验于2015年4月27日开始选用健康的经产泌乳期关中奶山羊17只,体重与泌乳量相近,随机分为低精料日粮组(精粗比35∶65,n=10)和长期饲喂高精料日粮组(精粗比65∶35,n=7)。饲喂15周后,将对照组羊分为2组,一组继续饲喂低精料日粮作为实验对照组(LC,精粗比35∶65,n=5),另一组饲喂高精料日粮,饲喂期为4周,作为高精料日粮短期饲喂组(HS,精粗比65∶35,n=5)。长期饲喂高精料日粮组饲喂期为19周(HL,精粗比65∶35,n=7)。
1.3样品采集、处理与分析测定
1.3.1样品的采集 采取瘤胃组织,迅速用磷酸缓冲盐溶液(phosphate buffer saline, PBS)反复清洗,剪碎后立即置于液氮中速冻保存,采样结束后放于-80 ℃冰箱保存。
1.3.2样品总RNA的提取和cDNA的制备 称取100 mg左右的瘤胃组织,用Trizol方法提取总的RNA,每个样品每次取2 μL,用Nano Drop分光光度计检测RNA浓度(260/280=1.8~2.0),2%琼脂糖凝胶电泳验证RNA质量,-70 ℃保存备用。反转录酶体系及Tap酶为Promega产品。引物采用Primer 5.0软件设计,由上海捷瑞生物工程有限公司合成,引物见表1。PCR的反应条件为95 ℃预变性3 min, 95 ℃变性30 s, 64 ℃退火20 s, 72 ℃延伸20 s,共40个循环。实时荧光定量分析采用2-△△CT法,以内标基因GAPDH为参照,计算目的基因转录的相对量,通过以下公式计算出每一个样本的△△CT值,最后每一个样本值以2-△△CT表示,x表示任意一个样本,公式如下:△△CT=(CT.目的基因-CT.内参基因)x-(CT.目的基因-CT.内参基因)control。
1.3.3组织总蛋白提取 蛋白酶抑制剂混合片(Roche,4693132001)购于上海罗氏;BCA蛋白测定试剂盒(Thermo,23225)购于生兴;NC膜(PALL,T91375)购于巴傲得;发光检测试剂盒(Thermo,NC15080或34076)购于生兴。
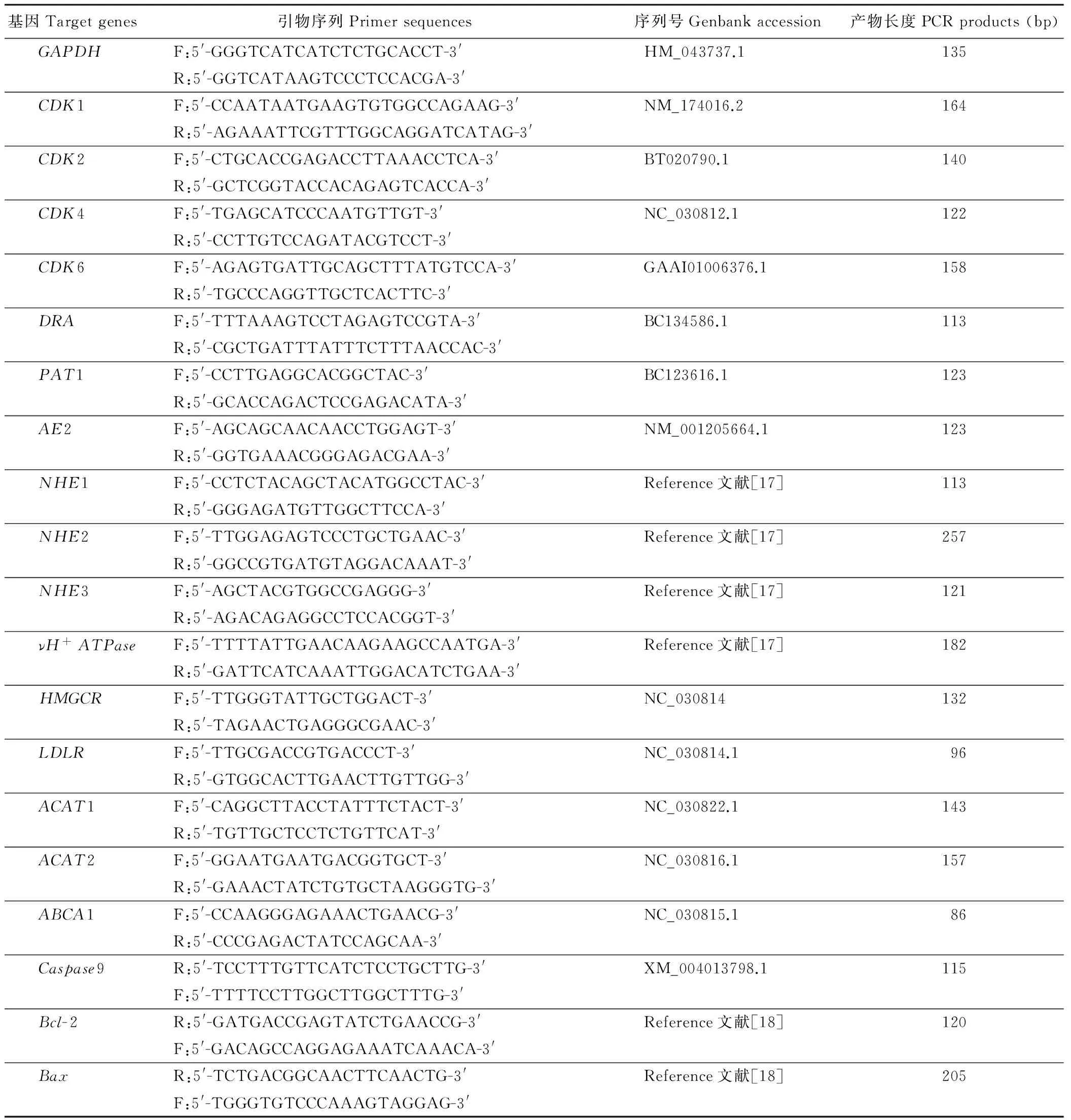
表1 目的基因引物序列Table 1 The primer sequences of the target genes
F:上游引物 Forward primer; R:下游引物 Reverse primer.GAPDH: 甘油醛-3-磷酸脱氢酶 Glyceraldehyde 3 phosphate dehydrogenase;CDK1: 细胞周期蛋白依赖性激酶 1 Cyclin-dependent kinase 1;CDK2: 细胞周期蛋白依赖性激酶 2 Cyclin-dependent kinase 2;CDK4: 细胞周期蛋白依赖性激酶 4 Cyclin-dependent kinase 4;CDK6: 细胞周期蛋白依赖性激酶 6 Cyclin-dependent kinase 6;DRA: SCFA-/HCO3-转运载体 Downregulated in adenoma;PAT1: 阴离子转运载体 1 Putative anion transporter, isform 1;AE2: 阴离子转运载体 2 Anion exchanger 2;NHE1: Na+/H+交换蛋白 1 Na+/H+exchanger 1;NHE2: Na+/H+交换蛋白 2 Na+/H+exchanger 2;NHE3: Na+/H+交换蛋白 3 Na+/H+exchanger 3;νH+ATPase: 空泡型H+ATP酶 Vacuolar H+ATPase subunit B;HMGCR: 3-羟-3-甲戊二酰辅酶A还原酶 3-hydroxy-3-methylglutaryl-CoA reductase;LDLR: 低密度脂蛋白受体 Low density lipoprotein receptor;ACAT1: 乙酰辅酶a胆固醇酰基转移酶 1 Acetyl-CoA cholesterol acyltransferase 1;ACAT2: 乙酰辅酶a胆固醇酰基转移酶 2 Acetoacetyl-CoA thiolase 2;ABCA1:ATP结合盒转运蛋白 1 ATP-binding cassette transporters 1;Casepase9:含半胱氨酸的天冬氨酸蛋白水解酶9 Cysteinyl aspartate specific proteinase 9;Bcl-2: B细胞淋巴瘤2 B-cell lymphoma 2;Bax: B细胞淋巴瘤2相关X蛋白 Bcl-2-associated X protein.
从-80 ℃冰箱取出瘤胃组织,称取100 mg左右,按1∶10(w∶v)加入冰浴的RIPA总蛋白裂解液;用匀浆器匀浆组织冰上静置10 min后,12000 r/min离心,4 ℃,20 min,取上清。用BCA试剂盒测定蛋白浓度,将蛋白统一用蛋白裂解液稀释至合适的浓度,变性,-80 ℃冰箱储存。上样量60 μg,分离胶10%,浓缩胶4%,电泳,转印至硝酸纤维膜上,之后室温封闭2 h,接着一抗4 ℃孵育过夜,1×TBST洗膜5 min 6次,再用二抗室温孵育2 h,1×TBST洗膜5 min 6次,最后,用pierce发光试剂盒和Versa DocTM imaging system成像系统,检测蛋白条带,并用Quantity One software软件进行数据统计分析。
1.3.4抗氧化能力的测定 所有瘤胃上皮组织抗氧化能力测定试剂盒均购自南京建成生物工程研究所,包括总抗氧化能力(total anti-oxidative capacity, T-AOC)测定试剂盒(货号:A015);超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(货号:A001-3);过氧化氢酶(catalase, CAT)测定试剂盒(货号:A007-1)。
1.3.5总胆固醇的测定 瘤胃上皮组织总胆固醇的测定采用组织细胞甘油三酯酶法测定试剂盒(货号:E1013),购自北京普利莱基因技术有限公司。
1.4数据统计与分析
采用SPSS 17.0软件对试验数据进行ANOVA方差分析,结果用平均值±标准误(mean±SEM)表示,Plt;0.05表示差异显著,Plt;0.01表示差异极显著。
2 结果与分析
2.1饲喂高精料日粮对山羊瘤胃上皮细胞周期与功能状态的影响
如图1所示,与对照组相比,HL和HS组山羊瘤胃上皮组织细胞增殖相关基因CDK2和CDK4 mRNA表达显著升高(Plt;0.05)(图1A),HS组ERK1/2蛋白磷酸化水平显著升高(Plt;0.05),但各组间GPR41和GPR43蛋白表达无显著变化(图1B)。
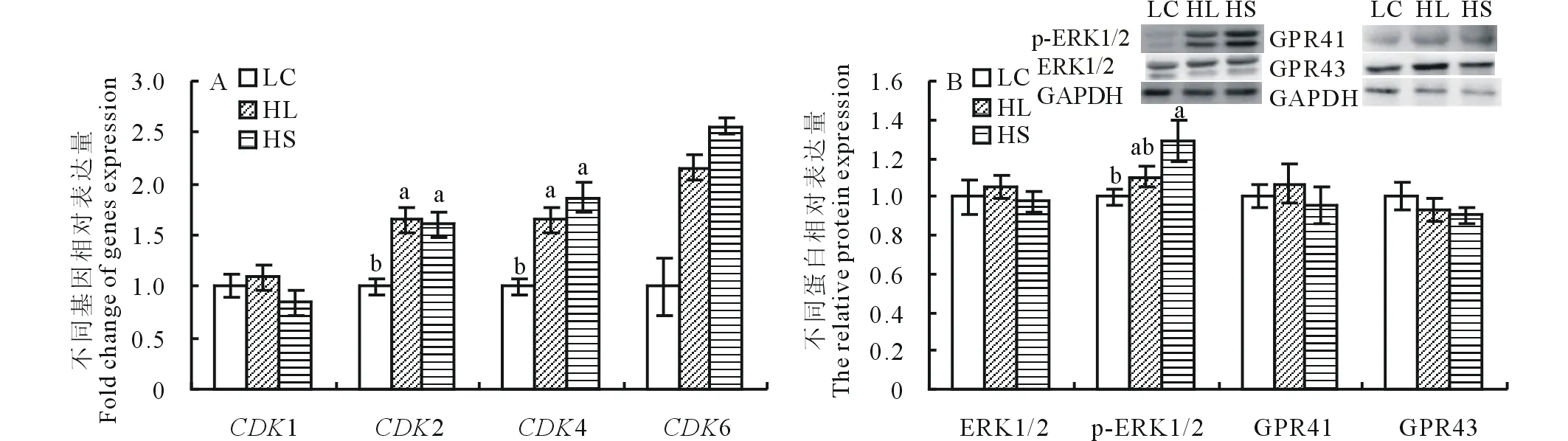
图1 高精料日粮对瘤胃上皮细胞周期相关基因与蛋白表达的影响 Fig.1 Effects of high concentrate diets on cell cycle of ruminal epithelium A: 细胞周期相关基因mRNA of the cell cycle; B: 增殖相关蛋白Protein of the proliferation。LC:低精料对照组Low concentrate diet control group; HL:高精料长期组Long-term feeding high concentrate diet group; HS:高精料短期组Short-term feeding high concentrate diet group。不同小写字母表示差异显著(Plt;0.05),相同或无字母表示差异不显著(Pgt;0.05),#表示有趋势(0.05lt;Plt;0.1)。下同。Different small letters mean significant difference (Plt;0.05), and the same or no letter mean no significant difference (Pgt;0.05),# means tendency (0.05lt;Plt;0.1). The same below.
2.2饲喂高精料日粮对山羊瘤胃上皮细胞凋亡和抗氧化能力的影响
由图2可知,与对照组相比,HL和HS组山羊瘤胃上皮组织细胞凋亡相关基因Caspase9 mRNA表达水平显著升高(Plt;0.05),HS组Bcl-2/Bax基因表达比例呈下降趋势(P=0.08)(图2A);HS组瘤胃上皮组织中抗氧化酶CAT和总抗氧化能力T-AOC显著升高(Plt;0.05),HL组CAT含量和SOD酶活性显著升高(Plt;0.05),但总抗氧化能力T-AOC无显著差异(Pgt;0.05)(图2B~D)。与HL组相比,HS组山羊瘤胃上皮组织中总抗氧化能力T-AOC显著升高(Plt;0.05)(图2D)。
2.3饲喂高精料日粮对山羊瘤胃上皮组织胆固醇代谢的影响
由图3可知,与对照组相比,HS组山羊瘤胃上皮组织中胆固醇含量显著下降(Plt;0.05)(图3A),HL组胆固醇含量呈下降趋势(P=0.06),与HL组相比,HS组山羊瘤胃上皮组织中胆固醇含量显著下降(Plt;0.05)(图3A);HL和HS组瘤胃上皮组织中胆固醇代谢相关基因ACAT1和ACAT2 mRNA表达显著升高(Plt;0.05)(图3B);且HS组瘤胃上皮组织中胆固醇的含量与ACAT1和ACAT2 mRNA的表达呈显著的负强相关(P=0.0067,r=-0.8208;P=0.0100,r=-0.7980)(图3C)。

图2 高精料日粮对山羊瘤胃上皮组织细胞凋亡和抗氧化能力的影响 Fig.2 Effects of high concentrate diets on cell apoptosis and antioxidant ability of ruminal epithelium

图3 高精料日粮对山羊瘤胃上皮组织中胆固醇代谢的影响Fig.3 Effects of high concentrate diets on the cholesterol metabolism in ruminal epithelium
2.4饲喂高精料日粮对山羊瘤胃上皮组织VFA 转运相关基因和蛋白表达的影响
如图4所示,与对照LC组相比,HL和HS组山羊瘤胃上皮组织中VFA转运相关基因AE2、DRA、NHE2、NHE3和νH+ATPasemRNA表达水平均显著升高(Plt;0.05)(图4A),但NHE2蛋白表达无显著差异(图4B)。
3 讨论
3.1饲喂高精料日粮对山羊瘤胃上皮细胞周期与功能状态的影响
瘤胃上皮细胞数量增多是通过加快细胞的有丝分裂来完成的,细胞从一次有丝分裂结束开始到下一次有丝分裂完成所经历的整个有序过程称为细胞周期。细胞周期受两个蛋白家族的调控:细胞周期蛋白(Cyclin)家族和细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)家族。Cyclin D/CDK4/6和Cyclin E/CDK2复合物调控细胞从G1进入S期[19]。有研究表明,山羊日粮精料含量从10%提高到35%时,瘤胃上皮中CDK和Cyclin基因mRNA的表达水平显著升高[18]。同样,本实验结果显示,饲喂高精料日粮显著上调瘤胃上皮组织中CDK2和CDK4 mRNA的表达。GPR41和GPR43是VFAs特异性受体,其中丙酸和丁酸与GPR41和GPR43结合的能力强于乙酸。GPR41可以通过组蛋白乙酰化作用调节细胞的增殖、凋亡以及细胞周期,丙酸可以激活ERK通路参与调节细胞活力[20]。本研究结果显示,65%精料饲喂泌乳期奶山羊4或19周,瘤胃液中乙酸、丙酸、丁酸和VFA的总量没有发生显著变化[21],且瘤胃上皮组织的VFAs特异性受体GPR41和GPR43未被激活。HS组磷酸化ERK1/2蛋白表达水平显著升高,提示短期饲喂高精料日粮可促进瘤胃上皮组织细胞的增殖,但其增殖可能不是G蛋白偶联通路介导的。
机体都具有清除体内生物活性物质的抗氧化防御系统[22],机体防御系统的抗氧化能力的强弱与健康程度存在着密切联系。季节和日粮均可影响山羊瘤胃组织的抗氧化能力[23]。血液和组织中SOD、GSH-PX(谷胱甘肽过氧化物酶,glutathione peroxidase)、CAT、MDA和T-AOC是反映机体氧化/抗氧化状态的重要参数。抗氧化剂能有效调控机体的氧化应激与细胞凋亡,保障机体细胞内外环境的稳定和生理机能正常[24]。而在细胞凋亡过程中,Bcl-2是细胞凋亡的负调控因子,可保护细胞免于凋亡;Bax是促凋亡因子,Bcl-2/Bax比值可反映细胞凋亡状态。本研究结果表明,短期饲喂高精料日粮可提高山羊瘤胃上皮组织的抗氧化能力,同时伴随细胞凋亡的增加,提示更高的细胞更新速率,这与其高泌乳性能相一致。然而,长期饲喂高精料对瘤胃上皮组织的细胞凋亡和总抗氧化能力无显著影响,其原因可能与机体应激状态的改变有关。高精料因其快速发酵引起瘤胃内VFAs累积,导致SARA的发生。从而推测,SARA长期存在威胁机体健康,并最终降低泌乳反刍动物的生产性能。
3.2饲喂高精料日粮对山羊瘤胃上皮组织胆固醇代谢的影响
胆固醇是细胞膜的重要组成成分,且是多种激素的合成前体物,绝大多数组织能合成胆固醇。正常情况下,组织中胆固醇的合成受到严格的调控,从而使胆固醇的含量不致过多蓄积或缺乏。反刍动物瘤胃上皮组织利用瘤胃发酵产生的VFAs,合成胆固醇从而减少瘤胃VFA的蓄积。β-羟-β-甲基戊二酸单酰辅酶α还原酶(3-hydroxy-3-methyl-glutaryl-CoA reductase,HMGCR)是胆固醇合成的限速酶。低密度脂蛋白受体(low density lipoprotein receptor,LDLR)将胆固醇转运入细胞进行生物转化。ATP结合盒转运蛋白(ATP-binding cassette transporters,ABCA1)调节细胞内的胆固醇流出细胞膜[25]。胆固醇酰基转移酶(Acetyl-CoA cholesterol acyltransferase,ACAT)是细胞内已知的唯一一个催化游离胆固醇与长链脂肪酸连接形成胆固醇酯的酶[26-27]。干奶期奶牛采食高精料日粮后,瘤胃上皮组织中胆固醇代谢相关的基因表达呈动态变化[28]。本研究结果表明,与LC组相比,HL和HS组瘤胃上皮组织中ACAT1和ACAT2基因表达显著上调,组织中胆固醇含量显著下降。瘤胃组织内胆固醇含量的降低提示对其功能的潜在不利影响。
3.3饲喂高精料日粮对山羊瘤胃上皮组织VFA转运的影响
瘤胃上皮吸收VFA为动物机体提供能量,同时伴有质子的吸收保证了瘤胃内环境和pH的稳态。瘤胃上皮组织中NHE在Na+的吸收和维持瘤胃上皮细胞内的pH起着重要的作用[29]。DRA,PAT1和AE2的主要功能是将碳酸氢盐从上皮细胞运出同时将游离的VFA转运进入瘤胃上皮,在VFA吸收过程中起到中和酸的作用。饲喂一定比例的精料日粮既可增强瘤胃的发酵功能又可以增加VFA的吸收。高精料在瘤胃内发酵产生大量的VFA,瘤胃上皮对VFA的吸收增加。为了避免瘤胃细胞内因质子过量积累而引起pH下降,NHE3的表达水平会升高,从而加快瘤胃上皮细胞的Na+和H+交换,将细胞内过多的H+排出细胞[30]。本实验结果与此相一致,HL和HS组维持山羊瘤胃上皮细胞pH相关基因(NHE2,NHE3和νH+ATPase)的mRNA表达水平显著升高,且与VFA转运相关基因(DRA,AE2)的mRNA表达水平显著升高。结果提示,饲喂高精料日粮可以加快泌乳期奶山羊瘤胃上皮组织对VFA的转运,但与饲喂时间长短无关。
4 结论
短期饲喂高精料日粮可加快泌乳期奶山羊瘤胃上皮组织的更新,提高组织氧化应激能力;而长期饲喂高精料日粮未引起细胞增殖相关蛋白和总抗氧化能力的显著变化;饲喂高精料日粮可以加快瘤胃上皮组织对VFA的转运。此外,饲喂高精料日粮引起瘤胃上皮组织内胆固醇含量降低,胆固醇酰基转移酶基因表达显著上调,提示其对瘤胃上皮组织更新的潜在影响。
References:
[1] Bondzio A, Gabler C, Badewien-Rentzsch B,etal. Identification of differentially expressed proteins in ruminal epithelium in response to a concentrate-supplemented diet. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2011, 301(2): G260-268.
[2] Lu J H, Liu J, Lu W,etal. Effects of dietary energy levels on cell cycle of ruminal epithelium in goats. Jiangsu Agricultural Science, 2014, 42(6): 145-149.
卢劲晔, 刘静, 卢炜, 等. 日粮能量水平对山羊瘤胃上皮细胞周期的影响. 江苏农业科学, 2014, 42(6): 145-149.
[3] Wang Y A, Zhang C L, Wang Y H,etal. Signal pathway and physiological functions of short chain fatty acid receptor GPR41 and GPR43. China Cattle Science, 2013, 39(6): 49-53.
王永安, 张春雷, 王艳红, 等. 短链脂肪酸受体GPR41、GPR43的信号通路及生理功能. 中国牛业科学, 2013, 39(6): 49-53.
[4] Lu Z, Gui H, Yao L,etal. Short-chain fatty acids and acidic pH upregulate UT-B, GPR41, and GPR4 in rumen epithelial cells of goats. American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2015, 308(4): R283-293.
[5] Le Poul E, Loison C, Struyf S,etal. Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation. Journal of Biological Chemistry, 2003, 278(28): 25481-25489.
[6] Khajah M A, Mathew P M, Luqmani Y A. Inhibitors of PI3K/ERK 1/2/p38 MAPK show preferential activity against endocrine resistant breast cancer cells. Oncology Research, 2017, 25(8): 1283-1295.
[7] Shen H, Lu Z, Chen Z,etal. Rapid fermentable substance modulates interactions between ruminal commensals and toll-like receptors in promotion of immune tolerance of goat rumen. Frontiersin Microbiology, 2016, 7: 1812.
[8] Argov-Argaman N, Eshel O, Moallem U,etal. Effects of dietary carbohydrates on rumen epithelial metabolism of nonlactating heifers. Journal of Dairy Science, 2012, 95(7): 3977-3986.
[9] Aschenbach J R, Penner G B, Stumpff F,etal. Ruminant nutrition symposium: Role of fermentation acid absorption in the regulation of ruminal pH. Journal of Animal Science, 2011, 89(4): 1092-1107.
[10] Zhang X L. Effects of Lovastatin on Proliferation and Apoptosis of HL-60 Cells and Its Molecular Mechanisms[D]. Chongqing: Chongqing Third Military Medical University, 2002.
张雪玲. 胆固醇合成抑制剂洛伐他汀对HL-60细胞增殖和凋亡的影响及机制研究[D]. 重庆: 重庆第三军医大学, 2002.
[11] Mao Y H, Mi M T. Effects of cholesterol on cellular structure and function. Foreign Medical (Hygiene Branch), 2004, 31(6): 352-355.
毛应华, 糜漫天. 胆固醇对细胞膜结构和功能的影响. 国外医学(卫生学分册), 2004, 31(6): 352-355.
[12] Gao X, Oba M. Characteristics of dairy cows with a greater or lower risk of subacute ruminal acidosis: Volatile fatty acid absorption, rumen digestion, and expression of genes in rumen epithelial cells. Journal of Dairy Science, 2016, 99(11): 8733-8745.
[13] Goodlad R A. Some effects of diet on the mitotic index and the cell cycle of the ruminal epithelium of sheep. Quarterly Journal of Experimental Psychology Section B-comparative and Physiological Psychology, 1981, 66(4): 487-499.
[14] Khafipour E, Krause D O, Plaizier J C. A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation. Journal of Dairy Science, 2009, 92(3): 1060-1070.
[15] Tao S, Duanmu Y, Dong H,etal. A high-concentrate diet induced colonic epithelial barrier disruption is associated with the activating of cell apoptosis in lactating goats. BMC Veterinary Research, 2014, 10: 235.
[16] Tao S, Duanmu Y, Dong H,etal. High concentrate diet induced mucosal injuries by enhancing epithelial apoptosis and inflammatory response in the hindgut of goats. PLoS One, 2014, 9(10): e111596.
[17] Yan L, Zhang B, Shen Z. Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats. Journal of Dairy Science, 2014, 97(9): 5668-5675.
[18] Gui H, Shen Z. Concentrate diet modulation of ruminal genes involved in cell proliferation and apoptosis is related to combined effects of short-chain fatty acid and pH in rumen of goats. Journal of Dairy Science, 2016, 99(8): 6627-6638.
[19] Lee J I, Kim I H, Nam T J. Crude extract and solvent fractions ofCalystegiasoldanellainduce G1 and S phase arrest of the cell cycle in HepG2 cells. International Journal of Oncology, 2017, 50(2): 414-420.
[20] Wu J, Zhou Z, Hu Y,etal. Butyrate-induced GPR41 activation inhibits histone acetylation and cell growth. Journal of Genetics and Genomics, 2012, 39(8): 375-384.
[21] Hua C, Tian J, Tian P,etal. Feeding a high concentration diet induces unhealthy alterations in the composition and metabolism of ruminal microbiota and host response in a goat model. Frontiersin Microbiology, 2017, 8: 138.
[22] He Z X, Sun Z H, Tan Z L,etal. Effects of maternal protein or energy restriction during late gestation on antioxidant status of plasma and immune tissues in postnatal goats. Journal of Animal Science, 2012, 90(12): 4319-4326.
[23] Sharifi M, Bashtani M, Naserian A A,etal. The effect of increasing levels of date palm (PhoenixdactyliferaL.) seed on the performance, ruminal fermentation, antioxidant status and milk fatty acid profile of Saanen dairy goats. Journal of Animal Physiology and Animal Nutrition (Berl), 2017, 101(5): e332-e341.
[24] Zhu R Q, Jiang W W, Tan Z L,etal. Progress of reactive oxygen species, oxidative, stress, cell apoptosis and antioxidant in animals. China Veterinary Medicine Journal, 2015, 3: 21-25.
朱若岑, 蒋维维, 谭柱良, 等. 动物体内活性氧、氧化应激与细胞凋亡以及抗氧化剂研究进展. 中兽医医药杂志, 2015, 3: 21-25.
[25] Idriss A A, Hu Y, Sun Q,etal. Prenatal betaine exposure modulates hypothalamic expression of cholesterol metabolic genes in cockerels through modifications of DNA methylation. Poultry Science, 2017, 96(6): 1715-1724.
[26] Tessema M, Belinsky S A. Mining the epigenome for methylated genes in lung cancer. Proceedings of the American Thoracic Society, 2008, 5(8): 806-810.
[27] Yao X M, Song B L, Wang C H,etal. Human Acyl-coenzyme A: cholesterol Aacyltr ansfer ase (ACAT). Journal of Shanghai Jiaotong University (Agricultural Science), 2006, 24(1): 108-115.
姚晓敏, 宋保亮, 王灿华, 等. 人酰基辅酶A: 胆固醇酰基转移酶(ACAT). 上海交通大学学报(农业科学版), 2006, 24(1): 108-115.
[28] Steele M A, Vandervoort G, AlZahal O,etal. Rumen epithelial adaptation to high-grain diets involves the coordinated regulation of genes involved in cholesterol homeostasis. Physiological Genomics, 2011, 43(6): 308-316.
[29] Lu Z, Yao L, Jiang Z,etal. Acidic pH and short-chain fatty acids activate Na+transport but differentially modulate expression of Na+/H+exchanger isoforms 1, 2, and 3 in omasal epithelium. Journal of Dairy Science, 2016, 99(1): 733-745.
[30] Schlau N, Guan L L, Oba M. The relationship between rumen acidosis resistance and expression of genes involved in regulation of intracellular pH and butyrate metabolism of ruminal epithelial cells in steers. Journal of Dairy Science, 2012, 95(10): 5866-5875.
Effectsoffeedinghighconcentratedietstolactatingdairygoatsonoxidativestressandcholesterolmetabolisminruminalepithelium
GENG Ya-Li, TIAN Ping, LUO Yan-Wen, HUA Can-Feng, TAO Shi-Yu, TIAN Jing, NI Ying-Dong*
Key Laboratory of Animal Physiology and Biochemistry, Ministry of Agriculture, Nanjing Agriculture University, Nanjing 210095, China
In order to investigate the effects of feeding high concentrate diets on the functional status of ruminal epithelia in terms of oxidative stress and cholesterol metabolism, seventeen lactating goats with similar body weight and milk production were randomly divided into three groups, including LC (n=5), HS (n=5) and HL (n=7) groups, which were fed by diets of concentrate∶forage of 35∶65 for whole experiment period (LC), concentrate∶forage of 65∶35 for 4 weeks (HS), and concentrate∶forage of 65∶35 for 19 weeks (HL), respectively. At the end of the experiment, ruminal epithelial tissues were sampled, promptly immersed in liquid nitrogen and then stored at -80 ℃ for analysis. The results showed that mRNA expression of theCDK2 andCDK4 genes related to cell cycle significantly increased in both HS and HL goats (Plt;0.05). The level of p-ERK1/2 proteins increased in HS but not in HL goats (Plt;0.05). However, GPR41 and 43 protein expression in the ruminal epithelium was not changed both in HS and HL compared to LC. The expression of theCasepase9 gene participating in cell apoptosis was significantly up-regulated in the HL and HS groups, while the anti-apoptotic index of the relative ratio ofBcl-2/BaxmRNA expression showed a tendency to decrease in the HS group compared to LC group (0.05lt;Plt; 0.1). In addition, the enzyme activity of SOD and CAT in the epithelium significantly increased in HL and HS goats compared to LC goats (Plt;0.05), whereas the total anti-oxidative capacity (T-AOC) increased only in HS goats (Plt;0.05). The level of cholesterol in ruminal epithelium significantly decreased in the HS group (Plt;0.01), and also showed a decreasing trend in the HL group (P=0.06). The enzymesACAT1 and 2, which may be involved in the regulation of cholesterol metabolism, significantly increased in HL and HS goats compared to LC goats (Plt;0.05). Correlation analysis revealed that cholesterol concentration in the ruminal epithelium was negatively correlated withACAT1 andACAT2 mRNA expression in the HS group (P=0.0067,r=-0.8208;P=0.0100,r=-0.7980). Compared with the LC group, mRNA expressions ofAE2,DRA,NHE2,NHE3andνH+ATPasegenes involving VFAs transportation significantly increased (Plt;0.05), while NHE2 protein expression was not altered both in HS and HL groups. Compared with the HL group, the HS group’s T-AOC significantly increased (Plt;0.05) and the level of cholesterol significantly decreased (Plt;0.05). These results indicate that feeding high concentrate diets over a short time period can improve the health status and functions of ruminal epithelium, while feeding high concentrate diets over a longer period might lessen these beneficial effects.
high concentrate diet; ruminal epithelium; oxidative stress; cholesterol; goat
10.11686/cyxb2017160http//cyxb.lzu.edu.cn
耿雅丽, 田平, 罗燕文, 华灿枫, 陶诗煜, 田靖, 倪迎冬. 高精料对泌乳奶山羊瘤胃上皮氧化应激和胆固醇代谢的影响. 草业学报, 2017, 26(11): 94-103.
GENG Ya-Li, TIAN Ping, LUO Yan-Wen, HUA Can-Feng, TAO Shi-Yu, TIAN Jing, NI Ying-Dong. Effects of feeding high concentrate diets to lactating dairy goats on oxidative stress and cholesterol metabolism in ruminal epithelium. Acta Prataculturae Sinica, 2017, 26(11): 94-103.
2017-03-31;改回日期:2017-06-14
国家重大基础研究发展计划 973 项目(No. 2011CB100802)资助。
耿雅丽(1992-),女,河北衡水人,在读硕士。E-mail:2604413221@qq.com
*通信作者Corresponding author. E-mail:niyingdong@njau.edu.cn
