破碎和均细化处理方式对胡萝卜汁中类胡萝卜素释放的影响
2017-11-24刘嘉宁毕金峰张佰清易建勇
刘嘉宁,刘 璇,毕金峰,张佰清,易建勇,彭 健
(1. 沈阳农业大学食品学院,沈阳 110866;2. 中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)
破碎和均细化处理方式对胡萝卜汁中类胡萝卜素释放的影响
刘嘉宁1,2,刘 璇2,毕金峰2,张佰清1※,易建勇2,彭 健2
(1. 沈阳农业大学食品学院,沈阳 110866;2. 中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)
为研究不同破碎和均细化处理对胡萝卜汁中类胡萝卜素释放途径的影响,采用打浆﹑胶体磨和高压均质3种破碎和均细化方式处理胡萝卜汁。应用分光光度法对处理后不同植物组织(大细胞聚集体﹑小细胞聚集体和有色体)中类胡萝卜素含量,游离类胡萝卜素含量,总类胡萝卜素含量,油脂可萃取类胡萝卜素含量进行测定。应用激光共聚焦扫描显微镜观察不同处理后类胡萝卜素的分布情况。利用高效液相色谱法对油脂可萃取类胡萝卜素单体含量进行测定。通过显著性分析确定不同均细化处理对以上3种植物组织中类胡萝卜素含量﹑游离类胡萝卜素含量﹑总类胡萝卜素释放率和油脂可萃取总类胡萝卜素含量及单体含量的影响。结果表明破碎和均细化处理后,大细胞聚集体中类胡萝卜素所占比例减小(从36.18%减小至15.28%),小细胞聚集体(从11.11%增加至15.73%)和有色体部分(8.36%增加至30.56%)中类胡萝卜素所占比例增大,类胡萝卜素释放在对其释放阻碍程度低的组织部分中。经过均细化处理后,激光共聚焦显微镜下可见的类胡萝卜素颗粒减少,处理越均细,可见的类胡萝卜素颗粒越少。对胡萝卜汁处理越均细,胡萝卜汁中类胡萝卜素释放率越高,其中胶体磨和高压均质联合处理胡萝卜汁后类胡萝卜素的释放率为50.91%。对胡萝卜汁处理越均细,胡萝卜汁中油脂可萃取总类胡萝卜素﹑β-胡萝卜素和α-胡萝卜素含量越少。研究结果对后续分析如何提高胡萝卜汁中类胡萝卜素生物利用率提供依据。
压力;温度;果汁;均细化处理;高压均质;类胡萝卜素;胡萝卜汁
0 引 言
类胡萝卜素通常分为以下两类:一是不含有氧原子的碳氢族类胡萝卜素,被称为胡萝卜素(carotene),主要包括β-胡萝卜素﹑α-胡萝卜素和番茄红素等。另外一种是至少含有一个氧原子的叶黄素类(xanthophylls),主要包括β-隐黄素﹑玉米黄素等[1]。类胡萝卜素被广泛熟知和关注的是其维生素A原活性,特别是β-胡萝卜素﹑α-和β-隐黄素,由于其具有抗氧化活性,已经被证实可以降低许多疾病的发病率,如心血管疾病﹑老年性黄斑变性﹑癌症[2]等。胡萝卜具有很高的营养价值,含有丰富的类胡萝卜素,是β-胡萝卜素含量最高的蔬菜之一,每 100 g鲜胡萝卜中含β-胡萝卜素1.35~4.3 mg。在胡萝卜中,类胡萝卜素主要存在于植物细胞的有色体中,被细胞壁和细胞膜包围[3]。类胡萝卜素从食品基质中的释放是其消化吸收的第一步,也是决定其生物利用率的关键步骤[4],而有色体的亚细胞结构和细胞壁的存在限制了类胡萝卜素的释放,因此鲜食胡萝卜的类胡萝卜素生物利用率较低。采用合适机械加工处理,例如榨汁﹑打浆和均质等方法破坏细胞壁并减小其粒径[5],是提高类胡萝卜素生物利用率的有效途径。近年来,国内外关于高压均质处理果蔬汁的研究逐渐增多,主要集中于对果蔬汁杀菌效果[6-8],果蔬汁理化性质如流变特性[9-11]﹑稳定性(粒径分布、ζ-电位、色泽)[12-13]﹑营养品质[14-15]和果蔬汁类胡萝卜素生物利用率[16-17]等方面。在高压均质处理后类胡萝卜素含量变化方面,有研究表明,高压均质处理(100,200和300 MPa)橙汁比热处理(90℃加热1 min)橙汁总类胡萝卜素含量高,不同均质压力对总类胡萝卜素含量无显著影响[14]。Svelander等[18]结果表明高压均质处理后的胡萝卜乳液中胡萝卜素含量无明显变化。在高压均质对类胡萝卜素生物利用率的影响方面,研究的内容主要涉及在口腔咀嚼、胃消化阶段和小肠消化吸收阶段中类胡萝卜素含量的变化。而关于高压均质对类胡萝卜素等脂溶性物质从食品中释放以及其释放途径尚未见报道。
本试验采用打浆﹑胶体磨和高压均质 3种破碎和均细化方式处理胡萝卜汁,以研究破碎和均细化处理对类胡萝卜素释放途径的影响,对后续提高胡萝卜汁中类胡萝卜素的生物利用率具有指导意义。
1 材料与方法
1.1 材料与试剂
胡萝卜购于北京市清河小营农副产品市场,产地山东;BETIS特级初榨橄榄油,托雷斯和贝雷斯公司;正己烷﹑丙酮﹑无水乙醇﹑氯化钠,国药集团化学试剂有限公司,以上试剂均为分析纯;2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT),纯度99%,北京依诺凯科技有限公司;用于色谱分析的正己烷﹑甲基叔丁基醚(methyl-t-butyl-ether,MTBE)﹑甲醇均为色谱纯,美国Tedia公司;尼罗红,纯度≥95%,上海Aladdin公司;β-胡萝卜素标品﹑α-胡萝卜素标品,色谱级,美国Sigma-Aldrich公司。
1.2 仪器与设备
九阳料理机JYL-C51V,九阳股份有限公司;高压纳米均质机JN-02HC(含加热/冷却循环系统),广州聚能生物科技有限公司;胶体磨JM-30A,廊坊市廊通机械有限公司;金属丝编制网试验筛,中国航空工业第五四零厂;超声高能筛分机USC,上海纳维加特机电科技有限公司;紫外/可见光分光光度计UV-1800,日本Shimadzu公司;高速冷冻离心机Sigma 3K15,德国Sigma公司;旋转蒸发器 RE-3000,上海亚荣生化仪器厂;C30柱,YMC Carotenoid S-5μm(250 mm×4.6 mm);HPLC 设备(Waters 1525溶剂输送系统和Waters 2489紫外/可见光检测器),Waters公司;激光共聚焦扫描显微镜LSM 880,德国蔡司公司。
1.3 方法
1.3.1 含有类胡萝卜素的植物组织部分的分离
参照Palmero等[19]的方法,稍作修改,分离出大细胞聚集体、小细胞聚集体和有色体部分,并制备游离类胡萝卜素。上述4种部分对类胡萝卜素释放的阻碍作用由大到小顺序为:大细胞聚集体、小细胞聚集体、有色体、游离类胡萝卜素。
1)不同植物组织部分的分离
胡萝卜经过清洗﹑去皮﹑切分后与去离子水1∶1(质量比)混合打浆1 min。制得的胡萝卜浆在超声高能筛分机下进行筛分,大细胞聚集体采用20目试验筛进行分离,取上层未过筛的部分。小细胞聚集体采用60目和300目试验筛分离,60目试验筛在上层,300目试验筛在下层,取通过60目试验筛,并截留于300目试验筛上的部分。
胡萝卜经过清洗﹑去皮﹑切块后加入0.05 mol/L的EDTA(1∶1,体积比)打浆5 s,过滤,滤液在10 000×g,4 ℃条件下离心30 min,得到有色体部分[20]。
2)游离类胡萝卜素的制备
按照1)的方式制得胡萝卜浆,制得的胡萝卜浆与橄榄油(5∶1,体积比)充分混合5 h,在9 000×g,4 ℃条件下离心30 min得到游离类胡萝卜素。
3)不同组织状态占胡萝卜浆的比例
通过以上方法分离得到的部分按照下述公式计算其所占比例:

式中ma为不同组织部分的质量(g);mb分别为100g胡萝卜原料经过不同处理后胡萝卜浆的质量(g)。
4)类胡萝卜素分布比例
类胡萝卜素在 4种组织部分中的分布比例按下列公式进行计算:

式中mc为经过不同处理后不同组织部分中类胡萝卜素总量(μg/g);mt为经过不同处理后4种组织部分类胡萝卜素总量的和(μg/g)。
1.3.2 破碎和均细化方式
胡萝卜经过清洗﹑去皮和切块后,与去离子水 1∶1(质量比)打浆1 min,过滤得到胡萝卜汁。得到的胡萝卜汁分别通过高压均质﹑胶体磨及胶体磨和高压均质串联的均细化方法处理,具体处理条件及编号见表1。

表1 样品编号和处理条件Table 1 Sample coding and processing conditions
1.3.3 总类胡萝卜素含量的测定
1)胡萝卜汁中总类胡萝卜素含量的测定
参照 Knockaert等[21]的方法进行总类胡萝卜素含量的测定和计算,取1 g胡萝卜汁加50 mL提取液(含体积分数为50%的正己烷,25%的丙酮,25%的乙醇,质量分数为0.1%的BHT和0.5 g NaCl),搅拌20 min。然后向上述溶液中加入15 mL蒸馏水,搅拌10 min。将混合物放入分液漏斗,收集有机相并定容。在450 nm下测定吸光度,用正己烷加0.1% BHT做空白。

其中A为450 nm处的吸光值,V为提取液总体积(mL),M为胡萝卜汁质量(g),E1cm1%(2 560)为β-胡萝卜素在正己烷中的消光系数[22]。整个操作在避光条件下进行。
2)原料中总类胡萝卜素含量的测定
称0.5 g鲜胡萝卜于研钵中,用50 mL上述提取液,分数次研磨提取,直到提取液和渣为无色。合并提取液,加入15 mL蒸馏水和0.5 g NaCl搅拌10 min。将混合物放入分液漏斗中,收集有机相并定容,按上述方法测定和计算原料中总类胡萝卜素含量。
3)释放率
胡萝卜汁中总类胡萝卜素的释放率用如下公式计算:
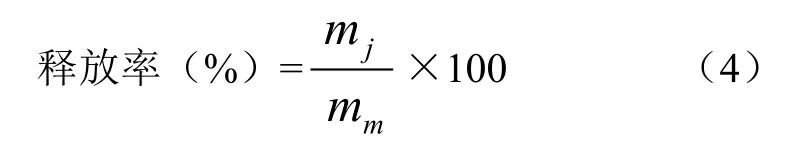
式中mj为不同均细化处理后胡萝卜汁中总类胡萝卜素质量分数(μg/g);mm为原料中总类胡萝卜素质量分数(μg/g)。
1.3.4 油脂可萃取总类胡萝卜素含量的测定
胡萝卜中的类胡萝卜素由于机械作用初步释放,因类胡萝卜素具有亲脂性,在胃中与食糜中的油相结合,随后在小肠中与油脂、磷脂和胆盐一起混合转化为水溶性胶束,被小肠上皮细胞吸收[23]。因此测定均细化处理后的油脂可萃取类胡萝卜素含量,可以反映其能够溶于油脂部分的含量,即可能被人体吸收利用的有效量。参照Palmero等[19]的方法,稍作修改,取不同破碎和均细化处理的胡萝卜浆与橄榄油(5∶1,体积比),充分混合5 h。在9 000×g,4 ℃条件下离心30 min得到油脂可萃取类胡萝卜素,取油脂部分测定油脂可萃取总类胡萝卜素含量。
1.3.5 油脂可萃取类胡萝卜素单体含量测定
取不同破碎和均细化处理的胡萝卜浆与橄榄油(5∶1,体积比),充分混合5 h。在9 000 ×g,4 ℃条件下离心30 min得到油脂可萃取类胡萝卜素,得到的部分加入50 mL上述提取液,并搅拌20 min。然后加入15 mL蒸馏水,搅拌10 min。将混合物放入分液漏斗,收集有机相于旋转蒸发仪,在(40±2) ℃的条件下蒸至近干。用正己烷溶解残渣并转移至容量瓶中定容,用0.45μm滤膜过滤,在-18 ℃条件下冷藏备用。采用高效液相色谱法,反相C30柱加紫外可见光检测器。流动相A:甲醇:甲基叔丁基醚(MTBE)∶水=81∶15∶4,流动相B:甲醇∶MTBE∶水=6∶90∶4;梯度洗脱条件:100% A在45 min内降至44%;流速:1.0 mL/min;检测波长:450 nm;进样量:10μL;柱温:30 ℃[24]。采用外标法计算样品中β-胡萝卜素和α-胡萝卜素含量。图1为油脂可萃取类胡萝卜素的HPLC图,由图1可知油脂可萃取类胡萝卜素中主要为β-胡萝卜素和α-胡萝卜素。类胡萝卜素化学结构的中心部分含有交替排列的双键与单键的聚烯烃链,因此类胡萝卜素通常有高度的疏水性,尤其是不含有任何氧原子的类胡萝卜素,例如β-胡萝卜素和α-胡萝卜素,因此测定油脂可萃取β-胡萝卜素和α-胡萝卜素可以充分反映其可以溶于油部分的含量。
1.3.6 类胡萝卜素的分布图
参照Low[25],Liu[26]的方法稍作修改,将尼罗红溶解于正己烷中,配置成0.25 g/L尼罗红,对胡萝卜汁染色30 min后,在10倍物镜,激发波长561 nm,激光功率密度2 mW条件下观察。采用Zen(Black)软件处理图片。
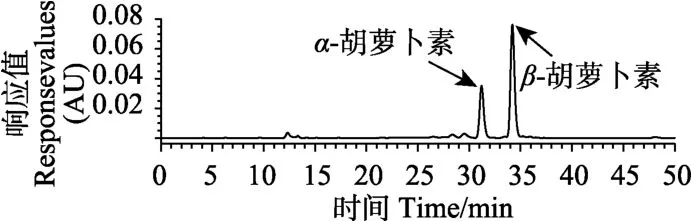
图1 油脂可萃取类胡萝卜素的HPLC图Fig.1 HPLC chromatogram of oil-extracted carotenoids
1.4 数据处理
试验设计均采用平均值±标准差(Mean±SD)表示。数据分析采用SPSS 19.0统计分析软件的ANOVA及LSD多重比较分析显著性差异(P<0.05),试验分析图采用Excel 2010软件绘制。
2 结果与分析
2.1 均细化处理对不同组织中类胡萝卜素分布的影响
不同组织状态占胡萝卜浆的比例见图2,由图2可知,游离类胡萝卜素,有色体和小细胞聚集体部分所占比例在均质前后无显著差异(P>0.05),均质后大细胞聚集体所占比例显著低于未均质时大细胞聚集体所占比例(P<0.05)。均质前后有色体部分所占比例都在90%以上,这是因为离心后有色体部分存在于上清液中,所以这一部分质量包含水的质量,因此所占比例很高。测定不同组织状态的比例主要目的是对比均质前后每一部分的质量占比差异。

图2 不同组织状态占胡萝卜浆的比例Fig.2 Proportion of different organizational state in carrot puree
表 2为均细化处理对类胡萝卜素在不同组织分布的影响,由表 2可知,对于总类胡萝卜素质量分数,未均质时,胡萝卜浆中游离类胡萝卜素含量最高,其次是大细胞聚集体、小细胞聚集体和有色体。游离类胡萝卜素作为对类胡萝卜素释放没有阻碍的部分,类胡萝卜素含量最高。大细胞聚集体中类胡萝卜素含量较高,作为对类胡萝卜素释放含有最多屏障的部分,这一部分如果经过合适的机械处理,可以释放较多类胡萝卜素。而有色体部分类胡萝卜素含量很少,这可能是由于未均质的胡萝卜浆中有色体的完整性破坏程度低,因此有色体部分类胡萝卜素未完全释放。均质后,胡萝卜浆中游离类胡萝卜素含量与未均质相比无显著差异(P>0.05),均质后的有色体部分的类胡萝卜素含量是未均质的 4倍左右(P<0.05),均质后的小细胞聚集体中的类胡萝卜素含量显著高于未均质的小细胞聚集体中的类胡萝卜素含量(P<0.05),均质后的大细胞聚集体中类胡萝卜素含量显著低于未均质的大细胞聚集体中类胡萝卜素含量(P<0.05)。因此可以看出均质后,类胡萝卜素更多的释放在对其释放阻碍程度低的组织部分中。

表2 均细化处理对不同组织中类胡萝卜素分布的影响Table 2 Effects of refining treatment on carotenoid distribution in different organizational state
对于类胡萝卜素总量,未均质的胡萝卜浆中游离类胡萝卜素总量最高,其次是大细胞聚集体、小细胞聚集体和有色体。由于小细胞聚集体所占比例比较少,因此其类胡萝卜素总量相对较低。以上 4部分的类胡萝卜素总量在均质前后呈现以下规律:均质前后游离类胡萝卜素总量无显著差异(P>0.05),均质后有色体中类胡萝卜素总量是未均质的 4倍左右(P<0.05),均质后小细胞聚集体中类胡萝卜素总量是未均质2倍左右(P<0.05),而均质后大细胞聚集体中类胡萝卜素含量显著减少(P<0.05),是未均质的1/2左右。对于类胡萝卜素分布比例,未均质胡萝卜浆中,游离类胡萝卜素所占比例最高,其次是大细胞聚集体,占比例较小的是小细胞聚集体和有色体部分,而均质后游离类胡萝卜素所占比例最高,其次是有色体部分。均质后大细胞聚集体中类胡萝卜素所占比例减小,小细胞聚集体和有色体部分中类胡萝卜素所占比例增大,游离类胡萝卜素所占比例减少,但是减小程度不大,由此可以看出,类胡萝卜素更多的释放在对其阻碍程度低的组织部分中,这是由于均质处理破坏细胞壁和细胞膜,促进类胡萝卜素的释放,更多的类胡萝卜素从大细胞中释放出,进入其他组织部分。Palmero等[19]从胡萝卜中分离出上述4部分,得出的结论为对其释放阻碍程度越低的组织中的类胡萝卜素生物利用率越高。Svelander等[18]报道高压均质可以提高胡萝卜乳液中类胡萝卜素生物利用率。因此,高压均质可能通过使类胡萝卜素更多的释放在对其释放阻碍程度低的组织部分中,从而提高胡萝卜中类胡萝卜素生物利用率,而这一假设有待于进一步试验的证明。
2.2 不同破碎和均细化处理后类胡萝卜素在细胞组织中的分布图
在胡萝卜中,有色体主要以晶体形态存在,其中主要含有的类胡萝卜素是β-胡萝卜素[27-28],晶体形态有色体在机械作用下容易受到破坏[16]。由图 3可知,均质和胶体磨处理相对于打浆处理,可见的类胡萝卜素颗粒减少,胶体磨与均质串联处理与单独胶体磨处理相比,类胡萝卜素颗粒也会减少。Croak等[29]发现橙汁的ζ-电位随pH值的变化规律与果胶分子在此pH范围内带电性变化规律一致,因此橙汁中带负电的果胶可能包裹在小颗粒周围,形成保护层。结合本试验结果,可推测类胡萝卜素颗粒减小可能是由于均细化处理后,细胞壁受到较严重的破坏,而处理越均细,细胞壁破坏的程度越严重,从而使细胞壁中的果胶等物质释放出来,包裹在类胡萝卜素周围。均质压力范围为100 MPa~150 MPa(25 ℃,均质1次)与均质压力为10 MPa~60 MPa(25 ℃,均质1次)相比,可观察到的类胡萝卜素减少,这是由于均质压力升高后,产生了更高的速度梯度,增加了湍流作用和空穴作用等[30],对细胞壁结构的破坏增强[31],从而使细胞壁中更多的果胶物质释放出来,因此果胶对类胡萝卜素的包裹程度增高。当均质压力为180 MPa(25 ℃,均质 1次)时,类胡萝卜素倾向于形成聚集体,这可能是由于压力较高的情况下,破坏果胶等物质与类胡萝卜素分子的结合作用,类胡萝卜素释放出来。在均质压力为60 MPa和进料温度为25 ℃的条件下,随着均质次数的增加,类胡萝卜素颗粒减小,这可能是由于处理越均细,对细胞壁的破坏程度越大,有越多的果胶等物质释放出来,包裹类胡萝卜素。在均质压力为60 MPa和均质1次的条件下,随着进料温度的增加,类胡萝卜素发生聚集,可能是由于温度的升高,细胞结构变得松散[32],果胶与类胡萝卜素结合作用减弱,因此类胡萝卜素释放出来。
2.3 不同破碎和均细化处理对类胡萝卜素释放率的影响
由图4a可以看出均质(48.82%)﹑胶体磨(49.16%)和胶体磨与均质串联(50.91%)这 3种处理方式相对于打浆(42.69%)处理可以显著提高类胡萝卜素的释放率(P<0.05),处理越均细,类胡萝卜素释放率越高。这是因为均细化处理对细胞壁起到进一步破坏的作用,从而促进类胡萝卜素的释放。由图4b可以看出,在高压均质处理中,不同均质压力对类胡萝卜素含量没有显著影响(P>0.05),这可能是由于胡萝卜汁中颗粒本身就很小,因此不同均质压力产生的挤压和剪切作用对胡萝卜汁中颗粒的影响较小,该结果与Velázquez-Estrada等的研究结果一致,不同均质压力对橙汁中总类胡萝卜素含量无显著影响[14]。由图4c可以看出,均质次数的增加可以显著提高类胡萝卜素的释放率(P<0.05),这可能是由于均质次数的增加可以使果肉颗粒变得更小更均匀[9],从而使更多类胡萝卜素释放在胡萝卜汁中,提高胡萝卜汁中类胡萝卜素的含量,该结果与吴亦兵[33]报道的研究结果一致。由图4d可以看出,进料温度越高,类胡萝卜素的释放率越高,可能是因为加热后细胞结构变得松散[32],从而促进类胡萝卜素释放到胡萝卜汁中。结合图 3可以看出,均细化处理在破坏细胞方面作用效果好,可有效促进类胡萝卜素释放到胡萝卜汁中,而且均细化处理可以使胡萝卜果肉颗粒更细小,更多地悬浮在果汁中,间接提高类胡萝卜素含量。

图3 不同破碎和均细化处理后类胡萝卜素的分布图Fig.3 Micrograph of carotenoid distribution by different crushing and refining treatment
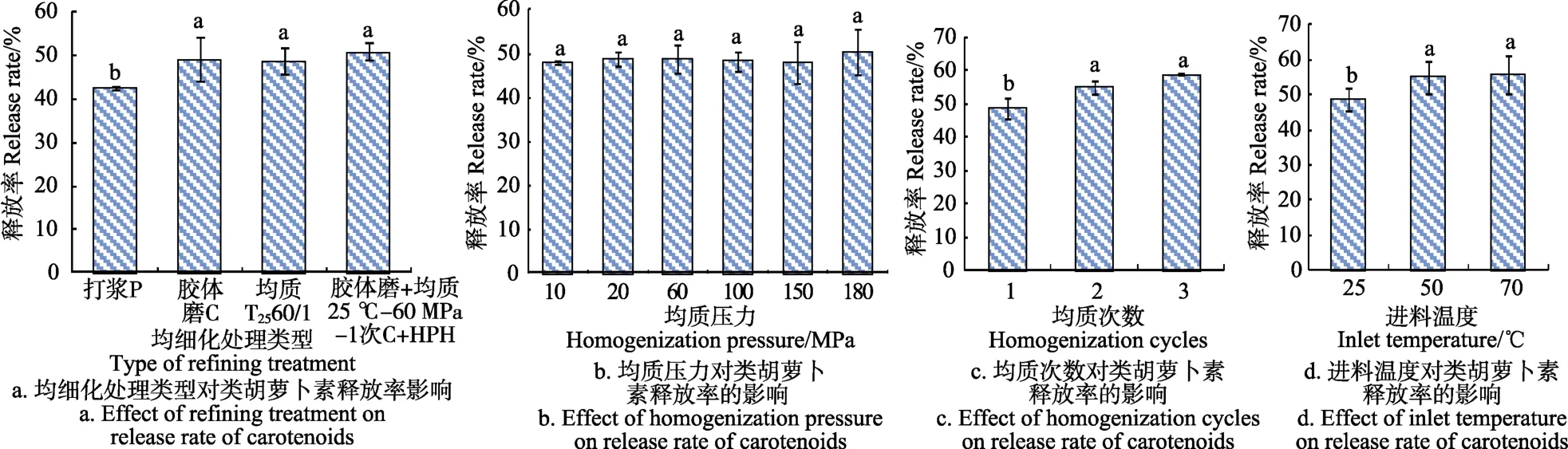
图4 不同均细化处理参数对类胡萝卜素释放率的影响Fig.4 Effects of different crushing and refining treatment on release rate of carotenoids
2.4 不同破碎和均细化处理对油脂可萃取总类胡萝卜素含量的影响
从表 3可以看出,打浆处理总类胡萝卜素含量最高(P<0.05),而均质﹑胶体磨以及胶体磨和均质串联处理相对于打浆处理会显著降低总类胡萝卜素含量(P<0.05)。均质压力从10 MPa升高到180 MPa(25 ℃,均质 1次)时,总类胡萝卜素含量先减少后增加又减小,在100 MPa和150 MPa达到较高水平,在压力为180 MPa时降低。均质次数从1次增加到2次(25 ℃,60 MPa)可以显著增加总类胡萝卜素含量(P<0.05),而再增加次数不会显著影响总类胡萝卜素含量(P>0.05),这可能是由于对细胞壁的破碎程度增高,增加细胞壁果胶等的溶出,从而影响总类胡萝卜素含量。Beysseriat等报道[34]膳食纤维可以吸附在乳化的脂滴表面,形成一层保护层。结合本试验结果,可推测高压均质促进胡萝卜中内源果胶的释放,而其形成的保护层可能会影响油脂中总类胡萝卜素的释放。进料温度为 70 ℃比进料温度为50 ℃和25 ℃(60 MPa,均质1次)时总类胡萝卜素含量高(P<0.05),由此可以看出当进料温度较高时,才可以提高油脂可萃取总类胡萝卜素的含量,这可能是由于温度较高时,加速对细胞壁和细胞膜的破坏,果胶发生β-消除反应,从而使细胞结构软化,减弱与类胡萝卜素结合的物质对其释放的阻碍作用,使更多类胡萝卜素释放到油脂中。

表3 不同破碎和均细化处理方式对胡萝卜汁中油脂可萃取总类胡萝卜素和类胡萝卜素单体含量的影响Table 3 Effects of different crushing and refining treatments on contents of total oil-extracted carotenoid, oil-extracted β-carotene and α-carotene in carrot juice
2.5 不同破碎和均细化处理对油脂可萃取类胡萝卜素单体含量的影响
由表3可知,打浆处理后β-胡萝卜素和α-胡萝卜素含量最高(P<0.05),均质﹑胶体磨和均质胶体磨串联处理相对于打浆处理会显著降低β-胡萝卜素和α-胡萝卜素含量(P<0.05),这与总类胡萝卜素含量变化规律一致,因此可推测高压均质促进胡萝卜中内源果胶的释放,而其形成的保护层可能会影响油脂中总类胡萝卜素的释放。对于β-胡萝卜素,均质压力从10 MPa升到20 MPa(25 ℃,均质 1 次),β-胡萝卜素含量显著降低(P<0.05),在压力为60 MPa~150 MPa时(25 ℃,均质1次),β-胡萝卜素含量无显著差异(P>0.05),当压力为180 MPa(25 ℃,均质1次)时,含量显著降低(P<0.05)。这一现象可能是由于不同均质压力对果胶结构产生影响[35],引起果胶解聚,从而影响果胶对类胡萝卜素的包裹作用,引起类胡萝卜素含量变化。进料温度较低时,β-胡萝卜素含量较高,进料温度为50 ℃和70 ℃,与25 ℃时相比均显著降低β-胡萝卜素含量(P<0.05),这可能是由于热对β-胡萝卜素氧化的降解作用引起的[36]。对于α-胡萝卜素,均质压力在10 MPa~60 MPa(25 ℃,均质1次)时,α-胡萝卜素含量无显著差异(P>0.05),当压力为100 MPa时,α-胡萝卜素含量显著降低(P<0.05),压力升高到150 MPa~180 MPa(25 ℃,均质1次)时,α-胡萝卜素含量又显著增加(P<0.05)。进料温度为50 ℃和 70 ℃,与 25 ℃时相比均显著降低α-胡萝卜素含量(P<0.05),这可能是由于热对α-胡萝卜素氧化的降解作用引起的。β-胡萝卜素和α-胡萝卜素在不同均质压力条件下,含量变化趋势不同,这可能是由于两者结构不同,溶于油脂的能力不同,因此含量变化趋势不同。
3 结 论
1)均质处理后,大细胞聚集体中类胡萝卜素总量所占比例减小(从 36.18%减小至 15.28%),小细胞聚集体(从11.11%增加至15.73%)和有色体部分(从8.36%增加至30.56%)中类胡萝卜素总量所占比例增大,类胡萝卜素更多的释放在对其释放阻碍程度低的组织中。
2)破碎和均细化处理后,细胞壁受到破坏,激光共聚焦显微镜下可见的类胡萝卜素颗粒减小,处理越均细,可见的类胡萝卜素颗粒越小,类胡萝卜素被包裹的程度越高。均质压力为100 MPa~150 MPa和其他压力相比,激光共聚焦显微镜下可见的类胡萝卜素颗粒较小,类胡萝卜素被包裹程度较高。均质压力达到180 MPa时,类胡萝卜素倾向于形成聚集体。随着均质次数的增加,可见的颗粒越小,而随着进料温度的增加,类胡萝卜素倾向于形成聚集体。
3)对胡萝卜汁的处理越均细,类胡萝卜素释放率越高,胶体磨和高压均质联合处理胡萝卜汁后类胡萝卜素的释放率为50.91%。不同压力处理对类胡萝卜素释放率无显著影响(P>0.05),均质次数增加可以显著提高类胡萝卜素释放率(P<0.05),进料温度越高,类胡萝卜素释放率越高。对胡萝卜汁的处理越均细,胡萝卜汁中油脂可萃取总类胡萝卜素﹑β-胡萝卜素和α-胡萝卜素含量越低。
由于均细化处理对胡萝卜细胞壁的破坏作用,导致细胞壁中释放出蛋白质和多糖例如果胶等,包裹在类胡萝卜周围或与类胡萝卜素结合从而影响类胡萝卜素的释放,因此高压均质后胡萝卜汁中内源果胶与类胡萝卜素交互作用有待于进一步研究。
[1] Yonekura L, Nagao A. Intestinal absorption of dietary carotenoids[J]. Molecular nutrition & food research, 2007,51(1): 107-115.
[2] Fraser P D, BramLey P M. The biosynthesis and nutritional uses of carotenoids[J]. Progress in Lipid Research, 2004,43(3): 228-265.
[3] Hornero-Méndez D, Mínguez-Mosquera M I. Bioaccessibility of carotenes from carrots: Effect of cooking and addition of oil[J]. Innovative Food Science & Emerging Technologies,2007, 8(3): 407-412.
[4] Palmero P, Panozzo A, Colle I, et al. Role of structural barriers for carotenoid bioaccessibility upon high pressure homogenization[J]. Food Chemistry, 2016, 199: 423-432.
[5] Lemmens L, van Buggenhout S, van Loey A M, et al.Particle size reduction leading to cell wall rupture is more important for the β-carotene bioaccessibility of raw compared to thermally processed carrots[J]. Journal of Agricultural and Food Chemistry, 2010, 58(24): 12769-12776.
[6] Maresca P, Donsì F, Ferrari G. Application of a multi-pass high-pressure homogenization treatment for the pasteurization of fruit juices[J]. Journal of Food Engineering, 2011, 104(3):364-372.
[7] Suárez-Jacobo Á, Gervilla R, Guamis B, et al. Effect of UHPH on indigenous microbiota of apple juice: a preliminary study of microbial shelf-life[J]. International Journal of Food Microbiology, 2010, 136(3): 261-267.
[8] Bevilacqua A, Corbo M R, Sinigaglia M. Use of natural antimicrobials and high pressure homogenization to control the growth of Saccharomyces bayanus in apple juice[J]. Food Control, 2012, 24(1): 109-115.
[9] Tan J, Kerr W L. Rheological properties and microstructure of tomato puree subject to continuous high pressure homogenization[J]. Journal of Food Engineering, 2015,166(4): 45-54.
[10] Augusto P E D, Ibarz A, Cristianini M. Effect of high pressure homogenization (HPH) on the rheological properties of tomato juice: Time-dependent and steady-state shear[J].Journal of Food Engineering, 2012, 111(4): 570-579.
[11] Augusto P E D, Ibarz A, Cristianini M. Effect of high pressure homogenization (HPH) on the rheological properties of tomato juice: Creep and recovery behaviours[J]. Food Research International, 2013, 54(1): 169-176.
[12] Leite T S, Augusto P E D, Cristianini M. Using high pressure homogenization (HPH) to change the physical properties of cashew apple juice[J]. Food Biophysics, 2015, 10(2): 169-180.[13] van Buggenhout S, Wallecan J, Christiaens S, et al. Influence of high-pressure homogenization on functional properties of orange pulp[J]. Innovative Food Science & Emerging Technologies, 2015, 30: 51-60.
[14] Velázquez-Estrada R M, Hernández-Herrero M M, Rüfer C E,et al. Influence of ultra high pressure homogenization processing on bioactive compounds and antioxidant activity of orange juice[J]. Innovative Food Science & Emerging Technologies, 2013, 18: 89-94.
[15] Suárez-Jacobo Á, Rüfer C E, Gervilla R, et al. Influence of ultra-high pressure homogenisation on antioxidant capacity,polyphenol and vitamin content of clear apple juice[J]. Food Chemistry, 2011, 127(2): 447-454.
[16] Panozzo A, Lemmens L, van Loey A, et al. Microstructure and bioaccessibility of different carotenoid species as affected by high pressure homogenisation: A case study on differently coloured tomatoes[J]. Food Chemistry, 2013,141(4): 4094-4100.
[17] Colle I, van Buggenhout S, van Loey A, et al. High pressure homogenization followed by thermal processing of tomato pulp: Influence on microstructure and lycopene in vitro bioaccessibility[J]. Food Research International, 2010, 43(8):2193-2200.
[18] Svelander C A, Lopez‐Sanchez P, Pudney P D A, et al.High Pressure Homogenization Increases the In Vitro Bioaccessibility ofα-andβ-Carotene in Carrot Emulsions But Not of Lycopene in Tomato Emulsions[J]. Journal of Food Science, 2011, 76(9): H215-H225.
[19] Palmero P, Lemmens L, Ribas-Agustí A, et al. Novel targeted approach to better understand how natural structural barriers govern carotenoid in vitro bioaccessibility in vegetable-based systems[J]. Food Chemistry, 2013, 141(3):2036-2043.
[20] Hansen L U, Chiu M C M. Isolation and composition of chromoplasts from tomatoes[J]. Journal of Agricultural and Food Chemistry, 2005, 53(17): 6678-6682.
[21] Knockaert G, Lemmens L, van Buggenhout S, et al. Changes in β-carotene bioaccessibility and concentration during processing of carrot puree[J]. Food Chemistry, 2012, 133(1):60-67.
[22] Hart D J, Scott K J. Development and evaluation of an HPLC method for the analysis of carotenoids in foods, and the measurement of the carotenoid content of vegetables and fruits commonly consumed in the UK[J]. Food Chemistry,1995, 54(1): 101-111.
[23] Mutsokoti L, Panozzo A, Musabe E T, et al. Carotenoid transfer to oil upon high pressure homogenisation of tomato and carrot based matrices[J]. Journal of Functional Foods,2015, 19: 775-785.
[24] 刘凤霞. 基于超高压技术芒果汁加工工艺与品质研究[D].北京:中国农业大学,2014.Liu Fengxia. Effect of High Hydrostatic Pressure on Processing and Qualities of Mango Juice[D]. Beijing: China Agricultural University, 2014. (in Chinese with English abstract)
[25] Low D Y, D’Arcy B, Gidley M J. Mastication effects on carotenoid bioaccessibility from mango fruit tissue[J]. Food Research International, 2015, 67: 238-246.
[26] Liu Xuan, Bi Jinfeng, Xiao Hang, et al. Increasing carotenoid bioaccessibility from yellow peppers using excipient emulsions: Impact of lipid type and thermal processing[J].Journal of Agricultural and Food Chemistry, 2015, 63(38):8534-8543.
[27] Schweiggert R M, Mezger D, Schimpf F, et al. Influence of chromoplast morphology on carotenoid bioaccessibility of carrot, mango, papaya, and tomato[J]. Food Chemistry, 2012,135(4): 2736-2742.
[28] Kim J E, Rensing K H, Douglas C J, et al. Chromoplasts ultrastructure and estimated carotene content in root secondary phloem of different carrot varieties[J]. Planta,2010, 231(3): 549-558.
[29] Croak S, Corredig M. The role of pectin in orange juice stabilization: Effect of pectin methylesterase and pectinase activity on the size of cloud particles[J]. Food Hydrocolloids,2006, 20(7): 961-965.
[30] Floury J, Bellettre J, Legrand J, et al. Analysis of a new type of high pressure homogeniser. A study of the flow pattern [J].Chemical Engineering Science, 2004, 59(4): 843-853.
[31] Kubo M T K, Augusto P E D, Cristianini M. Effect of high pressure homogenization (HPH) on the physical stability of tomato juice[J]. Food Research International, 2013, 51(1):170-179.
[32] Sila D N, Smout C, Elliot F, et al. Non-enzymatic depolymerization of carrot pectin: Toward a better understanding of carrot texture during thermal processing[J].Journal of Food Science, 2006, 71(1): E1-E9.
[33] 吴奕兵. 超高压均质对胡萝卜汁理化性质及酶和微生物的影响[D]. 南京:南京农业大学, 2009.Wu Yibing. Effects of Ultra High Homogenization on Physicochemical Properties of Carrot Juice and Effects on Enzyme and Microorganism in Carrot Juice[D]. Nanjing:Nanjing Agricultural University, 2009. (in Chinese with English abstract)
[34] Beysseriat M, Decker E A, McClements D J. Preliminary study of the influence of dietary fiber on the properties of oil-in-water emulsions passing through an in vitro human digestion model[J]. Food Hydrocolloids, 2006, 20(6): 800-809.
[35] Shpigelman A, Kyomugasho C, Christiaens S, et al. The effect of high pressure homogenization on pectin: Importance of pectin source and pH[J]. Food Hydrocolloids, 2015, 43:189-198.
[36] Rodriguez-Amaya D B. Carotenoids and food preparation:the retention of provitamin A carotenoids in prepared,processed and stored foods[M]. Arlington, VA: John Snow Incorporated/OMNI Project, 1997.
Effects of different crushing and refining treatments on release of carotenoids in carrot juice
Liu Jianing1,2, Liu Xuan2, Bi Jinfeng2, Zhang Baiqing1※, Yi Jianyong2, Peng Jian2
(1.College of Food Science, Shenyang Agricultural University, Shenyang110866,China;2.Key Laboratory of Agro-products Processing, Ministry of Agriculture, Institute of Food Science and Technology,Chinese Academy of Agricultural Sciences, Beijing100193,China)
Carotenoids have
special attention owing to their health-related characteristics, including pro-vitamin A activity, antioxidant properties and prevention organisms against certain types of cancer. In carrot, the existence of chromoplast substructure and cell wall limit the release of carotenoids, thus adopting appropriate mechanical processing to destroy the cell wall and decrease the particle size is an effective way to improve carotenoid bioaccessibility. As the first step of digestion, the release of carotenoids from raw materials plays a crucial role in determining carotenoid bioaccessibility. The objective of this study was to investigate the effects of different crushing and refining treatments on release pathway of carotenoids in carrot juice. Pulping, colloid mill, and high pressure homogenization with different homogenization pressures,homogenization cycles and inlet temperatures were applied as crushing and refining treatments. After different crushing and refining treatments, carotenoid content in different organizational states (large cell clusters, small cell clusters and chromoplast fraction), free carotenoid content, micrograph of carotenoid distribution, release rate of carotenoids, as well as contents of oil-extracted carotenoids,β-carotene and α-carotene were investigated, respectively. Total carotenoid content was determined spectrophotometrically.β-carotene and α-carotene content were measured by HPLC. Micrograph of carotenoid distribution was observed by confocal laser scanning microscopy. The results demonstrated that after crushing treatment, carotenoid content of above-mentioned four fractions was in a decreasing order: free carotenoid, large cell clusters, small cell clusters and chromoplast fraction. After homogenization, there was almost no difference in free carotenoid content, however, there were about fourfold increase in carotenoid content for chromoplast fraction, twofold increase in carotenoid content for small cell clusters, and twofold decrease for large cell clusters. The proportion of carotenoid content decreased from 36.18% to 15.28%in large cell clusters, increased from 8.36% to 30.56% in chromoplast fraction and increased from 11.11% to 15.73% in small cell clusters. Therefore, an enhancement of carotenoid content could be observed with the decreasing level of bioencapsulation. After refining treatments, the visible carotenoid particles under laser scanning confocal microscopy decreased in size. As the homogenization pressure increased up to 100 MPa and 150 MPa, confocal micrographs showed that visible carotenoid particles became smaller than the ones treated by other homogenization pressures. When the pressure reached 180 MPa,carotenoid tended to aggregate. The visible particle became smaller with the increase of homogenization cycle. Increasing inlet temperature contributed to aggregation of carotenoid particles. The value of carotenoid release rate was 50.91% for joint processing of colloid mill and high pressure homogenization. However, different levels of homogenization pressure had no significant (P>0.05) effect on carotenoid release rate. Higher carotenoid release rate could be observed with an increment of homogenization cycle and inlet temperature. Therefore, suitable refining treatment can be found and applied to damage the cell wall and effectively promote the release of carotenoids in carrot juice. As lipophilic pigment, carotenoid must first be released from the food matrix, solubilized in the lipid phase followed by transferring into mixed micelles in the small intestine before the uptake by intestinal epithelium. Therefore, oil-extracted carotenoid content reflects the available dose that may be absorbed by human body. The highest oil-extracted carotenoid content in carrot juice was 34.79μg/g treated by pulping. When the pressure increased from 10 MPa to 180 MPa, the content of oil-extracted carotenoids decreased at first and then increased. The value of oil-extracted carotenoid content reached 31.93μg/g for 100 MPa and 31.5μg/g for 150 MPa, respectively. Contrarily,the value was 27.07μg/g for homogenization at 180 MPa. The highest contents of oil-extractedβ-carotene andα-carotene were 32.61μg/g and 6.64μg/g, respectively. Under the different conditions of homogenization, the content ofβ-carotene andα-carotene changed differently due to structural differentiation. This study has significance on subsequent analysis about how to improve carotenoid bioaccessibility in carrot juice. After refining treatment, polysaccharides such as pectin may be released from the cell wall, wrap around the carotenoid and affect the release of the carotenoid. Therefore, further research is needed to study the interaction between carotenoid and endogenous pectin in carrot juice after high homogenization.
pressure; temperature; fruit juices; refining treatments; high pressure homogenization; carotenoid; carrot juice
10.11975/j.issn.1002-6819.2017.14.041
TS255.5
A
1002-6819(2017)-14-0307-08
刘嘉宁,刘 璇,毕金峰,张佰清,易建勇,彭 健. 破碎和均细化处理方式对胡萝卜汁中类胡萝卜素释放的影响[J]. 农业工程学报,2017,33(14):307-314.
10.11975/j.issn.1002-6819.2017.14.041 http://www.tcsae.org
Liu Jianing, Liu Xuan, Bi Jinfeng, Zhang Baiqing, Yi Jianyong, Peng Jian. Effects of different crushing and refining treatments on release of carotenoids in carrot juice[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(14): 307-314. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.14.041 http://www.tcsae.org
2017-03-01
2017-05-21
国家自然科学基金项目资助(31671868);“十三五”国家重点研发计划项目:食品非热加工新技术研究与装备开发(2016YFD0400302)
刘嘉宁,女,辽宁大连人,研究方向农产品加工技术及装备。沈阳 沈阳农业大学食品学院,110866。Email:jianingliutracy@163.com
※通信作者:张佰清,男,黑龙江拜泉县人,博士,教授,博士生导师,研究方向为农产品加工。沈阳 沈阳农业大学食品学院,110866。
Email:sybaiqingxl@sina.com
