VEGF、Ki-67和TCF4在基底细胞癌中的表达及意义
2017-11-23张胜逆康瑞花张涛赵建伟丁秋允赵桂香张红岩刘春梅
张胜逆 康瑞花 张涛 赵建伟 丁秋允 赵桂香 张红岩 刘春梅
·论著·
VEGF、Ki-67和TCF4在基底细胞癌中的表达及意义
张胜逆 康瑞花 张涛 赵建伟 丁秋允 赵桂香 张红岩 刘春梅
目的探讨VEGF、Ki-67、TCF4在基底细胞癌的表达模式及其之间的相关性,为临床的预后判断提供帮助。方法采用免疫组化方法和免疫印迹法对58例基底细胞癌和46例脂溢性角化病的标本进行检测。结果VEGF、Ki-67、TCF4在基底细胞癌中的阳性率分别为60.10%(35/58)、83.27%(38/58)、91.07%(53/58)高于脂溢性角化病的26.20%(12/46)、27.39%(13/46)、21.74%(10/46),差异有统计学意义(Plt;0.05);VEGF、Ki-67、TCF4在BCC表达显著性升高,差异有统计学意义(Plt;0.01)。结论BCC的发生发展可能与VEGF、Ki-67、TCF4的异常高表达有关。
基底细胞癌;血管内皮生长因子;Ki-67;T细胞因子4;免疫组化;免疫印迹
基底细胞癌(basal cell carcinoma,BCC)是源自表皮或其附属器的皮肤恶性肿瘤,为最常见的皮肤恶性肿瘤之一[1-3]。BCC的好发部位以颜面部居多,尽管其恶性程度较低,但手术后可能会留有永久性瘢痕甚至出现容颜毁损,对患者生理和心理带来极大的不利影响[4],值得我们对BCC的病因和发病机制进行深入探讨。目前其病因及发病机制尚不清楚,有研究报道BCC发病机制可能与WNT信号通路有关[5],本研究采用免疫组化和免疫印迹检测血管内皮生长因子(vascular endothelial growth factor,VEGF)、Ki-67、T细胞因子4(T cell factor 4,TCF4)在BCC及脂溢性角化病(seborrheic keratosis, SK)中的表达特征及相关性,更进一步阐述血管生成因素、细胞增殖在BCC发生发展中的作用以及对于肿瘤恶性程度以及转移、预后的影响,以进一步探讨BCC的发病机制。
1 资料与方法
1.1 一般资料 收集2011年10月至2016年2月于河北大学附属医院皮肤科和普外科就诊并手术患者,结合临床表现、病理确诊为BCC和SK。选取58例BCC标本,其中男32例,女26例;年龄47~82岁,平均年龄(57.2±3.2)岁;病程1.3~4年,平均(3.52±0.86)年。选取46例SK标本作为对照组,其中男25例,女21例;年龄42~76岁,平均(55.4±3.1)岁。2组在年龄、性别比方面差异无统计学意义(Pgt;0.05)。同时对来自外科外伤患者切除的20例正常皮肤标本进行检测。本研究通过河北大学附属医院的伦理委员会审批,患者及家属签署知情同意书。
1.2 主要试剂 小鼠抗人VEGF单克隆抗体,购自美国santa公司;小鼠抗人Ki-67单克隆抗体,购自美国santa公司;小鼠抗人TCF4单克隆抗体,购自美国santa公司;SP免疫组化系列工作液试剂盒,购自北京中杉公司;DAB显色液,购自北京中杉公司。
1.3 实验方法
1.3.1 免疫组化:石蜡切片常规脱蜡水化,微波抗原修补,加入一抗为VEGF、Ki-67、TCF4(浓度1∶200,小鼠抗人单克隆一抗,美国santa公司),4℃孵育12 h。二抗(兔抗小鼠)采用北京中杉公司S-P试剂盒,DAB(北京中杉公司)显色经苏木素复染,脱水、透明后封片。每次染色均设阴性和阳性对照。采用 NIS-Elements Basic Research 多媒体彩色病理图像分析系统对VEGF、Ki-67、TCF4表达进行定位观察分析,每张切片分别观察200倍及400倍视野图像。
1.3.2 免疫印迹:取BCC及SK标本组织100 mg,匀浆后低温离心,应用南京凯基全蛋白提取试剂盒提取总蛋白。测定蛋白浓度后聚丙烯酰胺凝胶电泳,电转至硝酸纤维素膜上,然后一抗4℃孵育12 h,二抗孵育后ECL显色、曝光。对蛋白质含量进行密度分析,以相对灰度值代表蛋白表达量。
1.4 结果判定 VEGF以胞浆中出现棕黄色颗粒为阳性细胞;Ki-67、TCF4阳性表达表现为细胞核着色,呈棕色、棕黄色。计数肿瘤细胞密集域共10个,选择400倍视野进行阳性率的计算,取平均值,完全阴性或阳性率lt;10%者为(-), 10%~25%为(+), 26%~50%为(++),gt;50%为(+++)。
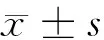
2 结果
2.1 免疫组化染色结果 TCF4阳性为细胞核着色,TCF4 在正常上皮的基底部位细胞中有少数弱阳性表达,其他部位基本为阴性表达(图1-1)。在BCC 组织细胞中,TCF4主要在细胞核呈弱阳性、阳性表达,并弥漫均匀的分布于整个肿瘤组织。在BCC皮损中53例阳性,阳性率为91.07% (图1-2);SK皮损10例阳性表达, 阳性率为21.74%(图1-3)。VEGF 在正常组织呈阴性表达(图1-4);在肿瘤部位的胞质,胞膜及在间质处均可见散在棕色颗粒,在BCC皮损中35例阳性,阳性率为60.10%(图1-5);SK皮损12例阳性表达, 阳性率为26.20%(图1-6);Ki-67阳性为细胞核着色,Ki-67在正常皮肤组织的基底层、棘细胞层仅个别细胞有着色,为阴性表达(lt;5%)(图1-7);在 BCC 组织细胞中, Ki-67主要在细胞核呈弱阳性、阳性表达,在BCC皮损中38例阳性,阳性率为83.27%(图1-8);SK皮损13例阳性表达,阳性率为27.39%(图1-9);VEGF、Ki-67、TCF4在BCC皮损中的表达明显高于SK组,差异有统计学意义(Plt;0.05)(表1)。Spearman等级相关分析:Ki-67和TCF4呈正相关(rs=0.879,Plt;0.01);VEGF和Ki-67呈正相关(rs=0.946,Plt;0.01);VEGF和TCF4呈正相关(rs=0.756,Plt;0.01)。见图1,表1。
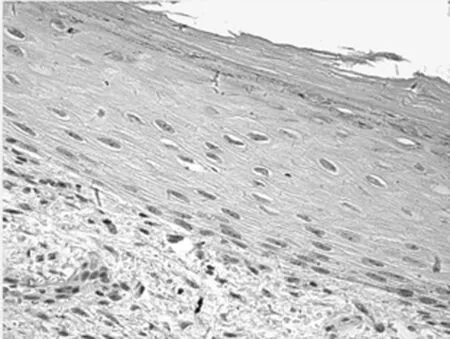
图1-1 TCF4在正常皮肤的表达
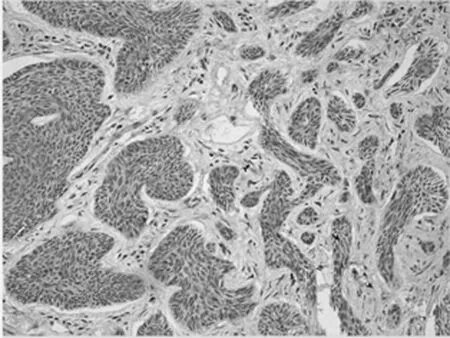
图1-2 TCF4在BCC的表达
图1-3 TCF4在SK的表达
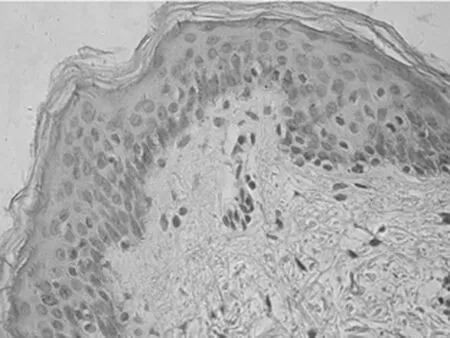
图1-4 VEGF在正常皮肤的表达
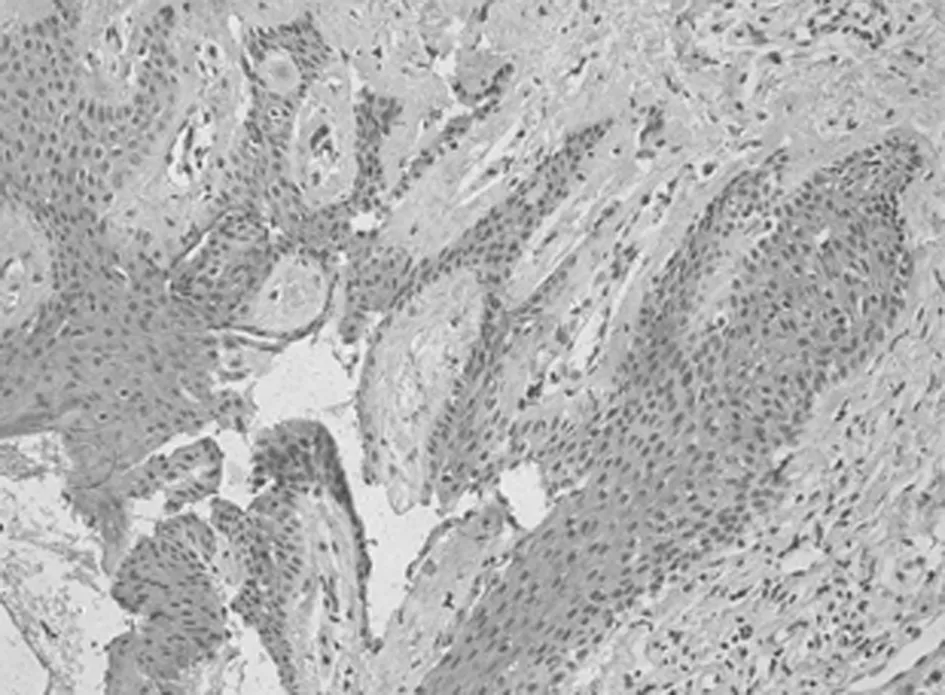
图1-5 VEGF在BCC的表达
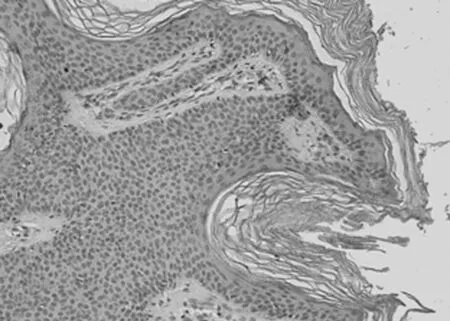
图1-6 VEGF在SK的表达

图1-7 Ki-67在正常皮肤的表达

图1-8 Ki-67在BCC的表达
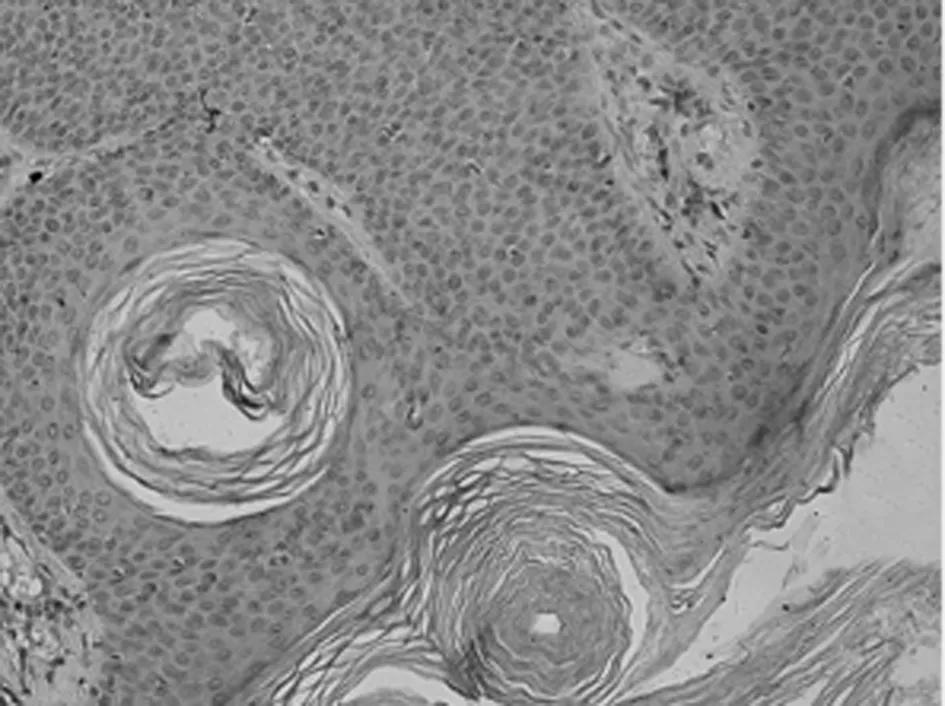
图1-9 Ki-67在SK的表达

2.2 Western蛋白印迹结果 BCC组VEGF(1.41±0.015 vs 0.67±0.008)、KI-67(1.26±0.021 vs 0.54±0.012)、TCF4(1.08±0.007 vs 0.36±0.001)蛋白表达水平均明显高于SK组(Plt;0.01)。见图2,表2。
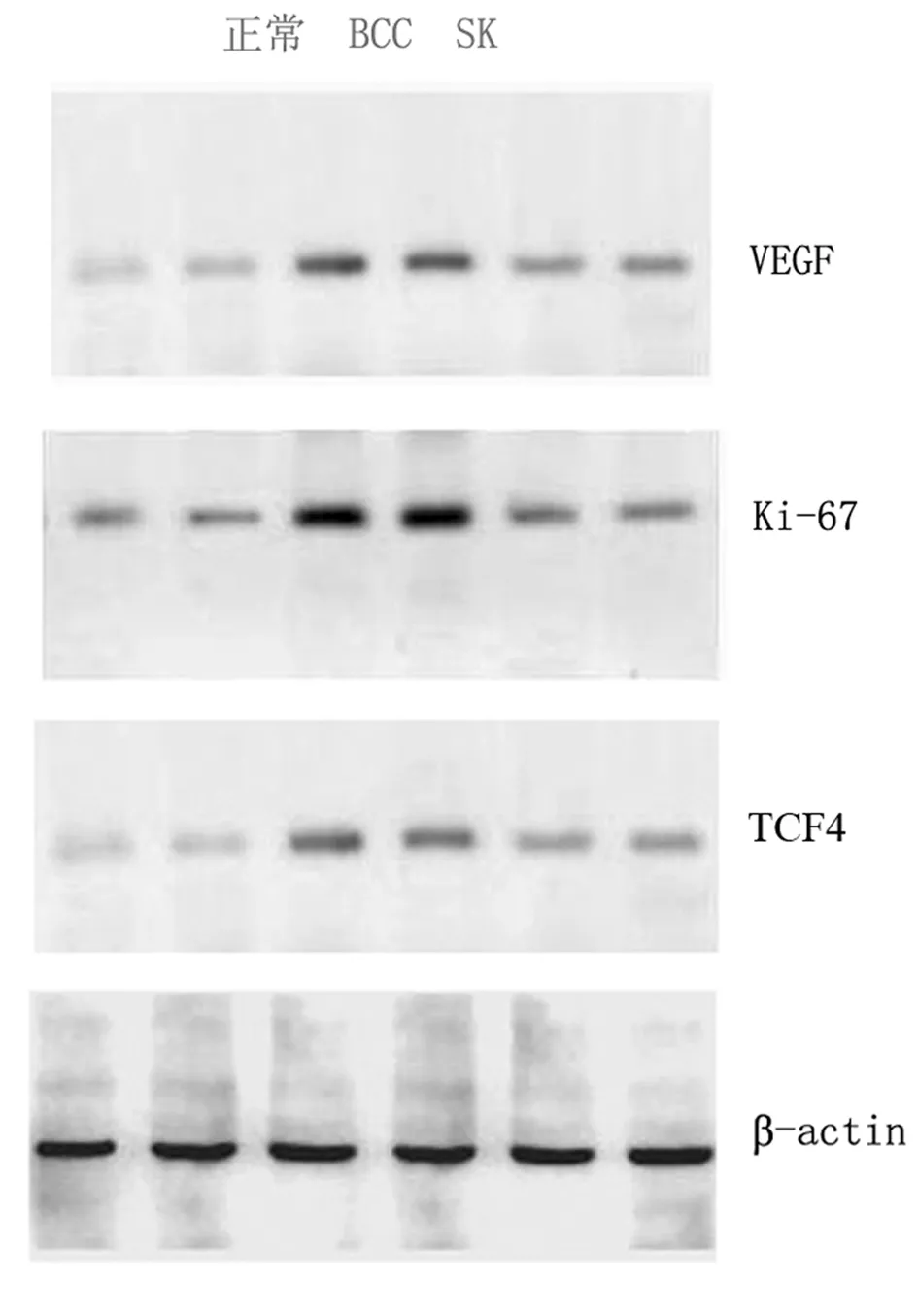
图2 Western blot显示VEGF、Ki-67、TCF4在BCC及SK中表达差异
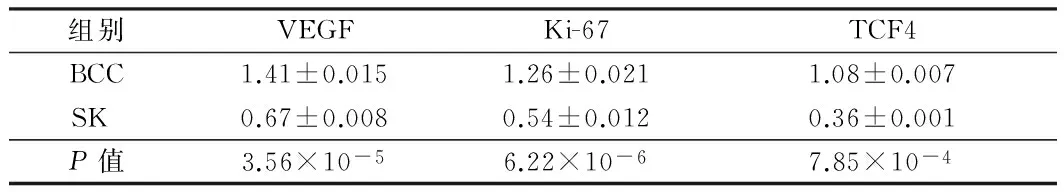
组别VEGFKi-67TCF4BCC1.41±0.0151.26±0.0211.08±0.007SK 0.67±0.0080.54±0.0120.36±0.001P值3.56×10-56.22×10-67.85×10-4
3 讨论
BCC是最常见的皮肤恶性肿瘤之一,好发于颜面部的暴露部位,随着病程进展肿瘤以浸润性生长方式破坏邻近组织,影响功能和美观,严重时转移至重要器官而危及生命,然而其确切的发病机制仍不清楚,亟待解决[6-8]。
本研究在前期研究发现BCC的发生发展与WNT信号通路密切相关,在BCC的发病过程中存在WNT1、β-catenin的表达的异常升高,提示了这种异常表达模式可能是促进肿瘤进展的重要因素,其可能的通路作用与BCC的发生是密切相关的[9]。研究显示WNT信号通路是调控细胞生长、增殖的重要信号通路,WNT-β-catenin-TCF信号转导通路异常激活可导致胚胎发育缺陷及多种肿瘤的发生、发展[10]。研究发现,WNT信号转导通路的激活与皮肤肿瘤的发生发展有着密切的关系[11]。通路中的TCF基因家族(包含4个不同的蛋白TCF1、TCF3、TCF4和LEF)在正常组织发育和分化过程中起至关重要的作用,既能促进细胞增殖分化,又可抑制细胞过度生长,防止肿瘤发生[12]。其中,TCF4被证实为与肿瘤关系最密切的核内转录因子。研究报道,TCF4在肺癌,结肠癌,肝癌,肾癌,胃癌等肿瘤发生中表达明显增强,推测异常升高的TCF4,刺激下游靶基因的表达,进而参与肿瘤的发生发展[13]。
本研究采用免疫组化方法及免疫印迹的方法分别检测了良、恶性角质形成细胞肿瘤(脂溢性角化病、基底细胞癌)组织中TCF4的表达情况。本研究结果显示:在基底细胞癌皮损中,TCF4在细胞核呈现不同程度的阳性表达,表达率高达阳性率为91.07%,而在脂溢性角化皮损及正常皮肤表皮全层表达显著减低。Western blot也证实其在表达量上也存在着显著性差异,这表明在BCC中TCF4的表达模式发生了异质性改变,这种改变可能与BCC的发生相关。Zhao等[14]发现在肝癌细胞系BEL-7402中TCF4呈高表达,杨连赫等[15]的研究表明TCF4在肺癌组织中呈强阳性表达,而在正常肺组织中不表达。在本研究中,TCF4在基底细胞癌和脂溢性角化病、正常皮肤组织中表达的强烈反差可推测TCF4的高表达与基底细胞癌的进展密切相关,从而提示TCF4的表达水平能够在一定程度上反映肿瘤细胞的活动性,进而推测TCF4的高表达可能与肿瘤细胞的恶性程度和分化程度有关。
有研究表明,当WNT信号通路异常激活后, TCF4在WNT信号传导中可调控下游基因表达[10],进一步激活c-myc、cyclinD1、TCF-1及Ki-67等,发挥进一步的生物学功能。本研究中我们采用Spearman等级相关分析发现TCF4和Ki-67呈正相关(rs=0.879,Plt;0.01),这表明TCF4的异常高表达的直接结果之一是促进了Ki-67的异常扩增,促进细胞过度增殖,细胞周期出现紊乱,导致细胞分裂异常。Ki-67的表达与细胞有丝分裂密切相关,随细胞周期不同而发生改变,是反映肿瘤细胞增殖活性的指标。Ki-67 仅在增殖细胞的胞核中表达,半衰期短,脱离细胞周期后迅速降解,其表达高低是反应肿瘤细胞增殖能力的重要参考之一[16]。研究证明,Ki-67的表达程度与肿瘤的恶性程度呈正相关,表达越高其恶性程度及细胞增殖能力越强。本研究结果显示,只在少数正常上皮的基底部位有散在的细胞核弱阳性表达,其余几乎均为阴性表达。而在基底细胞癌肿瘤组织细胞中阳性表达程度显著增高38例阳性,阳性率为83.27%; SK皮损13例阳性表达,阳性率为27.39%。Western blot也证实其在表达量上也存在着明显差异,说明在BCC可能在生物学本质上并不传统认为具备所谓“惰性”,而是增殖程度较高的恶性肿瘤;并且其表达程度与TCF4呈正相关,说明在BCC的发生过程中在多种致癌因素作用下可能是由于TCF4的异常表达激活了Ki-67的高表达,从而使得基底细胞发生过度增殖而发生恶变。
肿瘤新生血管的形成是肿瘤生长和转移的基础[17,18],之前研究对于BCC中血管生成的研究较少,本研究发现,在皮肤BCC中VEGF蛋白的表达明显高于SK组和对照组,本组资料显示VEGF在BCC有较高的表达,阳性率为60.10%;经统计学分析后显示VEGF在BCC皮损中的表达明显高于SK组,有显著性差异;而在正常皮肤及几乎不表达,这说明VEGF参与了BCC细胞间质肿瘤微环境的代谢,为肿瘤的生长和进一步浸润提供了基础,尤其是肿瘤的生长和转移,它依赖于人体内的新生血管。有研究显示在在肿瘤细胞中,WNT-β-catenin-TCF通路可以通过靶向调节miR-23b而促进VEGF的表达[19,20],肿瘤的血管形成受到多种调控因子的调节,其中血管内皮生长因子VEGF作为最重要的血管生长因子之一。VEGF的生物学功能包括促进血管形成和增加血管通透性,对血管内皮细胞的增殖、基底膜水解、迁移和血管构建的调控作用较强,且特异性高。近年来陆续发现,在一些肿瘤细胞上也存在VEGF受体的表达,提示肿瘤中可能存在VEGF的自分泌机制。有研究表明,人肝细胞癌组织中有VEGF的表达,且VEGF的表达于肝癌细胞的生长和转移密切相关[19]。从而我们认为,在BCC的发展过程中由于BCC肿瘤细胞不断自分泌VEGF促进了肿瘤微环境的形成,对其浸润性生长和转移提供了有力的条件。同时,我们对VEGF、Ki-67、TCF4两两之间进行Spearman相关性分析,研究结果表明两两之间表达均呈正相关,由此可以推测VEGF、Ki-67、TCF4在功能上存在协同作用,一致性的高表达可能参与了BCC的发生。
本研究显示,VEGF、Ki-67、TCF4在BCC的形成机制中可能起到一定的作用。可能三者之间通过协同作用改变WNT通路,导致细胞增值分化异常而致肿瘤发生。
1 Marzuka AG, Book SE. Basal cell carcinoma: pathogenesis, epidemiology, clinical features, diagnosis, histopathology, and management. Yale J Biol Med,2015,88:167-179.
2 Ruiz Salas V, Alegre M, Garcés JR,et al.Locally advanced and metastatic basal cell carcinoma: molecular pathways, treatment options and new targeted therapies. Expert Rev Anticancer Ther,2014,14:741-749.
3 Luz FB, Ferron C, Cardoso GP. Surgical treatment of basal cell carcinoma: an algorithm based on the literature. An Bras Dermatol,2015,90:377-383.
4 Nakamura Y, Teramoto Y, Tanaka R. Surgical management of umbilical basal cell carcinoma: Published work review and the optimal depth of surgical excision. J Dermatol,2014,41:992-995.
5 康瑞花,张胜逆,李美洲,等. Wnt1在基底细胞癌中的表达及意义.中国麻风皮肤病杂志,2010,26:34-35.
6 Sofen H, Gross KG, Goldberg LH.A phase Ⅱ, multicenter, open-label, 3-cohort trial evaluating the efficacy and safety of vismodegib in operable basal cell carcinoma.J Am Acad Dermatol,2015,73:99-105.
7 Longo C, Lallas A, Kyrgidis A.Classifying distinct basal cell carcinoma subtype by means of dermatoscopy and reflectance confocal microscopy. J Am Acad Dermatol,2014,71:716-724.
8 Ozgur OK, Yin V, Chou E.Hedgehog Pathway Inhibition for Locally Advanced Periocular Basal Cell Carcinoma and Basal Cell Nevus Syndrome. Am J Ophthalmol,2015,160:220-227.
9 张胜逆,康瑞花,高顺强. WNT信号传导通路与基底细胞癌关系的研究.河北医科大学,2009.
10 Sun X, He Y, Huang C.Distinctive microRNA signature associated of neoplasms with the Wnt/β-catenin signaling pathway. Cell Signal,2013,25:2805-2811.
11 Engeland M, van Steensel MA.Epigenetic changes in Basal Cell Carcinoma affect SHH and WNT signaling components. PLoS One,2012,7:e51710.
12 Wang Y, Liu S, Zhu H.FRAT1 overexpression leads to aberrant activation of beta-catenin/TCF pathway in esophageal squamous cell carcinoma. Int J Cancer,2008,123:561-568.
13 Jamieson C, Sharma M, Henderson BR. Targeting the β-catenin nuclear transport pathway in cancer. Semin Cancer Biol,2014,27:20-29.
14 Zhao DH, Hong JJ, Guo SY, et al. Aberrant expression and function of Tcf4 in the proliferation of hepatocellular carcinoma cell line BEL-7402. Cell Res,2004,14:74-80.
15 杨连赫,徐洪涛,王恩华.TCF-4在肺癌中高表达并与肺癌的进展有关.中国肺癌杂志,2008,11:214-219.
16 Arima N, Nishimura R, Osako T.The importance of tissue handling of surgically removed breast cancer for an accurate assessment of the Ki-67 index.J Clin Pathol,2016,69:255-259.
17 Chen JX, Deng N, Chen X.A novel molecular grading model: combination of Ki67 and VEGF in predicting tumor recurrence and progression in non-invasive urothelial bladder cancer. Asian Pac J Cancer Prev,2012,13:2229-2234.
18 Sobjanek M, Zabotna M, Lesiak A.The -1154 G/A VEGF gene polymorphism is associated with the incidence of basal cell carcinoma in patients from northern Poland. Arch Dermatol Res,2014,306:539-544.
19 Chen L,Han L,Zhang K,et al.VHL regulates the effects of miR-23b on glioma survival and invasion via suppression of HIF-1α/VEGF and β-catenin/Tcf-4 signaling.Neuro Oncol,2012,14: 1026-1036.
20 Hwang I,Kim J,Jeong S.β-Catenin and peroxisome proliferator-activated receptor-δ coordinate dynamic chromatin loops for the transcription of vascular endothelial growth factor Agene in colon cancer cells. J Biol Chem,2012,30:41364-41373.
10.3969/j.issn.1002-7386.2017.22.016
071000 河北省保定市,河北大学附属医院皮肤科(张胜逆、赵建伟、丁秋允、赵桂香、张红岩、刘春梅),胃肠外科(张涛);河北医科大学第四医院皮肤科(康瑞花)
康瑞花,050011 石家庄市,河北医科大学第四医院皮肤科;
E-mail:krh369@163.com
R 730.267.1
A
1002-7386(2017)22-3426-04
2016-04-16)
