ORP调控对马克斯克鲁维酵母发酵纤维素水解液的影响
2017-11-22冯华良高教琪侯胜博李益民袁文杰
冯华良,高教琪,侯胜博,李益民,袁文杰
(大连理工大学生命科学技术学院,辽宁 大连 116024)
ORP调控对马克斯克鲁维酵母发酵纤维素水解液的影响
冯华良,高教琪,侯胜博,李益民,袁文杰
(大连理工大学生命科学技术学院,辽宁 大连 116024)
采用通气的方式进行氧化还原电位(oxidation-reduction potential,ORP)调控,研究在添加抑制物条件下Kluyveromyces marxianus1727-5利用葡萄糖、木糖以及两者混合体系的发酵性能,在此基础上考察了ORP调控策略对玉米秸秆水解液发酵的影响。研究结果表明:在调控ORP策略下,多种混合抑制物对酵母生长代谢造成的损害得以有效改善,细胞活性高,木糖、葡萄糖代谢速率加快。葡萄糖与木糖共发酵时,ORP调控至-150 mV时,葡萄糖发酵时间缩短近30%,木糖醇浓度由3 g·L-1增加到10 g·L-1。ORP调控策略也同样能有效缓解玉米秸秆水解液中较高浓度的多种抑制物对酵母细胞的胁迫,ORP为-100 mV时,相比于对照组,在保持终点乙醇不变的情况下,葡萄糖的发酵时间缩短了22%;木糖消耗由4.88 g·L-1增至10.27 g·L-1,木糖醇得率也由0.20 g·g-1提高至0.48 g·g-1。
通气;氧化还原电位;木质纤维素;抑制物;发酵
引 言
木质纤维素原料是微生物发酵生产乙醇的良好底物,具有价格低廉,含糖量多,不与人争粮的优点。纤维素乙醇的使用可以减少温室气体的排放,对环境污染小[1-3],在世界范围内受到广泛关注。但木质纤维素具有复杂的木质素-纤维素-半纤维素结构,在降解成可被微生物利用的糖之前,需要进行包括酸处理、碱处理在内的预处理,使纤维素酶等水解酶类更易进入,从而将纤维素、半纤维素转化为可发酵的糖类[4-5]。而木质纤维素预处理过程中产生的一系列毒性副产物,主要有弱酸(乙酸、甲酸以及乙酰丙酸)、呋喃衍生物[糠醛、五羟甲基糠醛(5-HMF)]和酚类化合物等[6]。这些有毒化合物对发酵微生物的抑制作用是阻碍纤维素乙醇工业化发展的重要技术瓶颈之一[7-8]。
目前,降低或去除木质纤维素水解液中抑制物影响的策略主要可分为两大类[9]。一类是去除水解液中的抑制物、减少抑制物产生以及缓解微生物抑制,包括优化预处理、水解液脱毒技术、过程工程控制等。另一类是提高发酵微生物的抑制物耐受性,主要有微生物的筛选、进化工程、基因工程方法等。
细胞内进行着各种各样以氧化还原反应为主的代谢过程,保持胞内氧化还原平衡是维系正常生命活动的必要条件[10]。氧化还原电位(ORP)反映了溶液中物质表现出来的宏观氧化-还原性,因而ORP成为表征生化反应的重要参数之一。而且细胞内氧化还原平衡间接受到胞外环境的 ORP水平影响[11]。
Liu等[12]研究了 ORP(-150 mV)调控下S.cerevisiae高浓度乙醇发酵,发现控制水平下的细胞活性显著提高,乙醇产率增加。他们对发酵过程中酵母细胞全基因表达水平进行了分析,结果显示不仅部分糖代谢相关基因的表达与 ORP变化出现了关联的趋势,此外,还发现了与耐受渗透压胁迫、乙醇抑制等相关的甘油、海藻糖合成代谢基因,热休克蛋白基因的表达变化以适应环境胁迫。Gao等[13]在研究工作中已经对Kluyveromyces marxianusY179(在未通气条件分别以120、230 g·L-1菊粉为底物以及利用通入无菌空气的方式将发酵中 ORP调控至-130 mv水平下230 g·L-1菊粉为底物)的3种发酵条件下转录分析。发现合适的通气量引起了转录响应的变化,与氧化胁迫(如TPX1)和自噬(如ATG)相关的基因转录水平明显的上调或下调以保持较高的细胞活性,从而实现较优的发酵性能。郝学密等[14]在S. cerevisiae乙醇发酵过程中,利用氧化剂赤血盐和还原剂二硫苏糖醇调节初始 ORP(305、157、-150 mV),研究了不同ORP水平下细胞对抑制物的耐受性影响。发现氧化状态(305、157 mV)增强了细胞通过自身代谢脱毒。
这些研究表明对发酵过程中 ORP进行调控不仅能改变细胞代谢流,使其流向利于目标产物生成的方向,也能改善细胞的胁迫耐受性,这也是本研究引入ORP调控策略的切入点之一。
本文以比例-积分-微分(proportion integration differentiation,PID)控制为理论基础,采用通入无菌空气的方式进行ORP调控,研究在多种水解液抑制物(乙酸、甲酸、糠醛及5-HMF)存在的条件下,不同ORP条件对Kluyveromyces marxianus1727-5葡萄糖、木糖以及两者组成的混合糖发酵的影响。最后,结合相关实验结果,采用优化出的ORP调控策略,对K. marxianus1727-5发酵玉米秸秆水解液进行研究。
1 实验材料和方法
1.1 菌株和发酵
菌种:马克斯克鲁维酵母(Kluyveromyces marxianus),购自中国工业微生物保藏中心,编号1727。K. marxianus1727-5,由本实验室以K.marxianus1727为出发菌株驯化获得。以上菌株均由本实验室保藏。
活化(YPD)培养基(g·L-1):葡萄糖 20,蛋白胨10,酵母粉10,121℃灭菌15 min。
种子培养基(g·L-1):葡萄糖20,蛋白胨10,酵母粉10(葡萄糖发酵);木糖20,蛋白胨10,酵母粉10(木糖发酵和葡萄糖与木糖共发酵),121℃灭菌15 min。
发酵培养基(g·L-1):①葡萄糖 100,蛋白胨10,酵母粉10,乙酸1.5,甲酸0.8,糠醛0.8,五羟甲基糠醛 0.6(葡萄糖发酵);②木糖30,蛋白胨10,酵母粉10,乙酸1.2,甲酸0.6,糠醛0.6,五羟甲基糠醛0.5(木糖发酵);③葡萄糖100和木糖35,蛋白胨10,酵母粉10,各抑制物浓度与②发酵一致(葡萄糖与木糖共发酵),121℃灭菌15 min;抑制物在灭菌后,接种前添加至培养基中。本次研究中,抑制物的种类及浓度依据目前普遍使用的酸处理,参考相关文献添加[15-19]。
摇瓶种子培养:由-80℃冰箱中取出菌种保藏管,接种至8 ml活化培养基中进行活化,在30℃、150 r·min-1条件下培养20 h。再将活化后的菌株转接至种子培养基中,30℃、150 r·min-1条件下12 h。
发酵罐发酵培养:将种子培养液离心,5000 r·min-1、8min,并用去离子水重悬,接种至盛有1 L发酵培养基的发酵罐(Biotec-3BG-4,China)中,将初始菌种密度调至 OD620=2,通过 1 mol·L-1NaOH控制pH至5.0±0.05,温度、搅拌速率分别设定为 30℃、150 r·min-1。
1.2 玉米秸秆预处理及酶解
实验中所用玉米秸秆原料购自江苏连云港,其纤维素含量约为31%,半纤维素含量约为19%,木质素含量约为16%。纤维素酶购自诺维信生物技术有限公司,酶活力150 FPU·ml-1。
玉米秸秆预处理:玉米秸秆磨碎过0.5 mm筛。称取150 g,加至盛有1.5 L 2%稀硫酸的7 L发酵罐中,充分浸润,高压蒸汽处理(135℃、30 min)。
酶解:经预处理后,利用15 mol·L-1NaOH将pH调至5。以30 FPU·g-1的比例加入纤维素酶,酶解过程中,通过 1 mol·L-1NaOH 控制 pH 至4.70±0.05,温度、搅拌速率分别设定为50℃、200 r·min-1,酶解时长 72 h。酶解完成后 5000 r·min-1离心10 min,上清液即为玉米秸秆水解液,存于4℃备用。
1.3 ORP调控策略
利用通入无菌空气控制发酵过程 ORP稳定在预设值(±2 mV)。木糖发酵分别控制ORP -150、-120 mV;葡萄糖发酵设定值为-200、-150 mV;葡萄糖与木糖共发酵设定值为-200、-170、-150及-110 mV;玉米秸秆水解液发酵设定值为-100 mV。ORP电极(Pt4805-DPAS-SC-K8S/225,Mettler Toledo,Switzerland)监测发酵过程中氧化还原电位变化,并连接至ORP控制仪((pH/ORP Transmitter PC-3100,Suntex,China),当发酵过程中氧化还原电位值低于预设值时,控制仪开启气泵通入无菌空气,直至达到预设值(+2 mV),然后关闭气泵。
1.4 分析方法
生物量测定:利用酶标仪(Thermo labsystems Multiskan Ascent 354)测620 nm波长处菌体的吸光度,以OD620值表示。
发酵液成分测定:使用 Waters高效液相色谱(Waters 410,MA,USA)分析发酵液样品中葡萄糖、木糖、木糖醇、乙醇、甘油、乙酸等代谢物以及甲酸、糠醛、5-HMF等抑制物的含量。色谱柱为有机酸分析柱AminexHPX-87H(300 mm×7.8 mm,Bio-Rad,Hercules),进样量:20 μl,流动相:0.01 mmol·L-1H2SO4,流速:0.5 ml·min-1,示差检测器温度:50℃,柱温:50℃。
2 实验结果与讨论
2.1 ORP调控对多种抑制物存在下木糖发酵的影响

图1 ORP调控下的木糖发酵Fig.1 Effect of ORP regulation on fermentation using xylose as sole carbon source

表1 不同ORP条件下K. marxianus 1727-5发酵结果Table 1 Comparison of fermentation results using K. marxianus 1727-5 under different ORP conditions
2.1.1 细胞生长及ORP变化 纤维素预处理过程中产生的多种抑制物如有机酸、糠醛及其衍生物等对后续发酵最显著的影响是造成细胞活性下降,抑制细胞生长[20-22]。如图1(a)所示,以30 g·L-1木糖为底物,未调控的对照组,菌种接入发酵培养基后,其ORP在约4 h即降至最低点-163 mV±2 mV并维持了仅12 h,此后ORP一直在缓慢上升至发酵终点。这与其细胞生长呈现出一致的趋势,在整个发酵过程中其生物量OD620基本稳定在2左右,可见多种抑制物存在的无氧条件下,细胞生长受到严重影响,细胞活性较低,代谢缓慢。
由图1及表1也可知,在ORP设定为-150 mV时,发酵进行约2 h后达到预设值,开始通入无菌空气进行ORP调控,但仅仅维持了3 h,此后尽管通气速率已调至0.2 vvm,发酵系统中ORP仍迅速下降,发酵至24 h,ORP开始稳定在-170 mV±2 mV直到发酵终止。在ORP设定为-120 mV 时,发酵开始后不久ORP即达到预设值-120 mV,开始通气调控,但也仅维持了约12 h,并在发酵60 h之后,ORP下降至最低点-155 mV,之后逐渐上升,至96 h,ORP重新维持在-120 mV。发酵过程中出现了较为明显的“失控”现象,可能是由于一些关键代谢物的生成影响了发酵体系的氧化还原电位[23]。整个发酵过程,ORP预设-150、-120 mV条件下,通气总量分别达到1622.4和5818 L。ORP与通气量相互联系,并反映出细胞生长状况。ORP控制在-150 mV水平下,其生物量浓度(OD620)由未进行调控的对照组2.2增加到2.7,而-120 mV水平下,更增至5.5。可见较高的ORP值意味着通气量的增加。通气量高的环境,细胞活性高代谢旺盛,从而显著改善在多种抑制物存在下的细胞生长状况。
2.1.2 木糖消耗及产物生成 ORP调控对菌株木糖发酵性能也有相当明显的影响。如图1(c)所示,发酵至132 h,-150 mV水平下的残余木糖浓度从对照组的 19.83 g·L-1降至 2.18 g·L-1。而更显著的是,在-120 mV条件下,发酵108 h,木糖就被完全消耗。木糖醇浓度由不通气的 8.92 g·L-1增加至20.36 g·L-1,但得率略有降低,这可能是由于在较高的通气条件下ORP,更多的木糖用于细胞生长[24]。
综上所述,ORP调控策略改善了在多种抑制物存在下K. marxianus1727-5的生长及木糖发酵,但ORP“失控”问题突出,有待深入研究。
2.2 ORP调控对多种水解液抑制物存在下葡萄发酵的影响
2.2.1 细胞生长及 ORP变化 在多种抑制物存在条件下,含100 g·L-1葡萄糖的培养基中发酵结果如图2、表1所示。在对照组不通气发酵过程中,ORP逐渐降低。细胞生长也受到了抑制物胁迫等影响。其生物量OD620相比初始接种量,增加了约2倍。
由图2(a)、(b)也可发现,当ORP预设值为-200 mV时,通过通气控制,发酵开始2.5 h之后达到预设值,可保持稳定至发酵结束。而 ORP预设值为-150 mV时,发酵至1.5 h达到预设值,但仅维持不到3 h,之后便逐渐降至最低值-189 mV(葡萄糖耗完,发酵结束),后又逐渐上升。此外,如表1所示,两种调控状态下的总通气量分别是 53.3和272.5 L。这是由于ORP降低与细胞活性紧密联系[24]。通气量较少的状态下,细胞活性较差,ORP下降缓慢,即使通入少量的空气也可明显提高发酵液中的ORP。而通气量多的环境中,细胞活性高、代谢旺盛,生长快,ORP下降迅速,需要向发酵液中通入大量的空气才能提升ORP值。而且生物量增至较高水平时,即使大量通入空气,其中氧气的溶解速率也远不及细胞代谢耗氧速率,致使ORP呈现持续下降趋势。这可由ORP预设-200、-150 mV条件下,其生物量OD620最高分别增至初始的2.5、3.5倍来相互验证。

图2 ORP调控下的葡萄糖发酵Fig.2 Effect of ORP regulation on fermentation using glucose as sole carbon source
2.2.2 葡萄糖消耗及产物生成 由图2(c)、表1可知,对照、-200 mV、-150 mV 3种条件下的葡萄糖发酵结束时间依次缩短,分别为14、11、9 h,呈现出与木糖发酵相似的趋势,即预设ORP高,总通气量大,细胞耗糖速率快。而且并未出现之前研究中所报道的通气量大,乙醇产率降低的现象[25],其乙醇产率分别为0.40、0.39、0.40 g·g-1。可能是整个发酵过程时间相对短,气体夹带乙醇极少,也未造成其被进一步氧化代谢。此外,ORP调控下的甘油产量明显低于未通气对照组,甘油作为胞内主要的保护物质[26],其产量的减少在一定程度上揭示了通气降低了抑制物对细胞造成的不利影响。
2.3 ORP调控对多种抑制物存在下葡萄糖与木糖共发酵的影响
2.3.1 细胞生长及 ORP变化 根据实际木质纤维素物料水解液主要可发酵糖类的含量[27],确定了含多种抑制物的共发酵培养基中的混合糖浓度,分别是 100 g·L-1葡萄糖和 35 g·L-1木糖。
如图3(a)所示,未调控的对照组ORP曲线基本呈现“U”形。其原因是发酵前期(0~24 h),K.marxianus1727-5优先利用葡萄糖进行发酵,此阶段的 ORP变化基本与葡萄糖发酵相似,代谢较旺盛,细胞快速生长,产生较多 NADH等还原力,ORP逐渐下降,随生物量增加,其生成的还原力可基本用于维持细胞代谢生长,ORP维持短暂稳定[28]。当葡萄糖被消耗之后,木糖成为唯一底物,但其在无氧条件下较难被酵母利用。加之葡萄糖发酵阶段的代谢产物如乙醇、乙酸等加剧了细胞承受的胁迫压力。因此细胞代谢缓慢、酶活性下降,ORP逐渐回升。
而在ORP调控策略下,如前,生物量增长与维持ORP预设值的通气总量呈比例,随通气量增加,生物量最高浓度也随之上升。相比于对照组在发酵20 h后生物量达到最高浓度OD620为3.6,-200、-170、-150及-110 mV条件下分别在18、14、14、12 h后达到最高浓度(OD620)为 3.9、5.2、4.6、5.8。此外,也可看出-170、-110 mV条件下发酵前期出现了明显的“失控”现象,尽管通气量已分别占总通气量的近 2/3、1/5,ORP仍然逐渐降至最低值-180、-160 mV,约在30 h后才重新恢复至预设值水平,这可能是由于前期以葡萄糖为主的发酵阶段高细胞活性和生物量水平需要大量的氧气,而ORP调控的幅度越大,需要通入的空气(或氧气)量越大。进入木糖发酵阶段后,各条件下的生物量浓度相比发酵过程中的最大值都有不同程度降低,后趋于平稳。这主要是由于细胞活性的下降所致[23]。但通气总量高的条件,其降幅也较小,这也从侧面揭示了通气有利于促进酵母抵御不良的胁迫环境,提高细胞活性及木糖代谢。如图4所示,分别取发酵结束时,ORP调控至-150 mV(K. marxianus1727-5-ORP-150)、-170 mV(K. marxianus1727-5-ORP-170)条件下的菌体,以及出发菌K.marxianus1727-5,进行梯度稀释后,在含有多种较高浓度水解液抑制物存在下的固体培养基上进行培养,可发现-150 mV条件的细胞生长状况优于其他菌株,说明其多种抑制物耐受能力比其他菌株强,这也进一步证实了在合适通气条件下,通气总量与细胞抑制物耐受性之间的正向关系。

图3 ORP调控下的葡萄糖和木糖共发酵Fig.3 Effect of ORP regulation on fermentation using glucose and xylose as carbon source

图4 多种木质纤维素水解抑制物存在条件下K. marxianus 1727-5、1727-5-ORP-150和1727-5-ORP-170的细胞生长状况Fig.4 Growth testing of K. marxianus 1727-5,1727-5-ORP-150 and 1727-5-ORP-170 in presence of multiple lignocellulose-derived inhibitors
2.3.2 葡萄糖、木糖消耗及产物生成 ORP调控策略下对K. marxianus1727-5的葡萄糖与木糖共发酵性能的改善也是显而易见的。-200、-170、-150、-110 mV条件下葡萄糖耗完时间从对照组的22 h分别缩短至20、16、16、14 h。但乙醇产量基本随ORP值的升高,通气量的增加有所减少。由表1可见,ORP调控至-110 mV水平下,其产量已有明显下降,乙醇得率仅0.36 g·g-1。主要原因可能是需大量通气进行ORP调控,因此通气速率过大,气体夹带损失。
由表1也可知,同ORP的预设值相偶联的通气量与木糖消耗基本呈正相关,发酵至132 h,其残余木糖浓度分别由未调控对照27.06 g·L-1降至21.51、23.18、14.21、8.83 g·L-1。木糖醇得率与之也有类似关系,在-200、-170、-150 mV条件下,其得率依次递增,在-150 mV达到最高0.40 g·g-1,但-110 mV条件下木糖醇得率降至0.34 g·g-1,这是由于碳通量由产物流向了细胞生长所致。而-200 mV的木糖醇得率明显低于其他条件,主要是因为其通气调控主要集中在葡萄糖发酵阶段,发酵后期通气量不到总通气量的10%。由图3也可知其与对照组一样糖利用基本停滞,调控主要是促进前期葡萄糖和木糖的利用,而此阶段的木糖的碳代谢主要流向细胞生长,较少流向产物木糖醇。此外,也可发现ORP调控至-170 mV条件下,以葡萄糖发酵为主的前期阶段与-150 mV条件下的细胞生长和葡萄糖消耗状况相似,而后期发酵阶段木糖消耗与-200 mV条件类似。这也是因为其通气调控主要集中在葡萄糖发酵阶段,且通气总量较大,因此葡萄糖发酵性能改善明显,而后期基本未进行调控,通气量相对少,细胞活性低,木糖代谢不足以维持细胞生长,其生物量浓度的大幅下降验证了这一点。综合上述实验结果,ORP调控至-150 mV对于K. marxianus1727-5在多种抑制物存在条件下的葡萄糖与木糖共发酵可能是一个较合适的水平。不仅葡萄糖发酵时间明显缩短,木糖残余浓度显著降低,并且其乙醇和木糖醇得率都相对较高。而其通气量仅为-110 mV控制条件下的一半,这不仅大大降低了染菌风险,也大大减少了生产成本。
2.4 ORP调控对马克斯克鲁维酵母在玉米秸秆水解液中发酵的影响
未经脱毒的玉米秸秆水解液,经HPLC检测甲酸、乙酸、糠醛、5-HMF浓度分别为 0.9±0.18、1.95±0.25、0.5±0.12、0.26±0.05 g·L-1;葡萄糖为23.5±0.3 g·L-1,木糖为 14.9±0.6 g·L-1。以此水解液为底物,研究了K. marxianus1727-5的发酵情况。由于在不通气的情况下,ORP处于-100~-130 mV,因此根据前面的研究结果,将 ORP控制在-100 mV。由图5可知,相比于未通气对照组9 h耗完葡萄糖,ORP调控至-100 mV条件下,7 h即结束,其乙醇得率分别为0.45和0.44 g·g-1。木糖利用方面,未通气条件下同样出现了葡萄糖耗完后木糖消耗停滞的现象。但在-100 mV ORP调控下,未出现此种状况,其消耗木糖由对照组的 4.88 g·L-1增至10.27 g·L-1、而木糖醇得率由 0.20 g·g-1提高至 0.48 g·g-1,且其通气总量仅为31.5 L。这些实验结果基本与模拟物料发酵结果一致,即在一定范围内,通气量越大,细胞活性越高,木糖、葡萄糖代谢速率越快。表明ORP调控策略也同样有效缓解玉米秸秆水解液中较高浓度的多种抑制物混合物对细胞的胁迫,改善了其发酵性能,且能耗投入少,具有一定的工业应用前景。
此外,发现利用玉米秸秆水解液发酵与合成培养基相比,其发酵效率明显降低,推测是由于除糠醛、5-HMF等抑制物外,玉米秸秆水解液中还含有大量其他化合物,如不溶性的酚类化合物等造成[29-30]。
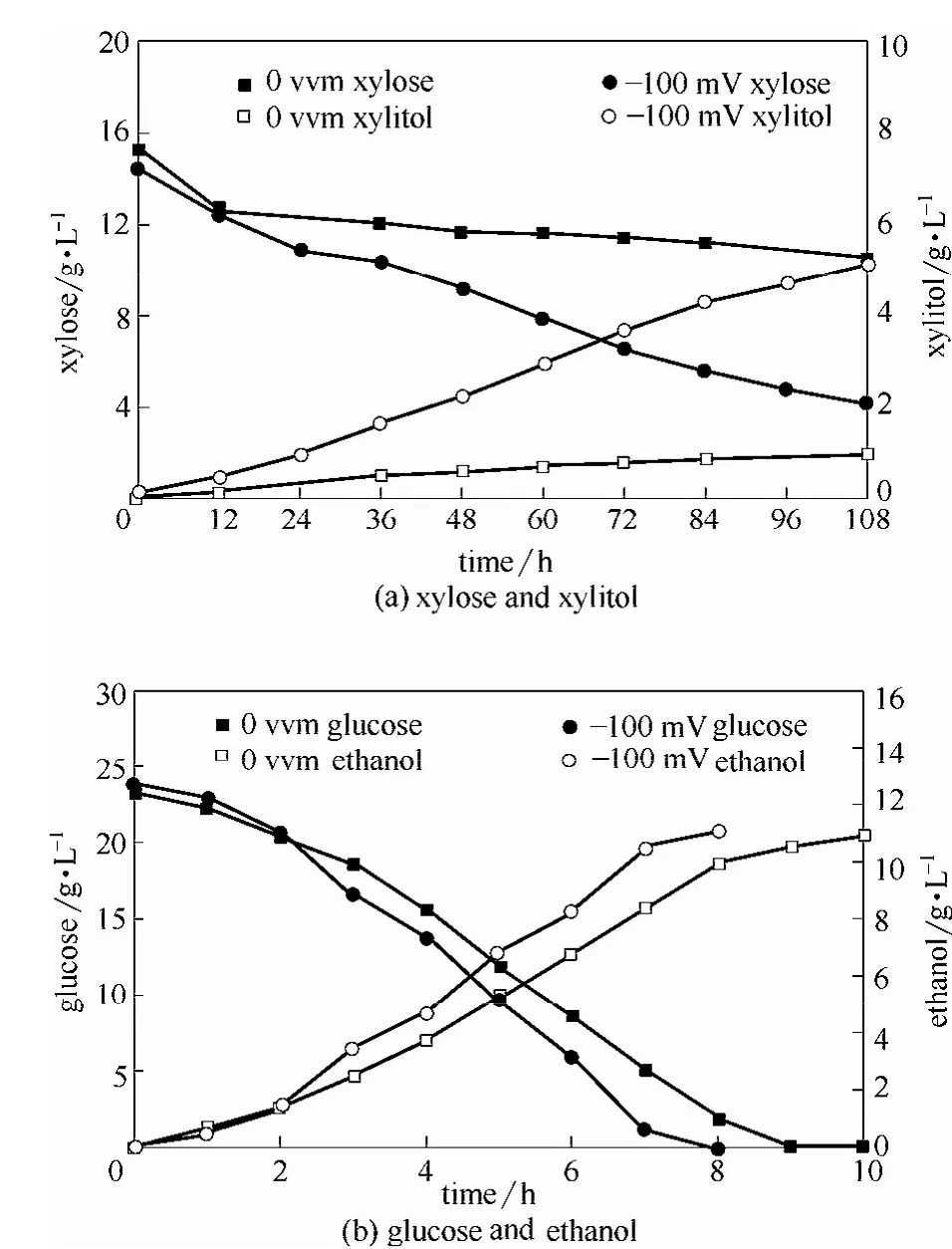
图5 ORP调控至-100 mV条件下未脱毒的玉米秸秆水解液发酵Fig.5 Effect of controlled ORP at -100 mV on fermentation by K. marxianus 1727-5 from non-detoxifed cornstraw hydrolysate
3 结 论
采用通气控制 ORP的方式,研究了K.marxianus1727-5在多种抑制物存在条件下的葡萄糖、木糖发酵性能以及未脱毒玉米秸秆水解液中的发酵情况,结论如下。
(1)木糖发酵过程中 ORP与细胞生长、木糖消耗关系密切,且ORP调控下多种抑制物对酵母生长代谢造成的严重影响得以有效改善。基本趋势是预设ORP值越高,通气量越大,细胞活性也高,细胞生长快,木糖代谢速率及木糖醇得率高。
(2)葡萄糖发酵与木糖发酵呈现相似的趋势,随预设ORP值升高,生物量浓度增加,发酵时间显著缩短,但3种条件下(未调控对照组、-150、-120 mV)的乙醇得率几乎无差异,未出现随ORP增加,乙醇得率下降的现象。此外,随ORP增加甘油产量呈现减少趋势,这也表明利用ORP控制通气,可有效改善抑制物对细胞生长代谢的不利影响。
(3)ORP调控策略下,葡萄糖与木糖共发酵性能得到改善。葡萄糖发酵时间缩短,木糖利用率增加,缓解胁迫压力,提高细胞活性。葡萄糖与木糖共发酵而言,ORP调控至-150 mV是一个较合适的水平。
(4)ORP调控至-100 mV有效缓解了玉米秸秆水解液中较高浓度的多种抑制物对细胞的胁迫,改善了其发酵性能。
[1] HAHN-HÄGERDAL B, GALBE M, GORWA-GRAUSLUND M F,et al. Bioethanol—the fuel of tomorrow from the residues of today[J].Trends. Biotechnol, 2006, 24(12): 549-556.
[2] NIGAM P S, SINGH A. Production of liquid biofuels from renewable resources[J]. Progress in Energy & Combustion Science, 2011, 37(1):52-68.
[3] JIN C, YAO M F, LIU H F,et al. Progress in the production and application ofn-butanol as a biofuel[J]. Renewable & Sustainable Energy Reviews, 2011, 15(8): 4080-4106.
[4] AGUSTINI L, EFIYANTI L, FAULINA S A,et al. Isolation and characterization of cellulase- and xylanase-producing microbes isolated from tropical forests in Java and Sumatra[J]. International Journal of Environment and Bioenergy, 2012, 3(3): 154-167.
[5] WYMAN C E, DALE B E, ELANDER R T,et al. Coordinated development of leading biomass pretreatment technologies[J].Bioresource Technol., 2005, 96(18): 1959-1966.
[6] BARAL N R, SHAH A. Microbial inhibitors: formation and effects on acetone-butanol-ethanol fermentation of lignocellulosic biomass[J].Appl. Microbiol. Biot., 2014, 98(22): 9151-9172.
[7] TAHA M, FODA M, SHAHSAVARI E,et al. Commercial feasibility of lignocellulose biodegradation: possibilities and challenges[J]. Curr.Opin. Biotech., 2016, 38: 190.
[8] SINGH A, PANT D, KORRES N E,et al. Key issues in life cycle assessment of ethanol production from lignocellulosic biomass:challenges and perspectives[J]. Bioresource Technol., 2010, 101(13):5003-5012.
[9] ZHAO X, XIONG L, ZHANG M,et al. Towards efficient bioethanol production from agricultural and forestry residues: exploration of unique natural microorganisms in combination with advanced strain engineering[J]. Bioresource Technol., 2016, 215: 84-91.
[10] JAIN V K. Modifying redox potential and its impact on metabolic fluxes inSaccharomyces cerevisiae[D]. Stellenbosch: Stellenbosch University, 2010.
[11] DE GRAEF M R, ALEXEEVA S, SNOEP J L,et al. The steady-state internal redox state (NADH/NAD) reflects the external redox state and is correlated with catabolic adaptation inEscherichia coli[J]. J.Bacteriol., 1999, 181(8): 2351-2357.
[12] LIU C G, LIN Y, BAI F. Global gene expression analysis ofSaccharomyces cerevisiaegrown under redox potential-controlled very-high-gravity conditions[J]. Biotechnol. J., 2013, 8(11):1332-1340.
[13] GAO J Q, YUAN W J, LI Y M,et al. Transcriptional analysis ofKluyveromyces marxianusfor ethanol production from inulin using consolidated bioprocessing technology[J]. Biotechnol. Biofuels, 2015,8(1): 115.
[14] 郝学密, 杜斌, 刘黎阳, 等. ORP对酿酒酵母在木质纤维素水解液抑制物中发酵的影响[J]. 化工学报, 2015, 66(3): 1066-1071.HAO X M, DU B, LIU L Y,et al. Effect of ORP regulation on yeast fermentation with inhibitors of lignocellulose hydrolysate[J]. CIESC Journal, 2015, 66(3): 1066-1071.
[15] KO J K, UM Y, HAN M W,et al. Ethanol production from lignocellulosic hydrolysates using engineeredSaccharomyces cerevisiae, harboring xylose isomerase-based pathway[J]. Bioresource Technology, 2016, 209: 290-296.
[16] 魏铭, 王彩霞, 邢建民. 高效液相色谱法测定玉米秸秆预处理过程的抑制物[J]. 西南林业大学学报, 2014, 34(6): 85-90.WEN M, WANG C X, XING J M. Determination of inhibitors in pretreatment corn straw by using high performance liquid chromatography[J]. Journal of Southwest Forestry University, 2014,34(6): 85-90.
[17] CHEN S F, MOWERY R A, CASTLEBERRY V A,et al.High-performance liquid chromatography method for simultaneous determination of aliphatic acid, aromatic acid and neutral degradation products in biomass pretreatment hydrolysates.[J]. Journal of Chromatography A, 2006, 1104(1): 54-61.
[18] CHUNDAWAT S P S, VISMEH R, SHARMA L N,et al.Multifaceted characterization of cell wall decomposition products formed during ammonia fiber expansion (AFEX) and dilute acid based pretreatments[J]. Bioresource Technology, 2010, 101(21):8429-8438.
[19] DU B, SHARMA L N, BECKER C,et al. Effect of varying feedstock-pretreatment chemistry combinations on the formation and accumulation of potentially inhibitory degradation products in biomass hydrolysates[J]. Biotechnology & Bioengineering, 2010,107(3): 430-440.
[20] PALMQVIST E, GRAGE H, MEINANDER N Q,et al. Main and interaction effects of acetic acid, furfural, andp-hydroxybenzoic acid on growth and ethanol productivity of yeasts[J]. Biotechnology &Bioengineering, 1999, 63(1): 46-55.
[21] SAKAI S, TSUCHIDA Y, NAKAMOTO H,et al. Effect of lignocellulose-derived inhibitors on growth of and ethanol production by growth-arrestedCorynebacterium glutamicumR[J]. Applied &Environmental Microbiology, 2007, 73(7): 2349-2353.
[22] CAO G L, REN N Q, WANG A J,et al. Effect of lignocellulose-derived inhibitors on growth and hydrogen production byThermoanaerobacteriumthermosaccharolyticumW16[J].International Journal of Hydrogen Energy, 2010, 35(24): 13475-134803.
[23] GAO J Q, YUAN W J, LI Y M,et al. Application of redox potential control to improve ethanol productivity from inulin by consolidated bioprocessing[J]. Process Biochem., 2016, 51(10): 1544-1551.
[24] KIM S Y, KIM J H, OH D K. Improvement of xylitol production by controlling oxygen supply inCandida parapsilosis[J]. Journal of Fermentation & Bioengineering, 1997, 83(3): 267-270.
[25] 孜力汗, 刘晨光, 王娜, 等. 多种通气策略下的高浓度乙醇生产[J].中国生物工程杂志, 2013, 33(6): 86-92.ZI L H, LIU C G, WANG N,et al. Very high gravity ethanol production under different aeration schemes[J]. China Biotechnology,2013, 33(6): 86-92.
[26] BROWN A D. Microbial water stress[J]. Bacteriological Reviews,1976, 40(40): 803-846.
[27] HE Y Q, ZHANG J, BAO J. Acceleration of biodetoxification on dilute acid pretreated lignocellulose feedstock by aeration and the consequent ethanol fermentation evaluation[J]. Biotechnol. Biofuels,2016, 9(1): 1-13.
[28] HASUNUMA T, KONDO A, XU J H,et al. Development of yeast cell factories for consolidated bioprocessing of lignocellulose to bioethanol through cell surface engineering[J]. Biotechnol. Adv.,2012, 30(6): 1207-1218.
[29] HASUNUMA T, SANDA T, YAMADA R,et al. Metabolic pathway engineering based on metabolomics confers acetic and formic acid tolerance to a recombinant xylose-fermenting strain ofSaccharomyces cerevisiae[J]. Microb. Cell Fact., 2011, 10(1):2-14.
[30] VAN DER POL E C, BAKKER R R, BAETS P,et al. By-products resulting from lignocellulose pretreatment and their inhibitory effect on fermentations for (bio)chemicals and fuels[J]. Appl. Microbiol.Biot., 2014, 98(23): 9579-9593.
date:2017-05-08.
YUAN Wenjie, ywj@dlut.edu.cn
supported by the International Cooperation and Exchanges NSFC (51561145014).
Effect of ORP regulation on fermentation byKluyveromyces marxianusfrom lignocellulosic hydrolysates
FENG Hualiang, GAO Jiaoqi, HOU Shengbo, LI Yimin, YUAN Wenjie
(School of Life Science and Biotechnology,Dalian University of Technology,Dalian116024,Liaoning,China)
The effect of ORP regulation on batch fermentation byKluyveromyces marxianus1727-5 was investigated using glucose, xylose and glucose/xylose mixture under stress conditions caused by mixture of acetic acid, formic acid, furfural and 5-HMF. Moreover, batch fermentation from corn stalk hydrolysate was further conducted with the optimized ORP control strategy. The experimental results showed that the stress tolerance of cells to multiple inhibitors above was significantly improved together with enhanced cellular metabolic activities involved in both glucose and xylose utilization. For the fermentation from glucose/xylose mixture, the significant improvements were also achieved with respects to xylose utilization under ORP control conditions. Especially,with ORP controlled at -150 mV, the glucose fermentation time was shortened about 30% with the same ethanol.The yields of xylitol was increased from 3 g·L-1to 10 g·L-1compared to the control without ORP regulation.More important, when the ORP controlled at -100 mV, fermentation from corn stalk hydrolysate was greatly facilitated in terms of inhibitors tolerance, and the glucose fermentation time was shortened about 22% with the same ethanol. More important, xylose utilization and xylitol yield were increased to 10.27 g·L-1and 0.48 g·g-1,respectively, compared to those of 4.88 g·L-1and 0.20 g·g-1in the control without ORP regulation.
aeration; ORP; lignocellulose; inhibitor; fermentation
Q 815
A
0438—1157(2017)11—4279—09
10.11949/j.issn.0438-1157.20170571
2017-05-08收到初稿,2017-07-25收到修改稿。
联系人:袁文杰。
冯华良(1991—),男,硕士研究生。
中泰农业生产及加工废弃物生产燃料乙醇基础研究和关键技术(51561145014)。
