萃取精馏复合溶剂的复配选择
2017-11-22方静轩碧涵李晓春李春利
方静,轩碧涵,李晓春,李春利
(河北工业大学化工学院,天津 300130)
萃取精馏复合溶剂的复配选择
方静,轩碧涵,李晓春,李春利
(河北工业大学化工学院,天津 300130)
提出按溶剂之间复配形成氢键的情况和修正的UNIFAC模型相结合的方法选择分离共沸体系的萃取精馏复合溶剂。准确测量了共沸体系与萃取精馏单溶剂和复合溶剂的汽液平衡数据,结果表明采用的萃取精馏单溶剂和复合溶剂的选择方法具有较好的准确度,模拟值与实验值比较,相对偏差均小于 9%。通过综合比较得到分离乙酸乙酯-乙醇、乙醇-水和环己烷-苯3个共沸体系的最佳复合溶剂及配比。在最佳复合溶剂组成下,原共沸体系的相对挥发度达到最大值,该值优于组成复合溶剂的单溶剂所达到的分离效果。在最佳复合溶剂组成下,改变原料体系组成,复合溶剂组成对原料体系相对挥发度的影响趋势基本相同,这表明复合溶剂在萃取精馏塔内不同原料组成下均能较好地增加体系的相对挥发度,为工业上在萃取精馏过程中使用复合溶剂提供了理论依据。
萃取精馏;复合溶剂;共沸(混合)物;相平衡;分离
引 言
决定萃取精馏过程分离效率高低的关键是溶剂的选择合理与否。用于萃取精馏的溶剂从组成上分为单一溶剂和复合溶剂两大类,在实践应用过程中,有些单一溶剂往往存在自身选择性与溶解性的矛盾,或是在萃取精馏塔内溶剂比过大造成生产过程中的能耗大,同时溶剂回收时的能耗也相应增加。
单一溶剂的这些弱点限制了萃取精馏技术的应用及发展,于是人们开始了使用混合溶剂进行萃取精馏的研究,并取得了良好的效果。混合溶剂就是在单一溶剂基础上加入一种或一种以上的组分构成新的溶剂,加入的组分称为副溶剂[1],其主要作用就是增大组分间挥发度的差异,从而降低分离的难度,一方面可以改善单一溶剂的选择性,另一方面可以避免当溶剂比过大时溶剂与待分离体系形成不完全互溶的两个液相,既能保证溶剂在萃取精馏塔内保持较高的浓度,同时又使整个萃取精馏混合物液相处于均相状态,有利于传质和传热。目前,关于萃取精馏溶剂国内外的研究进展主要针对离子液体、加盐溶剂和复合溶剂3类。
Orchillés 等[1-2]测定了离子液体 1-乙基-3-甲基咪唑二氰胺([EMIM][DCA])和1-乙基-3-甲基咪唑三氟甲磺酸盐([EMIM][CF3SO3])存在时乙醇-水物系的常压汽液平衡数据,发现了共沸现象消失。刘艳升等[3]以咪唑为阳离子,以氟磷酸或卤素为阴离子,合成了1种离子液体或者2种以上离子液体的复合溶剂用于分离苯和环己烷。Domańska等[4-8]测定了烷烃、环烷烃、芳香烃等多种溶质在离子液体 4-甲基-N-丁基吡啶([bmpy][Tf2N])、1-丁基 3-甲基吡啶硫氰酸盐([BMPY][SCN])、1-丙基-1-甲基吡啶双三氟甲磺酰亚胺盐([PMPIP][Tf2N])、1-丁基-1-甲基吡啶硫氰酸盐([BMPIP][SCN])、1-丁基-1-甲基吡咯烷酮硫氰酸盐([BMPYR][SCN])、1-丁基-1-甲基吡咯烷酮三氟甲磺酸盐([BMPYR][CF3SO3])中的无限稀释活度系数,计算出离子液体对苯-正庚烷和苯-环己烷物系的选择性系数,以及对苯的容量,并与传统的N-甲基吡咯烷酮(NMP)和环丁砜溶剂进行了比较。发现离子液体对苯-正庚烷和苯-环己烷的选择性系数高于NMP和环丁砜的选择性系数,离子液体对苯的容量也高于环丁砜溶剂,表明离子液体可替代传统溶剂用于这两种物系的分离。Jongmans等[9-10]对离子液体分离乙苯-苯乙烯的过程进行了研究,考察了离子液体结构对其性能的影响。发现由烷基链较短的阳离子和不存在电子离域的阴离子构成的离子液体的选择性较高;由烷基链较长的阳离子和存在电子离域的阴离子构成的离子液体的容量较大。国内外在离子液体萃取精馏方面做了大量工作,也取得了一定的进展。但离子液体存在价格昂贵、制备过程复杂、动力学和热力学数据缺乏等问题,其回收再生的报道较少,目前仅限于实验室研究[11]。
针对N,N-二甲基甲酰胺(DMF)溶剂萃取精馏分离 C4或 C5时溶剂用量大、能耗高的现状,Lei等[12]测定了DMF-C4物系和加盐DMF-C4物系的汽液平衡数据。实验结果显示,盐的加入使物系的相对挥发度提高了1.4倍。李东风等[13]对加盐萃取精馏分离C5的过程进行了研究,发现NaSCN的存在能提高物系的相对挥发度至 1.889,减少溶剂用量65%。为了脱除粗苯中的正庚烷等杂质,Dong等[14]采用加盐DMF溶剂,对苯-正庚烷的分离进行了研究,发现KSCN的加入使物系的相对挥发度的提高最大,达到3以上。总体来看,加盐溶剂可以改善物系的相对挥发度,减少溶剂用量,降低生产能耗,但在含盐的非电解质混合溶液中,盐效应情况十分复杂,理论研究还不够深入,仍需做进一步的工作[11]。
一些研究者采用复合溶剂作为萃取剂在一些萃取精馏过程中取得了良好的效果。Borwn等[15-17]通过对 2,3-二甲基戊烷和环己烷、环戊烷和 2,2-二甲基丁烷、苯乙烯和邻二甲苯分离体系的系列实验研究。研究表明混合溶剂比单一溶剂在相同条件下有更高的选择性,混合溶剂的选择性不仅与主溶剂密切相关而且还与辅助溶剂有着直接的关系。混合溶剂所含单一萃取剂不同时,其选择性差异明显,当混合溶剂含有相同的单一萃取剂但其配比不同时,其选择性也有很大的差异。新型混合溶剂提高了分离过程的选择性、降低了理论板数,在实际的工业领域也有较好的应用。
祝石华等[18]采用 N-甲酰吗啉(NFM)添加一种助溶剂(COS)构成复合溶剂作萃取精馏溶剂,从裂解加氢汽油苯馏分中回收高纯苯。研究了助溶剂含量、溶剂比等因素对萃取精馏效果的影响,适宜的助溶剂质量分数为5%~20%,溶剂比为4.5~6.0。采用复合溶剂,苯产品收率达到 99.8%,溶剂回收温度降至190℃以下,与NFM单溶剂萃取精馏工艺相比,具有产品质量好、苯收率高、操作苛刻度低的优点。
曹新波等[19]利用N-甲酰吗琳(NFM)和甲乙酮(MEK)作为混合溶剂萃取精馏分离正丁烯与丁烷,并用模拟计算考察了溶剂比、回流比、溶剂组成等参数对NFM-MEK混合溶剂萃取精馏提浓正丁烯过程的影响。结果表明合理溶剂比、溶剂组成的选择应基于经济权衡,而回流比则存在一个最佳值,所得出的结论对工业生产具有一定的指导意义。
华超等[20]利用改进的 UNIFAC模型来选择萃取精馏苯-甲基环戊烷过程中的混合萃取剂,对混合溶剂N-甲酰吗啉(NFM)-乙二醇(EG)对萃取精馏苯-甲基环戊烷的过程进行了详细的理论分析和实验研究,重点考察了混合溶剂配比和溶剂比对分离过程可行性的影响。研究结果表明,混合溶剂NFM-EG具有良好的选择性和溶解性,为粗苯精制过程中苯-甲基环戊烷的分离提供了必要的基础数据和指导。Yin等[21]开展了类似的研究工作,发现助溶剂EG的质量分数为20%时,苯-环己烷物系的分离效果最佳。张志刚等[22]采用N,N-二甲基甲酰胺和二甲亚砜作为复合溶剂萃取精馏分离苯-环己烷体系,考察了不同萃取剂在不同回流比及萃取溶剂加入速率情况下对分离苯-环己烷共沸体系的影响。结果表明,二元混合溶剂能够解决单一溶剂的选择性与溶解性相矛盾的问题,且在同等条件下,综合性能优于单一溶剂。
与离子液体和加盐溶剂相比,复合溶剂具有产品纯度和收率高、使用已有的工艺设备、操作条件简单等优点,因此目前复合溶剂更具实用价值,具有极好的开发应用前景。
为了提高萃取精馏溶剂的分离性能,减少精馏塔内的溶剂比,降低精馏能耗,提出了按溶剂间形成氢键的情况和修正UNIFAC模型相结合的萃取精馏复合溶剂的复配方法,选择出分离性能高于单溶剂的复合溶剂萃取精馏分离共沸体系,对复合溶剂的复配理论、选择方法、配比原则、复合溶剂组成对原料组分相对挥发度的影响等进行探索性研究,并以乙酸乙酯-乙醇、乙醇-水和环己烷-苯3种工业上典型的物系为研究对象,建立汽液平衡测量装置,准确测量汽液平衡数据,将实验值与模拟值进行比较并进行结果讨论,验证这种方法的可靠性与实用性,为工业上在萃取精馏过程中使用复合溶剂提供了理论依据。
1 萃取精馏溶剂的复配
1.1 复配理论研究
在萃取精馏过程中,溶剂与待分离体系组分之间的作用力主要是较弱的范德华力和较强的氢键力。范德华力包括感生力、取向力及色散力,但它们相对于氢键力而言都是很小的。从生成机理上说,氢键是由一个氢原子和两个电负性原子结合构成的,如C—H…D,此处C和D是电负性原子,“…”表示氢键,氢键是一种方向性很强的作用力。溶剂之间形成氢键的必要条件是:第一,要有电子接受体即质子给体(proton donor);第二,要有电子给予体即质子受体[23](proton acceptor)。按形成氢键的情况,可将溶剂分为以下4种类型。
(1)N型溶剂:它们不能形成氢键,分子电负性非常小。如苯、环己烷、四氯化碳等。
(2)A型溶剂:即受电子溶剂。如卤代烃等,可形成氢键。
(3)B型溶剂:即给电子溶剂。如酮、醛、醚、酯等,可形成氢键。
(4)A BⅠ型溶剂:给受电子溶剂。如水、醇、酸、胺等,可形成氢键。
(5)A BⅡ型溶剂:生成内氢键的给受电子溶剂。如邻硝基苯酚等,已形成内氢键,故性质同N型或B型溶剂相似。
根据上述分类将常用的溶剂分为质子给体和质子受体,当两种溶剂复配时形成的氢键比混合以前更强或是数目更多的时候则利于互溶,对被分离的共沸体系的分离效果也将更好。
1.2 混合物热力学性质的估算
基于热力学模型,建立定性定量选择萃取剂的的理论方法,已报道了Prausnitz & Anderson理论[24]、正规溶液理论Scatchard-Hildebrnad法[25]、无限稀释活度系数法[26]、官能团UNIFAC法[27]、官能团ASOG法[28]、溶解度参数MOSCED法[29]等多种利用各类热力学模型计算的方法。由于萃取精馏过程中存在的物系大都为非理想性极强的体系,所以大多数不以官能团作为基础模型参数的热力学方法在选择萃取溶剂的过程中,局限性很强。因此,这些方法发展速度较慢或不再进行。对于有机溶剂而言,它们虽然种类繁多,但基本是由几十种基团所构成。目前,通过应用官能团相互作用参数值预测组分和混合物比较流行的方法是UNIFAC法。
本文采用Gmehling等[30-32]修正的UNIFAC模型来计算组分的活度系数及无限稀释活度系数,求组分i在组分j中的无限稀释活度系数时,模型中的公式可以简化为如下形式

利用这些简化后的公式,可以比较便捷地求得体系中组分的无限稀释活度系数,为以后分离过程溶剂性能的计算提供了便利。
1.3 萃取精馏溶剂复配的流程
萃取精馏溶剂的复配流程如图1所示。

图1 萃取精馏复合溶剂复配流程Fig.1 Combination of mixed solvent in extractive distillation
2 复合溶剂的应用实例
2.1 乙酸乙酯-乙醇体系
从乙酸乙酯和乙醇分子极性来看,这两种分子均具有极性,乙酸乙酯分子为质子受体,易与质子给体形成氢键,乙醇分子既是质子给体又是质子受体,易与质子给体和受体物质形成氢键。乙酸乙酯和乙醇的极性及第一电离能见表1。分子间由极性引起的诱导力、静电力及色散力见式(13)~式(15)。由于乙酸乙酯和乙醇的偶极矩、第一电离能基本较为接近,诱导作用贡献一般都很小,从表1及式(13)~式(15)来看,分子之间产生静电力及色散力基本相等,故静电力及色散力影响比较小。

表1 乙酸乙酯、乙醇的偶极矩及第一电离能[33]Table 1 Dipole moment and first ionization energy of ethyl acetate and ethanol
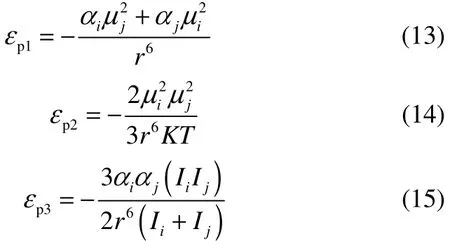
式中,εp1、εp2、εp3分别为分子间的诱导力、静电力、色散力;αi、αj为分子的极化率;μi、μj为分子的偶极矩;r为分子间距离;K为Boltzmann因子;Ii、Ij为第一电离能。
分离乙酸乙酯-乙醇体系的常用溶剂列于表2中。
2.1.1 不同复合溶剂对乙酸乙酯-乙醇体系相对挥发度的影响 由表2可以看出只有二甲亚砜(DMSO)与乙苯为质子受体,其他溶剂都是质子给体与受体同体的溶剂,其中多元醇类溶剂,由于黏度较大,易于聚合,在实际生产中应用困难,因此只将乙二醇(EG)作为醇类溶剂用作复合溶剂的复配。同时由于乙二醇和乙苯能形成共沸物不能复配组合,N-甲基吡咯烷酮(NMP)和二甲基亚砜(DMSO)缺少交互作用参数,无法用UNIFAC方程预测复配结果。将余下的溶剂用修正的UNIFAC方程经Matlab软件编程计算,有复合溶剂效应的有以下复配组合:
A.DMSO(a)+ DMF(b)
B.DMSO(a)+ EG(b)
C.NMP(a)+乙苯(b)
D.乙苯(a)+ DMF(b)
并将 A、B、C、D 4种复合溶剂与共沸组成(xEA=0.69)下的乙酸乙酯-乙醇体系在溶剂质量比为1:1的条件下,经修正的UNIFAC方程计算得到的随复合溶剂中 a组分的增加乙酸乙酯-乙醇相对挥发度的变化曲线绘制成图2。

表2 萃取精馏分离乙酸乙酯-乙醇体系单溶剂备选Table 2 Single-solvent of separating ethyl acetate-ethanol system by extractive distillation
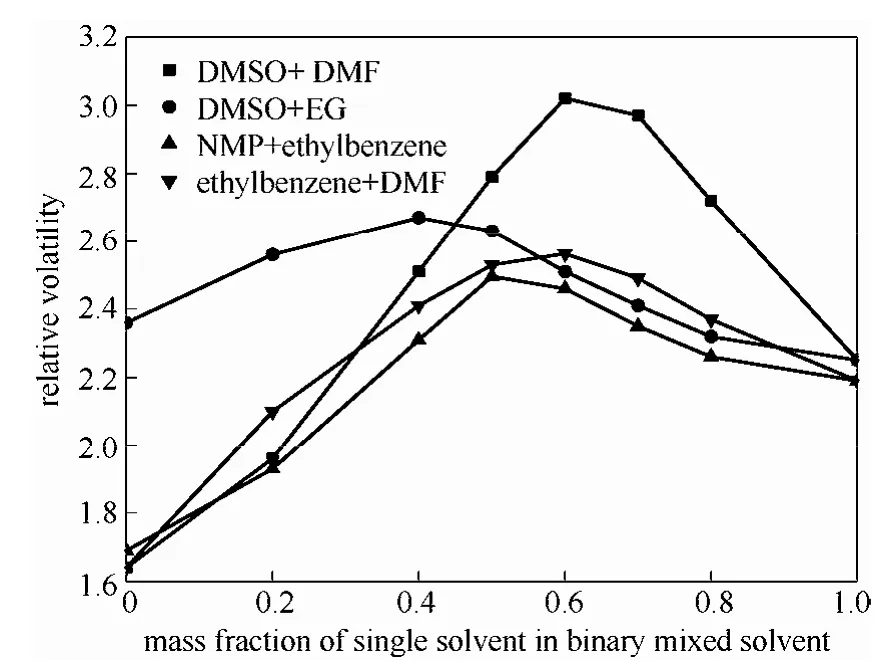
图2 溶剂复配对乙酸乙酯-乙醇的相对挥发度的影响Fig.2 Influence of mixed solvent content for ethyl acetate-ethanol on relative volatility
从图中可以看出这几组溶剂复配时对乙酸乙酯-乙醇共沸体系的相对挥发度均有影响,并且都存在一个最佳的溶剂配比。各组复合溶剂对体系的影响不相同,从图中可以看出DMSO和DMF复配时对乙酸乙酯-乙醇体系的影响最大。溶剂复配的最佳值见表3。

表3 萃取精馏分离乙酸乙酯-乙醇体系复合溶剂备选Table 3 Mixed-solvent of separating ethyl acetate-ethanol system by extractive distillation
从表中可以看出60%DMSO和40%DMF复配时得到的乙酸乙酯和乙醇的相对挥发度最大为3.0266,大于单溶剂分离乙酸乙酯-乙醇共沸体系的最大相对挥发度。
2.1.2 不同组成下的复合溶剂(DMSO+DMF)对乙酸乙酯-乙醇体系相对挥发度的影响 在溶剂比(质量比)为1:1时,改变复合溶剂DMSO和DMF的组成,并改变乙酸乙酯-乙醇体系中乙酸乙酯的质量分数,模拟计算乙酸乙酯-乙醇的相对挥发度(图3)。

图3 溶剂组成(DMSO+DMF)对乙酸乙酯-乙醇相对挥发度的影响Fig.3 Influence of DMSO+DMF ratio in binary mixed solvent for ethanol-ethyl acetate on relative volatility
从图3可以看出对于乙酸乙酯-乙醇体系,改变体系中乙酸乙酯的质量分数时复合溶剂组成对体系相对挥发度的影响趋势基本相同,即在不同的原料组成下(xEA=0.3,xEA=0.5,xEA=0.69)复合溶剂的最佳组成都在xDMSO=0.6(质量分数),这说明如果在萃取精馏操作的过程中,即使在萃取精馏段中乙酸乙酯的组成随塔高变化,使用适宜配比的复合溶剂,在一定的溶剂比下,都可以保持溶剂对乙酸乙酯-乙醇体系的高分离效果。

表4 萃取精馏分离乙醇-水体系单溶剂备选Table 4 Single-solvent of separating ethanol-water system by extractive distillation
2.1.3 不同溶剂比对乙酸乙酯-乙醇体系相对挥发度的影响 在单溶剂(DMSO、DMF)、复合溶剂(DMSO+DMF)的最佳组合下(xDMSO=0.6)改变溶剂比,得到乙酸乙酯-乙醇体系中(xEA=0.69)相对挥发度随溶剂比的变化趋势,结果如图4所示。

图4 不同溶剂比对乙酸乙酯-乙醇体系相对挥发度的影响Fig.4 Influence of solvent ratio for ethanol-ethyl acetate on relative volatility
从图4中可以看出随着溶剂比的增加,不管是单一溶剂还是复合溶剂,体系的相对挥发度都逐渐增加,在溶剂比较小时(小于 4)体系的相对挥发度增加很快,随着溶剂比的逐渐增加,体系的相对挥发度增加速度变化缓慢。这主要是因为当溶剂比较小时,随着溶剂比的增加,溶剂改变乙酸乙酯-乙醇相对挥发度的作用增强效果较为明显。但是,当溶剂比较大时,增加溶剂比,也会使溶剂对原料组分的稀释作用增强,因此相对挥发度的增加幅度减小。
2.2 乙醇-水体系
乙醇分子和水分子都是质子给体和质子受体同体的分子,分离乙醇-水体系的常用溶剂列于表4中。
2.2.1 不同复合溶剂对乙醇-水体系相对挥发度的影响 由表4可以看出只有二甲亚砜(DMSO)为质子受体,其他溶剂都是质子给体与受体同体的溶剂,其中多元醇类溶剂,由于黏度较大,易于聚合,在实际生产中应用困难,因此只将乙二醇作为醇类溶剂用作复合溶剂的复配。经修正的UNIFAC方程的计算,得到以下复配结果:
A.DMSO(a)+DMF(b)
B.DMSO(a)+乙二醇(b)
C.DMSO(a)+N,N-二甲基乙酰胺(DMAC)(b)
并将 A、B、C 3种复合溶剂与共沸组成(xEOH=0.95)下的乙醇-水体系在溶剂质量比为1:1的条件下,经修正的UNIFAC方程计算得到的随复合溶剂中 a组分的增加乙醇-水相对挥发度的变化曲线绘制成图5。

图5 溶剂复配对乙醇-水体系的相对挥发度的影响Fig.5 Influence of mixed solvent content for ethanol-water on relative volatility
从图5中可以看出这几组溶剂复配时对乙醇-水共沸体系的相对挥发度的影响均有一组最佳的溶剂配比,但是各个组合对体系的影响不同,其中复合溶剂 A(DMSO+DMF)与复合溶剂 C(DMSO+DMAC)对乙醇-水共沸体系相对挥发度的影响变化关系相似,而复合溶剂A在最佳复配组合下得到较高的相对挥发度1.65,高于单溶剂的最高相对挥发度。当二甲基亚砜与乙二醇复配时,没有出现明显的复配效果,随着DMSO在复合溶剂中质量分数的增加,乙醇-水体系的相对挥发度大体上呈递减的变化趋势。对于A、B、C 3种复配溶剂的最佳配比见表5。

表5 萃取精馏分离乙醇-水体系复合溶剂备选Table 5 Mixed-solvent of separating ethanol-water system by extractive distillation
从表5中可以看出溶剂70%DMSO+30%DMF复配时乙醇-水的相对挥发度为 1.6504为最佳的溶剂复配结果。
2.2.2 不同组成下的复合溶剂(DMSO+DMF)对乙醇-水体系相对挥发度的影响 在溶剂质量比为1:1时,改变复合溶剂DMSO和DMF的组成并改变乙醇-水体系中乙醇的质量分数,所得的乙醇-水的相对挥发度结果如图6所示。

图6 溶剂组成(DMSO+DMF)对乙醇-水相对挥发度的影响Fig.6 Influence of DMSO+DMF ratio in binary mixed solvent for ethanol-water on relative volatility
从图6中可以看出对于乙醇-水体系改变乙醇的质量分数时,复合溶剂(DMSO+DMF)对体系相对挥发度的改变趋势相似,均存一最佳配比,即在DMSO在复合溶剂中质量分数为0.7左右时,体系的相对挥发度达到最大值。这表明如果在萃取精馏操作的过程中,即使在萃取精馏段中乙醇的组成随塔高变化,使用适宜配比的复合溶剂,在一定的溶剂比下,都可以保持溶剂对乙醇-水体系的高分离效果。
2.2.3 不同溶剂比对乙醇-水体系相对挥发度的影响 在单溶剂(DMSO、DMF)、复合溶剂(DMSO+DMF)的最佳组合下(xDMSO=0.7)改变溶剂比,得到乙醇-水共沸体系中相对挥发度随溶剂比的变化趋势,结果如图7所示。

图7 不同溶剂比对乙醇-水体系相对挥发度的影响Fig.7 Influence of solvent ratio on relative volatility of ethanol-ethyl acetate
从图7中可以看出随着溶剂比的增加,不管是单一溶剂还是复合溶剂,体系的相对挥发度都逐渐增加,在溶剂比较小时(<3)体系的相对挥发度增加很快,随着溶剂比的逐渐增加体系的相对挥发度增加速度变化缓慢。
2.3 环己烷-苯
环己烷分子是饱和烃,为非极性化合物,既不是质子给体又不是质子受体。苯分子是具有π电子系统的质子受体。分离环己烷-苯的常用溶剂列于表6中。
2.3.1 不同复合溶剂对环己烷-苯体系相对挥发度的影响 由表6可以看出吡啶、苯乙酮、DMSO为质子受体,苯胺、DMF是质子给体与受体同体的溶剂,应将这两种溶剂进行组合得到复配溶剂。其中DMF作为溶剂,虽然其选择性相对较高,但是它与环己烷的互溶度较低,溶剂出现分层现象,影响萃取精馏的效果。2003年张志刚[34]在对苯-环己烷萃取精馏复配溶剂对研究时也发现,当原料中环己烷含量稍大时,由于混合液中存在 DMF出现分层现象,萃取精馏效果受到影响,因此复配时不考虑DMF。同时由于苯胺-二甲基亚砜均缺少交互作用参数,将余下的溶剂进行复配,经过修正的UNIFAC方程的计算,得到以下复配结果:

表6 萃取精馏分离环己烷-苯体系单溶剂备选Table 6 Single-solvent of separating ethyl cyclohexane-benzene system by extractive distillation
A.苯胺(a)+ 苯乙酮(b)
B.苯胺(a)+吡啶(b)
将A、B两种复合溶剂与共沸组成(xbex=0.55)下的环己烷-苯体系在溶剂质量比为1:1的条件下,经修正的UNIFAC方程计算得到的随复合溶剂中a组分的增加环己烷-苯相对挥发度的变化曲线绘制成图8。

图8 溶剂复配对环己烷-苯体系的相对挥发度的影响Fig.8 Influence of mixed solvent content for cyclohexane-benzene on relative volatility
从图8中可以看出这几组溶剂复配时对环己烷-苯共沸体系的相对挥发度均有影响,并且都存在一个最佳的溶剂配比。各组复合溶剂对体系的影响不相同,从图中可以看出苯乙酮和苯胺复配时对体系环己烷-苯的影响最大。溶剂复配的最佳值见表7。

表7 萃取精馏分离环己烷-苯体系复合溶剂备选Table 7 Mixed-solvent of separating cyclohexane-benzene system by extractive distillation
从表7中可以看出60%苯胺(aniline)+40%苯乙酮(hypnone)复配时得到的乙酸乙酯和乙醇的相对挥发度最大为 2.9404,大于单溶剂分离环己烷-苯共沸体系的最大相对挥发度。
2.3.2 不同组成下的复合溶剂(苯胺+苯乙酮)对环己烷-苯体系相对挥发度的影响 在溶剂质量比为1:1时,改变复合溶剂苯胺和苯乙酮的组成并改变环己烷-苯体系中环己烷的质量分数,所得的环己烷-苯的相对挥发度结果如图9所示。

图9 溶剂组成(苯胺+苯乙酮)对环己烷-苯相对挥发度的影响Fig.9 Influence of mass ratio in binary mixed solvent on relative volatility of cyclohexane-benzene
从图9中可以看出对于环己烷-苯体系改变环己烷的质量分数时,复合溶剂(苯胺+苯乙酮)对体系相对挥发度的改变趋势相似,均存一最佳配比,即在苯胺在复合溶剂中质量分数为60%左右时,体系的相对挥发度达到最大值。这表明如果在萃取精馏操作的过程中,即使在萃取精馏段中环己烷的组成随塔高变化,使用适宜配比的复合溶剂,在一定的溶剂比下,都可以保持溶剂对环己烷-苯体系的高分离效果。
2.3.3 不同溶剂比对环己烷-苯体系相对挥发度的影响 在单溶剂(苯乙酮、苯胺)、复合溶剂(苯乙酮+苯胺)的最佳组合下(xaniline=0.6)改变溶剂比,得到环己烷-苯共沸体系中相对挥发度随溶剂比的变化趋势,结果如图10所示。

图10 不同溶剂比对环己烷-苯体系相对挥发度的影响Fig.10 Influence of solvent ratio on relative volatility of cyclohexane-benzene
从图10中可以看出随着溶剂比的增加,不管是单一溶剂还是复合溶剂,体系的相对挥发度都逐渐增加,在溶剂比较小时(<3)体系的相对挥发度增加很快,随着溶剂比的逐渐增加体系的相对挥发度增加速度变化缓慢。
3 溶剂-共沸物系的汽液平衡实验验证
为了验证选择萃取精馏复合溶剂理论的可靠性,本节采用平衡釜法结合气相色谱分析直接测定常压下复合溶剂与被分离体系(乙酸乙酯-乙醇,乙醇-水,环己烷-苯)的汽液平衡数据,计算体系的相对挥发度,并将实验值与模拟值进行比较并进行结果讨论。
3.1 实验装置
实验中所用汽液平衡釜采用改进的 Othmer循环釜,其结构如图11所示。
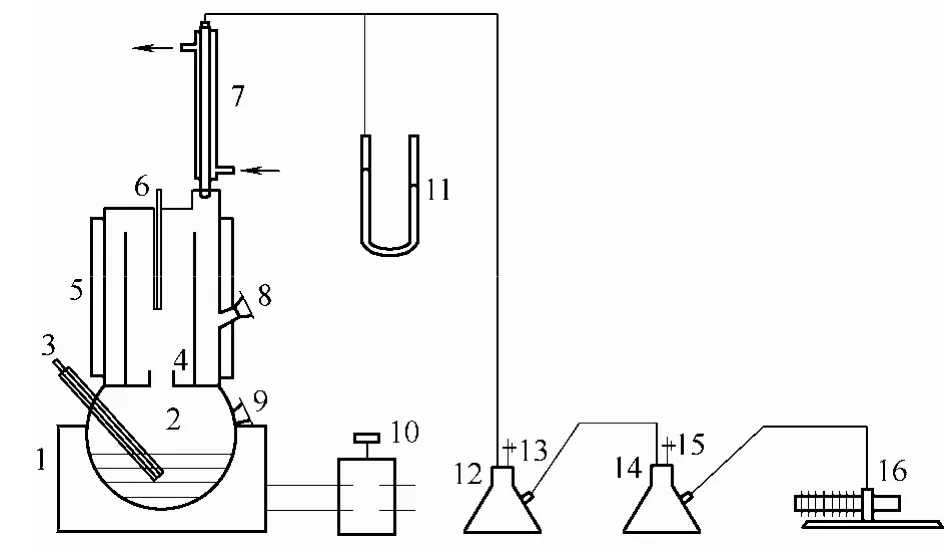
图11 汽液平衡实验测定装置Fig.11 Sketch of VLE determination system
3.2 汽液平衡实验结果与分析
3.2.1 乙酸乙酯-乙醇体系 在101.325 kPa下,采用上述实验装置和实验方法对单溶剂(DMF、DMSO)对乙酸乙酯-乙醇共沸体系相对挥发度的影响进行实验测定,以验证提出的分子设计方法及所用到的修正 UNIFAC方程,结果分别如图12、图13所示。
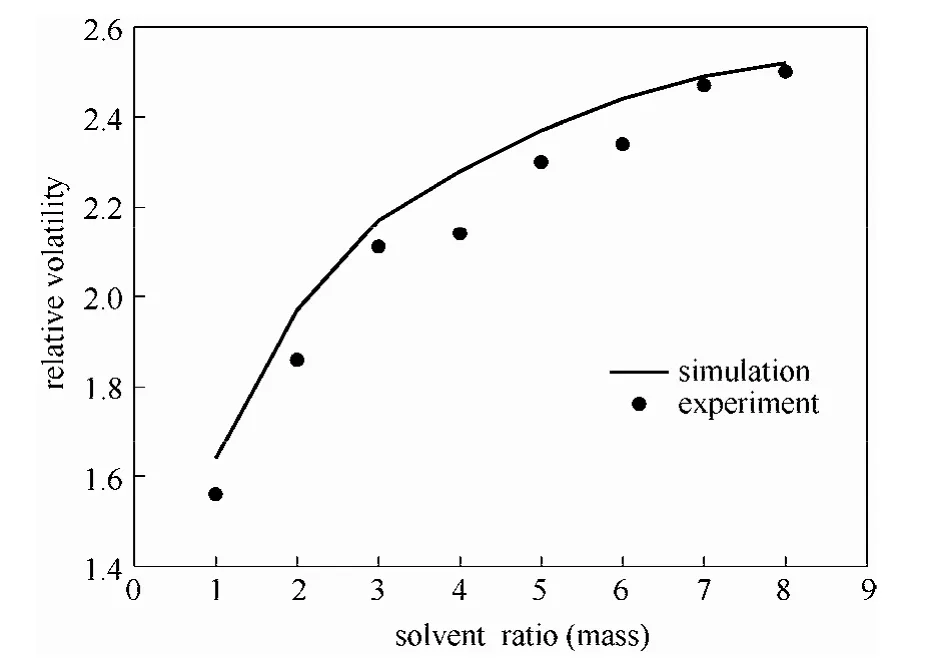
图12 DMF 对乙酸乙酯-乙醇共沸体系相对挥发度的影响Fig.12 Influence of DMF on relative volatility of ethyl acetate-ethanol azeotropic system

图13 DMSO 对乙酸乙酯-乙醇共沸体系相对挥发度的影响Fig.13 Influence of DMSO on relative volatility of acetate-ethanol azeotropic system
从图12、图13中可以看出,对于乙酸乙酯-乙醇体系的分离,随着单一溶剂DMSO和DMF溶剂比的增加,乙酸乙酯-乙醇之间的相对挥发度逐渐增大,DMSO对该体系的相对挥发度的影响要强于DMF。实验测定的汽液平衡数据及实验值和模拟值的结果比较如表8所示,其中分别是液相与汽相达平衡时乙酸乙酯脱除溶剂后的质量分数。相对偏差δ用式(16)表示

表8 实验值和计算值的结果比较(共沸体系:乙酸乙酯-乙醇,溶剂:DMF,DMSO)Table 8 Comparison of calculated value and experimental data(azeotropic system: ethyl acetate-ethanol, solvent: DMF,DMSO)

由表8可以看出单溶剂对乙酸乙酯-乙醇体系相对挥发度的影响,其实验值与计算值较为接近,最大偏差为0.0945,最小偏差为0.0082,说明模拟值与实验值吻合良好。
常压下,溶剂比(质量比)为1的条件下,改变复合溶剂(DMSO+DMF)组成,通过实验测定并计算出乙酸乙酯-乙醇共沸体系相对挥发度的改变与1.2小节中修正的UNIFAC模型得到的计算值进行比较,结果如图14所示。
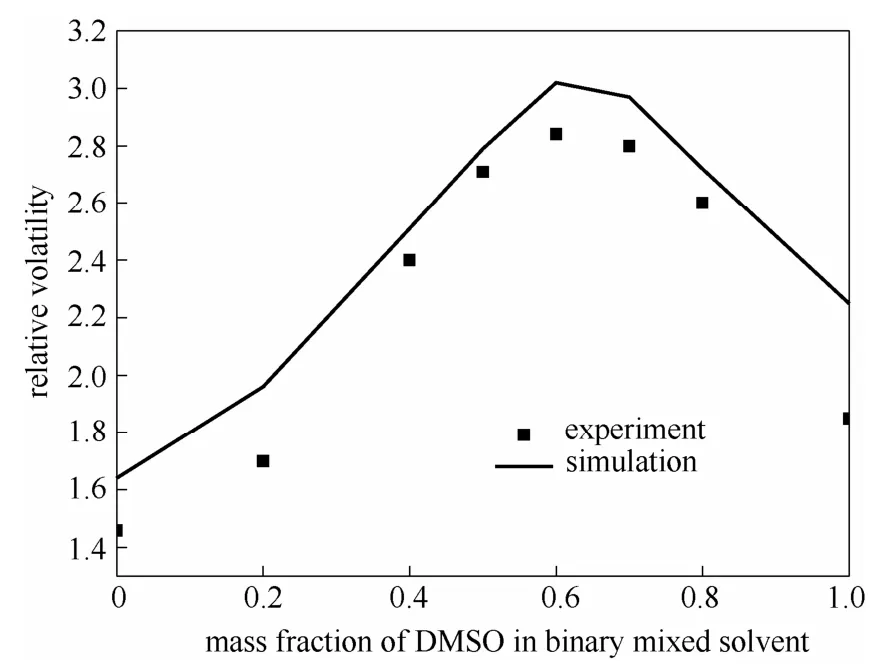
图14 混合溶剂DMSO+DMF组成对乙酸乙酯-乙醇共沸体系相对挥发度之间的影响Fig.14 Influence of mixed solvent (DMSO+DMF) on relative volatility of ethyl acetate-ethanol azeotropic system
从图14中可以看出,乙酸乙酯和乙醇的相对挥发度随着溶剂 DMSO含量的增加呈现先增加后减小的变化,存在一最佳复配组合即当DMSO在混合溶剂中的质量含量为0.6时,复合溶剂的分离效果最好,这一点模拟值和实验值基本吻合。实验值和计算值的结果比较见表9。

表9 实验值和计算值的结果比较(共沸体系:乙酸乙酯-乙醇,溶剂:DMF+DMSO)Table 9 Comparison of calculated value and experimental data (azeotropic system: ethyl acetate-ethanol, solvent:DMF+DMSO)
从表8和表9中可以看出,两种单一溶剂DMF和 DMSO对体系的相对挥发度的实验值和用修正的UNIFAC模型的计算值比较,两者的相对误差均在 9%以内,两种溶剂复配时实验值与计算值比较相对误差也在9%以内,所以修正的UNIFAC模型可以较好地应用于萃取精馏分离乙酸乙酯-乙醇体系单溶剂和复合溶剂的选择。
3.2.2 乙醇-水体系 在常压下,对乙醇-水共沸体系,通过实验测定的单一溶剂DMF和DMSO对乙醇-水的相对挥发度的影响和用修正的 UNIFAC模型得到的计算值进行比较,结果分别如图15、图16所示。
从图15、16中可以看出,对于乙醇-水体系无论是DMF还是DMSO,随着溶剂比的增加轻重关键组分之间的相对挥发度都在增加,使体系更易于分离。在相同的溶剂比条件下,乙醇-水体系在DMSO中的相对挥发度均要高于 DMF。在溶剂比较小时体系的相对挥发度随溶剂比增加较快。当溶剂比较大时,相对挥发度的变化相对缓慢。实验结果和计算结果增加的趋势基本相同。实验测定的汽液平衡数据及实验值和模拟值的结果比较见表10。其中分别是液相与汽相达平衡时乙醇脱除溶剂后的质量分数。
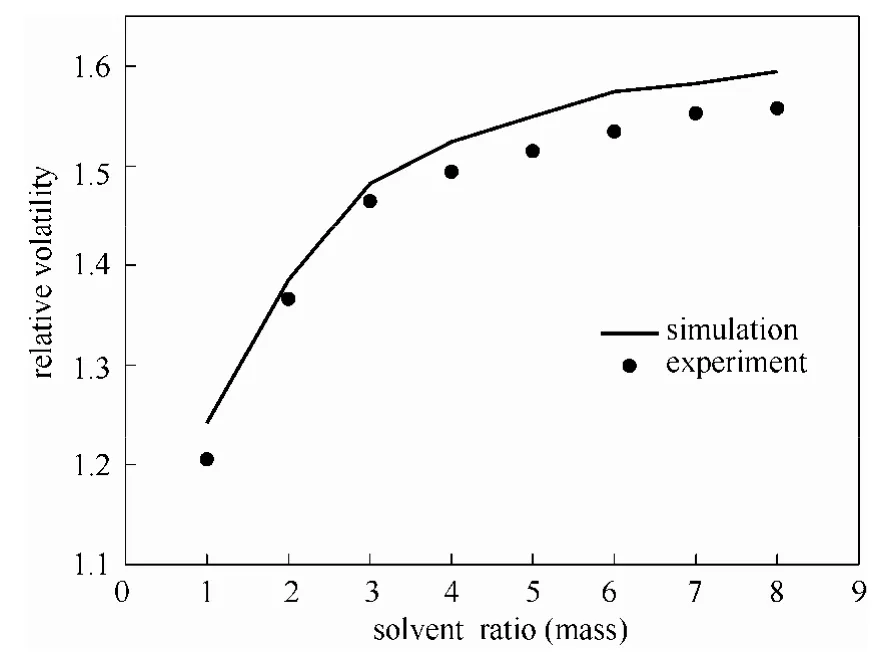
图15 DMF对乙醇-水体共沸系相对挥发度的影响Fig.15 Influence of DMF on relative volatility of ethanol-water azeotropic system

图16 DMSO对乙醇-水共沸体系相对挥发度的影响Fig.16 Influence of DMSO on relative volatility of ethanol-water azeotropic system

表10 实验值和计算值的结果比较(共沸体系:乙醇-水,溶剂:DMF、DMSO)Table 10 Comparison of calculated value and experimental data(azeotropic system: ethanol-water, solvent:DMF, DMSO)
在101.325 kPa下,在溶剂比为1(质量比)的条件下,改变复合溶剂(DMSO+DMF)的组成得到乙醇-水共沸体系的相对挥发度的实验数据和用修正的 UNIFAC模型的计算值比较,结果如图17所示。

图17 复合溶剂(DMSO+DMF)组成与乙醇-水共沸体系相对挥发度的影响Fig.17 Influence of mixed solvent (DMSO+DMF) on relative volatility of water-ethanol azeotropic system
从图17中可以看出两种溶剂均能改变乙醇和水的相对挥发度,在两种溶剂DMF和DMSO单独作用下乙醇和水的相对挥发度分别为 1.2050和1.4315,两者复合后随着溶剂中DMSO含量的增加乙醇和水的相对挥发度逐渐增加,当复合溶剂中DMSO质量含量为70%时,乙醇与水的相对挥发度的实验值达到最大为1.6809,之后随着DMSO的含量增加乙醇-水的相对挥发度降低直至逐渐与纯DMSO接近。计算值与实验值的变化趋势基本相同。实验测定的汽液平衡数据及实验值和模拟值的结果比较见表11。

表11 实验值和计算值的结果比较(共沸体系:乙醇-水,溶剂:DMF+DMSO)Table 11 Comparison of calculated value and experimental data (azeotropic system: ethanol-water,solvent: DMF+DMSO)
从表10、表11中可以看出,两种单一溶剂DMF和DMSO的实验值和用修正的UNIFAC模型得到的计算值比较两者的相对误差均在 8%以内,两种溶剂复配时实验值与计算值的相对误差均在 6%以内,所以修正的 UNIFAC模型可以较好地应用于萃取精馏分离乙醇-水体系单溶剂和复合溶剂的选择。
以上两种共沸体系均为极性很强的体系,UNIFAC模型在建模过程中未考虑分子特性,如分子缔合等,所以对于强极性混合物系的计算难免会出现误差。但对于两种体系所有的实验和计算误差均在9%以内,验证了本文所选择的模型的可行性,也说明了本文提出的复合溶剂复配方法的可行性。
3.2.3 环己烷-苯体系 在101.325 kPa下,对环己烷-苯共沸体系,通过实验测定的单一溶剂苯乙酮和苯胺对环己烷-苯的相对挥发度的影响和用修正的UNIFAC模型得到的计算值进行比较,结果分别如图18、图19所示。

图18 苯乙酮对环己烷-苯共沸体系相对挥发度的影响Fig.18 Influence of hypnone on relative volatility of cyclohexane-benzene azeotropic system

图19 苯胺对环己烷-苯共沸体系相对挥发度的影响Fig.19 Influence of aniline on relative volatility of cyclohexane-benzene azeotropic system
从图18、图19中可以看出,实验结果和计算结果增加的趋势基本相同。实验测定的汽液平衡数据及实验值和模拟值的结果比较见表12。其中xshex、yshex分别是液相与汽相达平衡时环己烷脱除溶剂后的质量分数。

表12 实验值和计算值的结果比较Table 12 Comparison of calculated value and experimental data (azeotropic system: cyclohexane-benzene,solvent: aniline, hypnone)
在101.325 kPa下,在溶剂比为1(质量比)的条件下,改变复合溶剂(苯胺+苯乙酮)的组成得到环己烷-苯共沸体系的相对挥发度的实验数据和用修正的UNIFAC模型的计算值,结果如图20所示。

图20 复合溶剂(苯胺+苯乙酮)组成对乙醇-水共沸体系相对挥发度的影响Fig.20 Influence of mixed solvent (aniline +hypnone)on relative volatility of cyclohexane-benzene azeotropic system
从图20中可以看出,环己烷和苯的相对挥发度随着溶剂中苯胺含量的增加呈现先增加后减小的变化,存在一最佳复配组合即当苯胺在混合溶剂中的质量含量为 0.6时,复合溶剂的分离效果最好,这一点实验值和模拟值基本吻合。实验测定的汽液平衡数据及实验值和模拟值的结果比较见表13。

表13 实验值和计算值的结果比较Table 13 Comparison of calculated value and experimental data(azeotropic system: cyclohexane-benzene,solvent: aniline+hypnone)
从表12、表13中可以看出,两种单一溶剂苯胺和苯乙胺的实验值和用修正的UNIFAC模型得到的计算值比较两者的相对误差均在 7%以内,两种溶剂复配时试验值与计算值的相对误差均在 7%以内,所以修正的UNIFAC模型可以较好地应用于萃取精馏分离极性较弱的环己烷-苯体系单溶剂和复合溶剂的选择。
4 结 论
提出按溶剂之间复配形成氢键的情况和修正的UNIFAC模型相结合的方法,以乙酸乙酯-乙醇、乙醇-水、环己烷-苯共沸体系为例,预测出萃取精馏分离这些共沸体系的复配溶剂及复合溶剂的最佳配比如下:
(1)分离乙酸乙酯-乙醇共沸体系的最佳复合溶剂及配比(质量分数)为60%DMSO+40%DMF;
(2)分离乙醇-水共沸体系的最佳复合溶剂及配比(质量分数)为70%DMSO+30%DMF;
(3)分离环己烷-苯共沸体系的最佳复合溶剂及配比(质量分数)为60%苯胺+40%苯乙酮。
利用汽液平衡釜测定了在101.325 kPa下,在单溶剂和复合溶剂作用下乙酸乙酯-乙醇、乙醇-水、环己烷-苯3个体系的汽液平衡数据,将实验得到的相对挥发度与采用修正UNIFAC方程估算得到的相对挥发度值进行了比较,结果表明计算值与实验值吻合较好,3个体系的相对挥发度估算值最大相对偏差均小于9%。
在最佳复合溶剂组成下,原共沸体系的相对挥发度达到最大值,该值优于组成复合溶剂的单溶剂所达到的分离效果。随着复合溶剂的溶剂比增加,原料体系的相对挥发度的增加,增加幅度均呈现先大后小的趋势。在最佳复合溶剂组成下,改变原料体系组成,复合溶剂组成对原料体系相对挥发度的影响趋势基本相同,这表明复合溶剂在萃取精馏塔内不同原料组成下均能较好增加体系相对挥发度,为工业上在萃取精馏中使用复合溶剂提供了理论依据。
符 号 说 明
a,b,c,ψ——基团相互作用参数
Q——基团体积参数
R——基团表面积参数
Sp——溶解性
T——温度
X——混合物中的摩尔分数
x——液相中的质量分数
γS,∞——在溶剂S中无限稀释活度系数
α——组分的相对挥发度
Γ——过剩活度系数
Γ(i)——在纯组分i中的过剩活度系数
δ——相对偏差
θ——基团面积分数
v(i)k——分子i中基团k的个数
上角标
s——平衡
下角标
cal——模拟值
exp——实验值
i,j——组分i、组分j
k,m,n——基团k、基团m、基团n
[1] ORCHILLÉS A V, MIGUEl P J, LLOPIS F J,et al. Isobaric vapor-liquidequilibria for the extractive distillation of ethanol+water mixturesusing 1-ethyl-3-methylimidazolium dicyanamide[J]. J. Chem.Eng. Data, 2011, 56(12): 4875-4880.
[2] ORCHILLÉS A V, MIGUEL P J, VERCHER E,et al. Using 1-ethyl-3-methylimidazolium trifluoromethanesulfonate as an entrainer for the extractive distillation of ethanol+water mixtures[J]. J.Chem. Eng. Data, 2010, 55(4): 1669-1674.
[3] 刘艳升, 胡玉峰, 曹睿, 等. 一种离子液体作为萃取精馏分离苯和环己烷的溶剂的应用: CN200710064448.X[P]. 2008-09-17.LIU Y S, HU Y F, CAO R,et al. Application of ionic liquid as solvent for extractive distillation separation of benzene and cyclohexane:CN200710064448.X[P]. 2008-09-17.
[4] DOMAŃSKA U, REDHI G G, MARCINIAK A,et al. Activity coefficients at infinite dilution measurements for organic solutes and water in the 1-hexyloxymethyl-3-methyl-imidazolium and 1,3-dihexyloxymethyl-imidazolium bis(trifluoromethylsulfonyl)-imide ionic liquids—the cation influence[J]. Fluid Phase Equilibria, 2009,286(2): 154-161.
[5] DOMAŃSKA U, LASKOWSKA M. Measurements of activity coefficients at infinite dilution of aliphatic and aromatic hydrocarbons,alcohols, thiophene, tetrahydrofuran, MTBE, and water in ionic liquid[BMIM][SCN] using GLC[J]. Journal of Chemical Thermodynamics,2009, 41(5): 645-650.
[6] DOMAŃSKA U, PADUSZYŃSKI K. Measurements of activity coefficients at infinite dilution of organic solutes and water in 1-propyl-1-methylpiperidinium bis{(trifluoromethyl)sulfonyl}imide ionic liquid using GLC[J]. Journal of Chemical Thermodynamics,2010, 42(11): 1361-1366.
[7] DOMAŃSKA U, KRÓLIKOWSKA M. Measurements of activity coefficients at infinite dilution in solvent mixtures with thiocyanate-based ionic liquids using GLC technique[J]. J. Phys.Chem. B, 2010, 114(25): 8460-8466.
[8] DOMAŃSKA U, KRÓLIKOWSKA M. Measurements of activity coefficients at infinite dilution for organic solutes and water in the ionic liquid 1-butyl-1-methylpiperidinium thiocyanate[J]. J. Chem.Eng. Data, 2011, 56(1): 124-129.
[9] JONGMANS M T G, SCHUUR B, HAAN A B D. Ionic liquid screening for ethylbenzene/styrene separation by extractive distillation[J]. Ind. Eng. Chem. Res., 2011, 50(18): 10800-10810.
[10] JONGMANS M T G, SCHUUR B, HAAN A B D. Binary and ternary LLE data of the system (ethylbenzene+ styrene+ 1-ethyl-3-methylimidazolium thiocyanate) and binary VLE data of the system(styrene+ 1-ethyl-3-methylimidazolium thiocyanate)[J]. Journal of Chemical Thermodynamics, 2012, 47: 234-240.
[11] 唐晓东, 袁娇阳, 李晶晶, 等. 萃取精馏溶剂的研究应用进展[J].现代化工, 2013, 33(12): 31-35.TANG X D, YUAN J Y, LI J J,et al. Research and application progresses in solvents for extractive distillation[J]. Modern Chemical Industry, 2013, 33(12): 31-35.
[12] LEI Z G, WANG H Y, ZHOU R Q,et al. Influence of salt added to solvent on extractive distillation[J]. Chemical Engineering Journal,2002, 87(2): 149-156.
[13] 李东风, 刘智信, 程建民, 等. 一种碳五分离用混合溶剂:CN201110178859. 8[P]. 2013-01-02.LI D F, LIU Z X, CHENG J M,et al. Mixed solvent for separating C5:CN201110178859.8[P]. 2013-01-02.
[14] ZHANG J, YUE G J, DONG H X,et al. Liquid-liquid equilibria determination and correlation for systen of benzene + cyclohexane+N,N-dimethylformamide + potassium thiocyanate[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(2):330-333.
[15] LEE F M. Extractivedistillation: close-boiling-point, adding co-solvents can make tough separations technically and economically feasible[J]. Chemical Engineering, 1998, 105 (12): 112-120.
[16] LEE F M, BROWN R E. Extractive distillation of hydrocarbons employing solvent mixture: US4921581[P]. 1990-05-01.
[17] BROWN R E, LEE F M. Extractive distillation of hydrocarbon feed employing mixed solvent: US 4954224[P]. 1990-09-04.
[18] 祝石华, 唐文成, 田龙胜. NFM-COS复合溶剂萃取精馏分离苯[J].石油化工, 2002, 31(1): 24-27.ZHU S H, TANG W C, TIAN L S. Extractive distillation process for benzene recovery with NFM-COS solvent[J]. Petrochemical Technology, 2002, 31(1): 24-27.
[19] 曹新波, 汤志刚. NFM-MEK混合溶剂萃取精馏分离正丁烯/丁烷的流程模拟与参数分析[J]. 计算机与应用化学, 2005, 22(5):366-369.CAO X B, TANG Z G. Process simulation and parameter analysis for separatingn-butene and butane by extractive distillation with the mixture ofN-formylmorpholine (NFM) and methyl ethyl ketone(MEK) as solvent[J]. Computers and Applied Chemistry, 2005, 22(5):366-369.
[20] 华超, 李鑫钢, 徐世民, 等.N-甲酰吗啉-乙二醇混合溶剂间歇萃取精馏苯-甲基环戊烷的研究[J]. 天然气化工(C1化学与化工), 2006,31(6): 22-27.HUA C, LI X G, XU S M,et al. Study on the batch extractive distillation of azerotropic mixture benzene-methyl cyclopentane by mixed solventN-formymorpholine-ethylene glycol[J]. Natural Gas Chemistry, 2006, 31(6): 22-27.
[21] YIN W, DING S H, XIA S Q,et al. Cosolvent selection for benzene-cyclohexane separation in extractive distillation[J]. Journal of Chemical & Engineering Data, 2010, 55(9): 3274-3277.
[22] 张志刚, 徐世民, 李鑫钢. 常规间歇萃取精馏分离苯-环己烷的研究[J]. 化学工程, 2006, 34(4): 5-8.ZHANG Z G, XU S M, LI X G. Study on separating benzene-cyclohexane by regular batch extractive distillation[J].Chemical Engineering, 2006, 34(4): 5-8.
[23] GMEHLING J, LI J D, SCHILLER M. A Modified UNI FAC Model(Ⅱ): Present parameter matrix and results for different thermodynamic properties[J]. Ind. Eng. Chem. Res., 1993, 32(1):178-193.
[24] PRAUSNITZ J M, ANDERSON R. Thermodynamics of solvent selectivity in extractive distillation of hydrocarbons[J]. AIChE Journal,1961, 7(1): 96-101.
[25] KYLE B G, LENG D E. Solvent selection for extractive distillation[J].Ind. Eng. Chem., 1965, 57(2): 92-107.
[26] TOMAS E R, ECHER C A. Prediction of limiting activity coefficients by a modified separation of cohensive energy density model and UNIFAC model[J]. Ind. Eng. Chem. Prog. Des., 1984,23(2): 194-209.
[27] SKJOLDJORGENSEN S, KOLBE B, GMEHLING J,et al.Vapor-liquid equilibria by UNIFAC group contribution. revision and extension[J]. Industrial & Engineering Chemistry Process Design &Development, 1979, 18(4): 2352-2355.
[28] TOCHIGI K, TIEGS D, GMEHLING J,et al. Determination of new ASOG parameters[J]. Chem. Eng. Japan, 1990, 23(4): 453-463.
[29] ABRAMS D S, PRAUSNITZ J M. Statistical thermodynamics of liquid mixtures: a new expression for the excess Gibbs energy of partly or completely miscible systems[J]. AIChE Journal, 1975, 21(1):116-128.
[30] WEIDLICH U, GMEHLING J. A modified UNIFAC model (Ⅰ):Prediction of VLE,hE, andγ∞[J]. Industrial & Engineering Chemistry Research, 1987, 26(7): 1372-1381.
[31] GMEHLING J, LOHMANN J, JAKOB A. A modified UNIFAC model (Ⅲ): Revision and extension[J]. Ind. Eng. Chem. Res., 2008,37(12): 4876-4882.
[32] GMEHLING J, WITTIG R, LOHMANN J,et al. A modified UNIFAC (Dortmund) model (Ⅳ): Revision and extension[J].Industrial & Engineering Chemistry Research, 2002, 41(6):1678-1688.
[33] 卢焕章. 石油化工基础数据手册[M]. 北京: 化学工业出版社,1982: 985-1081.LU H Z. Handbook of Basic Data in Petrochemical Engineering[M].Beijing: Chemical Industry Press, 1982: 985-1081
[34] 张志刚. 混合溶剂间歇萃取精馏的研究[D]. 天津: 天津大学,2003.ZHANG Z G. Study on batch extractive distillation by using mixed solvent[D]. Tianjin: Tianjin University, 2003.
date:2017-02-21.
Prof. LI Chunli, lichunli_hebut@126.com
supported by the Research Foundation for the Doctoral Program of China (20131317120014).
Combination of mixed solvent in extractive distillation
FANG Jing, XUAN Bihan, LI Xiaochun, LI Chunli
(School of Chemical Engineering,Hebei University of Technology,Tianjin300130,China)
Extractive distillation is an effective separation process to deal with the separation of close-boiling compounds and azeotropic systems. The selection of appropriate solvent is the key factor for feasibility and economy in extractive distillation. A new method of screening mixed solvent of extractive distillation was proposed, which was according to the situation of forming the hydrogen bond and modified UNFAC model. To take the polar systems (ethyl acetate-ethanol, ethanol-water) and non-polar system (cyclohexane-benzene) as examples, the appropriate mixed-solvents and the optimal proportion were sought out. The vapor-liquid equilibrium data of solvents (single-solvents and mixed-solvents) and azeotropic system were determined by modified Othmer kettle. The results showed that the calculated values were in good agreement with the experimental data and the relative error was less than 9%. By taking into the synthetical evaluation to the solvents,the optimal mixed solvents to separate ethyl acetate-ethanol, ethanol-water, and cyclohexane-benzene were obtained respectively. Under the action of optimal mixed-solvent, the relative volatility of feed components reached maximum which was higher than the value by using any single solvent. At different feed components the trend of volatility of feed components changed by a mixed solvent was almost the same, which indicated that the mixed solvent could improve the volatility of feed components in any tray of extractive distillation column efficiently.
extractive distillation; compound solvents; azeotrope; phase equilibria; separation
TQ 028
A
0438—1157(2017)11—4186—15
10.11949/j.issn.0438-1157.20170159
2017-02-21收到初稿,2017-05-15收到修改稿。
联系人:李春利。
方静(1977—),女,博士,教授。
教育部博士点基金项目(20131317120014)。
