膳食蛋白、机体抗氧化调节与健康的关系研究进展
2017-11-21,,,
,,,
(南京农业大学 国家肉品质量安全控制工程技术研究中心,江苏南京 210095)
膳食蛋白、机体抗氧化调节与健康的关系研究进展
朱菁,李春保,徐幸莲,周光宏*
(南京农业大学 国家肉品质量安全控制工程技术研究中心,江苏南京 210095)
膳食蛋白为机体提供必需氨基酸,还具有广泛的生理功能。膳食蛋白的消化代谢过程中,机体细胞会产生活性氧。活性氧积累可能引发氧化及衰老。细胞中的抗氧化蛋白——硫氧还蛋白、谷氧还蛋白及其他抗氧化酶等共同组成抗氧化系统,抵御活性氧,减少有害物生成。本文综合介绍不同来源的膳食蛋白与相应的抗氧化调节对机体健康的影响,以及活性氧代谢过程中两种抗氧化蛋白的调控作用,结合体内其他抗氧化指标,从而更好地认识不同膳食蛋白的代谢差异,指导个人膳食与健康。
膳食蛋白,肉蛋白,活性氧,谷氧还蛋白,硫氧还蛋白
随着生活日渐富足,人们更多关注食物的营养健康[1]。摄入富含蛋白质的食物与健康状况有很强的联系。膳食蛋白为机体提供必需氨基酸,还具有广泛的生理功能[2]。近年来,植物蛋白与动物蛋白、白肉与红肉对健康影响的争议不断,而关于红肉及其肉类加工产品的摄入量与导致肿瘤风险的研究结果也远未达成共识。已有的研究表明动物与植物蛋白对能量代谢、生理功能有区别性的影响[3-4]。猪肉、牛肉、禽肉、鱼肉的消化代谢和蛋白利用率有明显差异[5]。
膳食蛋白摄入促进机体内细胞水平的主要氧化反应,使细胞产生活性氧(reactive oxygen species,ROS)[6],并进一步改变一系列器官的代谢状态[7]。ROS是一类高反应活性的含氧分子或自由基,影响机体内各种信号传导、代谢调节及细胞凋亡[8]。国际上关于ROS与细胞氧化衰老的基础研究一直是热点[9]。而细胞中的抗氧化蛋白——硫氧还蛋白(Trx)和谷氧还蛋白(Grx)及抗氧化酶——超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、过氧化氢酶(CAT)等共同组成抗氧化体系,来对抗ROS[10-12]。癌细胞能在高浓度ROS条件下存活且不断增殖,主要靠Trx和Grx过表达来不断清除活性氧,抑制细胞凋亡[13-16],目前对两者的研究集中于医学领域。了解这两种抗氧化蛋白的调控作用,结合体内其他抗氧化指标,从而更好地认识不同来源的膳食蛋白的代谢差异,指导个人膳食与健康。
1 膳食蛋白与健康
蛋白质是构成生命的基本要素。蛋白质被摄入人体后,被分解成为氨基酸,进而被吸收利用[17-18]。膳食蛋白为机体提供必需氨基酸,还广泛参与各种生理功能包括:各类物质的代谢合成、免疫反应、酶类调节、信号传导、肌肉收缩、血液凝固等,继而有导致疾病的风险[2,19]。在小鼠模型中,膳食中限制含硫氨基酸(SAA)的摄入能增加胱硫醚γ裂解酶(CGL)代谢通路(TSP)的表达,导致内源性硫化氢生成量增加,使机体抗逆性增强[20]。
1.1不同来源的膳食蛋白对机体的影响
常见的膳食蛋白质包括植物蛋白、乳蛋白、肉蛋白等[21-22],根据现有报道,这些蛋白质摄入对机体健康有一定的影响。
运用基因芯片研究发现,饲喂大豆蛋白或小麦谷蛋白改变了大鼠肝脏或肌肉中与胆固醇代谢、脂肪代谢、抗氧化活性、转录调控、能量代谢等相关基因的表达,可降低胆固醇和甘油三酯的浓度[23]。大豆蛋白还可以让过氧化物酶体增殖物激活受体(PPARs)活化来改善胰岛素抗性和血脂水平[24]。Mezei等研究发现摄入具有高异黄酮的大豆蛋白可以改善肥胖Zucker大鼠的葡萄糖耐受量、胰岛素抗性、肝胆固醇、甘油三酯的浓度。在细胞培养研究中发现,含有异黄酮的大豆提取物和分离的大豆异黄酮能增加PPARs的基因表达[25]。这表明大豆蛋白对糖和脂质代谢的有益作用可能是通过激活PPAR介导。Morifuji等研究表明,摄入大豆蛋白可降低大鼠甘油三酯水平和附睾脂重量,这可能与脂肪酸氧化相关的一些酶的活性及其转录水平上调有关。此外,摄入大豆蛋白可通过激活PPAR通路从而刺激骨骼肌中脂肪氧化,导致身体脂肪积累减少[26]。
牛奶中大约五分之四的蛋白质是酪蛋白。酪蛋白不仅可以为身体补充能量,还可以供给必需氨基酸。在消化过程中,酪蛋白经过水解会产生活性肽,这类活性肽产物能够有效促进消化道蠕动,增强免疫功能,消除ROS、调节矿物质代谢和保护心血管[27]。在被特异性消化酶激活之前,活性肽被包裹在酪蛋白中,不具有生物活性。而活性肽经过食品加工或体内外消化,当活性基团被暴露出来后才发挥出巨大的生物活性优势。乳源性生物活性肽(酪啡肽、乳啡肽等)在心血管系统、免疫系统、消化系统及神经系统等均具有广泛的生理作用[28]。
研究表明鱼肉蛋白具有降血压、降胆固醇的作用[29-30],而此领域的研究仍存在一些矛盾的结果。Murata以大豆蛋白为对照进行实验,发现饲喂大鼠鱼肉蛋白可以降低血浆中甘油三酯浓度[31]。但Ait Yahia在大鼠模型中并未发现此类影响[32]。此外,鱼肉蛋白对高密度脂蛋白-胆固醇的影响结果也不一致。Anjali等研究发现,用阿拉斯加鳕鱼的鱼肉蛋白饲喂大鼠会增加其肝脏的胆固醇浓度,同时会降低肝脏中高密度脂蛋白浓度[33]。Madani等却发现沙丁鱼的鱼肉蛋白摄入能够有效减少大鼠肝脏中胆固醇含量并且降低大鼠血压[34]。这种相反的结果可能跟蛋白质来源的鱼类品种有关。目前对鱼肉蛋白的营养基因组学研究主要集中在肝脏基因表达上,而对肝脏蛋白表达的影响研究还很少。
Brandsch等对照酪蛋白和大豆蛋白,探究大鼠摄入牛肉蛋白、猪肉蛋白和火鸡肉蛋白后其肝脏脂质代谢的变化。结果表明:三种肉蛋白对胆固醇代谢的影响与对照组相比无差异;与酪蛋白相比,猪肉蛋白降低了大鼠的血浆甘油三酯的浓度,可能与肝脏的脂质合成能力降低相关[35]。目前肉源性蛋白对机体基因和蛋白表达的影响研究还较少,对肉类蛋白营养和生理功能的认识还远远不够。张英君等研究发现羊肉可以显著提高大鼠的甲状腺素水平,而大鼠摄入鸭肉后,甲状腺素分泌减少[36]。闫振国、冯宪超等研究表明羊肉参比猪肉,会使大鼠能量代谢升高,结肠AQP2基因转录和翻译水平上调,鸭肉则使其mRNA和蛋白表达量降低[37-38]。陈佳研究表明大鼠的动物肉粉摄入量与体重增重正相关,与总抗氧化能力水平负相关,摄入愈多,过氧化物终产物丙二醛(MDA)产生越多,对机体健康不利[39]。
1.2肉蛋白摄入与健康问题
还有学者从其他方言层面探究了语音影响母语迁移。词汇是语言构建的基石,是语言学习的关键。就词汇而言,学习者会受到母语的影响而使用错误的搭配。有学者对5种英语学习者(即不同水平、不同类型的英语学习者)的书面材料进行分析,结果显示语言失误三个层面中有两个与词汇相关,21种失误中与词汇相关的竟多达17种,由此得出,词汇迁移是英语学习中最主要的问题之一。
作为机体生长和健康维持所需的高品质蛋白来源[40],肉蛋白的必需氨基酸比例比植物蛋白更接近于人体需求,更适于人体吸收利用[41-42],这在人类文明发展过程中起到过重要作用[43]。均衡饮食情况下,摄入适量的瘦肉能改善机体内脂肪酸分布,并且不会增加患心血管疾病或癌症的风险。肉源性食物摄入不足,会导致营养不良、佝偻病、贫血等症状[44]。
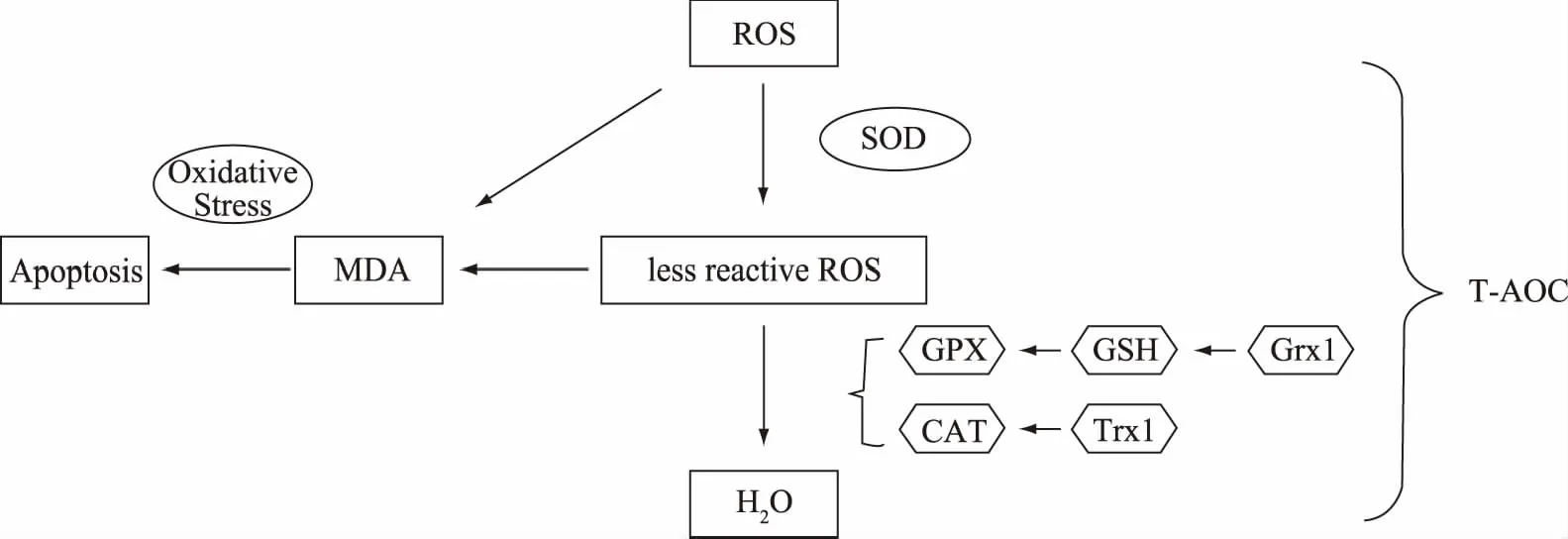
图1 ROS代谢途径Fig.1 ROS metabolic pathway
大量研究已经证明并且达成共识,肉的摄入量要在合理范围内,一旦过多易引发“富贵病”如肥胖、肿瘤、心脑血管病、糖尿病等慢性疾病[45-46]。近年来关于肉源性食物摄入量与癌症风险的研究结果并不一致,其复杂的机理仍需进一步研究[47]。来自猪、牛、羊、马等哺乳动物身上的被称为红肉。红肉对健康的影响始终存在争议[48]。元分析(对以往的研究结果进行系统分析)表明,过量摄入红肉,特别是加工红肉,会增加全因死亡率(All-cause mortality,指一定时期内各种原因导致的总死亡人数与该人群同期平均人口数之比)[49]。但另外一些研究表明,红肉摄入与部分癌症无关,如乳腺癌[50]。美国研究人员发现一种被称为Neu5Gc的糖分子——一种广泛存在于肉食哺乳动物体内的糖类物质,但未在人体内发现。人体摄入哺乳动物来源的肉后,会因为有异物Neu5Gc糖的存在而诱发免疫反应来清除它,持续的免疫状态容易引发炎症,最终有可能导致癌症。通过对普通小鼠和Neu5Gc基因敲除的小鼠饲喂Neu5Gc分子,发现Neu5Gc基因缺陷小鼠(类似于人类)的肿瘤产生率比普通小鼠高4倍[51]。该实验并非人体实验或临床数据,很难直接证明像二型糖尿病、动脉硬化等免疫慢性病与过量摄入来自哺乳动物的肉有关。
目前对肉类蛋白的研究还远远不够,对其全面营养和生理功能的认识还远远不足以达成共识。2002年第一届国际营养基因组会议在荷兰召开,第一次阐述了营养基因组学的概念,从此对肉蛋白的深入研究有了新的平台[52]。与国际相比,我国居民食物摄入来自动物的蛋白质比重低于世界平均水平,而来自动物的脂肪量比重偏高于世界平均水平[53]。营养不均衡问题正阻碍着国民健康建设,肉源性食物的消费亟需科学指导[54]。而一些研究表明,过量摄入动物蛋白可能会增加患2型糖尿病的风险[55],提高心血管和癌症相关的死亡率[56],这可能与ROS水平增加有关[57]。
2 机体抗氧化调节与健康
2.1活性氧与机体抗氧化调节
活性氧ROS指如超氧化物,过氧化物,羟基自由基和单线态氧等这类极不稳定的含氧分子[58]。ROS作为生理和病理条件下的特异性信号分子,是维持机体稳态(包括吞噬细胞防御,生长因子增殖反应,血管生成和内质网应激反应等)的主要因子[59-60]。有学者认为ROS造成的氧化应激是导致细胞凋亡的关键[61]。
ROS水平在一定范围内可以被分解代谢清除,若无过多积累,不会造成氧化损伤,但细胞内环境与外环境中其他不利因素会破坏ROS的正常代谢稳态。如果短时间内ROS产生过多,抗氧化防御系统无法及时消除,ROS累积会造成氧化应激损伤[62]。ROS积累过多会导致各种与氧化还原相关的疾病及细胞衰老。已经有大量研究表明过高的ROS水平与心肌梗塞、阿尔茨海默病、脑血管破裂、2型糖尿病等众多常见疾病有关[63-65]。线虫线粒体中ROS积累越多,寿命越短。机体衰老的速度在相当大程度上取决于动物机体功能代谢最旺盛时的衰老速度[66-67]。
膳食蛋白的摄入会引起机体内ROS水平的差异,相应影响各种信号传导、代谢调节、细胞凋亡及机体衰老。膳食摄入后,机体消化代谢过程中产生ROS不可避免,而机体具有抗氧化防御体系来控制ROS在体内的浓度[6]。内环境中最重要的ROS消除剂就是超氧化物歧化酶(SOD),它可以将高反应性的ROS转化为低反应活性的ROS,然后谷胱甘肽过氧化物酶(GPX)和过氧化氢酶(CAT)将后者转化为水[68]。同时还存在一个负反馈,若肝脏中血液更新效率降低,会导致SOD更新不及时。低水平的SOD会被过多的ROS削弱活性。SOD活性下降的同时,某些金属离子易催化ROS产生MDA,MDA对细胞有强毒性,能够使蛋白质产生内部或外部交联,从而导致细胞凋亡[69]。
2.2抗氧化蛋白Trx和Grx对健康的影响
癌细胞能在高浓度ROS条件下存活且不断增殖,主要通过硫氧还蛋白Trx和谷氧还蛋白Grx的过表达来不断清除ROS,从而抑制细胞凋亡[13-15]。在Grx基因敲除的小鼠体内,肿瘤细胞的增殖受到抑制[16]。硫氧还蛋白Trx中的主要功能蛋白是Trx1,是非酶抗氧化物。谷氧还蛋白Grx中主要代表性功能蛋白是Grx1,虽然也是一种抗氧化酶,但不同于三大主要抗氧化酶——包括超氧化物歧化酶SOD、谷胱甘肽过氧化物酶GPX和过氧化氢酶CAT[11-12]。
2.2.1 Trx的抗氧化机制 Trx最先从绿色植物中被获得,其后同样在微生物中发现并分离获得。Trx对温度耐受力强,高温下不会失活,证明Trx不是一种酶,并且普遍存在于机体中。Trx有104个氨基酸,分子量小,仅12 kD[70]。Trx的超级大家族中,主要的抗氧化代表有Trx1和Trx2。Trx1主要作用于细胞质中,自身具有两个催化半胱氨酸残基的位点及三个不具活性的半胱氨酸残基位点,分别是Cys-62、Cys-69和Cys-73。氧化半胱氨酸会破坏蛋白分子结构,从而影响Trx1的结构功能[71]。Trx2较Trx1表达量少,少量存在于线粒体中。

图2 Trx系统抗氧化过程[73]Fig.2 Trx system’s antioxidant process[73]

图3 Grx的两种抗氧化反应机制[77]Fig.3 Grx’s two antioxidant mechanisms[77]
SOD可以将ROS转化为低活性的产物,随后CAT会将低活性产物转化水,而Trx可以通过还原CAT酶来辅助消除ROS,减少MDA积累过多导致的基因损伤及细胞凋亡[72]。由于Trx能作为氢供体还原二硫键,来作用于某些转录因子、蛋白激酶及某些磷酸蛋白酶等,保持蛋白质结构功能活性。Trx及其还原酶和还原型辅酶Ⅱ共同作用于二硫键,不断还原被氧化的二硫键来消除ROS。Trx的半胱氨酸活性位点能通过可逆反应,催化保守的活性位点-Cys-Gly-Pro-Cys-形成氧化的Cys二硫化物,还原转化成含有二硫化物的底物。被氧化的Trx则需要被其还原酶还原成含有Cys的巯基化合物。大多数具有二硫键的蛋白都能通过与Trx的这种交换被还原[73]。
2.2.2 Grx的抗氧化机制 巯基转移酶Grx广泛分布于微生物与动植物中,与Trx同为小分子蛋白,分子量12 kD左右,比Trx多3~4个氨基酸。Grx作用方式也和Trx类似,蛋白质的二硫键和巯基作用于活性位点-Cys-Pro-Tyr-Cys-来维持蛋白活力,与谷胱甘肽之间存在二硫键转换作用[74]。近年来谷氧还蛋白大家族不断有新成员被发现,其中最具有代表性并起主要作用的是Grx1,主要分布于细胞质中[75]。后发现的分子量18 kD的Grx2主要存在于线粒体中,少量作用于核膜上。Grx2具有谷胱甘肽硫转移酶GST类似的蛋白质结构,而表现出巯基转移酶Grx的蛋白活力。Grx2活性显著强于Grx1,但在细胞中的浓度低,作用范围小,总抗氧还能力不及Grx1。人体中主要是这两种谷氧还蛋白[76]。Grx的主要抗氧化机制是通过GSH来可逆的转换巯基及二硫键,并且只针对性的作用于GSH关联的二硫化物,使得含有巯基的蛋白质处于动态平衡中,维持蛋白质生物活性[77]。
Lee等[12]研究证明,线粒体中的细胞凋亡信号调控激酶1可与还原型谷氧还蛋白连接从而失活。当细胞中氧化水平过高时,Grx1会被氧化。被氧化的Grx1与细胞凋亡信号调控激酶1接触,会激活细胞凋亡信号调控激酶1,从而诱发细胞自我毁灭。而Trx只可以与细胞凋亡信号调控激酶1结合抑制细胞凋亡[78]。此外Grx1可以通过核因子NF-κB途径调节细胞凋亡[79]。
3 总结与展望
高品质的膳食蛋白对机体健康很重要[80]。考虑到蛋白质的来源和成本,市售的膳食蛋白补充剂通常来源于牛奶蛋白或其他植物蛋白[81]。而动物蛋白能提供更适合人体吸收的高品质蛋白质,更适合像中国这样的发展中国家的国民[82]。相比植物蛋白,来自日常饮食中的动物蛋白能更有效地促进机体肌肉蛋白质合成[44]。
每一种膳食蛋白都是复杂的蛋白质、多肽和氨基酸的混合物。植物蛋白、动物蛋白以及不同物种来源的蛋白质之间氨基酸组成可能存在较大差异,因此摄食后可能会引起机体内ROS水平的差异,机体相应的抗氧化调节及抗氧化蛋白(Trx和Grx)的表现亦会不同,从而影响各种信号传导、生理代谢、细胞凋亡及机体衰老等等。了解这两种抗氧化蛋白的调控作用,结合体内其他抗氧化指标,更好地认识不同来源的膳食蛋白的代谢差异。日常生活中应该摄入多种来源的膳食蛋白,避免长期食用单一膳食蛋白对机体健康造成不良影响。谨慎地摄取高质量的肉类蛋白[83],这样既不会损失营养优势,也不会丧失吃肉的乐趣[84]。
膳食蛋白的摄入会引起机体氧化状态和抗氧化能力的差异可能与膳食蛋白来源及其氨基酸的组成有关。可以考虑进一步开展工作,探寻饮食中某些氨基酸限制如何影响机体的氧化状态与抗氧化调节及其对健康的影响。
[1]Kearney J. Food consumption trends and drivers[J]. Philosophical Transactions of the Royal Society B:Biological Sciences,2010,365(1554):2793-2807.
[2]Jahan-Mihan A,Luhovyy B L,El Khoury D,et al. Dietary proteins as determinants of metabolic and physiologic functions of the gastrointestinal tract[J]. Nutrients,2011,3(5):574-603.
[3]Song S,Hooiveld G J,Zhang W,et al. Comparative proteomics provides insights into metabolic responses in rat liver to isolated soy and meat proteins[J]. Journal of Proteome Research,2016,15(4):1135-1142.
[4]Song S,Hooiveld G J E J,Li M,et al. Distinct physiological,plasma amino acid,and liver transcriptome responses to purified dietary beef,chicken,fish,and pork proteins in young rats[J]. Molecular nutrition & Food Research,2016,60:1199-1205.
[5]Song S,Hooiveld G J,Li M,et al. Dietary soy and meat proteins induce distinct physiological and gene expression changes in rats[J]. Scientific Reports,2016,6:20036.
[6]Quindry J C,Kavazis A N,Powers S K. Exercise-induced oxidative stress:Are supplemental antioxidants warranted[J]. Sports Nutrition,2014:263-276.
[7]Diamanti-Kandarakis E,Papalou O,Kandaraki E A,et al. Mechanisms in endocrinology:Nutrition as a mediator of oxidative stress in metabolic and reproductive disorders in women[J]. European Journal of Endocrinology,2017,176(2):R79-R99.
[8]Bergamini C M,Gambetti S,Dondi A,et al. Oxygen,reactive oxygen species and tissue damage[J]. Current Pharmaceutical Design,2004,10(14):1611-1626.
[9]Harman D. The biologic clock:the mitochondria?[J]. Journal of the American Geriatrics Society,1972,20(4):145-147.
[10]Halliwell B,Gutteridge J M C. Free radicals in biology and medicine[M]. Oxford University Press,USA,2015.
[11]Holmgren A. Antioxidant function of thioredoxin and glutaredoxin systems[J]. Antioxidants & Redox Signaling,2000,2(4):811-820.
[12]Lee K O,Lee J R,Yoo J Y,et al. GSH-dependent peroxidase activity of the rice(Oryza sativa)glutaredoxin,a thioltransferase[J]. Biochemical and Biophysical Research Communications,2002,296(5):1152-1156.
[13]Peltoniemi M J,Rytila P H,Harju T H,et al. Modulation of glutaredoxin in the lung and sputum of cigarette smokers and chronic obstructive pulmonary disease[J]. Respiratory Research,2006,7(1):133-143.
[14]Powis G,Kirkpatrick D L. Thioredoxin signaling as a target for cancer therapy[J]. Current Opinion in Pharmacology,2007,7(4):392-397.
[15]Qu Y,Wang J,Ray P S,et al. Thioredoxin-like 2 regulates human cancer cell growth and metastasis via redox homeostasis and NF-κB signaling[J]. The Journal of Clinical Investigation,2011,121(1):212-225.
[16]Cheng N H,Zhang W,Chen W Q,et al. A mammalian monothiol glutaredoxin,Grx3,is critical for cell cycle progression during embryogenesis[J]. FEBS Journal,2011,278(14):2525-2539.
[17]陈辉. 现代营养学[M]. 北京:化学工业出版社,2005:38-45.
[18]中国就业培训技术指导中心. 公共营养师[M]. 北京:中国劳动社会保障出版社,2007:67-78.
[19]Khmelinskii A,Blaszczak E,Pantazopoulou M,et al. Protein quality control at the inner nuclear membrane[J]. Nature,2014,516(7531):410-413.
[20]Hine C,Harputlugil E,Zhang Y,et al. Endogenous hydrogen sulfide production is essential for dietary restriction benefits[J]. Cell,2015,160(1):132-144.
[21]Friedman M. Nutritional value of proteins from different food sources[J]. Journal of Agricultural and Food Chemistry,1996,44(1):6-29.
[22]Davis J,Sonesson U,Baumgartner D U,et al. Environmental impact of four meals with different protein sources:case studies in Spain and Sweden[J]. Food Research International,2010,43(7):1874-1884.
[23]Singhal R,Shankar K,Badger T M,et al. Hepatic gene expression following consumption of soy protein isolate in female Sprague-Dawley rats differs from that produced by 17β-estradiol treatment[J]. Journal of Endocrinology,2009,202(1):141-152.
[24]Ricketts M L,Moore D D,Banz W J,et al. Molecular mechanisms of action of the soy isoflavones includes activation of promiscuous nuclear receptors[J]. The Journal of Nutritional Biochemistry,2005,16(6):321-330.
[25]Mezei O,Banz W J,Steger R W,et al. Soy isoflavones exert antidiabetic and hypolipidemic effects through the PPAR pathways in obese Zucker rats and murine RAW 264.7 cells[J]. The Journal of Nutrition,2003,133(5):1238-1243.
[26]Morifuji M,Sanbongi C,Sugiura K. Dietary soya protein intake and exercise training have an additive effect on skeletal muscle fatty acid oxidation enzyme activities and mRNA levels in rats[J]. British Journal of Nutrition,2006,96(3):469-475.
[27]Möller N P,Scholz-Ahrens K E,Roos N,et al. Bioactive peptides and proteins from foods:indication for health effects[J]. European Journal of Nutrition,2008,47(4):171-182.
[28]Trompette A,Claustre J,Caillon F,et al. Milk bioactive peptides andβ-casomorphins induce mucus release in rat jejunum[J]. The Journal of Nutrition,2003,133(11):3499-3503.
[29]Wergedahl H,Liaset B,Gudbrandsen O A,et al. Fish protein hydrolysate reduces plasma total cholesterol,increases the proportion of HDL cholesterol,and lowers acyl-CoA:cholesterol acyltransferase activity in liver of Zucker rats[J]. The Journal of Nutrition,2004,134(6):1320-1327.
[30]Yahia D A,Madani S,Prost J,et al. Fish protein improves blood pressure but alters HDL2 and HDL3 composition and tissue lipoprotein lipase activities in spontaneously hypertensive rats[J].European Journal of Nutrition,2005,44(1):10-17.
[31]Murata M,Sano Y,Bannai S,et al. Fish protein stimulated the fibrinolysis in rats[J]. Annals of Nutrition & Metabolism,2003,48(5):348-356.
[32]Ait-Yahia D,Madani S,Savelli J L,et al. Dietary fish protein lowers blood pressure and alters tissue polyunsaturated fatty acid composition in spontaneously hypertensive rats[J]. Nutrition,2003,19(4):342-346.
[33]Shukla A,Bettzieche A,Hirche F,et al. Dietary fish protein alters blood lipid concentrations and hepatic genes involved in cholesterol homeostasis in the rat model[J]. British Journal of Nutrition,2006,96(4):674-682.
[34]Madani Z,Louchami K,Sener A,et al. Dietary sardine protein lowers insulin resistance,leptin and TNF-αand beneficially affects adipose tissue oxidative stress in rats with fructose-induced metabolic syndrome[J]. International Journal of Molecular Medicine,2012,29(2):311-318.
[35]Brandsch C,Shukla A,Hirche F,et al. Effect of proteins from beef,pork,and turkey meat on plasma and liver lipids of rats compared with casein and soy protein[J]. Nutrition,2006,22(11):1162-1170.
[36]张英君,魏法山,李春保,等. 饲喂羊肉和鸭肉日粮对大鼠血清甲状腺素水平的影响[J]. 南京农业大学学报,2011,34(1):128-132.
[37]闫振国,冯宪超,徐幸莲,等. 饲喂羊肉和鸭肉对大鼠水盐代谢影响的比较研究[J]. 食品科学,2011,32(9):285-289.
[38]闫振国,王思丹,王虎虎,等. 饲喂羊肉和鸭肉对大鼠结肠 AQP2 表达的影响[J]. 食品科学,2012,33(7):275-279.
[39]陈佳. 饲喂不同来源肉类对大鼠免疫功能的影响[D]. 南京:南京农业大学,2012.
[40]Pereira P M C C,Vicente A F R B. Meat nutritional composition and nutritive role in the human diet[J]. Meat Science,2013,93(3):586-592.
[41]Donovan S. Biochemical,physiological and molecular aspects of human nutrition 2nd edition,by Martha H Stipanuk,2006,1232 pages,hardcover,price not known. Elsevier Inc,St Louis,MO[J]. The American Journal of Clinical Nutrition,2007,85(1):244-245.
[42]Gilbert J A,Bendsen N T,Tremblay A,et al. Effect of proteins from different sources on body composition[J]. Nutrition,Metabolism and Cardiovascular Diseases,2011,21:B16-B31.
[43]Stipanuk M H,Caudill M A. Biochemical,physiological,and molecular aspects of human nutrition[M]. Elsevier Health Sciences,2013:681-683.
[44]McAfee A J,McSorley E M,Cuskelly G J,et al. Red meat consumption:An overview of the risks and benefits[J]. Meat Science,2010,84(1):1-13.
[45]Dwyer T,Hetzel B S. A comparison of trends of coronary heart disease mortality in Australia,USA and England and Wales with reference to three major risk factors-hypertension,cigarette smoking and diet[J]. International Journal of Epidemiology,1980,9(1):65-71.
[46]Armstrong B,Doll R. Environmental factors and cancer incidence and mortality in different countries,with special reference to dietary practices[J]. International Journal of Cancer,1975,15(4):617-631.
[47]Glade M J. Food,nutrition,physical activity,and the prevention of cancer:a global perspective[J]. American Institute for Cancer Research/World Cancer Research Fund,American Institute for Cancer Research,1997:523-526.
[48]Wiseman M. The second World Cancer Research Fund/American Institute for Cancer Research expert report. Food,nutrition,physical activity,and the prevention of cancer:a global perspective[J]. Proceedings of the Nutrition Society,2008,67(3):253-256.
[49]Larsson S C,Orsini N. Red meat and processed meat consumption and all-cause mortality:a meta-analysis[J]. American journal of epidemiology,2014,179:282-289.
[50]Kim A E,Lundgreen A,Wolff R K,et al. Red meat,poultry,and fish intake and breast cancer risk among Hispanic and Non-Hispanic white women:The Breast Cancer Health Disparities Study[J]. Cancer Causes & Control,2016,27(4):527-543.
[51]Samraj A N,Pearce O M T,Läubli H,et al. A red meat-derived glycan promotes inflammation and cancer progression[J].Proceedings of the National Academy of Sciences,2015,112(2):542-547.
[52]Van Ommen B,Stierum R. Nutrigenomics:exploiting systems biology in the nutrition and health arena[J]. Current Opinion in Biotechnology,2002,13(5):517-521.
[53]封志明,史登峰. 近 20 年来中国食物消费变化与膳食营养状况评价[J]. 资源科学,2006,28(1):2-8.
[54]Walker P,Rhubart-Berg P,McKenzie S,et al. Public health implications of meat production and consumption[J]. Public Health Nutrition,2005,8(4):348-356.
[55]Van Nielen M,Feskens E J M,Mensink M,et al. Dietary protein intake and incidence of type 2 diabetes in Europe:the EPIC-InterAct Case-Cohort Study[J]. Diabetes Care,2014,37(7):1854-1862.
[56]Rohrmann S,Overvad K,Bueno-de-Mesquita H B,et al. Meat consumption and mortality-results from the European Prospective Investigation into Cancer and Nutrition[J]. BMC Medicine,2013,11(1):63.
[57]Larsson S C,Wolk A. Meat consumption and risk of colorectal cancer:a meta-analysis of prospective studies[J]. International Journal of Cancer,2006,119(11):2657-2664.
[58]Bergamini C M,Gambetti S,Dondi A,et al. Oxygen,reactive oxygen species and tissue damage[J]. Current Pharmaceutical Design,2004,10(14):1611-1626.
[59]Finkel T,Holbrook N J. Oxidants,oxidative stress and the biology of ageing[J]. Nature,2000,408(6809):239-247.
[60]Brown D I,Griendling K K. Regulation of signal transduction by reactive oxygen species in the cardiovascular system[J]. Circulation Research,2015,116(3):531-549.
[61]Sims N R,Muyderman H. Mitochondria,oxidative metabolism and cell death in stroke[J]. Biochimica et Biophysica Acta(BBA)-Molecular Basis of Disease,2010,1802(1):80-91.
[62]Miyamoto H,Doita M,Nishida K,et al. Effects of cyclic mechanical stress on the production of inflammatory agents by nucleus pulposus and anulus fibrosus derived cellsinvitro[J]. Spine,2006,31(1):4-9.
[63]Tsang A H K,Chung K K K. Oxidative and nitrosative stress in Parkinson’s disease[J]. Biochimica et Biophysica Acta(BBA)-Molecular Basis of Disease,2009,1792(7):643-650.
[64]Shi S Y,Lu S Y,Sivasubramaniyam T,et al. DJ-1 links muscle ROS production with metabolic reprogramming and systemic energy homeostasis in mice[J]. Nature Communications,2015,6:1-10.
[65]Zhu X,Smith M A,Honda K,et al. Vascular oxidative stress in Alzheimer disease[J]. Journal of the Neurological Sciences,2007,257(1):240-246.
[66]Kenyon C J. The genetics of ageing[J]. Nature,2010,464(7288):504-512.
[67]Shen E Z,Song C Q,Lin Y,et al. Mitoflash frequency in early adulthood predicts lifespan in Caenorhabditis elegans[J]. Nature,2014,508(7494):128-132.
[68]Schieber M,Chandel N S. ROS function in redox signaling and oxidative stress[J]. Current Biology,2014,24(10):R453-R462.
[69]Franco R,Sánchez-Olea R,Reyes-Reyes E M,et al. Environmental toxicity,oxidative stress and apoptosis:menage a trois[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis,2009,674(1):3-22.
[70]Tamura T,Stadtman T C. A new selenoprotein from human lung adenocarcinoma cells:purification,properties,and thioredoxin reductase activity[J]. Proceedings of the National Academy of Sciences,1996,93(3):1006-1011.
[71]Burke-Gaffney A,Callister M E J,Nakamura H. Thioredoxin:friend or foe in human disease?[J]. Trends in Pharmacological Sciences,2005,26(8):398-404.
[72]Watson W H,Yang X,Choi Y E,et al. Thioredoxin and its role in toxicology[J]. Toxicological Sciences,2004,78(1):3-14.
[73]刘光慧,沈恂. 硫氧还蛋白与心血管疾病[J]. 生物物理学报,2007,22(6):406-414.
[74]Bushweller J H,Aaslund F,Wuethrich K,et al. Structural and functional characterization of the mutant Escherichia coli glutaredoxin(C14. fwdarw. S)and its mixed disulfide with glutathione[J]. Biochemistry,1992,31(38):9288-9293.
[75]Fernandes A P,Fladvad M,Berndt C,et al. A novel monothiol glutaredoxin(Grx4)from Escherichia coli can serve as a substrate for thioredoxin reductase[J]. Journal of Biological Chemistry,2005,280(26):24544-24552.
[76]Lundberg M,Johansson C,Chandra J,et al. Cloning and expression of a novel human glutaredoxin(Grx2)with mitochondrial and nuclear isoforms[J]. Journal of Biological Chemistry,2001,276(28):26269-26275.
[77]葛岩. 基因工程方法构建含硒谷氧还蛋白[D]. 长春:吉林大学,2009.
[78]Lee B C,Park B H,Kim S Y,et al. Role of Bim in diallyl trisulfide-induced cytotoxicity in human cancer cells[J]. Journal of Cellular Biochemistry,2011,112(1):118-127.
[79]Finkel T. Signal transduction by reactive oxygen species[J]. The Journal of Cell Biology,2011,194(1):7-15.
[80]Moore D R,Camera D M,Areta J L,et al. Beyond muscle hypertrophy:why dietary protein is important for endurance athletes 1[J]. Applied Physiology,Nutrition,and Metabolism,2014,39(9):987-997.
[81]Reidy P T,Walker D K,Dickinson J M,et al. Protein blend ingestion following resistance exercise promotes human muscle protein synthesis[J]. The Journal of nutrition,2013,143(4):410-416.
[82]Wedin W F,Hodgson H J,Jacobson N L. Utilizing plant and animal resources in producing human food[J]. Journal of Animal Science,1975,41(2):667-686.
[83]Phillips S M,Fulgoni V L,Heaney R P,et al. Commonly consumed protein foods contribute to nutrient intake,diet quality,and nutrient adequacy[J]. The American Journal of Clinical Nutrition,2015,101(6):1346S-1352S.
[84]Myhre J B,Løken E B,Wandel M,et al. Differences in nutrient composition and choice of side dishes between red meat and fish dinners in Norwegian adults[J]. Food & Nutrition Research,2016,60.
Researchprogressintheassociationsofdietaryproteinswithantioxidantregulationofthebodyandhumanhealth
ZHUJing,LIChun-bao,XUXing-lian,ZHOUGuang-hong*
(National Center of Meat Quality and Safety Control,Nanjing Agricultural University,Nanjing 210095,China)
Dietary proteins provide the essential amino acids for human body and have a wide range of physiological functions. The cellsinvivocan produce reactive oxygen species during dietary protein digestion and metabolism process. The accumulation of reactive oxygen species may lead to oxidation and aging. The antioxidant system including the antioxidant proteins,thioredoxin and glutaredoxin,and other antioxidant enzymes can resist reactive oxygen species and reduce the generetion of harmful substances. The effects of different dietary proteins and the corresponding antioxidant regulation on human health,as well as the regulation of the two antioxidant proteins during reactive oxygen species metabolism combined with other antioxidant indicators were described in this review. The background information is better for us to understand the metabolic differences of different dietary protein and to have a healthy diet.
dietary proteins;meat proteins;reactive oxygen species;glutaredoxin;thioredoxin
2017-05-02
朱菁(1992-),女,硕士研究生,研究方向:食品营养基因组学,E-mail:2014108081@njau.edu.cn。
*
周光宏(1960-),男,博士,教授,研究方向:食品科学,E-mail:guanghong.zhou@hotmail.com。
国家自然科学基金(31471600和31530054)。
TS201.4
A
1002-0306(2017)21-0335-07
10.13386/j.issn1002-0306.2017.21.065
