海藻植物发酵液饮料的研制
2017-11-21,,,,,,,*
,,,, , , ,*
(1.深圳市中科台富科技有限公司,广东深圳 518131; 2.中国科学院深圳先进技术研究院,广东深圳 518055; 3.山东省食品药品检验研究院,山东济南 250101)
海藻植物发酵液饮料的研制
于配配1,方孝贤1,何鑫平2,吴彬彬2,胡梅3,梁岩2,晏斌1,*
(1.深圳市中科台富科技有限公司,广东深圳 518131; 2.中国科学院深圳先进技术研究院,广东深圳 518055; 3.山东省食品药品检验研究院,山东济南 250101)
实验原料以海带、紫菜、螺旋藻为主,果蔬为辅。海藻及富含淀粉质的果蔬匀浆提取液与复合植物糖渍浸提液混合后依次经红曲霉发酵、复合菌种发酵、醋酸菌发酵,后经后熟、过滤得到口感优良的海藻植物发酵液饮料。结果表明:红曲霉、复合菌种及醋酸菌发酵时间分别为8、2、9 d,经单因素和正交实验优化后的其他发酵条件为:海藻提取液与植物提取液配比1∶2,起始发酵液可溶性固形物含量35%,复合菌种接种量5×107CFU/mL,乳酸菌和酵母菌接种数量比例15∶1。该饮料最终可溶性固形物含量33.6%,pH3.25,乳酸含量418 mg/L,乙酸含量1143 mg/L,乙醇含量低于0.5%,微生物指标均符合国家标准。该工艺与传统工艺相比发酵过程易于控制,产品口感优良,为解决海藻资源利用率低提供良好的示范作用。
海藻,植物,发酵,红曲霉,乳酸菌,鲁氏接合酵母菌,醋酸菌
“海藻”是海水中以光合作用产生能量的藻类,包括绿藻、红藻和褐藻三大类[1]。由于海藻特殊的生长环境,所含的营养成分与陆生植物有较大的区别,除含有丰富的蛋白质、纤维素、微量元素、维生素和矿物质外,还含有海藻多糖、海藻酸钠、高度不饱和脂肪酸等特殊的营养成分[2],再加上海藻具有生长速度快、适应能力强、结构简单等特点,使得其在食品、保健品、化妆品、纺织及化学等领域展示出良好的应用前景。据记载,人类将海藻作为食物已具有悠久的历史[3],目前,全世界可供食用的海藻种类有100多种,我国则有50多种。随着社会的发展,海藻食品加工也逐渐由盐渍、干制等初级加工方式向精深加工方式(如即食海藻食品、海藻生物活性成分浓缩产品)和食品添加剂方向发展。但目前国内市场上的食用海藻产品种类还比较少,且加工档次低,难以满足市场对精深加工海藻食品的需求,致使我国食用海藻产业发展受到严重制约[4-6]。
植物发酵液饮料[7-8]是近年新兴的一种植物发酵食品,兼具植物原料营养成分和发酵食品功效,因此在改善产品品质方面具有较大的优势。目前市面上销售的植物发酵液多为自然发酵,或经一步或多步接种复合菌剂,经长时间发酵、后熟而成,发酵过程缺乏调控,发酵时间长且产品质量稳定性差[8]。因此,本实验以我国丰富的海藻为主要原料,以部分水果、蔬菜为辅料,经多种有益微生物发酵,从而形成有特殊风味的发酵饮料。实验根据菌种特性和原料特点通过多步发酵、后熟得到营养丰富的海藻复合植物发酵液饮料,一方面全面保存了产品的营养物质,增加了新的生物活性成分,另一方面缩短了发酵周期,保证了产品质量稳定可控,为我国食用海藻资源的精深加工提供良好的示范作用。

图1 工艺流程图Fig.1 Process flow chart
1 材料与方法
1.1材料与仪器
螺旋藻粉 山东巨荣生物工程有限公司;干制海带,干制紫菜,富含淀粉质果蔬(香蕉、南瓜、山药、紫薯、大枣、陈皮),苹果、柠檬、梨、火龙果、芹菜、胡萝卜、菠菜、金针菇、青椒 均购于深圳市清湖农批市场;红曲霉(GIM3.439,MonascuspurpureusWent) 浙江百惠生物科技有限公司;植物乳杆菌(GIM1.181,Lactobacillusplantarum)、发酵乳杆菌(GIM1.429,Lactobacillusfermentum)、嗜酸乳杆菌(GIM1.208,Lactobacillusacidophilus)、鲁氏接合酵母(GIM2.173,Zygosaccharomycesrouxii(Saito)Lodd) 广东省微生物菌种保藏中心;醋酸菌 济宁玉园生物科技有限公司;食品级果胶酶(30000 U/g) 深圳安泰生物科技有限公司。
WAY-2W阿贝折光仪 上海易测仪器设备有限公司;UV-6100双光束紫外-可见光分光光度计 上海美普达仪器有限公司;SHP-150生化培养箱 上海精宏实验设备有限公司;THZ-98AB恒温振荡培养箱 上海一恒科学仪器有限公司;5180R高速冷冻离心机 德国Eppendorf AG。
1.2实验方法
1.2.1 工艺流程
1.2.2 菌种培养及计数
1.2.2.1 红曲霉 挑取斜面菌种至液体培养基中,30 ℃,150 r/min,培养2 d[9]。
1.2.2.2 耐高糖活性干酵母 活化制备种子液:称取10 g干酵母,加入28 ℃的2%蔗糖水100 mL,摇匀,静置活化30 min。
1.2.2.3 乳酸菌 按1%接种量接入MRS液体培养基,37 ℃静置培养24 h,采用平板计数法计数[10]。
1.2.2.4 鲁氏接合酵母 按2%接种量接入YPDA培养基,37 ℃,180 r/min摇床培养24 h,采用平板计数法计数[11]。
1.2.2.5 醋酸菌 培养基:酵母膏1%,葡萄糖1%,115 ℃高压蒸汽灭菌,20 min,冷却后加入4%无水乙醇,接种量3%,32 ℃,220 r/min摇床培养24 h[12]。
1.2.3 原料预处理
1.2.3.1 海藻提取液制备 将复水后的干制海带200 g、紫菜50 g,大枣、陈皮各10 g,切块并与50 g螺旋藻粉混合,香蕉、南瓜、山药、紫薯各50 g洗净、去皮、去籽,切块,与500 mL纯净水混合打浆,收集浆液,加入0.05%食品级果胶酶于37 ℃酶解2 h,200目纱布过滤取滤液,得海藻提取液,备用。
1.2.3.2 复合植物提液制备 分别称取剩余水果、蔬菜各100 g,洗净、去皮、去籽、控干水分,切块,与白砂糖按1∶1比例混合均匀,密封,常温糖渍浸提7 d,200目纱布过滤后取浸提液,得复合植物提取液,备用。
1.2.4 调配 将海藻提取液与复合植物提取液按1∶2比例混合,加入白砂糖调节可溶性固形物含量至25%,经巴氏灭菌(68 ℃,30 min),备用。
1.2.5 发酵
1.2.5.1 红曲霉发酵 将活化后的红曲霉按0.4%的接种量接入混合液,于28 ℃、150 r/min条件下发酵,待发酵液中淀粉酶活性降低时停止发酵,离心过滤除菌,收集滤液,备用,淀粉酶检测采用比色法[9]。
1.2.5.2 复合菌种发酵 接入乳酸菌和酵母菌,30 ℃发酵至残糖及pH均不再变化[13],并测定发酵液的乙醇含量[14]。
1.2.5.3 醋酸菌发酵时间的确定 按接种量8%接入醋酸菌,常温发酵,每天按时摇晃容器,以供给醋酸菌足够氧气,当发酵液乙醇含量低于0.5%时结束发酵[15]。
1.2.6 后熟 发酵结束后,分别将发酵液密闭保存,常温静置后熟30 d。
1.2.7 过滤 将发酵液经200 目袋式过滤、0.45 μm板框精滤、0.22 μm膜滤得海藻植物发酵液饮料。
1. 2.8 发酵条件优化
1.2.8.1 单因素实验 海藻提取液与复合植物提取液混合比例的选择:将海藻提取液与复合植物提取液分别按 1∶3、1∶2、1∶1、2∶1、3∶1比例混合,采用白砂糖调节可溶性固形物含量(20 ℃,按折光计)至 25%,接入红曲霉发酵8 d,过滤除菌后接入接种量为 5×107CFU/mL的复合菌种(乳酸菌∶酵母菌=5∶1),30 ℃条件下发酵至残糖及 pH均不再变化,醋酸菌发酵至乙醇含量低于0.5%,以感官品质为指标,选择合适的提取液配比。
起始发酵液可溶性固形物含量的选择:将海藻提取液与复合植物提取液按1∶2比例混合,采用白砂糖调节可溶性固形物含量分别至20%、25%、30%、35%、40%,接入红曲霉发酵8 d,过滤除菌后接入接种量为5×107CFU/mL的复合菌种(乳酸菌∶酵母菌=5∶1),30 ℃条件下发酵至残糖及pH均不再变化,醋酸菌发酵至乙醇含量低于0.5%,以感官品质为指标,选择合适的起始可溶性固形物含量。
复合菌种接种量的选择:将海藻提取液与复合植物提取液按1∶2比例混合均匀,采用白砂糖调节可溶性固形物含量至35%,接入红曲霉发酵8 d,过滤除菌后分别按接种量为1×107、3×107、5×107、7×107、9×107CFU/mL接入复合菌种(乳酸菌∶酵母菌=5∶1),30 ℃条件下发酵至残糖及pH均不再变化,醋酸菌发酵至乙醇含量低于0.5%,以感官品质为指标,选择合适的接种量。
乳酸菌和酵母菌接种量配比的选择:将海藻提取液与复合植物提取液按1∶2比例混合均匀,采用白砂糖调节可溶性固形物含量至35%,接入红曲霉发酵8 d,过滤除菌后将乳酸菌和酵母菌分别按数量比例1∶1、3∶1、5∶1、10∶1、15∶1、20∶1、30∶1接种,接种量为5×107CFU/mL,30 ℃条件下发酵至残糖及pH均不再变化,醋酸菌发酵至乙醇含量低于0.5%,以感官品质为指标,选择合适的接种量配比。
1.2.8.2 正交实验 根据单因素结果,选择发酵过程对感官评价影响较大的三个因素,即海藻提取液与植物提取液配比,起始发酵液可溶性固形物含量及乳酸菌和酵母菌接种比例设计正交实验,所有实验接种红曲霉发酵8 d,过滤除菌后接入复合菌种于30 ℃条件下发酵至残糖及pH均不再变化,醋酸菌发酵至乙醇含量低于0.5%,以感官品质为指标,以确定最佳的发酵培养条件组合,实验中保持接种量为单因素优化后的最佳量,对优化结果进行方差分析,找出显著性影响产品感官品质的因素。正交实验设计见表1。

表1 发酵条件正交实验设计L9(34)Table 1 Orthogonal test(L9(34))of fermentation conditions
1.2.8.3 统计学分析方法 采用SPSS 22.0统计分析软件对正交设计所得数据进行计算、统计以及单变量的方差分析。在α=0.05水平上,通过F检验判断各因素的显著性及影响顺序。
1.2.9 分析方法
1.2.9.1 感官评分 组织20名身体健康、感觉正常且有经验的人员参加评定,对样品的外观、色泽、香气及滋味进行评价并打分,取平均值作为结果,感官评定标准见表2。

表2 发酵饮料感官评定标准Table 2 Sensory evaluation standards of ferment beverage
1.2.9.2 可溶性固形物含量的测定 采用阿贝折光仪测定饮料的可溶性固形物含量,根据实际测定温度查表(见GB/T 12143-2008附录B)校正,得出20 ℃时饮料的可溶性固形物含量。
1.2.9.3 pH的测定 取一定量足以浸没电极的饮料,将电极用蒸馏水冲洗后,用纸巾浸干水分,插入试样中,摇匀,待读数稳定后,读取待测样液的pH。
1.2.9.4 乙酸、乳酸含量的测定 高效液相色谱法[16]。
1.2.9.5 微生物指标检测 参照食品安全国家标准GB 7101-2015[17]及GB 29921-2013[18],对产品中的大肠杆菌、霉菌、金黄色葡萄球菌等进行计数。
2 结果与分析
2.1红曲霉发酵
采用红曲霉进行发酵,一方面是利用其产生的淀粉酶将植物所含淀粉进行降解,利于后续发酵微生物的吸收转化,提高原材料的转化率;另一方面红曲霉发酵过程中可产生红曲色素[19]、Monacolin K[20]及γ-氨基丁酸(GABA)[21]等有益活性物质,可大大提高发酵液的营养价值,相对于单纯酶水解具有较大的优势。实验结果如图2所示。

图2 红曲霉发酵过程中发酵液中淀粉酶含量变化Fig.2 Changes of amylase content during Monascus fermentation process
由图2可知:红曲霉在发酵起始第3 d淀粉酶活力的增加速度大幅加快,在第6 d达到顶峰,至第8 d后淀粉酶活力开始下降,因此,本实验选择红曲霉的发酵时间为8 d。
2.2发酵条件优化
乳酸菌是一类对人体有益的菌群,其代谢产物有有机酸、醇类及各种氨基酸等,不仅提高食品的营养价值,改善食品风味,还具有抑菌、助消化、防癌等功效[22-24];鲁氏接合酵母菌是酱油酿造主发酵期的增香酵母,可赋予发酵液醇香味,并具有耐酸、耐高渗特性[25-26]。贺银凤[27]通过对传统发酵产品开菲尔及内蒙酸马奶酒的研究发现,酵母菌和乳酸菌之间有共生关系。因此,本实验采用乳酸菌、酵母菌复合菌种发酵来改善原料营养和口感。此外,发酵过程会产生一定量的乙醇,故发酵后期采用醋酸菌进行乙醇的转化,保证饮料的质量。
2.2.1 海藻提取液与植物提取液配比的选择 海藻具有特殊气味,其含量高低直接影响发酵液的口感。由图3可知,当海藻提取液与植物提取液比例为1∶2时,发酵液感官评分最高,因此优选发酵液配比为1∶2。

图3 海藻提取液与植物提取液配比的选择Fig.3 Selection of the proportion of seaweed extracts and plant extracts
2.2.2 起始发酵液可溶性固形物含量的选择 当可溶性固形物含量低时,发酵液口感较酸,含量过高时,乳酸菌在高糖渗透压的环境下生长会受到限制,从而影响产品的发酵,降低了产品的感官品质。由图4可知,当起始发酵液可溶性固形物含量为35%时,感官评分较高,因此优选可溶性固形物含量为35%。
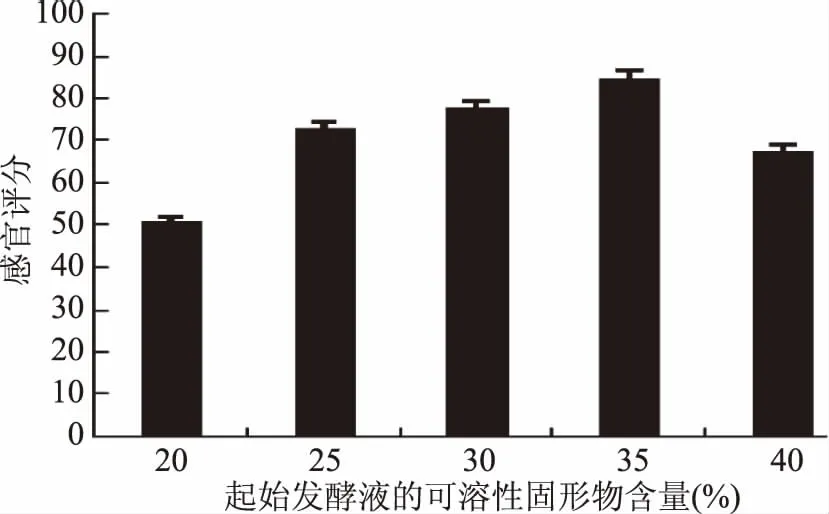
图4 起始发酵液可溶性固形物含量的选择Fig.4 Selection of soluble solids content of the initial fermentation broth
2.2.3 复合菌种接种量的选择 由图5可知,在一定范围内,随着接种量的增加,乳酸菌和酵母菌产物逐渐增加,产品感官品质逐步提升,超过此范围后,发酵液感官品质受接种量的影响较小,原因可能是乳酸菌和酵母菌大量增殖,各产物也随之增加,当乳酸和乙醇增加到一定程度后会对菌种产生一定的抑制作用[28],致使后期发酵缓慢甚至停止。由于接种量在一定范围内对产品感官品质影响较小,因此,该因素不参与后续的正交优化实验。结合成本,本实验优选接种量为5×107CFU/mL。
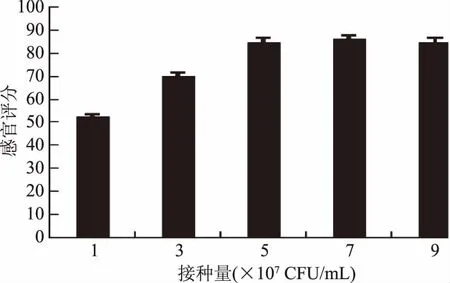
图5 复合菌种接种量的选择Fig.5 Selection of compound bacteria inoculation amount
2.2.4 乳酸菌和酵母菌接种量配比的选择 由图6可知,当乳酸菌和酵母菌接种数量比例为15∶1时,发酵液感官评分较高,比例低时,乳酸菌发酵产物少,发酵液酸度不够,影响感官品质;比例较高时,酵母菌增殖缓慢,产物少,降低了产品风味,最终发酵液缺乏醇香及酯香味[29],因此,实验选择最佳接种量比例为15∶1。

图6 乳酸菌和酵母菌接种量比例的选择Fig.6 Selection of the proportion of Lactobacillusand yeast
2.3正交实验
由表3的极差分析可知,各因素对感官评价的影响顺序为A>B>C,即海藻提取液与植物提取液配比>起始发酵液可溶性固形物含量>乳酸菌和酵母接种量配比;根据各因素水平之和的大小,可以得出最优设计方案是A2B2C3,即海藻提取液与植物提取液配比为1∶2,起始发酵液可溶性固形物含量为35%,乳酸菌和酵母菌的接种比例为15∶1,在此最优组合条件下,发酵液的感官评分达到了93.3。在此条件下,发酵2 d后发酵液pH和残糖含量均不再下降,接着进行醋酸菌的发酵。
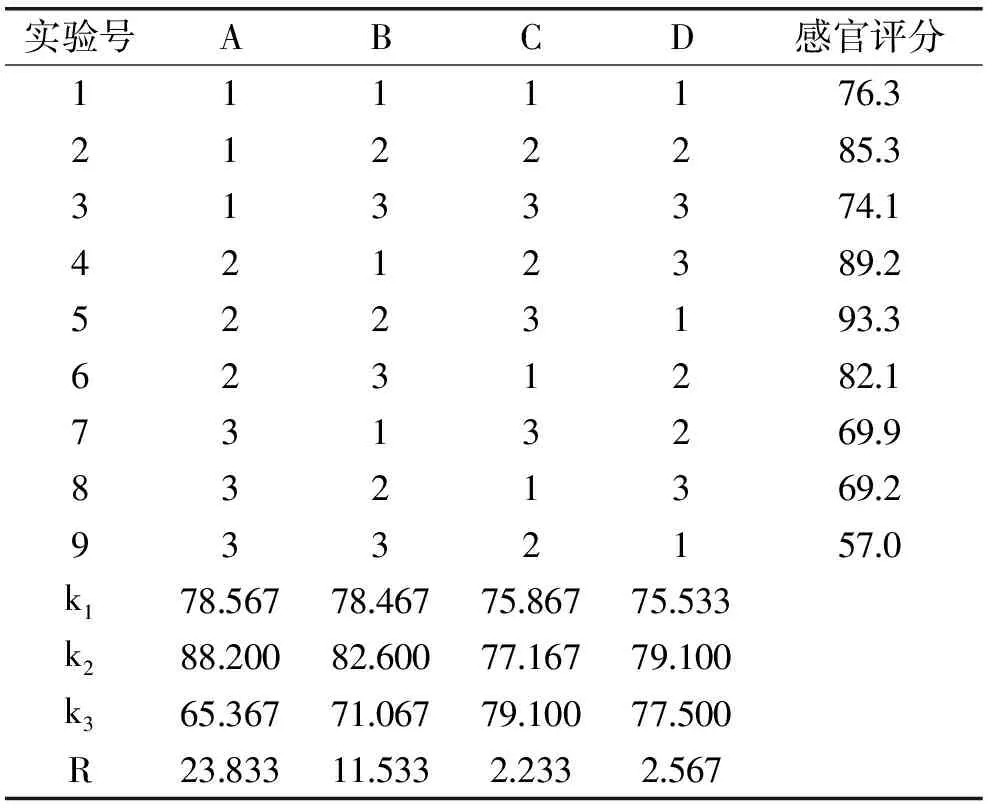
表3 正交实验结果Table 3 The result of orthogonal test
通过表4方差分析表可以看出,SA>SB>SC,因此三个因素对产品感官品质的影响大小顺序为A>B>C。由于FA>F临界值>FB>FC,所以因素A对产品的感官品质影响较显著,而因素B和C的影响不显著。
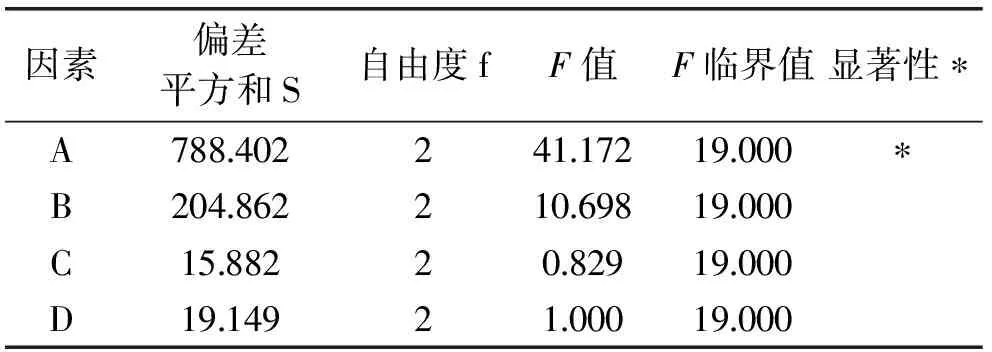
表4 正交实验方差分析表Table 4 The anova table of orthogonal test
注:显著性水平α=0.05。
2.4醋酸菌发酵时间的确定
由图7可知,醋酸菌发酵至8 d后,乙醇含量几乎不再变化,至第9 d乙醇含量已降至0.5%,因此选择醋酸菌发酵时间为9 d。
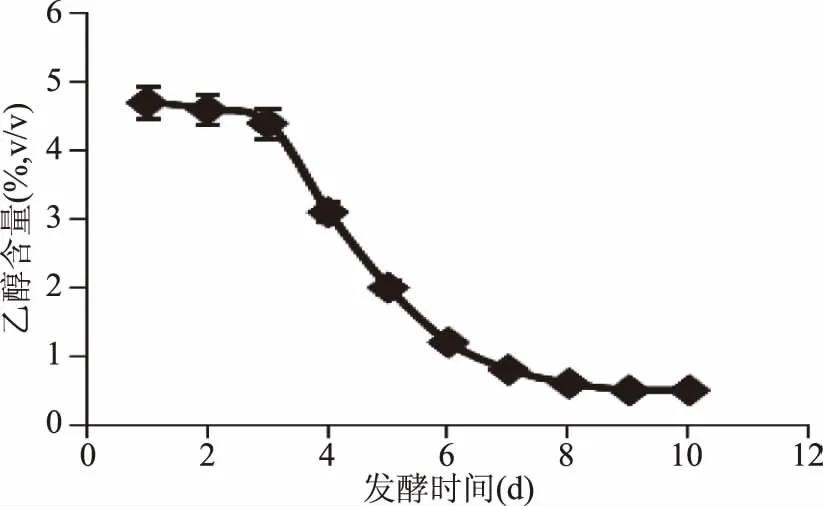
图7 醋酸菌发酵过程中乙醇含量的变化Fig.7 Changes of alcohol during acetic acid bacteria fermentation process
2.5饮料的理化指标及微生物指标
2.5.1 饮料的理化指标 由表5可知,原料经过分步发酵、后熟及过滤,发酵液饮料的最终可溶性固形物含量为33.6%,乳酸含量418 mg/L,乙酸含量1143 mg/L,pH为3.25,有利于产品的长期保存。
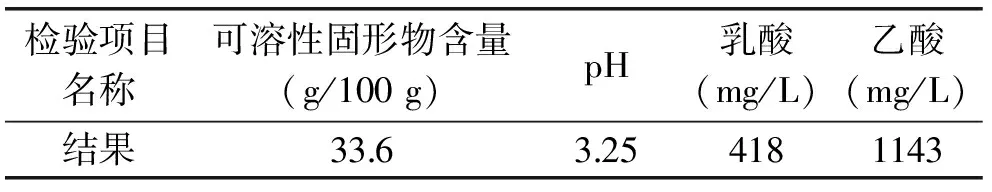
表5 饮料的理化指标Table 5 Physical and chemical index of the beverage
2.5.2 饮料的微生物指标 依据食品安全国家标准GB 7101-2015及GB 29921-2013,对海藻植物发酵液饮料进行微生物检验计数,未发现大肠菌群、霉菌及其他致病菌的存在。
3 结论
实验根据原料性质及发酵菌种特性进行分步发酵,即依次进行红曲霉发酵、复合菌种发酵、醋酸菌发酵,确保每种菌种皆能在有效时间内分解、转化出特定的营养元素,提高了原料的利用率。生产过程易于控制,产品质量稳定可控,与传统发酵工艺(发酵时间6个月甚至1年以上)相比大大缩短了发酵时间。此外,微生物发酵过程中会产生乳酸、醋酸及其他有益代谢产物,在增加海藻营养价值的同时还能改善海藻特有的腥味,为海藻资源的深加工开辟了新的途径。
[1]沈婷婷. 居住在海洋中的光合生物-海藻[J]. 海洋世界,2013,38(6):38-41.
[2]Tibbetts S M,Milley J E,Lall S P. Nutritional quality of some wild and cultivated seaweeds:Nutrient composition,total phenolic content andinvitrodigestibility[J]. Journal of Applied Phycology,2016,28:1-11.
[3]吕钟钟. 海藻复合膳食纤维的制备及其生物活性研究[D].青岛:中国海洋大学,2009.
[4]徐中平,腾照军,王波,等. 我国海藻生产与加工利用的现状·存在问题及发展策略[J]. 安徽农业科学,2012,39(30):14961-14963.
[5]郭莹莹,尚德荣,赵艳芳,等. 青岛海藻产业发展的现状及思路[J]. 中国渔业经济,2011,29(5):80-85.
[6]韩立民,白园园,于会娟. 我国海藻产业发展思路与模式选择研究[J]. 中国海洋大学学报(社会科学版),2016,28(6):1-6.
[7]Prado F C,Parada J L,Pandey A,et al. Trends in non-dairy probiotic beverages[J]. Food Research International,2008,41(2):111-123.
[8]Nosrati R,Hashemiravan M,Talebi M. Fermentation of vegetables juice by probiotic bacteria[J]. International Journal of Biosciences,2014(4):171-180.
[9]李琎杰,刘顺生. 紫红曲霉产生淀粉酶的优化研究[J]. 食品安全导刊,2015,30(8):124-126.
[10]全国文献工作标准化技术委员会第七分委员会.GB 4789.35-2010.中国标准书号[S]. 北京:中国标准出版社,2010.
[11]全国文献工作标准化技术委员会第七分委员会. GB 4789.15-2010.中国标准书号[S]. 北京:中国标准出版社,2010.
[12]魏长庆,王海庆,张凌,等. 葡萄果醋发酵用醋酸菌的分离及鉴定[J]. 中国酿造,2010,29(4):42-45.
[13]赵光远,梁晓童,陈美丽,等. 红枣酵素饮料的研制[J]. 食品工业,2015,36(9):124-128.
[14]郭利美,马美范. 饮料酒中酒精含量的分析方法研究[J].齐鲁工业大学学报,2008,22(3):14-17.
[15]王绍树. 影响软饮料感官质量的因素[J]. 饮料工业,1993,5(2):48-50.
[16]冯向东. 高效液相色谱法测定白酒中乳酸和乙酸含量[J]. 酿酒科技,2009,37(5):115-116.
[17]全国文献工作标准化技术委员会第七分委员会. GB 7101-2015.中国标准书号[S]. 北京:中国标准出版社,2015.
[18]全国文献工作标准化技术委员会第七分委员会. GB 29921-2013.中国标准书号[S]. 北京:中国标准出版社,2013.
[19]王金字,董文宾,杨春红,等. 红曲色素的研究及应用新进展[J]. 食品科技,2010,35(1):245-248.
[20]Huang C H,Shiu S M,Wu M T,et al. Monacolin K affects lipid metabolism through SIRT1/AMPK pathway in HepG2 cells[J]. Archives of Pharmacal Research,2013,36(12):1541-1551.
[21]Tillakaratne N J,Medinakauwe L,Gibson K M. gamma-Aminobutyric acid(GABA)metabolism in mammalian neural and non-neural tissues[J]. Comparative Biochemistry & Physiology Part A Physiology,1995,112(2):247-263.
[22]Alvarezsieiro P,Montalbanlopez M,Mu D,et al. Bacteriocins of lactic acid bacteria:extending the family[J]. Applied Microbiology and Biotechnology,2016,100(7):2939-2951.
[23]Khem S,Meng W W,Small D M,et al. Agent selection and protective effects during single droplet drying of bacteria[J]. Food Chemistry,2015,166:206-214.
[24]夏九学,汪欣,姜甜,等. 乳酸菌及其乳酸菌发酵食品[J].食品工业科技,2016,37(20):39-45.
[25]宋江. 酱油酿造用鲁氏接合酵母菌的生长及其产香气成分研究[D]. 长沙:湖南农业大学,2013.
[26]Wei Y,Wang C,Wang M,et al. Comparative analysis of salt-tolerant gene HOG1 in a Zygosaccharomyces rouxii mutant strain and its parent strain.[J]. Journal of the Science of Food & Agriculture,2013,93(11):2765-2770.
[27]贺银凤. 传统发酵乳制品中乳酸菌和酵母菌的互作关系[J]. 中国乳品工业,2010,38(10):43-45.
[28]朱敏. 乙醇胁迫对乳酸杆菌代谢活力及膜结构的影响[D]. 石河子:石河子大学,2015.
[29]徐亚杰,姜海波,逯家富. 酵母自溶的原因及防控措施[J]. 酿酒,2010,37(4):58-60.
Developmentoffermentedseaweed-plantsbeverage
YUPei-pei1,FANGXiao-xian1,HEXin-ping2,WUBin-bin2,HUMei3,LIANGYan2,YANBin1,*
(1.Shenzhen Zhongke Taifu Technology Co.,Ltd.,Shenzhen 518131,China; 2.Shenzhen Institutes of Advanced Technology Chinese Academy of Sciences,Shenzhen 518055,China; 3.Shandong Institute for Food and Drug Control,Ji’nan 250101,China)
Kelp,laver,spirulina,fruits and vegetables were used as materials in this paper. The mixture of seaweed with some starchy plants extracts and other plants extracts was fermented in turn byMonascuspurpureusWent,compound bacteria and acetic acid bacteria. After aging and filtration,a good-taste beverage was manufactured. Experimental results showed that the fermentation time of the three fermentation stages was 8,2,9 days. The other fermentation conditions optimized by single-factor and orthogonal test were:seaweed extract to plants extract ratio was 1 to 2,soluble solids content of the initial fermentation broth was 35%,inoculation amount of compound bacteria was 5×107CFU·mL-1,lactobacillus to yeast ratio was 15∶1. Under all these conditions the microbial index of the beverage accorded with the national standards and the final soluble solids level was 33.6%,pH was 3.25,lactic acid and acetic acid content was 418 mg·L-1and 1143 mg·L-1and ethanol content was below 0.5%. The process with good texture product was easy to operate which would serve as a model for solving the problem of low utilization efficiency with seaweed.
seaweed;plants;fermentation;MonascuspurpureusWent;Lactobacillus;Zygosaccharomycesrouxii(Saito)Lodd;acetic acid bacteria
2017-04-07
于配配(1987-),女,硕士研究生,研究方向:微生物工程和食品发酵,E-mail:ypeipie212@163.com。
*
晏斌(1962-),男,博士,研究员,研究方向:微生物学和生物信息学,E-mail:yanbin14@hku.hk。
深圳市科技计划项目(CXZZ20150422152108120)。
TS255.3
B
1002-0306(2017)21-0224-06
10.13386/j.issn1002-0306.2017.21.044
