清咽润喉双华李凉果的研制及功效评价
2017-11-21,,,,,,
,, ,,,,
(华南农业大学食品学院,广东广州 510642)
清咽润喉双华李凉果的研制及功效评价
宋倩,周爱梅*,王爽,胡燕敏,方琼谜,李雪娜,林春秀
(华南农业大学食品学院,广东广州 510642)
本文以双华李果胚为原料,采用响应面优化四种中草药(金银花、甘草、胖大海、薄荷)提取浓缩液的复配比,结合凉果传统加工工艺研发一种具有清咽润喉功效的双华李凉果,以脂多糖(LPS)诱导的RAW264.7小鼠巨噬细胞为模型,通过对炎症因子(TNF-α、IL-lβ、IL-6、PGE2、NO)分泌的影响评价其清咽润喉效果。结果表明,四种中草药提取浓缩液的最佳复配浓度分别为:金银花56 mg/mL、甘草59 mg/mL、胖大海61 mg/mL、薄荷105 mg/mL。在炎症反应中,一定浓度的样品均能使炎症因子TNF-α、IL-lβ、IL-6、NO的分泌显著降低(p<0.05),而对PGE2的分泌没有显著性影响(p>0.05);当浓度达到为50 mg/L时的抑制抑制作用最强,对TNF-α、IL-lβ、IL-6、NO的抑制率分别为54.42%、69.14%、38.50%、27.17%,说明研制的双华李凉果能够抑制炎症因子的分泌,具有清咽润喉功效。
双华李,凉果,中草药提取液,脂多糖,抑制炎症
凉果是以果蔬等为主要原料,经腌制、漂洗、糖(蜜)熬煮或浸渍,添加或不添加食品添加剂和其他辅料,经晾晒(烘干)等干燥处理加工而成的干态或半干态制品[1]。广式凉果深受消费者喜爱[2],而双华李含有大量的矿物质、维生素、有机酸等,营养成分种类非常丰富,是制作广式凉果的主要生产原料之一[3]。近年来,具有一定保健功能的新型凉果成为研究热点[4-6],而日趋严重的环境污染使越来越多的人患有咽喉病[7],因此清咽润喉功能性凉果的研究具有积极意义。而传统的清咽润喉凉果类产品,如黄皮[8]、李子等,功效并不显著,且产品经糖渍后会极大掩盖原料的固有功效。
因此本实验以双华李果为原料,添加国家食品药品监督管理局(SFDA)批准的具有清咽润喉功能的金银花、甘草、胖大海、薄荷提取液,研发一种具有清咽润喉功效的双华李凉果,并采用RAW264.7巨噬细胞模型评价其对炎症因子TNF-α、IL-lβ、IL-6、PGE2、NO分泌的影响,一方面可以丰富凉果市场,另一方面又可以丰富保健食品市场,为消费者提供更多选择。
1 材料与方法
1.1材料与仪器
硫藏双华李果胚、金银花、甘草根、胖大海、薄荷 广东展翠食品有限公司提供;金黄色葡萄球菌、乙型链球菌、肺炎双球菌 广东省微生物菌种保藏中心;RAW264.7小鼠单核巨噬细胞白血病细胞 中国科学院典型培养物保藏委员会昆明细胞库;亚硝酸钠、二甲基亚砜、DMEM培养基、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、胎牛血清、二甲亚砜(DMSO)、青霉素、链霉素 由Sigma公司提供;Mouse TNF-α、IL-1β、IL-6、PEG2ELISA试剂盒 南京建成公司;柠檬酸 市售分析纯;糖 市售食品级白糖。
EZ-SX500N质构仪 岛津企业管理(中国)有限公司;EnSpire酶标仪 PerkinElmer公司;LDZX-40B型立式自控电热蒸汽灭菌器 上海申安医疗器械厂;SWCJ-A超净工作台 上海浦东荣丰科学仪器有限公司;LRH系列生化培养箱 上海一恒科技有限公司;恒温水浴锅 上海精密科学仪器有限公司。
1.2实验方法
1.2.1 双华李凉果的制备 双华李凉果的制作工艺流程:硫藏双华李果胚→脱盐→脱硫→硬化→扎孔→第一次渗糖→第二次渗糖→第三次渗糖→第四次渗糖→干燥→成品(关键控制点为脱硫、渗糖、干燥)[10]。
清洗:选用饱满、大小均一的硫藏双华李果胚,清洗干净。
脱盐:将果胚在清水(自来水)中浸泡20 h进行脱盐。
脱硫:将果胚置于4%的柠檬酸液中于90 ℃下烫漂15 min[11](质量比1∶5)。
硬化:将果胚置于硬化液(0.5% NaCl、0.2%柠檬酸、0.5%CaCl)中进行硬化5 h(质量比3∶1)。
第一次渗糖:将四种中草药(金银花、甘草、胖大海、薄荷)提取浓缩液(100 mg/mL)、蔗糖、甜味剂与水混合得到糖液(金银花,56 mg/mL;甘草,59 mg/mL;胖大海,61 mg/mL;薄荷,105 mg/mL;蔗糖浓度,15%;甜菊糖,0.15 g/kg,其中中草药浓度为渗糖溶液中最终质量浓度),将糖液与果胚(质量比3∶1)一起于90 ℃下加热煮制,进行第一次渗糖,煮至糖液浓度约为20%左右(糖度计测定),浸泡24 h。
第二次渗糖:在第一次渗糖的基础上,加入蔗糖使糖液浓度为30%左右(糖度计测定),浸泡24 h,进行第二次渗糖。
第三次渗糖:在第二次渗糖的基础上,加入蔗糖使糖液浓度为40%左右,浸泡48 h,进行第三次渗糖。
第四次渗糖:在第三次渗糖的基础上,加入蔗糖使糖液浓度为45%左右,浸泡48 h,进行第四次渗糖。
干燥:将渗糖后的双华李果在55 ℃的恒温干燥箱中干燥至水分含量为25%左右取出,放于密闭的容器中储存。
1.2.2 四种中草药提取浓缩液最佳复配浓度的确定 前期单因素实验的基础上,以金黄色葡萄球菌、乙型链球菌、肺炎双球菌为供试菌,以抑菌圈大小为指标,根据单一中草药提取浓缩液的抑菌效果选取三个水平,利用响应面中的中心组合设计法设计这四种中草药之间协同抑菌实验,研究这四种草药之间的协同作用。因素水平表见表1。

表1 因素水平表Table 1 Factors and levels table
1.2.3 加权评分计算 根据细菌引起咽喉炎的影响程度,将金黄色葡萄球菌、乙型链球菌、肺炎双球菌的权重设为30、40、30,计算公式如下:
Y(加权评分)=d1/d1max×30+d2/d2max×40+d3/d3max×30
其中,d1为提取液对金黄色葡萄球菌的抑菌圈大小;d2为提取液对乙型链球菌的抑菌圈大小;d3为提取液对肺炎双球菌的抑菌圈大小;d1、d2、d3均为平均值。
1.2.4 抑菌实验方法 中草药提取浓缩液的制备采用水提法提取中草药,准确称取10 g中草药,加入20 mL蒸馏水,至于恒温水浴锅提取4 h,过滤(其中,中草药的最佳提取条件为:胖大海和甘草的料液比为1∶30 (g/mL),最适温度为70 ℃;金银花的料液比为1∶25 (g/mL),最适温度为70 ℃;薄荷的料液比为1∶30 (g/mL),最适温度为90 ℃)。将滤液60 ℃下旋转蒸发浓缩液至10 mL(若少于10 mL,加蒸馏水补足至刻度),作为母液(1 g生药/mL),过0.2 μm滤膜除菌无菌密封4 ℃保存。在无菌工作台中,将已灭菌的营养琼脂培养基加热到完全融化,倒在培养皿内,每皿约15~20 mL,凝固后用马克笔标记牛津杯摆放位置。吸取100 μL已稀释好后的菌悬液(107~108cfu/mL)打入凝固好的培养基表面,用无菌涂布棒将菌液涂布均匀,待培养基表面菌液干透后,在培养基表面垂直摆放牛津杯,轻轻加压,使其与培养基接触无空隙。在杯中加入已稀释的中草药提取浓缩液(100 mg/mL)200 μL,在37 ℃恒温培养箱中培养16~18 h后取出用游标卡尺量取抑菌圈直径。以无菌水作空白对照,以山梨酸钾溶液(0.12 g/mL)作阳性对照[12]。
1.2.5 双华李凉果指标测定
1.2.5.1 感官评分 根据响应面结果优选三组中草药复配比进行凉果制备,分别对其进行感官评分[13],筛选最佳复配比成分,感官评分见表2。
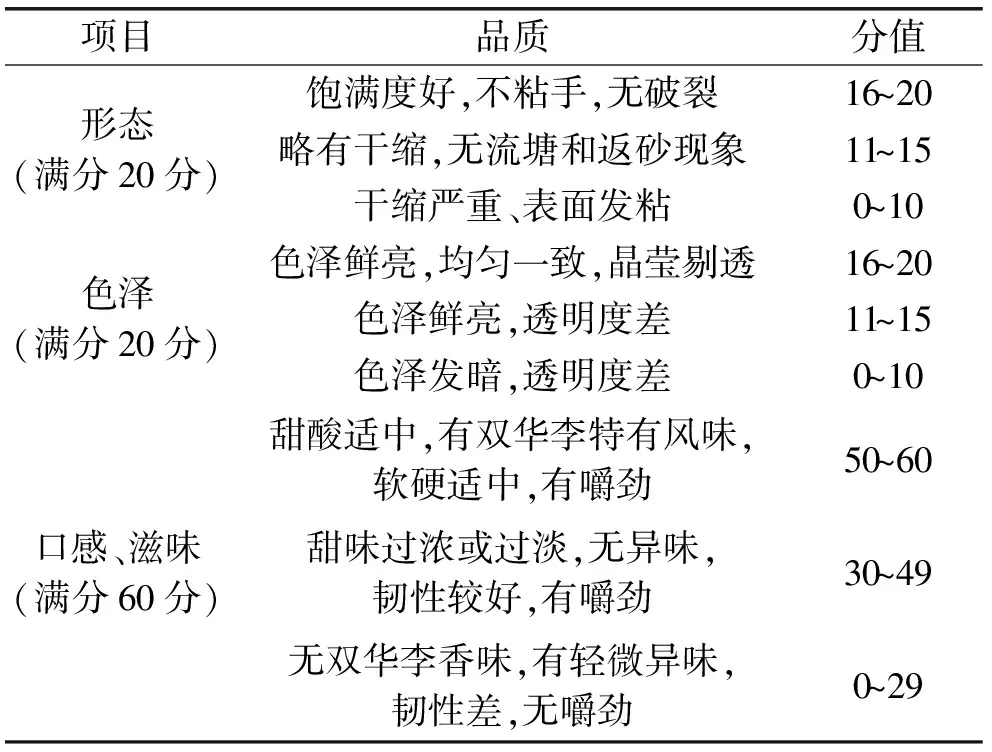
表2 感官评定方法Table 2 Sensory assessment method
1.2.5.2 颜色测定 采用全自动测色色差仪检测果胚褐变情况[14]。其中L*表示样品亮度,a*代表样品红绿程度,b*表示样品黄蓝程度。
1.2.5.3 质构测定 采用EZ-SX500N质构仪测定,测定条件为,探头型号:A/W EG;测前速率:1 mm/s;测试速率:2 mm/s;测后速率:5 mm/s;下压距离:5 mm;触发力大小:5 g。以最大剪切力(g)表示样品硬度[15]。
1.2.6 双华李凉果清咽润喉功效的评价
1.2.6.1 双华李凉果提取液的制备 取制备的双华李凉果样品1 g置于100 mL蒸馏水中,在50 ℃条件下进行磁力搅拌5 h,离心(5000 r/min,15 min)收集上清液,稀释成不同浓度(0.1、10、50、100、200、400、500 mg/L)进行细胞实验。
1.2.6.2 细胞培养 所用细胞为小鼠巨噬细胞RAW264.7细胞系,于DMEM完全培养基中,置于5% CO2、37 ℃培养箱中传代培养。细胞生长至70%~80%融合后进行传代,1~2 d换一次培养液,4~6 d传代一次[16-17]。所用操作均为无菌操作。
1.2.6.3 双华李凉果提取液的细胞毒性 取对数生长期的RAW264.7细胞,用DMEM培养基调整细胞浓度,以每孔1×105个细胞接种到96孔板,每孔体积200 μL。37 ℃、5% CO2条件下培养24 h,更换培养基,加入不同浓度的双华李凉果提取液共同培养18 h。培养结束后,每孔加入5 mg/mL MTT试剂20 μL继续孵育4 h,弃上清后每孔加入150 μL DMSO并振荡30 min溶解沉淀[17-18]。酶标仪570 nm波长处测定各孔吸光值(OD值),以无细胞仅含培养基的孔作为空白,以正常细胞孔为对照,以含样品的孔为样品组,通过以下公式计算得到相对活性:
1.2.6.4 双华李凉果提取液对PGE2、IL-6、IL-1β、TNF-α炎症因子分泌的影响 将对数生长期RAW264.7细胞以1×105/孔的浓度接种于12孔板,每孔体积2 mL。置于37 ℃、5%CO2条件下培养24 h。将RAW264.7细胞随机分为对照组,双华李样品组(200,100,50,10,0.1 mg/L),LPS组(1 mg/L)和LPS(双华李组,继续培养24 h后收集细胞培养上清液,依小鼠PGE2、IL-6、IL-1β、TNF-α的ELISA试剂盒说明书测定含量。各炎症因子标准曲线为:TNF-α,y=0.0013x+0.0373(R2=0.9990);IL-1β,y=0.003x-0.021(R2=0.9994);IL-6,y=0.0029x+0.1023(R2=0.9975);PGE2,y=0.0043x+0.079(R2=0.9948)。
1.2.6.5 双华李凉果对NO炎症因子分泌的影响 于96孔板中,每孔加RAW264.7细胞悬液(1.0×105cells/mL)100 μL,置于37 ℃、5% CO2培养箱孵育2 h,弃去培养液,加入含不同浓度药物的新鲜完全培养液100 μL(阳性对照不加药),继续培养2 h后,加入含LPS的完全培养液使终浓度为1 mg/mL。37 ℃、5% CO2培养箱中培养24 h后,将细胞上清液转移至另一96孔细胞培养板,各孔加入Griess A和Griess B混合试剂(1∶1)100 μL,暗处避光反应10 min,于540 nm处测定OD值[19]。根据标准曲线(y=0.0048x+0.0028,R2=0.9997)计算待测样品中NO含量。
1.3数据统计分析
实验数据采用Origin 8.5软件作图,SPSS Statistics 17.0.1软件进行方差分析。
2 结果与分析
2.1四种中草药提取浓缩液最佳复配浓度的确定
实验结果见表3。结果显示,利用Design-Expert8.0.6程序对30个实验点的响应值进行回归拟合,以加权分为指标得到二次多项回归模拟方程为:
Y=65.72-2.13A-1.76B-2.54C-1.94D+2.41AB+2.60AC+2.02AD+0.82BC+0.60BC+2.40CD-0.87A2+4.42B2+3.68C2+0.68D2

表3 响应面实验设计及结果Table 3 Response surface experimental design and result
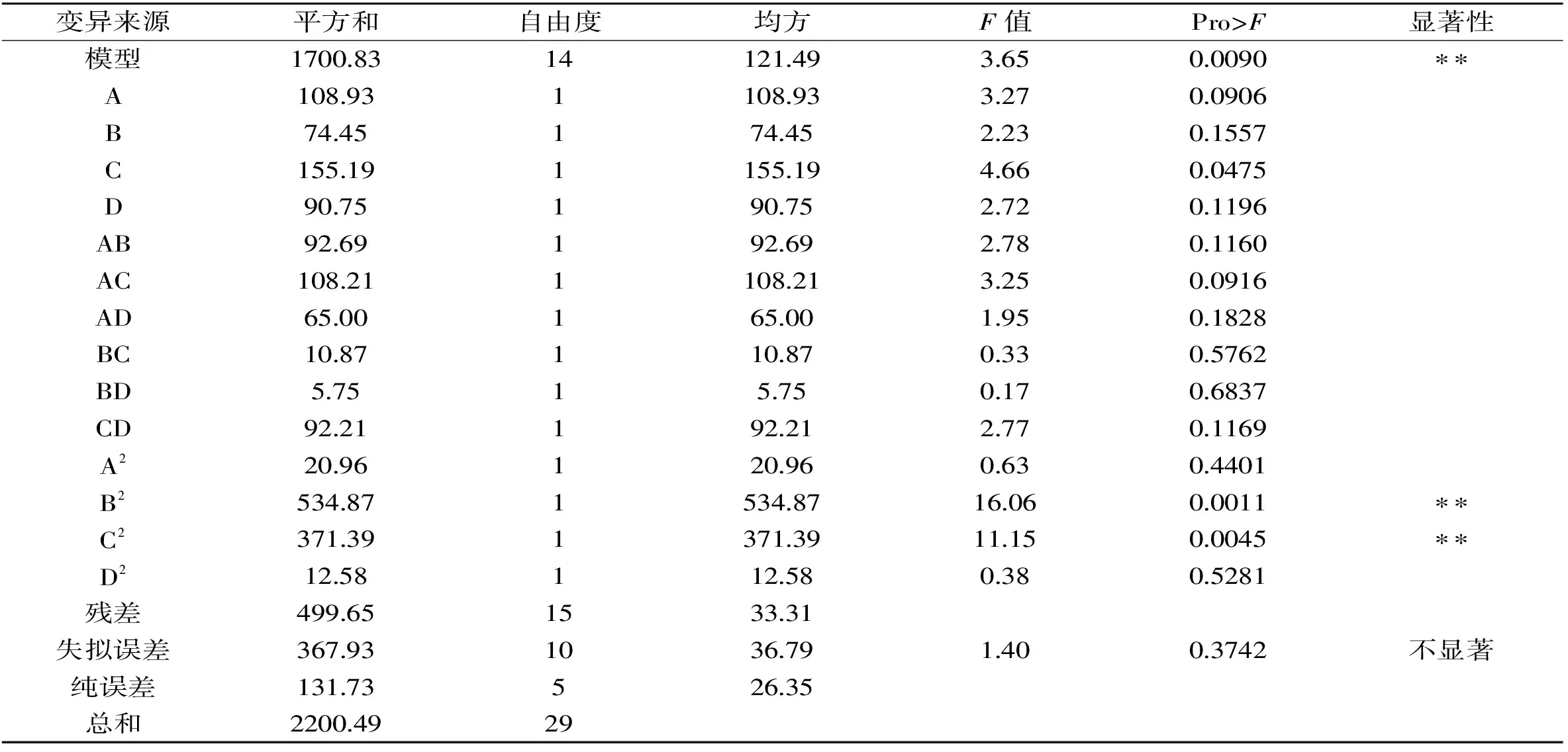
表4 回归系数模型及方差分析Table 4 Regression coefficient model and variance analysis
注:*代表0.05水平显著;**代表0.01水平显著。
由表4的分析结果可知,整体模型的“Prob>F”值为0.0090,表明模型的拟合度较好,能较好的对响应值进行预测。表中各个因素的F值越大表明该因素对抑菌效果的影响越显著,各中草药提取浓缩液对复配后抑菌效果的影响大小为:胖大海>金银花>薄荷>甘草。同时,回归方程的二次项B2和C2对复配抑菌效果均有极显著影响,表明各因素对响应值不是简单的线性关系,而是呈二次关系。
对所建立的数学模型进行分析,得到的四种中草药提取浓缩液的最佳复配浓度为:金银花为87.13 mg/mL、甘草为92.31 mg/mL、胖大海为52.02 mg/mL、薄荷为88.92 mg/mL,预测可得到复配后的抑菌加权分为92.84。为了检测RSM的实验结果可靠性,根据以上实验结果进行了验证。考虑实际操作性,调整各中草药提取浓缩液的浓度为:金银花为87 mg/mL、甘草为92 mg/mL、胖大海为52 mg/mL、薄荷为89 mg/mL,测得该条件下四种中草药复配后抑菌加权分为91.63(对三种供试菌的抑菌圈直径分别为16.92、15.32、14.87 mm),抑菌加权评分为结果与模型预测得很接近。
考虑到制备的凉果成品还需要保证外观和口感,因此另优选其它两组复配比(响应面预测的较高评分组)和最优复配比(记为复配组1)进行感官评分对比,以确定最终的四种中草药的复配比,所优选的另外两组分别记为复配组2(金银花56 mg/L、甘草59 mg/L、胖大海61 mg/L、薄荷105 mg/L)、复配组3(金银花95 mg/L、甘草59 mg/L、胖大海52 mg/L、薄荷116 mg/L)。
2.2三组双华李凉果样品的感官评分及质构对比
表5结果显示,三组样品感官评分有显著性差异(p<0.05),其中复配组1的感官评分均比复配组2和组3低,样品组2和组3的感官评分没有显著性差异(p>0.05),分别为81和83。
三组样品凉果在硬度、弹性上没有显著差异(p>0.05),但在色泽方面,样品组1的L*值和b*值均比样品组2和组3低,而样品2和3之间没有显著性差异(p>0.05),说明样品1颜色整体较暗,分析原因是由于样品1中加入的甘草提取液含量比其他两组高,所以导致凉果果胚颜色较暗。

表5 三组双华李样品组的质构及色泽Table 5 The texture and color of the three groups
根据以上对三组双华李凉果样品的感官评分、质地以及色泽方面的分析,确定复合组2为四种中草药提取浓缩液的最佳组合,在此基础上结合凉果的传统加工工艺制备出清咽润喉双华李凉果,并进行抗炎活性评价。
2.3RAW264.7巨噬细胞细胞生长状态
RAW264.7巨噬细胞是贴壁生长的细胞,当细胞重悬后于培养液中呈现透明状,椭圆形;传代2~4 h后开始贴壁,8 h以后大部分细胞贴壁,细胞生长很快,在倒置显微镜下观察,可见细胞形态以类圆形和不规则多边形为主,少量有伪足。从图1中可以看到细胞之间紧密连接,并且贴壁很紧,此时细胞生长状况良好。
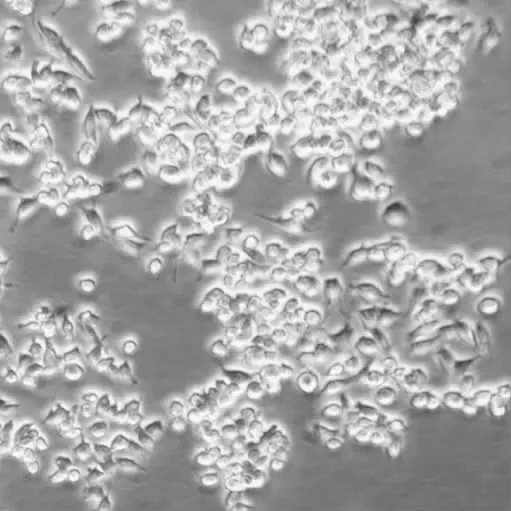
图1 RAW264.7细胞,细胞生长状况(100×)Fig.1 RAW264.7 cells,cell growth status(100×)
2.4双华李凉果提取液的细胞毒性
采用MTT法检测细胞活性,用不同浓度(25,50,100,200,400,500 mg/L)双华李凉果提取液处理RAW264.7细胞,孵育18 h,结果如图2显示。图2表明,不同浓度的双华李凉果提取液处理RAW264.7细胞18 h后,以对照组细胞活性为100%作比较,样品在剂量400 mg/L内对细胞活性没有显著性差异(p>0.05),说明在此范围内所选的双华李凉果的浓度不影响RAW264.7细胞的增殖活性,对细胞无毒性作用。此结果为后续实验设计双华李凉果剂量组提供参考依据,由此可以说明后续实验中检测的结果,不是由细胞死亡引起,而是双华李凉果直接或间接抗炎作用的结果。

图2 双华李凉果样品对RAW264.7巨噬细胞毒性分析Fig.2 Effect of shuanghua preserved fruit on RAW264.7 macrophage toxicity
2.5双华李凉果提取液对PGE2、TNF-α、IL-lβ、IL-6、NO分泌的影响
图3为双华李凉果提取液对PGE2、TNF-α、IL-6、IL-lβ、NO几种炎症因子分泌的影响。图中结果所示,对于TNF-α、IL-6、IL-lβ、NO四种炎症因子,LPS诱导的模型组与空白组之间细胞炎症因子的分泌水平均有显著性差异(p<0.05),说明造模成功,与模型组对照,双华李凉果提取液一定浓度条件下均能够显著降低炎症因子的分泌水平(p<0.05),当双华李凉果提取液浓度为50 mg/L时对抑制TNF-α的分泌作用最强,抑制率达到54.42%;当浓度在50、200、400 mg/L时对IL-lβ的抑制率分别为32.93%、35.83%、38.50%,继续增加浓度后抑制效果不再显著增加(p>0.05);当浓度为50 mg/L时对IL-6的抑制作用最强,抑制率达到69.14%;当浓度增加到200 mg/L时,对NO的分泌有显著抑制作用(p<0.05),此时抑制率最大为27.17%。图3结果所示,LPS诱导的模型组与空白组之间的PGE2含量没有显著性差异(p>0.05),说明LPS刺激细胞后并没有引起PGE2的变化,但双华李凉果提取液浓度在200 mg/L时对细胞因子PGE2的分泌有显著抑制作用(p<0.05),抑制率为9.52%,其他浓度没有显著影响(p>0.05)。
在炎症反应中,与对照组相比,一定浓度下研制的双华李凉果提取液均能使炎症因子TNF-α、IL-lβ、IL-6、NO的分泌显著降低,而对PGE2的分泌没有显著性影响。综合几种对炎症因子的抑制作用,当双华李凉果提取液浓度在50 mg/L时对细胞整体炎症因子的抑制作用最强。在此最强抑制浓度下,对TNF-α、IL-lβ、IL-6、NO的抑制率分别为54.42%、69.14%、38.50%、27.17%,Choi,J[17]等人的研究中显示阳性抗炎药物吲哚美辛(3.58 mg/L)对于TNF-α、IL-lβ、IL-6、NO的抑制率分别为41.57%、44.33%、41.19%、35.15%,说明此双华李凉果具有较好的抗炎效果。
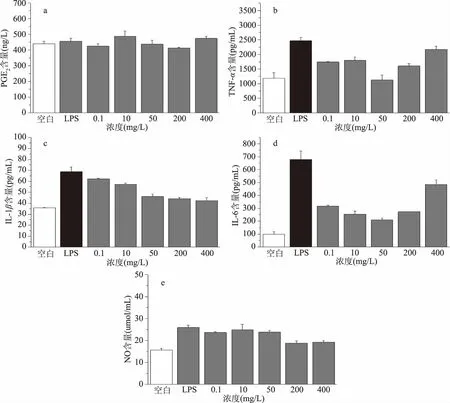
图3 双华李凉果提取液对LPS诱导的RAW264.7细胞分泌PGE2(a)、TNF-α(b)、IL-1β(c)、IL-6(d)和NO(e)的影响Fig.3 Effect of shuanghua preserved fruit on PGE2(a),TNF-α(b),IL-1β(c),IL-6(d)and NO(e)in LPS-induced RAW264.7 cells
3 结论
金银花、甘草、胖大海、薄荷四种中草药提取浓缩液的最佳复配浓度为:金银花56 mg/mL、甘草59 mg/mL、胖大海61 mg/mL、薄荷105 mg/mL,此时复配制备的凉果感官质量最好。采用LPS诱导的RAW264.7巨噬细胞为炎症模型中,双华李凉果样品在400 mg/L内对细胞的生长没有毒性。在炎症反应中,LPS诱导的巨噬细胞的炎症因子分泌量与空白组对照有极显著性增加,且一定浓度的样品均能使炎症因子TNF-α、IL-lβ、IL-6、NO的分泌显著降低,而对PGE2的分泌没有显著性影响,当双华李凉果提取液浓度达到50 mg/L时对细胞验证因子的抑制作用最强。在此最强抑制浓度下,对TNF-α、IL-lβ、IL-6、NO的抑制率分别为54.42%、69.14%、38.50%、27.17%,说明所研制的双华李凉果具有较好的抑菌抗炎效果。
[1]佚名. 广式凉果的加工工艺提升与安全控制技术研究及产业化[J]. 农业工程技术·农产品加工业,2013(8):33.
[2]戚桂军,马守海,陈宝芳,等. 果脯蜜饯的历史现状与发展趋势[J]. 粮食与食品工业,1998(1):33-35.
[3]吴继军,陈卫东,张友胜,等. 三华李酒生产工艺研究[J].酿酒,2006(2):74-75.
[4]陈舜京,林树杰. 潮安凉果封杀事件背后的思考[J]. 中国食品药品监管,2006(5):50-52.
[5]吕辰鹏,何泉泉,王丽斐,等. 清咽功能保健食品的研究进展[J].食品工业,2015(9):215-220.
[6]何凤林,刘晓娟,赵力超,等. 强化抗氧化性番薯干中茶多酚和葛根黄酮的热降解动力学研究[J]. 食品科技,2013(4):85-88.
[7]胡晓莉. 急性咽喉炎的发病特征及中西医结合护理对策[J]. 中药与临床,2013(4):37-38
[8]赵笑梅,黄苇,李远志. 低糖润喉黄皮果脯的研制[J]. 农产品加工(学刊),2013(7):36-39.
[9]焦镭,柴梦颖,石明生.十五种中草药及复配液的抑菌性及稳定性研究[J]. 农产品加工(学刊),2011(4):26-29.
[10]洪雁,李远志,卢昌阜,等.低糖益智果脯渗糖工艺影响因素研究[J]. 农产品加工(学刊),2012(11):93-95.
[11]宋倩,刘春花,王爽,等. 硫藏双华李柠檬酸烫漂脱硫工艺参数及其对品质的影响研究[J]. 食品工业科技,2016,37(19).
[12]陈志蓉,董银卯,孟宏,等. 10种中草药提取物对痤疮致病菌的体外抑菌活性研究[J]. 中医药学报,2011(6):24-27.
[13]傅锋,刘绍军,许高升,等. 红糖生姜果脯微波干燥工艺研究[J]. 食品研究与开发,2013(24):169-174.
[14]盛金凤,李丽,孙健,等.不同渗糖方式对芒果果脯品质及组织细胞的影响[J]. 现代食品科技,2014(6):202-206.
[15]黄苇,付光亮,李爱军,等. 超声波强化硫藏橄榄脱硫效果及工艺参数优化[J]. 食品科学,2009(12):43-47.
[16]Netea M G,van Deuren M,Kullberg B J,et al. Does the shape of lipid A determine the interaction of LPS with Toll-like receptors[J]. Trends in Immunology,2002,2(3):135-139.
[17]Choi J,Callaway Z,Kim H B,et al. The role of TNF-alpha in eosinophilic inflammation associated with RSV bronchiolitis[J]. Pediatr Allergy Immunol,2010,21(3):474-479.
[18]Desai A,Darland G,Bland J S,et al. META060 attenuates TNF-alpha-activated inflammation,endothelial-monocyte interactions,and matrix metalloproteinase-9 expression,and inhibits NF-kappaB and AP-1 in THP-1 monocytes[J]. Atherosclerosis,2012,223(1):130-136.
[19]Eliav E,Benoliel R,Herzberg U,et al. The role of IL-6 and IL-1beta in painful perineural inflammatory neuritis.Brain Behavior and Immunity[J]. Atherosclerosis,2009,23(4):474-484.
Preparationandevaluationofshuanghuaplumpreservedfruitwithqingyaneffect
SONGQian,ZHOUAi-mei*,WANGShuang,HUYan-min,FANGQiong-mi,LIXue-na,LINChun-xiu
(College of Food Science,South China Agricultural University,Guangzhou 510642,China)
With shuanghua plum being used as material,the optimum mixture ratio of the extract of four Chinese herbs was optimized by the response surface method using bacteriostatic testinvitro,prepared a functional preserved fruit with qingyan effect was prepared in combination with the traditional processing technology. LPS-induced RAW264.7 macrophage inflammatory model was adopted to determine the anti-inflammatory activity of shuanghua plum preserved fruit using inflammatory cytokines(TNF-α,IL-lβ,IL-6,PGE2,NO)as indicators. The results showed that the optimal combination ratio of the extract of the four herbs were honeysuckle 56 mg/mL,licorice 59 mg/mL,sterculia scaphigera 61 mg/mL and peppermint 105 mg/mL. In the inflammatory response,the samples at appropriate concentrations could decrease inflammatory cytokines(TNF-α,IL-lβ,IL-6,NO)significantly(p<0.05),while there was no significant effect on PGE2secretion(p>0.05). The strongest inhibitory effect of the extract of shuanghua plum preserved fruit was obtained at the concentration of 50 mg/L. Under this concentration,the inhibition rate against TNF-α,IL-l,IL-6 and NO was 54.42%,69.14%,38.50% and 27.17%,respectively,demonstrating the anti-inflammatory effect of the developed shuanghua plum preserved fruit by decomposing the inflammatory factors. This showed that the shuanghua plum preserved fruit can inhibit the secretion of inflammatory factors,with qingyan effect.
shuanghua plum;preserved fruit;the extract of Chinese herbs;lipopolysaccharide;anti-inflammation
2017-01-13
宋倩(1991-),女,硕士研究生,研究方向:果蔬加工研究,E-mail:songq0609@163.com。
*
周爱梅(1971-),女,博士,教授,研究方向:水产品及农产品深加工研究,E-mail:zhouam@scau.edu.cn。
广东省省部产学研结合项目(2013B090600003)。
TS255.1
B
1002-0306(2017)21-0174-07
10.13386/j.issn1002-0306.2017.21.035
