一株野生弯柄灵芝的鉴定与多糖、三萜含量的研究
2017-11-21,,,,
,, ,,
(福建农林大学菌物研究中心,国家菌草工程技术研究中心,福建福州 350002)
一株野生弯柄灵芝的鉴定与多糖、三萜含量的研究
赵丽丽,叶丽云,解凡,汤坤鹏,吴小平*
(福建农林大学菌物研究中心,国家菌草工程技术研究中心,福建福州 350002)
通过生物学特性比较和ITS测序比对对野生灵芝进行鉴定,并通过液体深层发酵培养和子实体有效成分分析对其多糖、三萜含量进行研究。结果显示,野生菌株属于Ganodermaflexipes(弯柄灵芝)。有效成分分析中,菌丝三萜含量(8.85 mg/g)和子实体三萜含量(9.67 mg/g)都显著高于参考菌株(p<0.05);发酵液多糖含量(6.59 mg/mL)极显著低于参考菌株(p<0.01),子实体多糖含量(23.70 mg/mL)极显著高于参考菌株(p<0.01),是参考菌株的2.56倍。子实体三萜HPLC指纹图谱显示,野生菌株三萜有效成分种类单一且含量少。说明野生菌株可以通过优化栽培技术来提取多糖。
弯柄灵芝,ITS测序,多糖,三萜,HPLC指纹图谱
我国灵芝人工栽培已有60多年的历史,野生灵芝资源有限,难以满足人们日益增长的需求,近年来灵芝的开发越来越受到人们的重视。我国的灵芝主栽品种大多引自韩国、日本等地,由于引进品种的产地自然气候和环境差异大,引起菌种活性退化、名称混杂、产量低、品质差、抗病虫害及杂菌能力差等情况,缺乏适宜我国各产地栽培的优良品种[1]。我国自主选育的灵芝专用品种较缺乏,有必要进行采集验证,发掘其他灵芝种的价值。
现代化学分析表明,灵芝含有丰富的生物活性物质,如多糖、三萜、蛋白质、多肽、核酸类、不饱和脂肪酸、生物碱、甾醇类、微量元素和维生素等[2]。灵芝多糖和灵芝三萜被认为是灵芝的主要药效成分,已知有119种灵芝三萜物质以及多种具有不同化学组成、结构和生物活性的灵芝多糖[3]。灵芝多糖具有降“三高”、抗癌、提高免疫调节作用等活性[4];灵芝三萜具有保肝、抑制肿瘤细胞以及抗艾滋病毒等活性[5]。三萜类可以分为灵芝酸、灵芝孢子酸、灵芝内酯、灵芝醇、灵芝醛、赤灵酸、灵赤酸、赤芝酮等10多种,其中灵芝酸为三萜类的主要活性成分[6]。
采用水提法结合醇提法提取多糖,苯酚-硫酸法进行检测;采用乙醇浸提结合超声法提取三萜,香草醛-冰醋酸法进行检测。分析该野生灵芝菌株多糖、三萜含量,以期为选育优质高产的灵芝菌株提供理论依据。
1 材料与方法
1.1材料与仪器
野生灵芝 采集自南平市顺昌县,分离方法参考邹莉等[7];参考菌株(分类号Ganoderma.5.0542) 来自中科院,是赤芝的一种,赤芝是常见的灵芝;固体PDA培养基 马铃薯200 g,琼脂20 g,葡萄糖20 g,蒸馏水1000 mL;液体PDA培养基 除不加琼脂外其余相同;LB固体培养基 胰化蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂20 g,蒸馏水1000 mL;LB液体培养基 除不加琼脂外其余相同;木屑培养基 木屑76%,麸皮20%,玉米粉3%,石膏1%;无水乙醇、苯酚、三氯甲烷、正丁醇、冰醋酸、高氯酸、香草醛、浓硫酸等 均为分析纯;灵芝酸A、赤芝酸A、灵芝酸C等 均为标准品;甲醇、乙腈 为色谱纯。
GSP-9160MB型生化培养箱 上海博迅实业有限公司医疗设备厂;ZHWY-2102型恒温培养振荡器 上海智城分析仪器制造有限公司;C1000型PCR仪 Bio-Rad;DYY-12型电泳仪 北京市六一仪器厂;TANON-2009型凝胶成像系统 上海天能公司;DHG-9240A型电热鼓风干燥箱 上海一恒科技有限公司;SB25-12DTDN型超声仪 宁波新芝生物科技股份有限公司;UV-1601型紫外可见分光光度计 北分瑞利分析仪器(集团)公司;LC-20ADXR型超快速分离液相色谱仪 日本岛津制作所。
1.2实验方法
1.2.1 灵芝菌株的生物学特性 供试菌株的菌落形态的比较和生长速率的测定参考叶丽云等[8]的方法。
1.2.2 ITS测序及比对
1.2.2.1 DNA的提取 参照傅俊生改良的CTAB法[9]提取供试菌株的总DNA。
1.2.2.2 ITS序列扩增及测序 采用ITS通用引物对供试菌株进行PCR序列扩增。ITS-PCR反应体系:10×Buffer 3 μL,dNTP 2 μL,ITS1和ITS4分别为1 μL,Taq DNA聚合酶0.3 μL,DNA模版1 μL,ddH2O 21.7 μL。ITS-PCR反应程序:94 ℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃ 10 min,4 ℃保存。1.0%琼脂糖凝胶电泳对ITS-PCR产物进行检测。
1.2.2.3 ITS-PCR产物的克隆测序 进一步与载体pMD 18-T Vector连接实验,将连接产物转化入大肠杆菌感受态细胞。挑选阳性转化子在100 μL LB液体培养基于37 ℃在200 r/min振荡培养3 h左右,按照ITS体系和程序经PCR验证后,阳性克隆子委托福州铂尚公司测序。
1.2.2.4 构建系统进化树 测定的序列结果在NCBI数据库中进行比对,选择在线BLAST分析,再选取nucleotide blast得到与测定序列相近的序列结果。于CLUSTXAL1.83软件将ITS序列进行对位排列并去掉两端差异部分,用MEGA 5.1软件采用最大似然法(Maximum Likelihood,ML)构建系统进化树[10]。
1.2.3 灵芝菌株的液体深层发酵
1.2.3.1 摇瓶培养 灵芝菌株的摇瓶培养参考汤坤鹏等[11]的方法。
1.2.3.2 生物量的测定 收集菌丝并除去接种块,蒸馏水反复洗涤3次,置于60 ℃烘箱中烘干至恒重。称量菌丝球干重,此为菌丝生物量。
1.2.3.3 发酵液多糖的提取与检测 提取方法为水提醇沉法[12]:用无菌水将菌丝冲洗至冲洗液澄清,将冲洗液和滤液合并。将合并液在60 ℃条件下真空浓缩,浓缩液中加入3倍体积的无水乙醇溶液,4 ℃醇沉24 h。然后将浓缩液离心(4000 r/min 8 min),收集沉淀,将沉淀物置于烘箱中,在60 ℃烘干至恒重,即灵芝发酵液多糖。发酵液多糖的检测采用苯酚-硫酸法[13]。每组 3个重复。
1.2.3.4 菌丝三萜的提取与检测 提取方法参考汤坤鹏的方法[11]:称取0.2 g灵芝菌丝体粉末,并加入30 mL的85%乙醇常温浸提2 h,然后进行超声提取0.5 h,功率为150 W。将滤液用旋转蒸发仪60 ℃减压蒸馏去除乙醇,最后用甲醇定容至25 mL。采用香草醛-冰醋酸法[14]测定菌丝三萜含量。
1.2.4 灵芝菌株的农艺性状 参考金珊珊[15]的实验方法进行灵芝栽培,选用37×22聚乙烯塑料袋,生物转化率(%)=(子实体重量/干料重量)×100[16]。记录供试菌株菌丝、子实体生长状况相关参数。
1.2.5 子实体有效成分分析
1.2.5.1 子实体多糖的提取及检测 提取方法[17]:精确称取灵芝干燥子实体粉末 2 g,加蒸馏水于90 ℃回流提取3 h,料液比为1∶50 (g/mL),提取后过滤,用旋转蒸发仪将提取液浓缩,定容至25 mL。吸取10 mL多糖溶液,加入80 mL无水乙醇,醇沉过夜(约12 h),5000 r/min离心10 min,将沉淀物用蒸馏水定容至25 mL。检测方法与发酵液多糖的检测相同。
1.2.5.2 子实体三萜的提取及检测 提取和检测方法与菌丝中三萜的提取和检测方法相同。
1.2.5.3 子实体三萜的HPLC图谱分析 提取液用0.45 μm的有机微孔过滤膜过滤备用,三萜的HPLC分析程序方法采用金珊珊[15]的方法。采用Inertsustain C18色谱柱,以0.1%乙酸水(A)和乙腈(B)的梯度洗脱系统,洗脱比例B浓度为:0~20 min:30%~40%;20~25 min:40%~55%;25~30 min:55%~65%;30~40 min:65%;柱温40 ℃,流速0. 8 mL/min,进样量10 μL,检测波长254 nm。
灵芝酸A标准样品图谱,精确称取4.0 mg的灵芝酸A晶体,用色谱级甲醇定容至50 mL,得到浓度为0.08 mg/mL的灵芝酸A标准液。按照以上方法对其进行HPLC分析。其他标准样品的分析同理。
1.3数据处理
实验中每个处理重复三次,数据分析采用Excel、SPSS DPS软件和中药色谱指纹图谱相似度评价系统2004A版。
2 结果与分析
2.1供试菌株的生物学性状
2.1.1 菌株菌落形态 食用菌菌丝在不同条件下培养,生长状态不同,其菌丝生长速度、长势、色泽等菌落形态特征存在一定差别,同时菌丝显微结构也会发生一些细微变化[18]。如图1所示,野生菌株菌丝密度浓密,洁白呈匍匐状,边缘整齐有力;参考菌株气生菌丝较厚,白色呈绒毛状,边缘不整齐,菌丝容易退化。
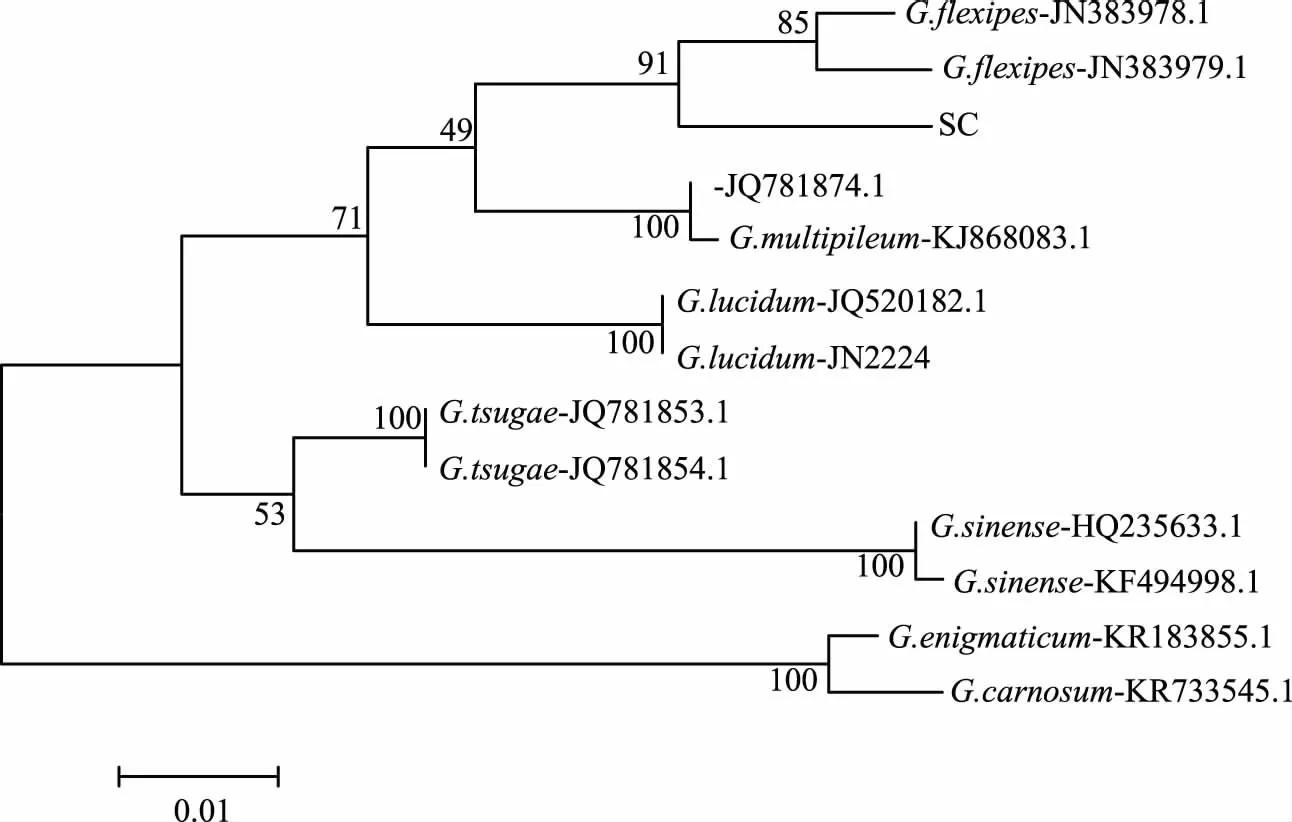
图4 灵芝菌株系统进化树Fig.4 Phylogenetic tree of Ganoderma
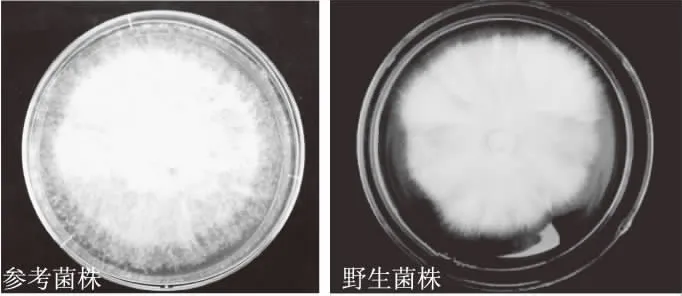
图1 不同灵芝种菌落形态特征Fig.1 The morphological specificity of different Ganoderma species
2.1.2 菌丝生长速率 从图2可以看出,在相同的培养条件下,不同菌株的生长速率不同。野生菌株的生长速率较慢,为0.158 cm/d;参考菌株的生长速率较快,为0.475 cm/d,显著高于野生菌株(p<0.05)。由于野外生长环境的不同,在人工培养的条件下,不同种类灵芝对营养元素的需求也有较大的差别[19]。
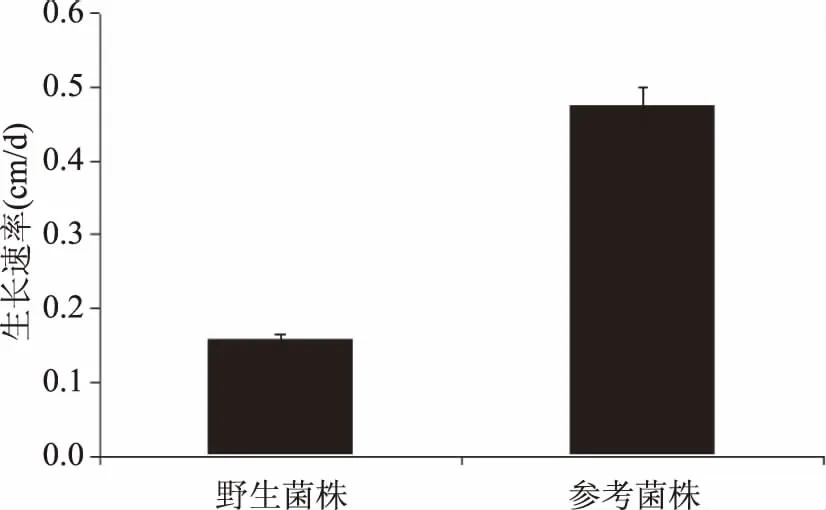
图2 不同灵芝种的生长速率Fig.2 The growth rate of different Ganoderma species
2.2ITS测序及比对
2.2.1 ITS琼脂凝胶电泳图 采用特异性引物ITS1和ITS4对供试菌株DNA进行PCR扩增,得到的ITS琼脂凝胶电泳图如图3所示,可以看出野生菌株和参考菌株的ITS序列片段大小都在500~750 bp。ITS序列在物种属内、近缘属间以及科内系统进化关系研究中有一定的价值,真菌ITS区域长度一般在650~750 bp[20]。
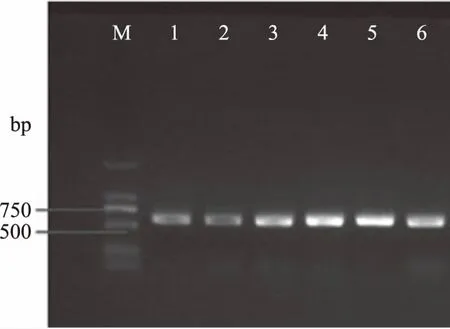
图3 不同灵芝种的ITS-PCR图谱Fig.3 ITS-PCR spectra of different Ganoderma species注:M为Marker,1,2,3为野生菌株,4,5,6为参考菌株。
2.2.2 ITS系统发育树 将菌株进行单克隆测序,所得序列置于NCBI数据库进行BLAST分析比对。比对结果显示该野生菌株和Ganodermaflexipes的相似性为97%,E值为0.0,表明该野生菌株属于Ganodermaflexipes[21]。下载不同种灵芝属的菌株ITS序列:JQ520182.1和JN222421.1;KJ868083.1和JQ781874.1;JN383978.1和JN383979.1;JQ781853.1和JQ781854.1;KR183855.1和KR733545.1;HQ235633.1和KF494998.1一起构建系统进化树。从图4可以看出该野生菌株与Ganodermaflexipes亲缘关系较近,与BLAST分析比对结果相一致。
2.3灵芝菌株的液体深层发酵

表2 供试灵芝出芝参数Table 2 The parameters of Ganoderma
经过195 h的发酵培养,检测记录菌丝生物量、多糖和三萜含量。如表1所示,野生菌株的菌丝生物量为0.269 g/100 mL,极显著高于参考菌株(0.149 g/100 mL)(p<0.01)。对于发酵液多糖,野生菌株的含量为6.59 mg/mL,低于参考菌株(7.01 mg/mL)。野生菌株菌丝三萜含量为8.85 mg/g,比参考菌株高出37.0%。菌株的液体深层发酵受到很多因素的影响,除了培养基质,调控工艺也能显著影响液体发酵,主要表现在pH、温度、接种量、氧溶量、搅拌速度等[22]。菌株经过液体深层发酵后菌丝生物量和代谢产物的量存在一定差异,在本实验条件下野生菌株的菌丝生物量和三萜含量较高。
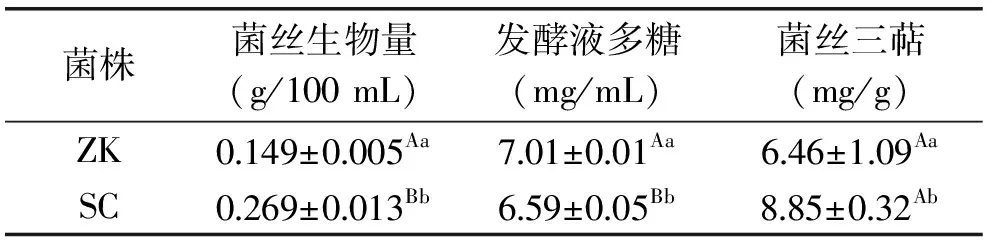
表1 灵芝液体深层发酵相关参数及分析Table 1 Ganoderma lucidum submerged fermentation parameters and analysis
注:字母表示差异的显著性,小写字母表示显著差异,p<0.05;大写字母表示极显著差异,p<0.01;ZK:参考菌株,SC:野生菌株;表2、表3同。
2.4灵芝菌株的农艺性状
供试灵芝菌株的出芝相关参数[23]如表2所示,与参考菌株相比,野生菌株菌丝满袋天数较长为43 d,开袋至成熟天数较短为40 d,颜色偏浅,分支多,能产生少量孢子。野生菌株的出芝率比参考菌株低了30个百分点,生物转化率低了7.6个百分点。灵芝整个生长期的生理活动除了与营养条件相关外,还受到温度、湿度、光照、空气、酸碱度等理化因素的影响。在本实验条件下野生菌株SC的出芝率和生物转化率偏低,商品价值不高。
2.5灵芝子实体的主要成分分析
2.5.1 子实体多糖和三萜含量的检测 由表3经计算可知,灵芝子实体多糖和三萜含量检测发现,菌株之间的子实体多糖含量有极显著性差异。野生菌株SC的子实体多糖含量为23.70 mg/g,是参考菌株ZK的2.56倍。品种不同导致灵芝多糖含量有所不同,可能与菌丝生长速率相关,菌株SC满袋时间长于ZK(表2),有利于多糖的积累。不同提取方法所得灵芝多糖的提取率不同,微波法高于超声波法,超声波法高于索氏法[24]。菌株SC三萜含量为9.67 mg/g,比参考菌株ZK提高9.27%。灵芝酸为三萜类的主要活性成分,不能以总三萜含量代表菌株的灵芝酸含量,需进一步HPLC分析其三萜种类和含量。

表3 子实体的多糖和三萜含量Table 3 Fruiting bodies of polysaccharides and triterpenoids
2.5.2 子实体三萜的HPLC分析 如图5所示,从6个三萜酸的标准样品HPLC指纹图谱可知,保留时间逐渐递增对应的标准样品为灵芝酸C2、灵芝酸C、灵芝酸A、赤芝酸A、灵芝酸E、灵芝酸F,其保留时间分别为15.90、19.96、22.89、25.92、27.29、28.32 min。以S1为参照图谱进行匹配,利用软件中药色谱指纹图谱相似度评价系统2004A版将供试灵芝菌株子实体进行图谱之间的相似度比较。由图6可知,结合标准样品的指纹图谱发现,菌株SC较显著的出峰仅有1个灵芝酸A,由峰面积可知其含量不高;菌株ZK除灵芝酸A外,还含有其他灵芝酸。菌株SC、ZK相似度为81.7%,但从图6中可以看出其匹配度不高,主要峰形的数量和保留时间有明显差别,菌株ZK灵芝酸A含量高于菌株SC且含有赤芝酸A、灵芝酸E、灵芝酸F等其他成分,菌株SC三萜有效成分种类少且含量低,说明两菌株三萜成分存在一定差异,通过HPLC指纹图谱可将这两种灵芝菌种区分开。
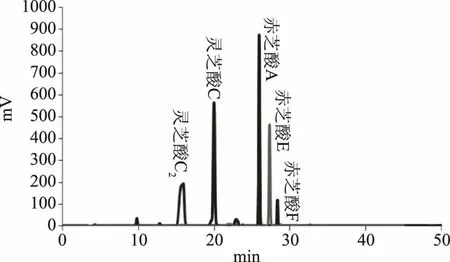
图5 标准样品的指纹图谱Fig.5 The fingerprint of standard samples

图6 子实体三萜指纹图谱Fig.6 The fingerprint of hyphae triterpene of fruiting body 注:S1表示参考菌株(ZK),S2表示野生菌株(SC)。
3 结论
本实验从形态学特征结合分子生物学技术手段鉴定了野生菌株属于Ganodermaflexipes。其菌丝洁白浓密,生长速率(0.158 cm/d)显著低于参考菌株(p<0.05)。野生菌株在液体深层发酵中菌丝生物量(0.269 g/100 mL)极显著高于参考菌株(p<0.01),发酵液多糖含量极显著低于参考菌株(p<0.01),菌丝三萜含量(8.85 mg/g)显著高于参考菌株(p<0.05)。可见野生菌株液体深层发酵除了菌丝生物量较高效果并不理想。液体深层发酵在食药用菌产品的生产上占据重要地位,先后在虫草、牛樟芝、长根菇、白灵菇等得到广泛应用[25-28]。食用菌液体发酵技术主要涉及培养基优化及发酵过程的动态调控等方面[29]。
野生菌株子实体多糖含量(23.70 mg/g)极显著高于参考菌株(p<0.01),是参考菌株的2.56倍;三萜含量(9.67 mg/g)显著高于参考菌株(p<0.05)。由HPLC指纹图谱分析可知,野生菌株含有效三萜成分种类少,主要是灵芝酸A,且含量低,说明野生菌株三萜的含量较高但质量不高。人工栽培灵芝所需周期长、抗外界环境因素干扰弱以及存在活性成分波动大等缺点[30],可以进一步优化栽培技术,使该野生弯柄灵芝成为提取多糖的优良菌株。
[1]金鑫,刘宗敏,黄羽佳,等. 我国灵芝栽培现状及发展趋势[J]. 食药用菌,2016,24(1):33-37.
[2]Zhou XW,Su KQ,Zhang YM. Applied modern biotechnology for cultivation of Ganoderma and development of their products[J]. Applied Microbiology and Biotechnology,2012,93(3):941-963.
[3]Kim HM,Paik SY,Ra KS,et al. Enhanced production of exopolysaccharides by fed-batch culture of Ganoderma resinaceum DG-6556[J]. The Journal of Microbiology,2006,44(2):233-242.
[4]李平作,章克昌. 灵芝胞外多糖的分离纯化及生物活性[J]. 微生物学报,2000,40(2):217-220.
[5]李晔,朱忠敏,姚渭溪,等. 灵芝三萜类化合物的研究进展[J]. 中国中药学杂志,2012,37(2):165-171.
[6]高建莉,禹志领,李绍平,等. 灵芝三萜类成分研究进展[J]. 中国食用菌,2005,24(4):6-11.
[7]邹莉,孙婷婷,王旭彤,等. 松杉灵芝分离纯化及ITS分子鉴定[J]. 江苏农业科学,2016,44(8):278-280.
[8]叶丽云,鲁欣,林强,等. 灵芝单、双核菌丝差异研究[J]. 食品工业科技,2016,37(20):211-215.
[9]傅俊生. 草菇杂交育种研究及其分子遗传标记的建立[D].福建农林大学,2007.
[10]郑秋霞,蒋木杉,应顺秋,等. 一株野生离褶伞菌株的ITS序列分析及其生物学特性的研究[J]. 基因组学与应用生物学,2015(1):106-111.
[11]汤坤鹏,刘盛荣,吴小平,等. 灰色关联度法筛选适合液体深层发酵灵芝菌株[J]. 核农学报,2015,29(10):1963-1969.
[12]潘明,徐轶婷,许艳丽,等. 灵芝发酵液多糖抑菌作用研究[J]. 中国酿造,2010(2):56-58.
[13]马敏,刘嘉宝,陈兰兰. 苯酚-硫酸法测定多糖含量显色条件的优化与改进[J]. 江苏农业科学,2015,43(12):323-324.
[14]刘海良,宋爱荣,黄芳. 树舌灵芝发酵液中灵芝酸的提取及测定[J]. 食用菌学报,2008,15(3):68-71.
[15]金珊珊,柯斌榕,吴小平,等. 适于菌草代料栽培的杂交灵芝菌株选育[J]. 亚热带资源与环境学报,2014,9(4):56-62.
[16]夏凤娜,张一帆,袁启华,等. 利用肉桂木屑栽培食用菌[J]. 食用菌学报,2013,20(4):31-33.
[17]陈凌华,程祖锌,杨志坚.灵芝多糖热水提取条件的优化实验[J]. 浙江食用菌,2009,17(4):21-23.
[18]郭勇,叶小金,甘炳成,等. 不同温度和光照培养条件下3种食用菌菌丝的茵落及菌丝形态的研究[J]. 西南农业学报,2011,24(6):2301-2306.
[19]陈永敢,陈光宙,陈忠萌,等. 几种海南产灵芝的生理学特性研究[J]. 食药用菌,2011,19(2):9-12.
[20]赵杰. ITS序列分析及其在植物真菌病害分子检测中的应用[J]. 陕西农业科学,2004,(4):35-37.
[21]王锦锋,李晶,I L Datti,等. 利用拮抗、ITS和RAPD技术对灵芝属菌株分类的研究[J]. 西南农业学报,2017,30(1):26-33.
[22]陈功明. 灵芝多糖的液体发酵、提取纯化及其硫酸化改性的研究[D]. 杭州:浙江大学,2010.
[23]李忠,凌宏通,王志达,等. 灵芝优良菌株的品比实验[C].海峡两岸灵芝桑黄专题研讨会论文集,2013:69-73.
[24]靳丹虹,牛艳秋,陈博,等. 不同提取方法对灵芝多糖提取率的影响[J]. 中国药师,2008,11(5):551-552.
[25]Shih IL,Tsai KL,Hsieh C. Effects of culture conditions on the mycelial growth and bioactive metabolite production in submerged culture of Cordyceps militaris[J]. Biochemical Engineering Journal,2007,33(3):193-201.
[26]Shih IL,PanK,Hsieh C. Influence of nutritional components and oxygen supply on the mycelial growth and bioactive metabolites in submerged culture of Antrodia cinnamomea[J]. Process Biochemistry,2006,41(5):1129-1135.
[27]Balaraju K,Park K,Jahagirdar S,et al. Production of cellulase and laccase enzymes by Oudemansiella radicata using agro wastes under solid-state and submerged conditions[J]. Research in Biotechnology,2010,2(1):21-28.
[28]Le J,Hu SZ,Xu M. Optimisation of submerged culture conditions for the production of mycelial biomass and exopolysaccharide by Pleurotus nebrodensis[J]. Annals of Microbiology,2007,57(3):389-393.
[29]郑永标,何佳,吴雅滨,等. 珊瑚菌液体发酵工艺优化及其菌丝体的化学成分分析[J]. 食用菌,2015,37(6):7-9,12.
[30]刘高强,王晓玲,韩文军,等. 响应曲面法优化灵芝廉价型深层发酵培养基的研究[J]. 菌物学报,2009(6):825-831.
IdentificationofawildGanodermaflexipesandstudyonthecontentofpolysaccharidesandtriterpenoids
ZHAOLi-li,YELi-yun,XIEFan,TANGKun-peng,WUXiao-ping*
(Mycological Research Center of Fujian Agricultural and Forestry University, JUNCAO National Engineering Technology Research Center,Fuzhou 350002,China)
The wild-type strain was identified by comparison of biological characteristics and ITS sequencing. The contents of polysaccharides and triterpenoids in this strain were evaluated by submerged fermentation and effective component analysis. The results confirmed that the wild-type strain wasG.flexipes. Active ingredient analysis showed that triterpenoids in mycelial(8.85 mg/g)and fruiting body(9.67 mg/g)of wild-type strain were significantly higher as comparing with the reference strain(p<0.05).However,polysaccharides content were significantly lower in fermentation broth(6.59 mg/mL)of wild-type strain than that of the reference strain(p<0.01). Whereas,polysaccharides(23.70 mg/mL)were 2.56 times higher in fruiting body of wild-type strain as comparing with the reference strain(p<0.01). HPLC analysis of the fruiting body extract showed a low prominent single peak with others non-significant low peaks of triterpenoids in the wild-type strain. Results also indicated that the wild-type strain has great potential for polysaccharides production and extraction of these components could be increased with optimized cultivation techniques.
Ganodermaflexipes;ITS sequencing;polysaccharides;triterpenoids;HPLC fingerprinting
2017-03-04
赵丽丽(1992-),女,硕士研究生,从事食用菌遗传育种方面的研究,E-mail:18363833962@163.com。
*
吴小平(1965-),男,博士,教授,从事食用菌教学与科研方面的研究,E-mail:fjwxp@126.com。
福建省食用菌产业重大农技推广服务试点项目(KNJ-153013)。
TS255.1
A
1002-0306(2017)21-0137-05
10.13386/j.issn1002-0306.2017.21.028
