乳酸菌复合发酵大蒜风味、活性成分和微生物种群变化分析
2017-11-21,,,
, ,,
(徐州工程学院,江苏徐州 221018)
乳酸菌复合发酵大蒜风味、活性成分和微生物种群变化分析
侯进慧,李勇,唐梦笛,韩芝洋
(徐州工程学院,江苏徐州 221018)
本文以大蒜为研究对象,添加植物乳杆菌、嗜酸乳杆菌和鼠李糖乳杆菌等三种乳酸菌发酵大蒜,分析乳酸菌复合发酵大蒜在风味、活性成分和微生物种群变化等方面的特征,为大规模的大蒜发酵生产提供参考。结果显示,发酵30 d后蒜味逐渐消失,并产生香味,口感显著改善;开始发酵后,发酵液pH下降明显,10 d以后发酵液的pH基本保持在4左右;发酵开始后,SOD酶活性有所增加,并保持在250 U的较高水平;细菌群落以添加的三种乳酸菌为主,发酵开始时还伴有肠杆菌、不动杆菌、寡养单胞菌、芽孢杆菌,但发酵后期没检测到肠杆菌、不动杆菌、寡养单胞菌,只检测到三种乳酸菌和芽孢杆菌,而且乳酸菌除了刚发酵时有所降低,其他时间一直保持在较高水平。本文为乳酸复合发酵大蒜的产品开发提供了研究基础。
大蒜,乳酸菌,复合发酵,SOD,16S rDNA,微生物种群
大蒜是葱科、葱属的重要经济作物,中国是全球最大的大蒜出口国[1-2]。我国大蒜加工产品主要有蒜粉、脱水蒜片、盐水大蒜等,而适合国内人群消费的即食大蒜制品,如糖蒜、黑蒜、蒜酱等相对较少。在餐饮行业,大蒜的消费也以鲜大蒜头为主,导致大蒜头市场价格剧烈波动。大蒜的主要活性成分包括超氧化物歧化酶(SOD)、蒜氨酸(Alliin)、大蒜素(Allicin)和多糖等。但是由于鲜蒜特殊的刺激性气味,限制了其消费和利用[3-7]。
在食品工业中,蔬菜发酵加工可提高蔬菜制品营养价值和经济效益。乳酸菌是一类重要的食品发酵微生物,可以发酵糖类物质,其在发酵过程中也可以产生乳酸菌素而抑制腐败菌,减少亚硝酸盐的形成,改善蔬菜风味,延长食品的保质期。乳酸菌还是一类重要的生理调节菌,可以改善人体的肠道内环境,并产生乳酸等营养物[8-10]。开展微生物发酵大蒜的研究,相关产品可以提高大蒜销售的附加值,稳定大蒜的产品品质和销量,降低大蒜销售的损耗,提升产品档次。
本文利用乳酸菌复合发酵技术对大蒜进行发酵,降低大蒜产品的刺激性异味,改善风味,提高其活性成分的含量,同时分析发酵过程中的微生物种群类型和变化特征,为开发出新型大蒜发酵产品提供基础研究资料。
1 材料与方法
1.1材料与仪器
发酵所用大蒜 江苏邳州;发酵大蒜所用的植物乳杆菌LactobacillusplantarumXN7、嗜酸乳杆菌LactobacillusacidophilusXM3、鼠李糖乳杆菌LactobacillusrhamnosusXN9等乳酸菌菌种 课题组选育保藏菌种;用于菌种培养的蛋白胨、琼脂粉等试剂 国药集团化学试剂有限公司;用于菌株分子鉴定的Taq DNA聚合酶等PCR试剂和琼脂糖等电泳试剂 宝生物工程(大连)有限公司。
MDF-382E型超低温冰箱 日本SANYO电子有限公司;HYG型振荡培养箱 上海欣蕊自动化设备有限公司;Sigma3-16pk型高速冷冻离心机 德国SIGMA公司;DYY-12型电泳仪 北京市六一仪器厂;Gel Doc XR+凝胶成像系统 美国BIO-RAD公司。
1.2培养基与菌体计数
使用结晶紫中性红胆盐琼脂(VRBA)培养基用于肠杆菌计数、分析,接种样品,在37 ℃厌氧培养36 h计数[11]。使用MRS培养基用于乳酸菌计数、分析,接种样品,在30 ℃培养箱中厌氧培养48 h 计数[12]。用于菌种培养的LB(Luria-Bertani)液体培养基:酵母膏5 g,蛋白胨10 g,NaCl 10 g,加蒸馏水定容至1 L,灭菌备用。每1 L固体LB培养基需要再添加琼脂粉12 g到液体LB培养基,灭菌备用[13]。
1.3大蒜的发酵
1.3.1 原料前处理 对发酵的大蒜进行前处理,包括清洗、剥皮、晾干和紫外杀菌30 min。
1.3.2 发酵工艺 将大蒜原料进行剥皮、清洗、晾干,利用紫外线杀菌30 min,装料,添加发酵乳酸菌菌种,包含LactobacillusplantarumXN7、LactobacillusacidophilusXM3、LactobacillusrhamnosusXN9等菌种,根据课题组预实验经验,三种菌的数量比是1∶1∶1,菌液接种量为发酵液体积的5%,料水体积比是1∶1,NaCl含量占培养液的1%,保持自然pH。经搅拌均匀后,在28 ℃厌氧发酵。
1.4发酵液的pH和SOD检测
在发酵过程中,固定时间取样,用pH仪测定溶液的pH,以时间为横坐标,以pH变化为纵坐标,绘制出pH变化曲线。用邻苯三酚自氧化法测定SOD活性[14],将发酵过程中定时取出的发酵大蒜进行粉碎,获得提取液,在60 ℃处理20 min,4000 r/min离心后,取上清即为粗酶液,测定SOD活性。将1 min反应液SOD抑制邻苯三酚自氧化速率50%定义为1个SOD活力单位。
1.5菌株基因组DNA提取与16SrDNA扩增
利用苯酚-氯仿抽提获得菌株基因组DNA[15]。以提取的基因组DNA为模板,扩增16S rDNA,所用引物序列为:F:5′AGAGTTTGATCCTGGCTCAG3′,R:5′ GGTTACCTTGTTA CGACTT3′,进行22次PCR循环扩增。胶回收16S rDNA片段。与测序载体pGMT连接,挑选白色转化子,送上海生工测序[13]。
1.6发酵过程中的微生物种群变化分析
在发酵过程中,固定时间取样,利用LB培养基,采用纯培养方法获得菌种,利用基因扩增方法,获得菌株的16S rDNA序列。利用Blast程序,在NCBI的Genbank数据库中比对分析菌株序列,利用DNAMAN等生物信息学软件分析菌株的种群类型,确定发酵前、后的发酵液中微生物类群。
2 结果与分析
2.1乳酸复合发酵对大蒜风味的影响
利用三种乳酸菌对大蒜进行发酵,按照每10 d取一次样品进行风味分析,将结果统计见表1。可以看出,在发酵10 d以前,蒜味还非常强烈,辣味也很强,在发酵30 d后,蒜味逐渐消失,并产生香味,蒜辣味在50 d以后显著降低,口感显著改善。

表1 复合发酵对大蒜风味的影响Table 1 Effect of composite fermentation on garlic flavor
2.2复合发酵过程中pH变化情况
在发酵过程中,由于乳酸菌的生长和代谢作用,发酵液的pH不断下降,连续测定获得其pH变化曲线(图1)。在最初的10 d,发酵液pH下降明显,10 d以后溶液的pH基本保持稳定在4,处于酸性环境,说明乳酸菌生长良好。

图1 发酵过程pH变化情况Fig.1 pH variation in fermentation
2.3复合发酵过程中大蒜SOD活性变化
在发酵过程中,连续取样测定SOD酶的活性变化,得到变化曲线(图2)。在发酵20 d时,SOD酶活性增加到250 U左右,并在20~50 d的发酵过程中保持基本稳定,这是乳酸菌代谢的结果。在50 d以后,略有下降,可能是菌种活性有所降低。
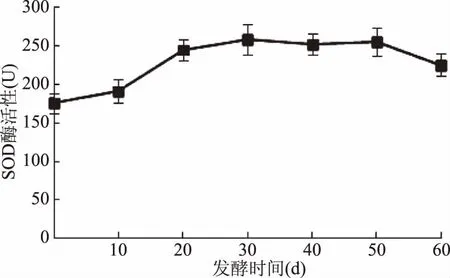
图2 发酵过程中SOD酶活性变化情况Fig.2 Variation of SOD activity in fermentation
2.4肠杆菌数目变化情况
使用结晶紫中性红胆盐琼脂(VRBA)培养基对肠杆菌进行分析和计数。开始时,肠杆菌数目为104CFU/mL,前5 d菌落对数由4.2下降到3.5左右,下降较缓慢;在5~15 d,肠杆菌菌落对数由3.5下降到0.5,下降较快;15 d以后几乎没有肠杆菌,30 d之后没有检测到肠杆菌。这主要是由于厌氧培养和酸性环境对肠杆菌的抑制作用。
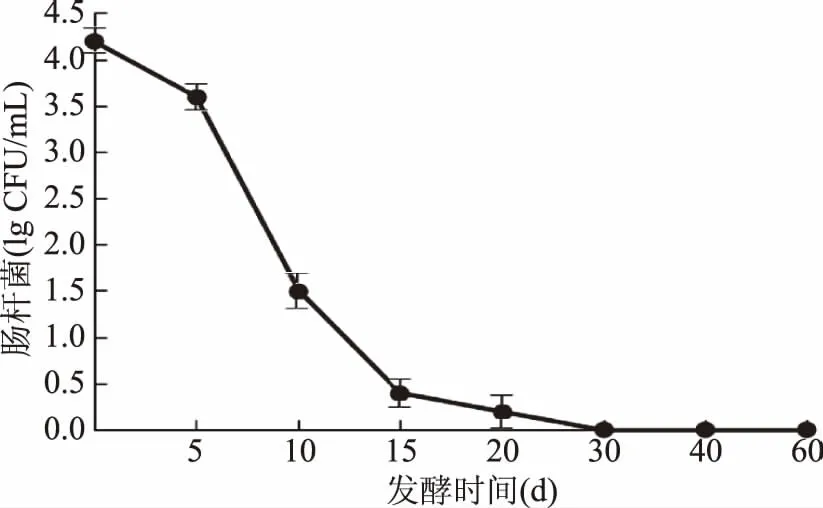
图3 发酵过程中肠杆菌数目变化情况Fig.3 Variation of enterobacteria number in fermentation
2.5乳酸菌数目变化情况
发酵开始时,乳酸菌为107CFU/mL,前5 d数目下降到105CFU/mL;5~10 d,乳酸菌数目保持在105CFU/mL左右;15 d以后,乳酸菌数目又回升到106~107CFU/mL。在40 d以后出现数目下降的情况。在开始的5 d出现乳酸菌数目下降,可能与发酵液pH、溶氧较高和大蒜的抑菌作用有关系。乳酸菌数目的增加可能是由于发酵液的酸性环境有利于乳酸菌的生长,导致其数目不断增加。
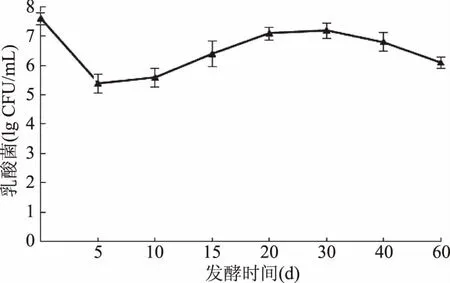
图4 发酵过程中乳酸菌数目变化情况Fig.4 Variation of lactic acid bacteria number in fermentation
2.6发酵液中微生物分离与16SrDNA扩增
利用LB培养基,通过纯培养方法,分离得到菌落形态各异的菌株,扩增获得各菌株的16S rDNA基因片段,通过测序获得序列。提取菌株基因组DNA,琼脂糖凝胶电泳结果显示提取的基因组DNA质量较好,是单一条带,断裂较少,适合作为PCR反应模板(图5,箭头所示)。利用琼脂糖凝胶电泳检测扩增的菌株16S rDNA基因,获得单一条带,质量较好,没有杂带(图6,箭头所示)。
图5 菌株基因组DNA 电泳Fig.5 Electrophoresis of genomic DNA注:M泳道是DNA Marker, 1~3泳道是基因组DNA(如箭头所示)。
图6 菌株16S rDNA电泳Fig.6 Electrophoresis of 16S rDNA注:M泳道是DNA Marker, 1~4泳道是16S rDNA(如箭头所示)。
2.7发酵液中微生物类群分析
利用DNAMAN生物信息学软件分析菌株的种群类型,确定发酵前和发酵后发酵液的微生物类群。发酵前,发酵体系中的主要微生物类群是(图7):植物乳杆菌(L.plantarum)、嗜酸乳杆菌(L.acidophilus)、鼠李糖乳杆菌(L.rhamnosus)、肠杆菌(E.xiangfangensis、Enterobactersp.)、不动杆菌(Acinetobactersp.)、寡养单胞菌(Stenotrophomonassp.)、芽孢杆菌(Bacillussp.)。发酵60 d后,发酵体系中检出的主要微生物类群是:植物乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌和芽孢杆菌,没有检测到肠杆菌。这与肠杆菌数目变化情况(图3)的结果一致,说明厌氧发酵显著抑制肠杆菌的生长。
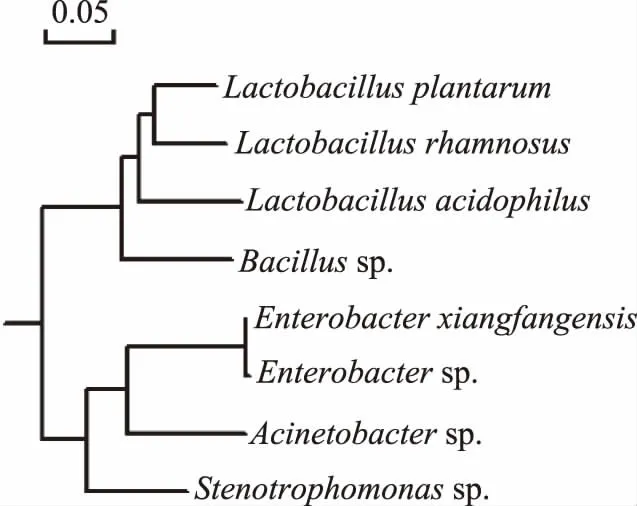
图7 发酵前的主要微生物类群Fig.7 The microbial population before fermentation

图8 发酵后的主要微生物类群Fig.8 The microbial population after fermentation
3 结论
乳酸菌是可以定植在人类肠道中的益生菌,具有调节肠道微生态平衡、降低胆固醇、抗氧化、抗肿瘤等功效,其研究和应用日益被人们重视[16]。利用菌种发酵大蒜,可以发挥出不同菌株的代谢优势、调节大蒜风味,开发出新型发酵大蒜产品[17]。本文利用植物乳杆菌L.plantarumXN7、嗜酸乳杆菌L.acidophilusXM3、鼠李糖乳杆菌L.rhamnosusXN9 等三种乳酸菌共同发酵大蒜,取得了较好的效果。经过30 d以上的发酵,蒜味逐渐消失,并产生香味,口感显著改善。发酵的中后期,pH下降到4左右并基本保持稳定,SOD酶的活性则有所升高,且能保持较高水平。本研究的微生物类群特征分析显示,肠杆菌、不动杆菌、寡养单胞菌只是在发酵前期存在,而中后期则没有检测到,这应该是厌氧和酸性环境对菌株生长的抑制作用。乳酸菌在发酵的前5 d数目有所下降并保持了一段时间,在15 d以后,乳酸菌数目又回升到开始的数目并保持到发酵后期,这可能与发酵液pH、溶氧和大蒜的抑菌作用有关系,还需要进一步研究。利用16S rDNA分析发酵过程中微生物类群的变化,可以很快揭示出种群变化特征,为整体把握发酵过程提供依据。利用16S rDNA序列同源性分析食品中的乳酸菌[18-21],结果表明利用分子序列对菌株进行分类鉴定是快速有效的。本文以16S rDNA为参考基因,分析发酵过程中的微生物种类,基本可以反映出微生物菌群的特征和变化。文中采用纯培养的方法,可以分析出发酵液中大量存在的微生物类群,也就是优势种群。但并不能完全反映出菌落的全部特征,还有一些数量极少的或者不可培养的菌株,采用提取总DNA的方法可以分析出更加全面的菌落种群特征。
[1]吕玉花,张留伟. 中国大蒜出口贸易现状研究[J]. 农业经济,2011(2):92-93.
[2]侯进慧,李同祥,蔡文佳. 大蒜在葱科的分子分类地位研究[J]. 徐州工程学院学报:自然科学版,2014(4):47-50.
[3]闫淼淼,许真,徐蝉,等. 大蒜功能成分研究进展[J]. 食品科学,2010,31(5):312-318.
[4]胡兴鹏,周华,杜阳敏,等. 蒜氨酸的热分解及其机理分析[J]. 食品科学,2017(3):64-68.
[5]宋莎莎,吕佳煜,冯叙桥. 大蒜多糖研究进展[J]. 食品工业科技,2017(1):364-368,378.
[6]孙艳,王振,黄清松,等. 大蒜素的提取工艺研究[J]. 食品科技,2016(6):260-263.
[7]李瑜,罗飞,许时婴. 大蒜生物活性功能及蒜粉微胶囊化的研究进展[J]. 食品科学,2007,28(9):610-613.
[8]Gupta R,Srivastava S. Antifungal effect of antimicrobial peptides(AMPs LR14)derived fromLactobacillusplantarumstrain LR/14 and their applications in prevention of grain spoilage[J]. Food Microbiol,2014,42(12):1-7.
[9]Arena MP,Silvain A,Normanno G,et al. Use ofLactobacillusplantarumstrains as a bio-control strategy against food-borne pathogenic microorganisms[J]. Front Microbiol,2016,7:464.
[10]彭新颜,于海洋,李杰,等. 乳酸菌抗氧化作用研究进展[J]. 食品科学,2012,33(23):370-374.
[11]李书华,蒲彪,陈封政.泡菜的功能及防腐研究进展[J]. 中国酿造,2005(4):6-8.
[12]周泽义,胡长敏,王敏健,等.中国蔬菜硝酸盐和亚硝酸盐污染因数及控制研究[J].环境科学进展,1998,7(5):1-13.
[13]侯进慧,蔡侃,孔文刚. 基于生物信息学方法对一株产纤维素酶细菌的分析[J].生物技术,2011,21(2):48-50.
[14]许申鸿,杭瑚,李运平. 超氧化物歧化酶邻苯三酚测活法的研究及改进[J]. 化学通报,2001,64(8):516-519.
[15]Syn CKC,Swarup S. A scalable protocol for the isolation of largesized genomic DNA within an hour fromseveral bacteria[J]. Analytical Biochemistry,2000,278:86-90.
[16]崔艳,张亚伟,肖林,等. 肠道有益菌及代谢产物对肠道和人体的影响[J]. 生物产业技术,2017(1):91-94.
[17]陆俊,刘佳佳,徐刚标,等. 微生物发酵对大蒜风味及活性成分的影响[J]. 食品工业科技,2008,29(8):150-152.
[18]夏雪娟,陈芝兰,陈宗道,等. 16S rDNA序列分析法快速鉴定西藏地区传统乳制品中的乳酸菌[J]. 食品科学,2013,34(14):245-249.
[19]范铁男,邹继宏,袁杰利. 16S rRNA序列分析及其相关分子生物学方法在乳酸菌分类、鉴定中的应用[J]. 中国微生态学杂志,2010,22(2):179-183.
[20]刘国荣,周康,李平兰,等. 传统干酪中一株产Ⅱa类细菌素乳酸菌的分离与鉴定[J]. 食品科学,2007,28(5):185-190.
[21]王昱敬,李伟叶,张潇俊,等. 传统乳扇中乳酸菌的多样性研究[J]. 食品科技,2017(1):12-18.
Analysisofthechangesofflavor,activecomponentsandmicrobialpopulationinfermentationofgarlicbylacticacidbacteria
HOUJin-hui,LIYong,TANGMeng-di,HANZhi-yang
(Xuzhou University of Technology,Xuzhou 221018,China)
In the paper,three kinds of lactic acid bacterial strains,LactobacillusplantarumXN7,LactobacillusacidophilusXM3,LactobacillusrhamnosusXN9,were added in the composite fermentation of garlic,and flavor,active ingredients and microbial population changes were analyzed. The results showed that after 30 days of fermentation the smell of garlic gradually disappeared,fragrance appeared,and the taste significantly improved. After fermentation,pH decreased significantly and after 10 days the pH of the solution remained at 4. The SOD activity increased at the beginning of fermentation,and maintained at a higher level,250 U. At the beginning of fermentation,bacterial community was composed by the three kinds of lactic acid bacteria added,and accompanied byEnterobactersp.,Acinetobactersp.,Stenotrophomonassp. andBacillussp.,butEnterobactersp.,Acinetobactersp.,Stenotrophomonassp. cannot be detected at the end of the fermentation,only three kinds of lactic acid bacteria andBacillussp. can be detected. The paper provides a reference for the production of fermented garlic.
Alliumsativum;lactic acid bacteria;composite fermentation;SOD;16S rDNA;microbial population
2017-05-08
侯进慧(1980-),男,博士,副教授,研究方向:食品生物技术,E-mail:houjinhui0@126.com。
江苏省科技厅项目(BN2016022);江苏省青蓝工程骨干教师项目(2017年);徐州市科技计划项目(KC15N0011);徐州工程学院校级科研课题(XKY2013108);徐州工程学院实验室开放项目(2017年)。
TS201.3
A
1002-0306(2017)21-0092-04
10.13386/j.issn1002-0306.2017.21.019
