浸泡条件对燕麦发芽过程中酶活性的影响
2017-11-21,,,,,*
,,,,,*
(1.贺州学院食品与生物工程学院,广西贺州 542899) (2.贺州学院食品科学与工程技术研究院,广西贺州 542899)
浸泡条件对燕麦发芽过程中酶活性的影响
张巧1,2,段振华1,2,陈凤雪1,邓春丽1,2,陈振林1,2,*
(1.贺州学院食品与生物工程学院,广西贺州 542899) (2.贺州学院食品科学与工程技术研究院,广西贺州 542899)
为探究浸泡条件对燕麦发芽过程中淀粉酶、蛋白酶以及纤维素酶活力的影响,通过在不同的浸泡温度、时间和含有不同金属离子的浸泡水溶液中浸泡燕麦籽粒,测定燕麦中各酶活力随发芽时间的变化情况。研究结果表明,燕麦浸泡最优条件为浸泡温度15 ℃,时间8 h,浸泡水溶液添加2 mmol/L MgSO4。在此浸泡条件下,16 ℃发芽10 d,发芽燕麦中的总淀粉酶、α-淀粉酶、蛋白酶和纤维素酶活力较高,分别达到54.39、25.3、0.55 和1.35 U/g。
燕麦发芽,浸泡条件,酶活性,金属离子,淀粉酶
燕麦中含有β-葡聚糖、多酚和燕麦皂苷等活性成分,营养价值较高,具有降低胆固醇、稳定血糖水平等保健功能[1-3]。燕麦的发芽就是发生一系列复杂的生理生化反应,同时产生各种酶,如蛋白酶、淀粉酶、氧化还原酶等,这些酶制剂的形成对产品的色泽、风味等感官产生重要的影响[4-5]。且种子萌发过程中,内源酶在外界条件下被逐渐激发,不仅酶活力不断变化,酶作用下的淀粉、蛋白质、多酚、黄酮等营养成分也随之改变[6-7]。付晓燕[8]研究了燕麦发芽过程中酚类物质的变化,结果表明,酚类物质的含量在发芽过程中明显提高;徐托明[9]研究了裸燕麦发芽过程中三大营养素的变化,总氮和脂肪含量变化不明显,游离氨基酸、还原糖含量明显增加,发芽后营养价值增加。
浸泡和发芽处理是燕麦发芽过程中的重要步骤,不仅可以提高燕麦的营养价值,还可以降低燕麦籽粒的植酸或蛋白酶抑制剂的含量,有效提高燕麦中矿物质和维生素等的生物利用率[10]。近年来,燕麦发芽的相关研究主要集中在比较发芽前后燕麦的物理特性和营养成分的变化情况,而关于燕麦浸泡和发芽条件的相关报道非常少。优化燕麦浸泡和发芽条件,提高燕麦发芽后的营养物质含量和酶活力,对于燕麦产品的深加工有重要的意义。本文主要以不同的条件浸泡燕麦,研究燕麦发芽过程中主体酶(淀粉酶、蛋白酶和纤维素酶)活力的变化趋势。优化浸泡条件,以期达到缩短发芽周期或提高发芽后各酶活力。通过发芽形成的酶制剂可用于燕麦自身的酶解,而不需要外加酶制剂,不仅节约了成本,也为燕麦新产品的开发提供一定的参考依据。
1 材料与方法
1.1材料与仪器
燕麦种子 山西省朔州市,晋燕八号,水分含量约8%;次氯酸钠、可溶性淀粉、麦芽糖、酪氨酸、酪蛋白、羧甲基纤维素钠、3,5-二硝基水杨酸、乙二胺四乙酸二钠盐,AR 国药集团化学试剂有限公司。
PMB53水分分析仪 深圳盛美仪器有限公司;722N分光光度计 上海仪电分析仪器有限公司;HWS12型电热恒温水浴锅 上海一恒科学仪器有限公司;KRQ-250P人工气候箱 上海齐欣科学仪器有限公司;5424R高速冷冻离心机 Eppendorf公司。
1.2实验方法
1.2.1 燕麦籽粒的消毒处理 挑选出饱满且无裂口的燕麦籽粒50 g,用2%的次氯酸钠溶液浸泡30 s进行表面消毒,用去离子水冲洗干净,然后浸泡在200 mL的去离子水中。
1.2.2 浸泡温度对燕麦发芽酶活力的影响 将消毒好的燕麦分别置于15、20、25 ℃的培养箱中,浸泡12 h后,滤纸吸干表面水分,燕麦籽粒置于16 ℃的气候箱中发芽12 d,相对湿度保持在90%以上,每隔一段时间取样,测定含水率、总淀粉酶、α-淀粉酶、蛋白酶、纤维素酶活力。
1.2.3 浸泡时间对燕麦发芽酶活力的影响 将消毒好的燕麦置于15 ℃的培养箱中,分别浸泡8、12、24 h后,滤纸吸干表面水分,燕麦籽粒置于16 ℃的气候箱中发芽12 d,相对湿度保持在90%以上,每隔一段时间取样,测定含水率、总淀粉酶、α-淀粉酶、蛋白酶、纤维素酶活力。
1.2.4 浸泡液金属离子对燕麦发芽酶活力的影响 在去离子水中分别添加2 mmol/L的NaCl、MgSO4、FeSO4、EDTA,燕麦浸泡后置于15 ℃的培养箱中8 h,滤纸吸干表面水分,燕麦籽粒置于16 ℃的气候箱中发芽12 d,相对湿度保持在90%以上,每隔一段时间取样,测定含水率、总淀粉酶、α-淀粉酶、蛋白酶、纤维素酶活力。
1.2.5 湿基含水率的测定 参照GB5009.3-2016《食品安全国家标准 食品中水分的测定》,测定发芽过程中燕麦的含水率。
1.2.6 发芽燕麦中酶的提取制备 参照文献[11]并稍作修改。称取一定量的发芽燕麦,测定其水分含量,计算其干重。将发芽燕麦置于研钵中,加少许石英砂和10倍燕麦干重的缓冲液(50 mmol/L的PBS,pH6.5),冰浴上研磨;将匀浆倒入离心管。4 ℃放置2 h提取酶,每隔数分钟搅动一次,10000 r/min离心5 min,上清液即为酶液。
1.2.7 淀粉酶活力的测定 采用DNS比色法,参照文献[12]并稍作修改。
总淀粉酶活力的定义:40 ℃,pH7.0条件下,以 1%淀粉为底物,1 min内产生1 mg麦芽糖所需的酶量,定义为一个总淀粉酶活力单位。
α-淀粉酶活力的定义:先将稀释酶液在pH7.0,70 ℃水浴15 min,冷却至40 ℃。40 ℃,pH7.0条件下,以 1%淀粉为底物,1 min内产生1 mg麦芽糖所需的酶量,定义为一个α-淀粉酶活力单位。
1.2.8 蛋白酶活力的测定 采用福林-酚试剂法,参照文献[13]并稍作修改。
蛋白酶活力的定义:40 ℃,pH7.0条件下,1 min水解酪蛋白产生1 μg酪氨酸所需的酶量,定义为一个蛋白酶活力单位。
1.2.9 纤维素酶活力的测定 采用DNS比色法,参考文献[14]并稍作修改。
纤维素酶活力的定义:50 ℃,pH5.5条件下,1 min分解0.5%的羧甲基纤维素钠产生1 μmol葡萄糖所需的酶量,定义为一个纤维素酶活力单位。
1.2.10 数据处理 所有数据均为3次以上重复实验的平均值,使用Origin 8.0进行数据处理。
2 结果与分析
2.1燕麦浸泡和发芽过程中含水率的变化
燕麦的浸泡就是一个吸水的过程,浸泡后的燕麦种子,其种皮吸水软化,有利于燕麦内重要生命活动的进行。燕麦浸泡过程中含水率的变化情况见图1(a),含水率随浸泡时间的增加而不断增长,前期含水率增长较快,后期增长速度减慢。
燕麦发芽过程中含水率的变化情况见图1(b)所示,燕麦发芽前的含水率为15%,在相对湿度高于90%的环境中,燕麦种子不断吸收环境中的水分,且随着发芽过程中燕麦组织的分化,其含水量不断增加,这与大豆发芽过程中水分含量的变化趋势相一致[15]。且燕麦籽粒在发芽前期,吸收水分较多,水分含量增长较快,后期则处于一种较饱和的状态,水分含量增长较慢。
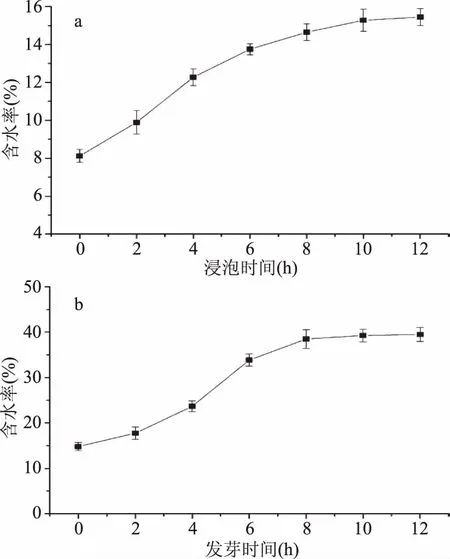
图1 燕麦浸泡和发芽过程中含水率的变化Fig.1 Changes of moisture rate in oats during soaking and germination
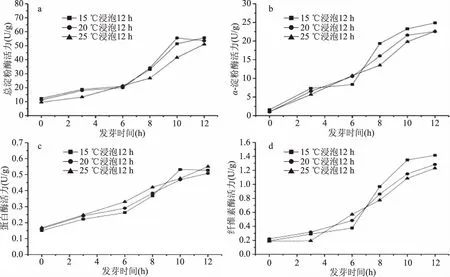
图2 不同浸泡温度对燕麦发芽过程中酶活力的影响Fig.2 Effects of soaking temperatures on enzymes activity in oats during germination
2.2浸泡温度对产酶活力的影响
有研究表明,浸泡温度、浸泡时间对种子萌发和活力有一定的影响[16-17]。不同浸泡温度下,燕麦发芽过程中各酶活力的变化情况如图2所示。经浸泡后的燕麦籽粒,在适当的条件下进行发芽,在发芽前期(6 d前),各酶活力增加比较缓慢;发芽中期(6~10 d),酶活力增长较快;发芽后期(10 d后),酶活力增长速率减慢。
在不同浸泡温度下,燕麦发芽期间总淀粉酶活力的变化趋势见图2(a),15、20 ℃温度下浸泡的燕麦,其总淀粉酶活力稍高于25 ℃浸泡后的发芽燕麦。α-淀粉酶活力的变化趋势见图2(b),经15、20、25 ℃浸泡过的燕麦,在发芽前期,三者的α-淀粉酶活力差异较小;发芽中后期,浸泡温度低的燕麦,其α-淀粉酶活力反而较高。蛋白酶活力的变化趋势见图2(c),在发芽前中期,浸泡温度高的燕麦,其蛋白酶活力也相对较高;到发芽12 d,三者的蛋白酶活力差异较小。纤维素酶活力的变化趋势见图2(d),在发芽中后期,浸泡温度低的燕麦籽粒,发芽时形成的纤维素酶的活力较高。总体而言,浸泡温度较低的燕麦籽粒,发芽中后期的总淀粉酶、α-淀粉酶、纤维素酶活力均较高,蛋白酶活力差异不显著,因此确定燕麦浸泡温度为15 ℃。
2.3浸泡时间对产酶活力的影响
不同浸泡时间下,燕麦发芽过程中的各酶活力变化情况如图3所示。由图3可知,燕麦浸泡时间对总淀粉酶、α-淀粉酶、纤维素酶活力的影响在发芽前期不明显,到发芽中后期较为明显。由图3(a)不同浸泡时间下燕麦总淀粉酶活力的变化情况可知,浸泡时间为24 h的燕麦籽粒,发芽过程中的总淀粉酶活力增长较缓慢,其总淀粉酶活力明显低于浸泡8、12 h的发芽燕麦。由图3(b)不同浸泡时间下燕麦α-淀粉酶活力的变化情况可知,在发芽中后期,随着燕麦浸泡时间的延长,燕麦发芽时的α-淀粉酶活力明显降低。由图3(c)不同浸泡时间下燕麦蛋白酶活力的变化情况可知,浸泡8、12、24 d的燕麦发芽过程中的蛋白酶活力差别较小。由图3(d)不同浸泡时间下燕麦纤维素酶活力的变化情况可知,浸泡时间越长的燕麦,发芽过程中的纤维素酶活力越低。因此,确定燕麦浸泡的最佳时间是8 h。相对而言,本研究采用的燕麦种子,发芽过程中各酶的增长趋势较为缓慢,发芽10 d时间才基本上达到最高酶活力,而其他燕麦种子的发芽时间大约4~7 d[7-9]。
2.4不同金属离子对产酶活力的影响
在浸泡液中添加不同的金属离子,燕麦籽粒在发芽期间各酶活力变化情况如图4所示。由图4(a)和图4(b)可知,浸泡在NaCl和MgSO4水溶液的燕麦,发芽时的总淀粉酶和α-淀粉酶活力较高,且MgSO4对燕麦总淀粉酶活力的促进作用强于NaCl。而经EDTA浸泡过的燕麦,发芽时的酶活力明显低于空白组,对总淀粉酶的抑制作用较强。李珊[18]研究了制麦过程中添加金属离子对大麦发芽过程中淀粉酶活力的影响,结果表明,适当浓度的金属离子Mg2+、Na+也对α-淀粉酶、β-淀粉酶活性有一定的激活作用。由图4(c、d)可知,经FeSO4浸泡过的燕麦籽粒,对发芽时的蛋白酶和纤维素酶的活力影响不大,而NaCl和MgSO4仍促进发芽燕麦的蛋白酶和纤维素酶的增长,EDTA抑制酶活力的增长。燕麦发芽中的淀粉酶、蛋白酶和纤维素酶的活力与金属离子密切相关,而EDTA能够络合金属离子,对各酶活力有抑制作用。因此,确定在浸泡液中添加2 mmol/L的MgSO4。

图3 不同浸泡时间对燕麦发芽产酶活力的影响Fig.3 Effects of soaking time on enzymes activity in oats during germination
2.5燕麦发芽过程中各酶活力的变化趋势
综合上述优化结果,将燕麦的浸泡温度设定为15 ℃,浸泡时间为8 h,浸泡水中添加2 mmol/L的MgSO4,在燕麦发芽过程中,总淀粉酶、α-淀粉酶、蛋白酶和纤维素酶活力的变化情况见图5所示。总淀粉酶在燕麦发芽过程中的酶活力大小不断增加,其平均增长速率分别为2.28 U/g·d-1(0~6 d)和7.09 U/g·d-1(6~10 d)。在发芽的第10 d后,酶活力增加非常缓慢。α-淀粉酶活力的变化趋势为在发芽的前6 d,酶活力缓慢增加,平均增长速率为1.13 U/g·d-1,在第6~10 d,酶活力增长较快,平均增长速率为4.24 U/g·d-1,第10 d后,α-淀粉酶活力下降。蛋白酶活力在发芽的前8 d一直保持缓慢增长,8 d后,蛋白酶活力下降,但下降速率减慢。纤维素酶活力在发芽期间一直保持增长,发芽前6 d的平均增长速率为0.031 U/g·d-1,6~12 d的平均增长速率为0.19 U/g·d-1。综上所述,确定最佳发芽时间为10 d,各酶活力分别为总淀粉酶54.39 U/g,α-淀粉酶25.3 U/g、蛋白酶0.55 U/g、纤维素酶1.35 U/g。
3 结论
在一定时间范围内,燕麦发芽过程中的含水率、淀粉酶、蛋白酶、纤维素酶活力不断增加。且发芽前的浸泡温度、浸泡时间、金属离子均对酶活性产生一定的影响,确定较佳的浸泡条件为:浸泡温度15 ℃,浸泡时间8 h,添加2 mmol/L的MgSO4。在此条件下
浸泡,16 ℃发芽,发芽时间10 d时,总淀粉酶、α-淀粉酶、蛋白酶、纤维素酶活力分别达到54.39、25.3、0.55和1.35 U/g。
[1]Deepak Mudgil,Sheweta Barak,B S Khatkar. Development of functional yoghurt via soluble fiber fortification utilizing enzymatically hydrolyzed guar gum[J].Food Bioscience,2016,14:28-33.
[2]Prasad R,Alok J,Latha S,et al. Nutritional advantages of oats and opportunities for its processing as value added foods-a review[J]. Journal of Food Science and Technology,2015,52(2):662-675.
[3]Jrg MA,Vera K,Sven BA,Sren B. Molecular activities,biosynthesis and evolution of triterpenoid saponins[J]. Phytochemistry,2011,72(6):435-457.
[4]孙丽华,郭建华,刘乃侨.大麦萌发过程中过氧化物酶酶学特性初探[J].辽宁经济管理干部学院学报,2009(6):64-65.
[5]Stepan K. Study of structural changes in the cells of the stimulated seed sprouts[J]. International Agrophysics,2016,30(4):545-550.
[6]刘宝祥,朴永哲,翟明昌,等.大麦发芽过程中蛋白质组的变化研究[J].食品工业科技,2013(11):108-111.
[7]徐建国,郝艳芳,闫华娟,等.燕麦发芽过程中淀粉及其相关酶活性的动态变化[J].中国粮油学报,2012,27(4):25-27.
[8]付晓燕,胡崇琳,田斌强,等.燕麦发芽过程中酚类物质的变化[J].食品科学,2011,32(5):137-142.
[9]徐托明,田斌强,孙智达,等.燕麦发芽过程中三大营养素的变化[J].天然产物研究与开发,2011(3):534-537.
[10]张秀金,李慧,李再贵.浸泡与发芽处理对于燕麦籽粒中植酸含量的影响[J].农产品加工,2013(9):1-3.
[11]白盼.不同大麦籽粒品质及发芽后蛋白质含量和主要水解酶活力变化的研究[J].中国酿造,2011(12):117-121.
[12]徐康.酶法制备燕麦乳饮料的工艺技术研究[D].暨南大学,2010.
[13]周景祥,王桂芹,余涛.蛋白酶和淀粉酶活性检测方法探讨[J].中国饲料,2001(11):23-25.
[14]于跃,张剑,何德志.纤维素酶活力测定条件研究及其在洗涤剂中的应用[J].日用化学工业,2015,45(8):457-461.
[15]杨铭铎,陈健,张晓宇,等.大豆发芽工艺是优化[J].食品科学,2010,31(20):97-101.
[16]李丽,刘翠兰,吴德军,等.淡竹种子发芽实验研究[J].山东农业科学,2016,48(8):57-60.
[17]袁泉.糙米发芽工艺参数的研究[J].应用技术,2016,(4):117-118.
[18]李珊,管斌,荀娟,等.制麦过程中添加金属离子与赤霉素对大麦发芽过程淀粉酶系影响的研究[J].食品与发酵工业,2009,35(1):82-86.
Effectsofsoakingconditionsonenzymesactivityinoatsduringgermination
ZHANGQiao1,2,DUANZhen-hua1,2,CHENFeng-xue1,DENGChun-li1,2,CHENZhen-lin1,2,*
(1.College of Food and Biological Engineer,Hezhou University,Hezhou 542899,China; 2.Institute of Food Science and Engineering Research,Hezhou University,Hezhou 542899,China)
In order to explore the effect of soaking conditions on the activity of amylase,protease and cellulose formed in the oats germination process,the activity of various enzymes in oats with germination time was measured through soaking the oat seeds in different temperatures,time and solutions with different metal ions. Results revealed that the optimal soaking conditions were 15 ℃ of soaking temperature,8 h of soaking time,2 mmol/L of MgSO4added in the soaking solution. Under these soaking conditions,the activity of total amylase,α-amylase,protease and cellulose were higher when the oats germinated at 16 ℃ for 10 d,with the activity of 54.39,25.3,0.55 and 1.35 U/g,respectively.
oat germination;soaking conditions;enzyme activity;metal ions;amylase
2017-04-18
张巧(1990-),女,硕士研究生,助教,研究方向:农产品研究与开发,E-mail:zq2203@126.com。
*
陈振林(1963-),男,硕士研究生,研究员,研究方向:农产品研究与开发,E-mail:myin182@163.com。
2016年广西果蔬保鲜和深加工研究人才小高地(厅发[2015]41号);广西特聘专家专项经费(厅发[2016]21号)。
TS210.1
A
1002-0306(2017)21-0088-05
10.13386/j.issn1002-0306.2017.21.018
