胃癌组织中eIF-4E和p-4EBP-1蛋白表达的临床意义
2017-11-21张春燕张毅强马丽莉裴晋红
郑 军,张春燕,张毅强,马丽莉,裴晋红
胃癌组织中eIF-4E和p-4EBP-1蛋白表达的临床意义
郑 军1,张春燕2,张毅强1,马丽莉3,裴晋红1
目的探讨eIF-4E和p-4EBP-1蛋白在胃癌组织中的表达及与临床病理特征的关系。方法采用免疫组化SP法检测eIF-4E和p-4EBP-1蛋白在168例胃癌和52例癌旁胃组织中的表达。结果eIF-4E和p-4EBP-1蛋白在胃癌组织中的阳性率显著高于癌旁胃组织(P=0.001,P=0.000);有淋巴结转移的胃癌组织中eIF-4E和p-4EBP-1蛋白阳性率高于无淋巴结转移的胃癌(P=0.025,P=0.001);临床Ⅲ+Ⅳ期胃癌eIF-4E和p-4EBP-1蛋白阳性率高于临床Ⅰ+Ⅱ期胃癌(P=0.001,P=0.049);胃癌组织中eIF-4E和p-4EBP-1蛋白表达呈显著正相关(r=0.432,P<0.01);eIF-4E蛋白阴性胃癌患者生存时间明显高于阳性患者(P=0.012)。结论eIF-4E和p-4EBP-1蛋白共阳性可能在胃癌的发生、发展和侵袭转移过程中起重要作用,有望成为胃癌判断预后及诊治的新分子靶标。
胃肿瘤;eIF-4E;p-4EBP-1
胃癌是最常见的消化道恶性肿瘤,虽然手术治疗是早期胃癌的主要治疗手段,但仍有60%的患者出现复发、转移,另有50%以上患者发现时已为晚期,5年生存率仍低于30%[1-2]。目前,胃癌的发病机制仍不清楚,细胞信号通路异常活化是肿瘤发生、发展的分子基础,真核细胞翻译起始因子-4E(eukaryotic initiation factor 4E, eIF-4E)是多条信号通路的中心集结点,与多种人类恶性肿瘤的发生、发展密切相关。AKT/mTOR信号通路调控的4EBPs磷酸化可促进eIF-4E与eIF-4G相互作用组装形成eIF-4F复合物,激活帽依赖性肿瘤相关蛋白翻译[3-6]。目前,eIF-4E和p-4EBP-1在胃癌中的作用机制及与临床病理特征的相关性少有报道,本文探讨eIF-4E和p-4EBP-1蛋白表达与胃癌临床病理特征及与患者预后的相关性,为eIF-4E在胃癌中的发病机制研究奠定基础。
1 材料与方法
1.1一般资料收集长治医学院附属和平医院2009年5月~2015年5月病理科存档的石蜡标本合计220例(均未进行治疗),其中168例为胃癌组织,52例为癌旁组织标本,165例胃癌患者具有完整的临床随访资料。168例胃癌中,男性98例,女性70例;年龄>55岁者122例,≤55岁者46例;TNM临床分期:Ⅰ+Ⅱ期36例,Ⅲ+Ⅳ期132例;有淋巴结转移者108例,无淋巴结转移者60例;分化程度:高+中分化65例,低+未分化103例。
1.2免疫组化采用免疫组化SP法检测eIF-4E和p-4EBP-1蛋白在组织中的表达。兔抗人单克隆抗体eIF-4E和p-4EBP-1购于Epitomics公司。免疫组化SP法(EnVision+Dual Link System-HRP Kit,辣根过氧化物酶HRP标记)检测试剂盒购于福州迈新公司。切片脱蜡、水化、3%H2O2阻断内源性过氧化物酶30 min,置于0.01 mol/L柠檬酸盐缓冲液中,微波炉抗原修复15 min;正常非免疫血清封闭30 min;滴加一抗eIF-4E和p-4EBP-1 4 ℃孵育过夜。加二抗于室温(25 ℃)30 min。DAB显色,苏木精复染,中性树胶封固。试剂提供的阳性对照片作阳性对照,PBS代替一抗作为阴性对照。
1.3结果判断eIF-4E蛋白主要表达于细胞核,p-4EBP-1蛋白主要表达于细胞质。结果由两位资深病理专家评判:(1)根据阳性染色强度判断:细胞无阳性染色为0分;细胞呈黄、浅棕色为1分;细胞染成棕色并无背景染色,或细胞呈深棕色、有浅棕色背景为2分;细胞呈深棕色,无背景着色为3分。(2)根据阳性细胞数计分:无阳性细胞为0分;阳性细胞数≤25%为1分;25%~50%为2分;>50%为3分。将两项得分结果相乘:0~1分为阴性,>2分为阳性。
1.4统计学处理利用SPSS 18.0软件进行χ2检验,检测eIF-4E和p-4EBP-1蛋白表达与胃癌临床病理特征的相关性;Spearman相关分析检测eIF-4E和p-4EBP-1蛋白在胃癌组织中表达的相关性;Kaplan-Meier生存分析eIF-4E和p-4EBP1蛋白表达与胃癌患者存活时间的相关性。
2 结果
2.1eIF-4E和p-4EBP-1蛋白在胃癌及癌旁正常胃组织中的表达eIF-4E蛋白主要表达于细胞核(图1)。p-4EBP-1蛋白主要表达于细胞质(图2)。eIF-4E和p-4EBP-1蛋白在胃癌组织中阳性率分别为78%(131/168)、73%(123/168),在癌旁胃组织中阳性率分别为35%(18/52)、17%(9/52);eIF-4E和p-4EBP-1在胃癌组织中的阳性率分别显著高于癌旁胃组织(P=0.001,P=0.000,图3)。

①②
图1胃癌细胞核eIF-4E阳性,SP法
图2胃癌细胞质p-4EBP-1阳性,SP法
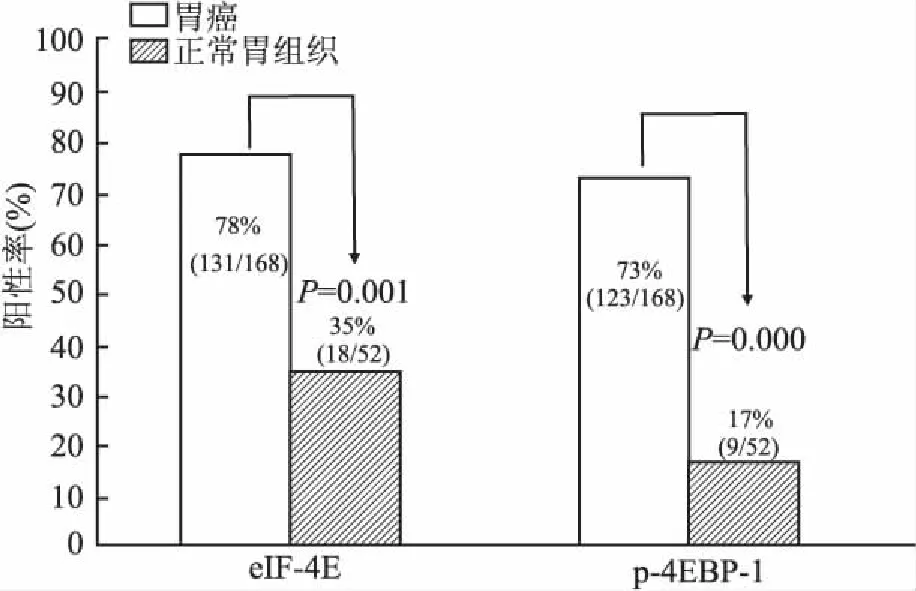
图3 eIF-4E和p-4EBP-1在胃癌及癌旁胃组织中的表达
2.2eIF-4E和p-4EBP-1蛋白表达与胃癌临床病理特征的关系eIF-4E和p-4EBP-1蛋白在有淋巴结转移的胃癌组织中表达高于无淋巴结转移的胃癌组织(P=0.025,P=0.001);eIF-4E和p-4EBP-1蛋白在临床Ⅲ+Ⅳ期胃癌组织中的表达高于Ⅰ+Ⅱ期(P=0.001,P=0.049);eIF-4E和p-4EBP-1表达与患者年龄、性别、分化程度无关(P>0.05,表1)。

表1 eIF-4E和p-4EBP-1蛋白表达与胃癌临床病理特征的关系
2.3eIF-4E和p-4EBP-1蛋白在胃癌中表达的相关性168例胃癌中,eIF-4E和p-4EBP-1蛋白在胃癌中的表达呈显著正相关(r=0.432,P<0.01,表2)。

表2 eIF-4E和p-4EBP-1蛋白在胃癌中表达的相关性
Spearman相关性分析,*r=0.432,P<0.01
2.4eIF-4E和p-4EBP-1蛋白表达与胃癌患者生存时间的相关性Kaplan-Meier生存分析显示(图4),eIF-4E蛋白阴性胃癌患者生存时间明显高于阳性患者,差异具有显著性(P=0.012);而p-4EBP-1蛋白阳性和阴性胃癌患者生存时间差异无统计学意义(P=0.134)。
3 讨论
肿瘤的发生常常伴随多条信号转导通路的异常激活,eIF-4E是多条信号转导通路的共同衔接点。文献报道,eIF-4E的表达上调可以促进多种肿瘤相关蛋白(如VEGF、Cyclin D1、Survivin、c-myc和MMP-9等)表达,与肿瘤发生、发展密切相关。eIF-4E蛋白过表达在多种人类恶性肿瘤(如肺癌、乳腺癌、白血病、卵巢癌和头颈部癌等)中已被证实,并与恶性转化及不良预后密切相关,抑制eIF-4E表达可有效抑制肿瘤细胞生长、转化和侵袭[3-7]。Liang等[8-9]报道,eIF-4E在胃癌组织中的表达远高于癌旁正常胃组织,这与本组实验结果相同。但eIF-4E的表达与胃癌临床病理特征的关系尚存在争议,本组实验显示,eIF-4E在有淋巴结转移和临床Ⅲ+Ⅳ期胃癌组织中的表达高于无淋巴结转移和临床Ⅰ+Ⅱ期的胃癌组织,Liang等[8]认为eIF-4E表达与淋巴结转移、临床分期无关,而与远处转移相关。提示eIF-4E可能在胃癌的致癌作用中起重要作用,与胃癌的侵袭和恶性转化的关系还需进一步证实。
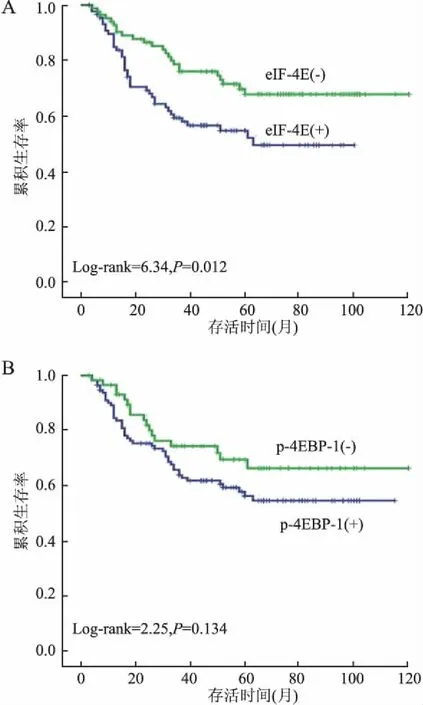
图4 eIF-4E(A)和p-4EBP-1(B)蛋白表达与胃癌患者生存时间的相关性
4EBP1是负性调控蛋白,受AKT/mTOR信号转导通路的调控。4EBP1高表达抑制细胞的生长和增殖,而磷酸化4EBP1失去与eIF-4E的结合,从而促进致瘤相关蛋白的合成。许多研究认为Rapamycin 抑制mTOR mRNA的表达,进而抑制4EBP1磷酸化水平,可有效地抑制淋巴瘤、胃癌、骨肉瘤等肿瘤细胞的增殖,诱导其凋亡[4,10-11]。本组结果与Tapia等[9]的研究均显示p-4EBP-1高表达于胃癌组织,说明p-4EBP-1可能表现出致癌的潜能。本组实验结果显示,p-4EBP-1与淋巴结转移和临床分期相关,这与Lee等[12]的研究结果一致,说明p-4EBP-1可能在细胞信号转导通路中起瓶颈作用,在胃癌的临床进展中起重要作用。对eIF-4E和p-4EBP-1蛋白表达相关性分析显示,两者在胃癌组织中的表达呈显著正相关,且eIF-4E阳性的胃癌组织恶性程度高患者生存时间短。因此,eIF-4E和p-4EBP-1蛋白可能协同促进胃癌的发生、发展,有望为胃癌的临床诊治提供新的分子靶标。作者下一步准备通过体外实验靶向抑制eIF-4E的活性,探讨eIF-4E在胃癌发生、发展中的具体分子机制,从而寻找靶向治疗胃癌的新策略。
[1] Ferlay J, Soerjomataram I, Dikshit R,etal. Cancer incidence and mortality worldwide: sources, methods and major patterns in globocan 2012[J]. Int J Cancer, 2015,136(5):E359- E386.
[2] Oba K, Paoletti X, Bang Y J,etal. Role of chemotherapy for advanced/recurrent gastric cancer: an individualpatient-data meta-analysis[J]. Eur J Cancer, 2013,49(7):1565-1577.
[3] Bitterman P B, Polunovsky V A. eIF4E-mediated translational control of cancer incidence[J]. Biochim Biophys Acta, 2015,1849(7):774-780.
[4] So L, Lee J, Palafox M,etal. The 4E-BP-eIF4E axis promotes rapamycin-sensitive growth and proliferation in lymphocytes[J]. Sci Signal, 2016,9(430):ra57.
[5] Modrak-Wojcik A, Gorka M, Niedzwiecka K,etal. Eukaryotic translation initiation is controlled by cooperativity effects within ternary complexes of 4E-BP1, eIF4E, and the mRNA 5′ cap[J]. FEBS Lett, 2013,587(24):3928-3934.
[6] Liu T, Li R, Zhao H,etal. eIF4E promotes tumorigenesis and modulates chemosensitivity to cisplatin in esophageal squamous cell carcinoma[J]. Oncotarget, 2016,7(41):66851-66864.
[7] Chen B, Zhang B, Xia L,etal. Knockdown of eukaryotic translation initiation factor 4E suppresses cell growth and invasion, and induces apoptosis and cell cycle arrest in a human lung adenocarcinoma cell line[J]. Mol Med Rep, 2016,13(4):3384.
[8] Liang S, Guo R, Zhang Z,etal. Upregulation of the eIF4E signaling pathway contributes to the progression of gastric cancer, and targeting eIF4E by perifosine inhibits cell growth[J]. Oncol Rep, 2013,29(6):2422-2430.
[9] Tapia O, Riquelme I, Leal P,etal. The PI3K/AKT/mTOR pathway is activated in gastric cancer with potential prognostic and predictive significance[J]. Virchows Arch, 2014,465(1):25-33.
[10] Kim S T, Kim S Y, Klempner S J,etal. Rapamycin-insensitive companion of mTOR (RICTOR) amplification defines a subset of advanced gastric cancer and is sensitive to AZD2014-mediated mTORC1/2 Inhibition[J]. Ann Oncol, 2016,28(3):547-554.
[11] Campbell L, Jasani B, Griffiths D F,etal. Phospho-4e-BP1 and eIF4E overexpression synergisti- cally drives disease progression in clinically confined clear cell renal cell carcinoma[J]. Am J Cancer Res, 2015,5(9):2838-2848.
[12] Lee H W, Park M I, Kim M S,etal. Overexpression of phosphorylated 4E-binding protein 1 and its clinicopathological significances in gastric cancer[J]. Pathol Res Pract, 2015,211(4):298-302.
ClinicalsignificanceofexpressionofeIF-4Eandp-4EBP-1proteininthegastriccarcinoma
ZHENG Jun1, ZHANG Chun-yan2, ZHANG Yi-qiang1, MA Li-li3, PEI Jin-hong1
(1DepartmentofBiochemistry,ChangzhiMedicalCollege,Changzhi046000,China;2DepartmentofObstetrics,ChangzhiMedicalCollege,Changzhi046000,China;3DepartmentofPathology,ChangzhiMedicalCollege,Changzhi046000,China)
PurposeTo study the expression of eIF-4E and p-4EBP-1 and its clinical significance in the gastric carcinoma.MethodsExpression of eIF-4E and p-4EBP-1 was detected in tissue array including 168 cases of gastric carcinoma and 52 cases of peri-cancer tissues by immunohistochemical SP method.ResultsThe positive expression of eIF-4E and p-4EBP-1 in the gastric carcinoma was significantly higher than that of peri-cancer tissues (P=0.001,P=0.000). There was significantly higher expression of eIF-4E and p-4EBP-1 with lymph node metastases than without lymph node metastases in the gastric carcinoma (P=0.025,P=0.001). Also, there was significantly higher expression of eIF-4E and p-4EBP-1 with clinical stages Ⅲ+Ⅳ than that of stagesⅠ+Ⅱ(P=0.001,P=0.049). In addition, there was a significantly positive correlation between the expression of eIF-4E and p-4EBP-1 in the gastric carcinoma (r=0.432,P<0.01). The overall survival rates for patients with negative expression of eIF-4E protein was higher than that with positive expression (P=0.012).ConclusionThe abnormal co-expression of eIF-4E and p-4EBP-1 may be related to the tumorgenesis, development, metastasis and invasion of gastric carcinoma, and eIF-4E and p-4EBP-1 may act as the new molecular targets for the therapy and diagnosis of gastric carcinoma.
gastric neoplasms; eIF-4E; p-4EBP-1
R 735.2
A
1001-7399(2017)10-1078-04
时间:2017-10-23 13:30 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.004.html
10.13315/j.cnki.cjcep.2017.10.004
接受日期:2017-04-09
长治医学院科技创新项目(CX201502)
1长治医学院生化教研室,长治 046000
2长治医学院附属和平医院妇科,长治 046000
3长治医学院病理科,长治 046000
郑 军,男,硕士,讲师。E-mail: zhengjun8983@163.com
裴晋红,女,硕士,副教授,通讯作者。E-mail: 13096562305@163.com
