不同产地博落回离体培养与植株再生研究△
2017-11-21徐敏宋锡帅黄鹏唐其唐昭山刘薇
徐敏,宋锡帅,黄鹏,唐其,唐昭山,刘薇,3*
(1.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128;2.湖南美可达生物资源股份有限公司,湖南 长沙 410128;3.湖南农业大学分析测试中心,湖南 长沙 410128)
·中药农业·
不同产地博落回离体培养与植株再生研究△
徐敏1,宋锡帅1,黄鹏1,唐其1,唐昭山2,刘薇1,3*
(1.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128;2.湖南美可达生物资源股份有限公司,湖南 长沙 410128;3.湖南农业大学分析测试中心,湖南 长沙 410128)
目的探索不同产地的博落回离体培养效果差异,为筛选最适博落回植株再生材料提供研究基础。方法采用植物组织培养技术对博落回叶片组织进行愈伤诱导及胚状体分化,并对结果进行分析。结果安徽祁门、湖南炎陵和湖南高坊产地分别在不同培养阶段与其他产地比诱导率和分化率最高。结论湖南高坊和安徽祁门的愈伤组织和胚状体的诱导及分化能力优于其他产地的样本。因此,不同产地叶片离体培养效果差异显著。
博落回,体细胞胚胎发生,离体培养,植株再生
血根碱(sanguinarine,SAN)属于苄基异喹啉类生物碱(BIAs),主要分布于罂粟科等植物中[1]。SAN具有调节畜禽类肠道菌群和抗炎促生长的作用,已作为饲用抗生素的替代品在欧洲等地区广泛销售[2]。目前血根碱只能从植物中提取,主要来源于博落回Macleayacordata(Willd.) R.Br.。该植物属于罂粟科博落回属植物,主要分布于中国、东亚、北美洲和欧洲[3]。随着2006年欧盟全面禁止在饲料中添加抗生素使得市场对血根碱的需求逐年增长,而博落回作为血根碱的主要来源植物因野生资源连年大规模的人工采集后严重影响到了野生资源可采收量。因此,我们找到一种新的血根碱来源的资源获取途径是一个值得关注的技术。
植物组织培养是以细胞的全能性以及植物的再生作用为理论基础建立的一种离体培养技术。植物体细胞胚胎发生是植物组织或细胞在离体条件下,通过培养条件诱导不断产生非合子胚,并萌发成完整植物体的形态发生过[4]。植物体细胞胚胎发生技术已经被用于多种药用植物次生代谢产物生产,如西洋参、刺五加、半夏、铁皮石斛等[5-7]。通过该方法能够获得遗传相对稳定的再生植株并且能够为遗传转化和人工种子制作提供理想的实验体系。
本实验室前期通过对8个不同产地的博落回花药进行组织培养并对诱导产生单倍体植株的因素进行研究,建立了稳定高效的博落回花药离体培养以及植株再生体系[8]。同时,我们在对博落回全基因组测序植株进行离体培养时发现不同产地来源的博落回叶片的愈伤诱导率具有明显差异,而这一现象在其他植物中也有报道[9]。为了深入研究该现象,我们以8个不同产地的博落回叶片作为外植体进行组织培养,并对其叶片诱导成愈伤组织、愈伤组织分化成胚状体以及胚状体分化成苗的现象进行分析,为完善博落回体细胞胚胎发生体系提供技术支撑。
1 材料与方法
1.1 试验材料及培养基配方
供试材料为不同产地的博落回叶片及对应编号见表1,均采自湖南农业大学国家中药材生产(湖南)技术中心的博落回种质资源圃。由来自8个不同产地的野生博落回叶片经组织培养后而产生的博落回再生植株。不同类型培养基配方见表2。

表1 博落回产地来源编号

表2 培养基配方
注:+代表已添加该试剂,-代表未添加该试剂。
1.2 外植体培养的过程
从健康博落回植株上采集叶片,放入自封袋并置于采样盒内,然后置于4 ℃的冰箱中冷藏3 d。取出用无菌水浸泡30 min,75%酒精浸泡10 s,再用无菌水冲洗3次,然后用0.1%的HgCl2(升汞)浸泡7 min,最后用无菌水冲洗5次。在超净工作台下将叶片剪成约0.5×0.5 cm2见方,然后将其接种到愈伤诱导培养基上,每皿接种9个叶片,每个产地接种30皿,放在光照强度2000 lx、光照时间16 h·d-1、恒温25 ℃的恒温培养箱中进行培养。经过40 d的诱导培养后,统计其愈伤诱导率,然后将形态健康的愈伤组织接种在增殖培养基上进行继代增殖,每隔10 d继代一次,继代2次后将初步形成的愈伤组织分别接种在胚状体诱导培养基和分化培养基上,每皿接种6块愈伤组织,每个产地接种30皿,放在光照强度2000 lx、光照时间16 h·d-1、恒温25℃的光照培养箱中进行培养,接种在培养基上20 d后统计其出胚率及分化率,每个产地均重复三次。
1.3 实验观察及记录
在相应的培养基上培养一定时间后,统计愈伤诱导率、胚状体发生率、分化率。相应的计算公式如下:

1.4 数据统计与分析方法
对不同产地的愈伤诱导率、胚状体发生率以及分化率数据使用SPSS 19.0软件分别进行统计学分析。采用3次重复实验数据的平均值±标准差并对结果用Duncan’s multiple range test(邓肯多个范围测试)方法进行分析,同一列不同字母表示显著性差异。
2 结果
2.1 不同产地叶片愈伤诱导率差异分析
博落回叶片经培养基诱导后产生愈伤组织(图1)。表3为8个不同产地叶片的愈伤诱导率。结果显示,在所有8个产地中,安徽祁门(MCQ)的愈伤诱导率最高,达到了约44.9%;湖南高坊(MCG)其次,其愈伤诱导率约为39.4%;贵州凯里(MCL)的愈伤诱导率最低,只达到了约9.6%;另外,编号为福建光泽(MCZ)和贵州松桃(MCS)的叶片未能诱导出愈伤组织。

表3 不同产地来源的博落回叶片愈伤诱导率比较
注:采用3次重复实验数据的平均值±标准差并对结果用Duncan’s multiple range test 方法进行分析,同一列不同字母表示显著性差异(P<0.05,n=3)小写字母代表是在0.05水平下比较,差异显著。

图1 叶片诱导成愈伤组织
2.2 不同产地来源对胚状体诱导的影响
博落回愈伤组织经诱导培养成胚状体(图2)。编号为浙江开化(MCK)、湖南高坊(MCG)、贵州凯里(MCL)、安徽祁门(MCQ)、湖南炎陵(MCY)、重庆秀山(MCX)的愈伤组织经过一段时间培养均有胚状体产生(表4)。其中胚状体发生率最高的是湖南炎陵(MCY),达到了约39.4%,重庆秀山(MCX)的胚状体发生率最低,仅约为15.4%。

表4 不同产地来源的博落回胚状体发生率比较
注:采用3次重复实验数据的平均值±标准差并对结果用Duncan’s multiple range test 方法进行分析,同一列不同字母表示显著性差异(P<0.05,n=3)小写字母代表是在0.05水平下比较,差异显著。

图2 愈伤组织培养成胚状体
2.3不同产地来源愈伤组织分化成不定芽的影响
博落回愈伤组织分化成不定芽(图3)。6份供试材料中所形成的愈伤组织经过分化培养基的培育,均发现了不同程度的不定芽产生,但是总体而言其分化成不定芽的几率都小于通过胚状体途径进行分化。通过表5可以知道,不同产地来源的博落回的愈伤组织分化成苗的能力是不相同的。其中分化率最高的是湖南高坊(MCG),约为21.5%,分化率最低为重庆秀山(MCX),仅约为3.6%。

表5 不同产地来源的博落回愈伤组织分化率比较
注:采用3次重复实验数据的平均值±标准差并对结果用Duncan’s multiple range test 方法进行分析,同一列不同字母表示显著性差异(P<0.05,n=3)小写字母代表是在0.05水平下比较,差异显著。

图3 为愈伤组织分化成不定芽
2.4 不同产地来源对胚状体分化成不定芽的影响
博落回胚状体分化成不定芽(图4)。通过表6可知,通过胚状体发生的途径得到不定芽的几率都比较高,即便是分化率最低的贵州凯里(MCL)其分化率都达到了约54.4%,湖南高坊(MCG)的胚状体的分化率甚至高达约91.4%,其他产地来源的博落回组培产生的胚状体的分化率基本上都达到了50%以上。
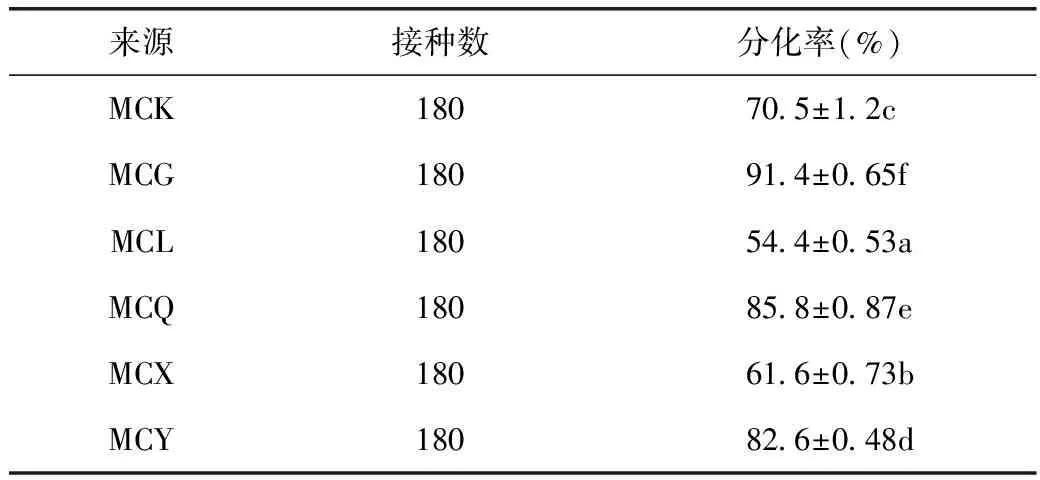
表6 不同产地来源的博落回胚状体分化率比较
注:采用3次重复实验数据的平均值±标准差并对结果用Duncan’s multiple range test 方法进行分析,同一列不同字母表示显著性差异(P<0.05,n=3)小写字母代表是在0.05水平下比较,差异显著。

图4 为胚状体分化成不定芽
3 讨论
博落回具有较好的药用价值和广阔的市场前景,利用植物组织培养等技术对博落回资源的可持续开发及研究具有重要的意义。本课题组在前期研究中已实现博落回植株再生、快繁以及花药离体培养并初步建立了博落回遗传转化体系[8,10],为下一步的博落回单倍体育种及分子育种提供了前期基础。本研究在前期研究基础上进一步对不同产地的博落回叶片离体培养效果差异进行研究,发现不同产地叶片在不同阶段的离体培养效果差异显著。其中MCQ产地在第一阶段(叶片诱导产生愈伤)中诱导率最高;MCY在第二阶段(愈伤到胚状体阶段的胚状体)中胚状体发生率最高;而MCG在另外两个阶段(愈伤组织分化成不定芽和胚状体分化成不定芽阶段)中分化率最高。这种差异现象的发生可能是由于不同产地的博落回基因型不同导致的。在其他物种中,研究人员发现[11-14]在不同基因型的草莓离体叶片中不定芽诱导再生率差异显著。除了草莓以外,不同基因型对于辣椒的花药离体培养胚状体诱导率具有决定性的影响[15]。虽然本实验对不同产地博落回叶片的离体培养效果进行了初步探索但是并未关注每个阶段的增殖率,所以下一步将对不同产地的博落回组培的愈伤组织及胚状体的增殖率进行研究。同时,本实验仅对博落回叶片组织进行离体培养,而未对茎段,叶柄,根等部位进行离体培养,因此下一步将对这些部位的离体培养效果进行探讨。另外,对于造成不同产地博落回离体培养效果差异的原因及其机制将在下一步的实验中进行探讨。
[1] Zeng J,Liu Y,Liu W,et al.Integration of transcriptome,proteome and metabolism data reveals the alkaloids biosynthesis in Macleaya cordata and Macleaya microcarpa[J].PLoS One,2013,8(1):e53409.
[2] Windisch W,Schedle K,Plitzner C,et al.Use of phytogenic products as feed additives for swine and poultry[J].J Anim Sci,2008,86(14 Suppl):E140-E148.
[3] 刘秀斌.博落回属植物中生物碱代谢累积研究[D].长沙:湖南农业大学,2012.
[4] 陶雷.刺五加体细胞胚发生机制的初步研究[D].黑龙江:东北林业大学,2013.
[5] Manoharan Rajesh G S K S.Establishment of somatic embryogenesis and podophyllotoxin production in liquid shake cultures of Podophyllum hexandrum Royle[J].Industrial Crops and Products,2014,60(1):66-74.
[6] 江艳华.半夏规范化种植关键技术及组培快繁体系建立的研究[D].北京:北京协和医学院,2013.
[7] 罗成科,彭正松,陈卫民.三叶半夏悬浮培养下的体细胞胚胎发生及植株再生[J].西北植物学报,2006,126(4):842-846.
[8] 宋锡帅,彭琼,柳亦松,等.博落回花药离体培养及植株再生研究[J].湖南农业科学,2014(7):28-31.
[9] 张建瑛,许传玲,沈海龙,等.不同产地花楸树愈伤组织诱导和体胚发生比较分析[J].北方园艺,2014(13):102-105.
[10] 卓奕秀,柳亦松,谢红旗,等.博落回遗传转化体系的初步建立[J].生命科学研究,2016,20(3):224-229.
[11] 吴雪梅,汤浩茹.草莓叶片培养研究进展[J].北方园艺,2004,21(6):8-10.
[12] 邓馨,胡文玉.草莓叶片再生芽及遗传转化系统的建立[J].植物学通报,2000,17(2):174-178.
[13] Passey A J,Barrett K J,James D J.Adventitious shoot regeneration from seven commercial strawberry cultivars (Fragaria x ananassa Duch.) using a range of explant types[J].Plant Cell Rep,2003,21(5):397-401.
[14] Passey A J,Barrett K J,James D J.Adventitious shoot regeneration from seven commercial strawberry cultivars (Fragaria x ananassa Duch.) using a range of explant types[J].Plant Cell Rep,2003,21(5):397-401.
[15] 孙少霞,戈伟,王述彬,等.甜(辣)椒花药培养胚状体诱导与植株再生[J].江苏农业学报,2009,25(6):1330-1334.
StudyonVitroCultureandPlantRegenerationofMacleayacordata
XU Min1,SONG Xishuai1,HUANG Peng1,TANG Qi1,TANG Zhaoshan2,LIU Wei1,3*
(1.NationalandLocalUnionEngineeringResearchCenterfortheVeterinaryHerbalMedicineResourcesandInitiative,HunanAgriculturalUniversity,Changsha410128,China;2.MicolltaBioresourceInc,Changsha410128,China;3.CenterOfAnalyticServiceHunanAgricultureUniversity,Changsha410128,China)
Objective:To explore the differenle of different regions vitro culture ofMacleayacordataand provide data for screening the optimal plant regeneration materials.MethodsThe leaves ofM.cordatawere isolated to callus induction and differentiation of leaves into embryos by using plant cell culture technology and the results differentiation was analyzed.ResultsThe samples from Qimen of Anhui,Yanling of Hunan and Gaofang of Hunan had the highest induction and differentiation rate compared with others in different periods.ConclusionThe induction and the differentiation ability of callus and embryos bodies from Gaofang of Hunan and Qimen of Anhui were superior to those from other regions.Therefore,the vitro culture effect of leaves from different regions was significant difference.
Macleayacordata,somatic embryo genesis,vitro culture,plant regeneration
湖南省科技重点计划(2016SK3002);湖南省教育厅科学研究项目(16C0769);博落回血根碱/白屈菜红碱生物合成关键酶-P6H的功能研究(2016JJ4040)
*
刘薇,实验师,研究方向:化学成分分析与检测;Tel:(0731)84673824 E-mail:37892293@qq.com
10.13313/j.issn.1673-4890.2017.10.014
2017-02-20)
