在模拟人工胃肠道环境中博落回主要生物碱类成分的稳定性特征分析△
2017-11-21张换成陈梅柳亦松唐昭山曾建国刘兆颖
张换成,陈梅,柳亦松,唐昭山,曾建国*,刘兆颖*
(1.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128;2.湖南农业大学 动物医学院,湖南省兽药工程技术研究中心,湖南 长沙 410128;3.湖南美可达生物资源股份有限公司,湖南 长沙 410005)
·基础研究·
在模拟人工胃肠道环境中博落回主要生物碱类成分的稳定性特征分析△
张换成1,2,陈梅1,2,柳亦松1,2,唐昭山3,曾建国1,2*,刘兆颖1,2*
(1.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128;2.湖南农业大学 动物医学院,湖南省兽药工程技术研究中心,湖南 长沙 410128;3.湖南美可达生物资源股份有限公司,湖南 长沙 410005)
目的为解释博落回中4个生物碱(原阿片碱、别隐品碱、血根碱、白屈菜红碱)生物利用低的原因,对这四个生物碱在模拟人工胃肠道环境下的稳定性进行考察。方法采用HPLC测定博落回中4个生物碱在不同pH缓冲液、人工胃液(pH=1.3)和人工肠液(pH=6.8)中的稳定性。结果原阿片碱和别隐品碱在酸性、中性、碱性、人工胃液及人工肠液环境下8 h回收率为97.16%~101.89%;血根碱在pH=6.8磷酸盐缓冲液、水、pH=7.8~8.0 磷酸盐缓冲液及人工肠液中8 h回收率为48.81%~60.53%;白屈菜红碱在pH=5.8磷酸盐缓冲液、pH=6.8磷酸盐缓冲液、水及人工肠液中8 h的回收率为81.21%~93.48%;在pH=7.8~8.0 磷酸盐缓冲液中8 h回收率为57.43%。结论原阿片碱和别隐品碱的稳定性不受pH的影响,血根碱和白屈菜红碱随pH升高稳定性降低,博落回中4个生物碱在模拟人工胃肠道环境中的稳定性结果与其在不同pH环境中一致,为阐明博落回散在体内的药代动力学特点提供科学依据。
博落回;血根碱;白屈菜红碱;胃肠道稳定性
博落回Macleayacordata(Willd.)R.Br.属于罂粟科博落回属植物,主要分布于中国西北以及西南部、东南亚、北美洲和欧洲,在中国已有1000多年的用药历史[1]。国内外研究表明,博落回具有抗菌[2]、杀虫[3-5]、抗炎[6]、抗肿瘤[7-9]、改善肝功能和增强免疫力[10]、调节肠道菌群[11]、抗血小板聚集[12]等作用。博落回已被开发为不同的产品,广泛应用于家禽疾病治疗、饲料添加、生物杀虫、能源调节等领域[13]。长久以来,国内外学者对博落回的研究主要集中在其化学成分和药理作用[14],博落回中生物碱的胃肠道稳定性研究少见报道。目前国内外文献报道了约30个博落回生物碱[13],其中4个主要生物碱(原阿片碱、别隐品碱、血根碱、白屈菜红碱)具有显著生物活性[15]。有文献报道,血根碱在给药后,主要分布在肠道,生物利用度偏低[16]。在不同pH介质中,血根碱存在亚胺型(SA+)和烷基醇胺型(SAOH)两种形式,pH小于6时主要以亚胺型(SA+)存在[17-18]。本实验室怀疑血根碱生物利用度低与胃肠道的pH值有关,因此本文采用离体实验法[19-20]分别考察博落回中原阿片碱、别隐品碱、血根碱、白屈菜红碱在不同pH缓冲液、人工胃液、人工肠液中的稳定性,为阐明博落回中4个生物碱的药物代谢动力学提供科学依据。
1 仪器与试药
Agilent 1260高效液相色谱仪(美国Agilent公司),Agilent 5 TC-C18色谱柱(250 mm×4.6 mm,5 μm);KQ-5200DE型超声波清洗器(昆山市超声仪器有限公司);AE240型电子天平(上海梅特勒-托利多仪器有限公司);HERMLE Z323K型低温高速离心机(德国Hermle公司);Milli-Q Advantage A10系统(美国MILLPORE公司)。
原阿片碱(纯度>98%)、别隐品碱(纯度>98%)、血根碱(纯度>95%)和白屈菜红碱(纯度>95%)由湖南美可达生物资源有限公司提供;胃蛋白酶(1∶10 000)、胰蛋白酶(1∶250),购自美国Sigma公司;乙腈、甲醇为色谱纯,水为超纯水,盐酸、氢氧化钠、磷酸氢二钾、磷酸二氢钾为分析纯。
2 方法
2.1 色谱条件
参照本实验室方法[21]改进。色谱柱:Agilent 5 TC-C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.2%甲酸溶液,按程序洗脱(0~14 min,乙腈25%;14~27 min,乙腈25%~60%;27~29 min,乙腈60%~25%;29~35 min,乙腈25%);流速:0.8 mL·min-1;检测波长:284 nm;柱温:35 ℃;进样量:10 μL。
2.2 稳定性考察
2.2.1 储备液的配制 分别精密称取原阿片碱、别隐品碱、血根碱、白屈菜红碱5.0 mg,置于50 mL容量瓶内,用甲醇溶液定容。
2.2.2 溶液制备
2.2.2.1 不同pH溶剂制备 按照《中华人民共和国药典》2010年版二部附录,配制pH=1盐酸液、pH=2.5磷酸盐缓冲液、pH=5.8磷酸盐缓冲液、pH=6.8磷酸盐缓冲液、水、pH=7.8~8.0磷酸盐缓冲液。
2.2.2.2 供试液制备 精密移取储备液1 mL于10 mL容量瓶中,分别加入上述6种溶液,定容,摇匀,置37 ℃恒温水浴锅,分别于0、0.5、1、2、4、6、8 h取样0.8 mL置于2.0 mL离心管中,加入0.8 mL甲醇,混合,摇匀,离心(12 000 r·min-1)1 min,上清液过0.22 μm微孔有机滤膜。
2.2.2.3 实验方法 取上述供试液按照2.1项下条件进行HPLC分析。
2.2.3 人工胃液和人工肠液
2.2.3.1 人工胃液制备 取浓盐酸9 mL,加至800 mL超纯水中,用1 mol·L-1盐酸调节pH值至1.3;取胃蛋白酶10.0 g溶于100 mL超纯水。两液混合,摇匀,加超纯水稀释至1000 mL。
2.2.3.2 人工肠液制备 精密称取磷酸二氢钾6.8 g,加超纯水溶解至500 mL,用0.4%氢氧化钠溶液调节pH值至6.8;取胰蛋白酶10.0 g溶于100 mL超纯水。两液混合,摇匀,加超纯水稀释至1000 mL。
2.2.3.3 供试液制备 同2.2.2项下,加入溶液为人工胃液和人工肠液。
2.2.3.4 实验方法 取上述供试液按照2.1项下条件进行HPLC分析。
2.3 数据处理
用回收率表示生物碱的稳定性,用单点校正法计算回收率,HPLC分析后记录各生物碱峰面积,按公式(1)计算生物碱回收率。

(1)
3 结果
3.1 博落回中4个生物碱在不同pH条件下的稳定性结果
由图1可知,原阿片碱和别隐品碱在pH=1盐酸液、pH=2.5磷酸盐缓冲液、pH=5.8磷酸盐缓冲液、pH=6.8磷酸盐缓冲液、水、pH=7.8~8.0磷酸盐缓冲液中8 h的回收率为97.16%~101.89%。由此可得,原阿片碱和别隐品碱的稳定性不受pH影响,在酸性、中性、碱性条件下均稳定。
血根碱在pH=1盐酸液、pH=2.5磷酸盐缓冲液中8 h的回收率为100.30%~100.60%;在pH=5.8磷酸盐缓冲液中8 h的回收率为86.63%;在pH=6.8磷酸盐缓冲液、水、pH=7.8~8.0磷酸盐缓冲液中8 h回收率为48.81%~57.14%。由此可得,血根碱的稳定性受pH影响,血根碱在酸性条件下较稳定,在中性和碱性条件下不稳定。
白屈菜红碱在pH=1盐酸液、pH=2.5磷酸盐缓冲液中8 h的回收率为99.75%~100.02%;在pH=5.8磷酸盐缓冲液、pH=6.8磷酸盐缓冲液、水中8 h的回收率为81.21%~93.48%;在pH=7.8~8.0磷酸盐缓冲液中8 h回收率为57.43%。由此可得,白屈菜红碱的稳定性受pH影响,白屈菜红碱在酸性和中性条件下较稳定,在碱性条件下不稳定。
3.2 博落回中4个生物碱在模拟胃肠道环境中的稳定性结果
由图2可知,博落回中4个生物碱在人工胃液中8 h的回收率为99.04%~101.13%,由此可得,博落回中4个生物碱在人工胃液中均稳定。这主要与人工胃液的pH值有较大关系,试验结果与4个生物碱在不同pH溶液中的稳定性结果一致。
原阿片碱和别隐品碱在人工肠液中8 h的回收率为97.76%~100.50%;白屈菜红碱在人工肠液中8 h的回收率为87.89%;血根碱在人工肠液中8 h的回收率为60.53%。由此可得,原阿片碱和别隐品碱在人工肠液中均稳定;白屈菜红碱在人工肠液中较稳定;血根碱在人工肠液中不稳定。这主要与人工肠液的pH有较大关系,实验结果与4个生物碱在不同pH溶液中的稳定性结果一致。
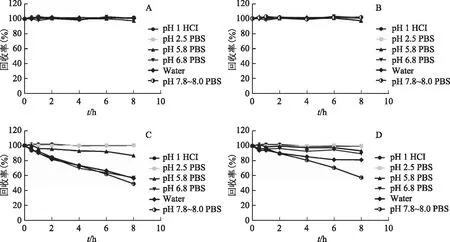
注:A.原阿片碱;B.别隐品碱;C.血根碱;D.白屈菜红碱。图1 博落回中4个生物碱在不同pH条件下的稳定性结果
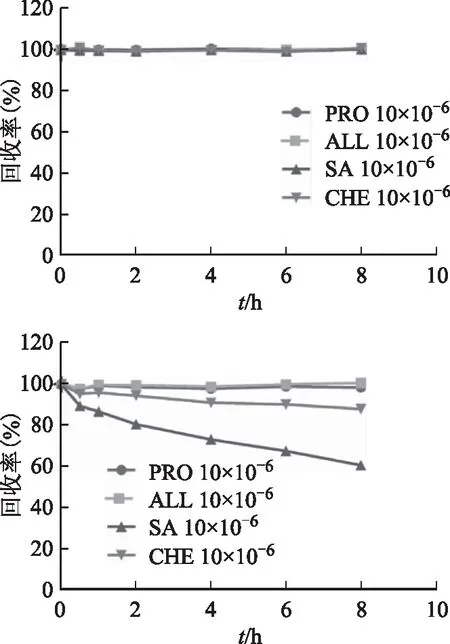
注:A.人工胃液;B.人工肠液。图2 博落回中4个生物碱在模拟人工胃肠道环境中的稳定性结果
4 讨论
药物的溶解性、稳定性、膜通透性和首过作用等生物药剂学性质是影响药物口服后经胃肠道吸收的主要因素。药物在胃肠道中的稳定性直接影响消化道内的母体药物量。消化液中的药物有可能因其在胃肠道的不稳定性而发生化学降解或者酶降解以及在肠道下段被肠内细菌菌丛代谢,从而使得母体药量减少,降低生物利用度[22]。
本实验结果显示,博落回4个生物中原阿片碱和别隐品碱的稳定性不受pH影响,在酸性、中性、碱性条件下均稳定;而血根碱和白屈菜红碱的稳定性均受pH影响。血根碱在酸性条件下较稳定,在中性和碱性条件下不稳定,白屈菜红碱在酸性和中性条件下较稳定,在碱性条件下不稳定。结果与文献报道一致[17-18]。同时,博落回中4个生物碱在模拟胃肠道环境中的稳定性结果和其在不同pH条件下的结果一致。
有研究表明,食物在胃内停留时间为1~2 h,最长达4 h,饭前pH=1~3.5,饭后pH最高达5;食物在小肠内停留时间为3~8 h,pH=6.4~7.4[23-24],营养成分的吸收主要在小肠段。血根碱和白屈菜红碱在胃液中主要以离子形式(SA+)存在,不易被吸收;血根碱和白屈菜红碱在小肠液中主要以分子形式(SAOH)存在,其碱基是亲脂性的,所以比较容易通过亲脂扩散方式被肠道吸收[25]。本实验结果表明,血根碱和白屈菜红碱在人工胃液中稳定,在人工肠液中不稳定,导致其吸收减少,这也可能是血根碱和白屈菜红碱生物利用度较低的原因。
本文采用离体实验法考察博落回中4个生物碱在不同pH缓冲液、人工胃液、人工肠液中的稳定性,对进一步研究博落回中4个生物碱的吸收代谢情况及成药后的剂型设计有一定的指导意义,对解释其药代动力学特点有重要作用。
[1] Sai C M,Li D H,Xue C M,et al.Two pairs of enantiomeric alkaloid dimers fromMacleayacordata[J].Org Lett,2015,17(16):4102-4105.
[2] 王朝元,童胜兰,胡鑫.博落回生物碱成分及其抗菌活性的研究[J].中南民族大学学报(自然科学版),2015,34(1):39-42.
[3] 张胜菊,柯治国,南玉生.博落回抽提物对黄守瓜、菜青虫的田间药效评价[J].华中农业大学学报,2003,22(5):450-451.
[4] 陈昭存,宋清,王素侠,等.博落回防治梨木虱和二斑叶螨药效试验[J].果农之友,2003(8):30.
[5] 袁涛忠,张华生.博落回杀灭蝇蛆效果的实验观察[J].中国寄生虫学与寄生虫病杂志,1999,17(2):66.
[6] Pi G,Ren P,Yu J,et al.Separation of sanguinarine and chelerythrine inMacleayacordata(Willd)R.Br.based on methyl acrylate-co-divinylbenzene macroporous adsorbents[J].J chromatogr A,2008,1192(1):17-24.
[7] 庞建新,马仁强,刘兰梅,等.博落回总碱对肝癌细胞的毒性作用和体内抗肿瘤作用[J].第一军医大学学报,2005,25(3):325-328.
[8] 樊淑莲,焦峰,张园,等.博落回总生物碱对动物移植性肿瘤的作用研究[J].陕西肿瘤医学,2000,8(3):174-149.
[9] 潘岳华.博落回汁治愈肿瘤一例[J].湖北中医杂志,1991,13(3):48.
[10] 杨军,王静,刘信顺,等.博落回的药效研究[J].中药材,1999,22(2):82-85.
[11] Stiborova M,Vostalova J,Zdarilova A,et al.Macleaya cordata extract and Sangrovit genotoxicity.Assessment in vivo[J].Biomedical papers of the Medical Faculty of the University Palacky,Olomouc,Czechoslovakia,2008,152(1):35-39.
[12] Zhang H H,Wu Y,Sun Z L,et al.Identification of sanguinarine metabolites in pig liver preparations by accurate mass measurements using electrospray ionization hybrid ion trap/time-of-flight mass spectrometry[J].Rapid Commun Mass Spectrom,2013,27(9):979-984.
[13] 卿志星,程辟,曾建国.博落回中生物碱质谱裂解规律研究进展[J].中草药,2013,44(20):2929-2939.
[14] 王珂佳,刘芸.药用植物博落回研究进展[J].河南农业,2015(14):62-64.
[15] 刘金凤,黄鹏,柳亦松,等.博落回属植物内生真菌种类与分布差异[J].中国现代中药,2016,18(7):872-876.
[16] Vecera R.,Klejdus B,Kosina P,et al.Disposition of sanguinarine in the rat[J].Xenobiotica,2007,37(5):549-558.
[17] Satpathi S,Gavvala K,Hazra P.Fluorescence switching of sanguinarine in micellar environments[J].Phys Chem Chem Phys,2015,17(32):20725-20732.
[18] Miskolczy Z,Megyesi M,Tarkanyi G,et al.Inclusion complex formation of sanguinarine alkaloid with cucurbit[7]uril:inhibition of nucleophilic attack and photooxidation[J].Org Biomol Chem,2011,9(4):1061-1070.
[19] 戎晓娟,韩阳,蔡晓翠,等.神香草水提取物在模拟胃肠道环境中的稳定性[J].药物分析杂志,2015,35(3):454-459.
[20] 何小解,卢向阳,易著文,等.模拟人体胃肠道环境对儿茶素稳定性的影响[J].湖南农业大学学报(自然科学版),2005,31(5):69-71.
[21] 郭宇鸽,曾建国,谈满良,等.博落回叶与小果博落回叶中4种生物碱的含量比较[J].中南药学,2011,9(11):829-832.
[22] 高坤,孙进,何仲贵.口服药物吸收中的生物药剂学性质[J].沈阳药科大学学报,2007,24(3):186-192.
[23] 张建福,彭聿平,闫长栋.人体生理学[M].北京:高等教育出版社,2007:164-176.
[24] 任大喜,郭鸰,霍贵成.体外模拟法研究生物利用率的影响因素[J].食品科技,2007(3):12-14.
[25] 郑宓,俞昌喜.天然生物碱类药物药代动力学研究的进展[J].海峡药学,2011,23(3):8-11.
StabilityAnalysisofMajorAlkaloidsinMacleayacordataunderSimulatedGastrointestinalEnvironment
ZHANG Huancheng1,2,CHEN Mei1,2,LIU Yisong1,2,TANG Zhaoshan3,ZENG Jianguo1,2*,LIU Zhaoying1,2*
(1.NationalandLocalUnionEngineeringResearchCenterfortheVeterinaryHerbalMedicineResourcesandInitiative,
HunanAgriculturalUniversity,Changsha410128,China;2.NationalandProvincialUnionEngineeringResearchCenterfortheVeterinaryHerbalMedicineResourcesandInitiative,HunanAgriculturalUniversity,Changsha410128,China;3.MicoltaBiologicalResourceINC,Changsha410005,China)
Objective:In order to explain the reasons of low bioavailability of four alkaloids (protopine,allocryptopine,sanguinarine,chelerythrine) inMacleayacordata,the study explored the stability of four alkaloids in the simulated gastrointestinal environment.MethodsA high performance liquid chromatography method was used to determine the stability of four alkaloids inM.cordataunder the environment of different pH media,artificial gastric juice (pH=1.3) and artificial intestinal juice (pH=6.8).ResultsThe recovery rate of protopine and allocryptopine were ranging from 97.16% to 101.89% in the environment of acidic,neutral,alkalinity media,artificial gastric juice and artificial intestinal juice for 8 h.The recovery rate of sanguinarine was 48.81%-60.53% in the environment of pH=6.8 phosphate buffer solution (PBS),water,pH=7.8-8.0 PBS and artificial intestinal juice for 8 h.The recovery rate of chelerythrine was 81.21%-93.48% in the environment of pH=5.8 PBS,pH=6.8 PBS,water and artificial intestinal juice for 8 h,while in the environment of pH=7.8-8.0 PBS for 8 h,the recovery rate of chelerythrine was 57.43%.ConclusionThe stability of protopine and allocryptopine was not affected by pH.While along with the increase of pH,the stability of sanguinarine and chelerythrine was reduced.The stability of four alkaloids inM.cordataunder the simulated gastrointestinal environment accorded with the environment of different pH media.The results provide a scientific basis for clarifying the pharmacokinetic characteristics of Sangrovit.
Macleayacordata;sanguinarine;chelerythrine;gastrointestinal tract stability
湖南省科技重点计划(2016SK3002);湖南省自然科学基金(2017JJ1017)
*
曾建国,博士生导师,教授,研究方向:中药资源与综合利用,Tel:(0731)84673824,E-mail:zengjianguo@hunau.edu.cn;刘兆颖,硕士生导师,副教授,研究方向:兽医药理学与毒理学,E-mail:liu_zhaoying@sina.com
10.13313/j.issn.1673-4890.2017.10.007
2017-02-22)
