D2型细胞质雄性不育小麦绒毡层细胞程序化死亡与活性氧代谢
2017-11-18刘子涵石晓艺闫鹏娇段阳耿兴侠叶佳丽李莎杨雪桐张高明贾雨林张玲丽宋喜悦
刘子涵,石晓艺,闫鹏娇,段阳,耿兴侠,叶佳丽,李莎,杨雪桐,张高明,贾雨林,张玲丽,宋喜悦
D2型细胞质雄性不育小麦绒毡层细胞程序化死亡与活性氧代谢
刘子涵,石晓艺,闫鹏娇,段阳,耿兴侠,叶佳丽,李莎,杨雪桐,张高明,贾雨林,张玲丽,宋喜悦
(西北农林科技大学农学院,陕西杨凌 712100)
D2型细胞质是细胞质雄性不育小麦(cytoplasmic male sterility,CMS)的重要胞质来源,深入研究其败育机理对小麦杂种优势利用具有重要价值。以3种同核异质D2型细胞质雄性不育小麦Va87B1-706A、C687B1-706A、Ju87B1-706A及其相应保持系706B为试材,通过体式显微镜和DAPI染色分别在四分体时期、单核早期、单核晚期、二核期和三核期观察小麦花药的外形和小孢子发育的形态;利用扫描电镜和KI-I2染色分析三核期花药外皮层、内皮层、乌氏体和花粉粒的表型及败育特点;采用石蜡切片和DNA ladder的技术观察不同发育时期D2型不育系和保持系小麦花药绒毡层细胞形态变化特征以及绒毡层细胞程序化死亡(programmed cell death,PCD)的过程;测定花药发育过程中活性氧(reactive oxygen species,ROS)的含量,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(hydrogen peroxidase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的活性以及非酶物质还原型抗坏血酸(ascorbic acid,AsA)和谷胱甘肽(glutathione,GSH)的含量变化;同时利用RT-PCR技术对部分抗氧化酶相关基因的表达模式进行分析。与保持系706B比较,3种D2型细胞质雄性不育小麦在三核期均表现出外皮层表皮褶皱、乌氏体排列稀疏散乱以及小孢子皱缩、表皮粗糙和萌发孔闭合的不育特征,败育类型为典败和染败;自单核晚期开始3种不育小麦的小孢子发生紊乱;石蜡切片观察绒毡层细胞的变化,发现不育系均比保持系延迟一个时期在二核期发生解体,并于三核期完全降解;进一步检测细胞凋亡DNA小片段发现3种不育系花药绒毡层的DNA损伤均起始于单核晚期,绒毡层PCD比保持系延迟一个时期启动,并且优先细胞学表型检测到凋亡;生理指标测定和定量分析的结果说明绒毡层细胞的延迟凋亡和小孢子的结构异常与不育系花药内活性氧的过度积累、抗氧化酶活性的异常变化、非酶促抗氧化物质的严重下调以及部分抗氧化酶相关基因在两系花药中表达水平的严重差异密切相关。D2型细胞质雄性不育小麦败育的关键时期是单核晚期,绒毡层PCD的延迟启动诱导了活性氧的过量积累,进一步破坏了抗氧化防御系统的平衡,进而造成绒毡层细胞形态异常,最终导致D2型细胞质雄性不育小麦的败育。
小麦;D2型细胞质雄性不育;绒毡层细胞程序化死亡;活性氧代谢;基因表达
0 引言
【研究意义】作物杂种优势是自然界普遍存在的一种生物学现象,实践证明杂交种具有产量高,品质优以及抗性强等优势[1],许多植物杂交种的大面积推广已取得一定的经济效益[2]。因此,深入研究与开发利用作物杂种优势在提高小麦的品质和单位面积产量等方面具有重要作用,而雄性不育是实现杂种优势利用的一条重要途径,对雄性不育机理的研究一直引起国内外科学家们的广泛关注[3]。【前人研究进展】近50多年来,杂种小麦因为外源细胞质的引用而得以广泛应用。1951年,Kihara创制的尾状山羊草()异质不育系开启了小麦异质雄性不育的研究,之后相继获得130多种质核杂交小麦。其中,D2型细胞质具有一定应用潜力[4]。D2型细胞质对小麦主要农艺性状无不利效应,且能引起许多小麦品种(系)雄性不育[5-6]。同时发现在D2型细胞质中,特别是牡山羊草()细胞质对杂交小麦的开发利用价值最大,并且具有易恢复、增加普通小麦的生长势、改良小麦品质以及提高小麦对白粉病的抗性等优点,在杂交小麦育种和生产上具有广阔的应用前景和市场价值[7-8]。尽管科学研究者们证明D2型细胞质对普通小麦的农艺性状没有不利效应[9-10],但对这种细胞质雄性不育系及其败育机理并不是很明确,且国内外研究甚少。细胞程序化死亡(programmed cell death,PCD)在多种生物的生长过程中占有重要地位,是一种由基因控制有序的选择性细胞凋亡的过程[11]。在植物发育过程中,一些组织和器官的发育都会发生细胞程序化死亡过程,如许多特定组织细胞的分化、生殖器官的发育、叶片的自然凋亡、根冠细胞的消失以及糊粉层的瓦解等[12-14]。目前,许多学者也证实了花药绒毡层降解的基本特征与细胞程序化死亡的过程相符[15-17],作为花药壁最内层的绒毡层直接和小孢子接触,适时降解的绒毡层能为小孢子正常生长发育准确地提供脂肪、蛋白质和多糖等营养物质,在小孢子发育过程中起着极其重要的作用。绒毡层细胞的PCD过程提前(或延迟)均会导致植物(如水稻、玉米、向日葵、小麦等)花粉败育[18-21]。目前,人们普遍认为,细胞程序化死亡与活性氧(reactive oxygen species,ROS)的代谢之间具有紧密的联系,对于PCD与ROS的研究大多集中在生物胁迫和非生物胁迫对微生物、昆虫、动物以及植物叶片的PCD影响[22-25],而对于细胞质雄性不育小麦绒毡层的自然凋亡过程与ROS关系的研究较少。在植物体中,细胞中所有的活动所需要的能量都离不开线粒体中的呼吸作用。在正常情况下,植物线粒体产生的活性氧能够抵御外来伤害,但一旦发生代谢紊乱,过量的ROS就会与细胞内的多种物质相互作用,导致细胞代谢的平衡。植物在面临伤害的过程中形成一套可有效阻止或延迟氧化伤害的防御机制,即酶促抗氧化系统和非酶促抗氧化系统。其中,酶促抗氧化系统中的SOD酶能将超氧自由基歧化为H2O2和O2,POD协同CAT能同时清除生物体内过量的过氧化氢[26]。APX和GPX在过量H2O2的刺激下能直接参与植物的氧化反应,同时GSH被氧化成GSSG[27]。其中,马翎健等[28]研究细胞质雄性不育小麦酶活性,发现小麦ROS含量升高、SOD和CAT活性降低,最终导致膜损伤,从而造成细胞质雄性不育小麦花粉败育。非酶促抗氧化系统中,AsA-GSH循环系统也可以消除过多的H2O2进而调节细胞内的信号转导途径使植物向有利的方向发育[29]。研究表明不同的细胞质雄性不育小麦AsA和GSH代谢的异常是导致花粉败育的根本原因[30]。目前,研究表明ROS与植物细胞的程序化死亡有关,并发现在PCD过程中ROS起到2种作用,一种是ROS作为信号分子启动了细胞调亡的反应,一种是直接导致了细胞的PCD过程[12]。【本研究切入点】小麦雄性不育的形成机理十分复杂,近年来,探究细胞质雄性不育败育的原因已成为研究的热点问题。而且关于细胞质雄性不育的研究一般采用核遗传背景不同或者单一的材料进行比较,具有很大的局限性。【拟解决的关键问题】本研究选用3种同核异质D2型细胞质雄性不育小麦,在消除核背景遗传差异的前提下,从细胞学、生理生化和分子生物学等方面,利用扫描电镜、DAPI染色、石蜡切片、DNA ladder、生理指标测定和qRT-PCR的方法,客观详细地分析了3种细胞质雄性不育系绒毡层PCD、ROS及抗氧化系统三者之间的关系,进一步揭示雄性败育原因,为细胞质不育类型的划分以及探索败育机理开拓了新的方向。
1 材料与方法
1.1 植物材料
试验材料Va87B1-706A、C687B1-706A和Ju87B1-706A,其细胞质分别源于瓦维洛夫山羊草()、粗厚山羊草()和牡山羊草()。3种D2型细胞质雄性不育系以及同型保持系706B的细胞质源于普通小麦细胞质()。所有不育系均与保持系706B于杨凌回交20代以上,不育性稳定。所有试验材料均在2014年10月和2015年10月播种于西北农林科技大学实验田。2015年4月,对所有不育系随机选10株进行自交套袋,并调查自交结实率(均为0),进一步说明不育系的稳定性(姚盟2015)。每种材料种植2行,行长1 m,行间距0.25 m,株距6.7 cm,常规大田管理。
1.2 花药及小孢子的表型观察
于4月份选取3种D2型细胞质雄性不育系以及同型保持系穗中部小穗基部的花药,用醋酸洋红进行压片镜检,确定小麦的不同发育时期(stage1,四分体时期、stage2,单核早期、stage3,单核晚期、stage4,二核期和stage5,三核期)。通过已经鉴定的小麦发育时期,记录相应的植株形态,确保材料时期的准确性。利用体式显微镜(Motic K400)对不同时期的小花和花药进行观察和拍照。按照王书平[31]的扫描电镜方法观察三核期的花药,之后用导电胶将花药外皮、内皮和小孢子固定在铜台上进行喷金处理,用扫描电镜(M-6360LV)观察其表型结构并拍照。利用FAA固定液固定不同时期的花药,保存于4℃,用于DAPI染色和I2-K染色制片。
1.3 花药绒毡层观察
取出FAA固定液中各时期的花药,参照王书平[31]的方法制作石蜡切片,切片厚度为10 μm,所有样品制片在显微镜(Nikon ECLIPSE E600)下观察并用NIS-Elements软件拍照。
1.4 DNA的提取纯化与DNA ladder的分析
取5个时期的花药各0.25 g,参照王书平[31]的方法提取DNA并纯化,将纯化的DNA用核酸蛋白质检测仪测定浓度,取10 μg DNA于2.0%的琼脂糖凝胶进行电泳,利用凝胶成像系统(JY04S-3C)拍照。
1.5 生理指标的测定
在4℃环境下,选取3种D2型细胞质雄性不育系以及同型保持系5个时期的花药进行主要生理指标的测定,重复3次,取其平均值。
1.5.1 活性氧(ROS)含量的测定 参照王书平[31]的方法测定超氧阴离子(O2-)和过氧化氢(H2O2)含量,参考Noreen等[32]方法测定丙二醛(MDA)含量,并稍有改进。
1.5.2 抗氧化酶活性的变化 参照Li等[33]方法并稍作修改测定超氧化物歧化酶(superoxide dismutase,SOD)和过氧化物酶(peroxidase,POD)活性。参照杨冬业等[34]的方法测定过氧化氢酶(hydrogen peroxidase,CAT)活性。参照张悦等[27]方法测定抗坏血酸过氧化物酶(ascorbate peroxidase,APX)以及谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性,并加以改进。
1.5.3 非酶促抗氧化物质含量的变化 按照黄志明等[35]方法测定还原型抗坏血酸(ascorbic acid,AsA)和谷胱甘肽(glutathione,GSH),并稍作改动。
1.6 抗氧化酶相关基因表达分析
1.6.1 RNA的提取和cDNA第一链的合成 采用TRIzol法提取3种D2型细胞质雄性不育系及同型保持系花药5个时期的总RNA。利用HiScriptTMQ Select RT SuperMix for qPCR(Vazyme 南京)进行cDNA反转录,方法参考说明书,cDNA产物用于RT-PCR反应。
1.6.2 SOD、CAT和APX酶基因的半定量分析及荧光定量PCR分析 所用引物序列(电子附表1)由上海生物工程股份有限公司合成。RT-PCR参照石晓艺[36]方法进行操作,利用凝胶成像系统(JY04S- 3C)拍照。
用AceQ®qPCR SYBR®Green Master Mix 试剂盒(Vazyme 南京),按照试剂盒说明书在ABI PRISM 7000上进行操作。每个模板设3次重复。目的基因相对表达量用2-ΔΔCt的方法进行计算。
1.7 数据分析
采用Microsoft Office Excel 2010和SPSS 19.0进行数据统计与分析,利用SSR法对数据进行方差分析。
2 结果
2.1 D2型细胞质雄性不育系败育的表型特征
从不育系和保持系5个发育时期小花的结果可以看出,不育系的雌蕊发育均正常。然而,从单核晚期开始不育系的花药比706B小且颜色偏淡(图1)。尤其在三核期时,所有不育系花药端部不开裂,底部不分叉,捻开后没有花粉或者只可见少量花粉散出(图1和图2)。而保持系706B花药饱满且颜色亮黄,两端分叉明显,花药中有大量花粉散出(图1和图2)。

A—E:Va87B1-706A;F—J:C687B1-706A;K—O:Ju87B1-706A;P—T:706B。A、F、K和P:四分体时期;B、G、L和Q:单核早期;C、H、M和R:单核晚期;D、I、N和S:二核期;E、J、O和T:三核期。不育系花药从四分体时期到单核早期正常发育,但是从单核晚期开始不育系的花药要比706B偏小且颜色偏淡。尤其在三核期时,所有不育系花药干瘪,不散粉。标尺为 0.5 mm
为进一步观察不育系三核期花药和小孢子的败育特征,利用扫描电镜观察不育系和保持系三核期花药的外皮层、内皮层和小孢子的形态。结果显示,保持系的外皮层表皮光滑平整,细胞排列整齐紧密有序,而不育系的外皮层表皮褶皱粗糙,细胞排列散乱且没有规则,细胞间相互叠加呈现出扭曲变形的不育特征(图2)。内皮层表面是由大量乌氏体覆盖而成,从图中可以看出保持系内皮层表面乌氏体排列致密,形态规则且个体饱满,而不育系内皮层表面乌氏体呈现相互黏连、排列稀疏、大小不一的不育特征(图2)。通过扫描电镜观察小孢子的特征,发现保持系的小孢子形状圆润表面光滑,萌发孔呈现开放状态。而不育系的小孢子表面粗糙且容易黏连微粒,形状不规则,萌发孔闭合或皱缩(图2)。
I2-KI染色鉴定结果显示,3种不育系大部分花粉粒形态不规则有皱缩现象且不染色,少部分呈圆形且染色浅,因而败育类型为典败和染败。保持系706B花粉粒经染色后,绝大多数花粉粒被染成棕黑色且染色充分(图2)。
以上结果表明,D2型细胞质雄性不育系的质核互作效应严重影响了花药和小孢子的正常发育,最终导致完全雄性不育。
A1—A9:Va87B1-706A;B1—B9:C687B1-706A;C1—C9:Ju87B1-706A;D1—D9:706B;A1、A6、B1、B6、C1、C6、D1和D6:花药;A2、A3、B2、B3、C2、C3、D2和D3:外皮层细胞;A4、A5、B4、B5、C4、C5、D4和D5:内皮层细胞;Uby:乌氏体;A7-D7:碘染花粉粒;A8、A9、B8、B9、C8、C9、D8和D9:小孢子;Ap:萌发孔。保持系的外皮层表皮光滑平整,内皮层表面乌氏体排列致密形态规则且个体饱满,小孢子形状圆润表面光滑;不育系外皮层表皮褶皱粗糙,细胞排列散乱,内皮层表面乌氏体现相互黏连、排列稀疏,小孢子表面粗糙且容易黏连微粒,且败育类型为典败和染败。A1、A6、B1、B6、C1、C6、D1和D6的标尺为1mm;A2、B2、C2和D2的标尺为100 μm;A7—A9、B7—B9、C7—C9和D7—D9的标尺为50 μm;A3—A5、B3—B5、C—C5和D3—D5的标尺为10 μm
A1-A9: Va87B1-706A; B1-B9: C687B1-706A; C1-C9: Ju87B1-706A; D1-D9: 706B. A1, A6, B1, B6, C1, C6, D1, and D6: anther; A2, A3, B2, B3, C2, C3, D2, and D3: outer epidermal cells; A4, A5, B4, B5, C4, C5, D4, and D5: inner epidermal cells; Uby: indicates the Ubisch bodies; A7, B7, C7 and D7: microspore of I2-KI staining. A8, A9, B8, B9, C8, C9, D8 and D9: microspores; Ap: indicate the germination aperture. The outer epidermal cells of fertile anthers appeared to be slippy and smooth, and the inner epidermal cells accumulated a lot of tight Ubisch bodies. The epidermis of fertile microspores was rounded and plump with a gymnotremoid germinal aperture. The outer epidermal cells of sterile anthers appeared to be adhesive and loose, and the inner epidermal cells accumulated less and more unconsolidated Ubisch bodies. The epidermis of the CMS microspores were crenate and extremely scabrous, with a malformed germinal aperture. Scale bars represent 1mm in A1, A6, B1, B6, C1, C6, D1, and D6; 100 μm in A2, B2, C2 and D2 ; 50 μm in A7 to A9, B7 to B9, C7 to C9, and D7 to D9; 10 μm in A3 to A5, B3 to B5, C3 to C5, and D3 to D5
图2 三核期不育系和保持系花药及小孢子外部形态及育性的比较
Fig. 2 Comparison of scanning electron micrograph observations, I2-KI staining, and anther morphology in Va87B1-706A, C687B1-706A, Ju87B1-706A and fertile wheat plants at the trinucleate stage
2.2 D2型细胞质雄性不育系败育的细胞学特征
为进一步探究D2型细胞质雄性不育系小孢子的发育,笔者分别对不同时期的花药细胞进行了DAPI染色观察(图3)。保持系706B和不育系的花粉母细胞通过减数分裂形成四分体,单核早期小孢子细胞核于中央。与保持系单核晚期圆形的小孢子不同,不育系小孢子呈不规则形状且表面皱缩,细胞核位于萌发孔对侧;二核期保持系小孢子出现圆形的营养核和精核;在三核期,圆形的精核形成了2个梭形的精核,营养核颜色变浅。不育系Va87B1-706A、C687B1-706A和Ju87B1-706A,二核期花粉粒能正常形成精核和营养核,但有些细胞形状不规则且营养核模糊。而三核期大部分花粉粒细胞精核呈现圆形退化变小,不能形成2个梭形的精核,且有部分细胞呈空胞化,花粉败育。

A—E:Va87B1-706A;F—J:C687B1-706A;K—O:Ju87B1-706A;P—T:706B;A、F、K和P:四分体时期;B、G、L和Q:单核早期;C、H、M和R:单核晚期;D、I、N和S:二核期;E、J、O和T:三核期。不同于保持系小孢子的正常发育,不育系单核晚期细胞表面皱缩且呈不规则形状;二核期花粉粒营养核不清晰且细胞形状不规则;而三核期大部分花粉粒精核呈现圆形退化变小,且有部分细胞发生空胞化。标尺为 50 mm
2.3 花药绒毡层细胞程序化死亡的观察
为了观察D2型细胞质雄性不育小麦花药发育过程中绒毡层细胞程序化死亡启动时期的异常变化,并进一步确定败育时期和原因,利用甲苯胺蓝染色法观察不育系和保持系不同发育时期花药绒毡层的变化(图4)。在四分体时期,不育系和保持系花药绒毡层体积明显偏大,细胞质浓厚染色深,花药壁的中层结构完整,呈带状分布。单核早期,不育系和保持系花药绒毡层细胞质染色依然很深,中层开始变窄,且绒毡层没有明显区别。到了单核晚期,不育系和保持系的中层细胞完全退化消失,而保持系的绒毡层开始降解,即启动了细胞程序化死亡的过程,此时期表现为绒毡层边界模糊,并且能够明显地观察到未退化的细胞核碎片及较多的细胞质残留。而不育系在此时期并没有观察到绒毡层的退化,且排列紧密,结构完整,同时由于绒毡层未及时发生降解,不能为小孢子发育提供重要的营养物质,而导致花粉发育畸形,形态异常。二核期和三核期,保持系的绒毡层完全降解,而不育系绒毡层细胞在二核期才开始降解,三核期降解不完全,依然能够观察到清晰的轮廓和解体的碎片。
以上结果表明,3种D2型细胞质雄性不育小麦花药的绒毡层细胞在花药发育过程中均发生了细胞凋亡的延迟启动,从而影响了小孢子的正常发育,最终导致败育的形成。因此,推断D2型细胞质雄性不育小麦绒毡层的延迟降解可能为败育的细胞学原因。

A—E:Va87B1-706A;F—J:C687B1-706A;K—O:Ju87B1-706A;P—T:706B;A、F、K和P:四分体时期;B、G、L和Q:单核早期;C、H、M和R:单核晚期;D、I、N和S:二核期;E、J、O和T:三核期。E:表皮层;En:内皮层;ML:中层;T:绒毡层;Tds:四分体;Msp:小孢子。在单核晚期,保持系的绒毡层启动了细胞程序化死亡,绒毡层边界模糊,并且能够明显地观察到未退化的细胞核碎片及较多的细胞质残留;不育系在单核晚期时期并没有观察到绒毡层的退化,且排列紧密,结构完整。二核期和三核期,保持系的绒毡层完全降解;不育系绒毡层细胞在二核期开始降解,导致了绒毡层PCD的延迟启动。标尺为50 mm
2.4 花药绒毡层PCD检测
为验证D2型细胞质雄性不育小麦花药发育过程中绒毡层PCD的异常过程,对所有材料不同时期的花药绒毡层内细胞核的DNA片段化程度进行了DNA ladder分析。结果显示,保持系706B在单核早期开始产生了大量以140 bp倍增的DNA片段启动PCD,然而3种D2型细胞质雄性不育小麦均在单核晚期才发生DNA损伤,进一步证实了绒毡层PCD的延迟启动(图5)。因此,通过DNA ladder的结果,发现小麦花药绒毡层呈现出典型的细胞程序化死亡特征,并且3种D2型细胞质雄性不育小麦凋亡的启动时间明显延迟于706B。与细胞学不同,花药绒毡层的DNA损伤要比形态学特征早一个时期,即当DNA发生片段化后,即启动了花药绒毡层的PCD,最终导致花药绒毡层细胞的表型异常。
2.5 活性氧(ROS)含量的测定
为进一步探究D2型细胞质雄性不育小麦绒毡层异常延迟细胞程序化死亡与活性氧代谢的关系,对3种D2型细胞质小麦雄性不育系和其同型保持系在不同时期花药中O2-、H2O2和MDA含量的测定(图6)。发现在所有不育系的花药内作为活性氧源头的超氧阴离子自由基O2-的含量和O2-的衍生物H2O2的含量均在单核晚期达到峰值。并在此时期,不育系的O2-和H2O2含量均显著高于706B(<0.05)。说明过度积累的活性氧使得花药内细胞膜的不饱和脂肪酸发生过氧化反应降解为小分子物质MDA,因此,不育系花药的MDA含量从单核晚期开始明显高于706B,在后2个时期,所有不育系与保持系有显著差异(<0.05)。说明绒毡层延迟启动PCD导致活性氧的过量积累,多余的ROS作为一个信号,破坏了抗氧化防御系统的平衡,进而可能造成绒毡层延迟降解的表型特征,最终导致了D2型细胞质雄性不育小麦的败育。
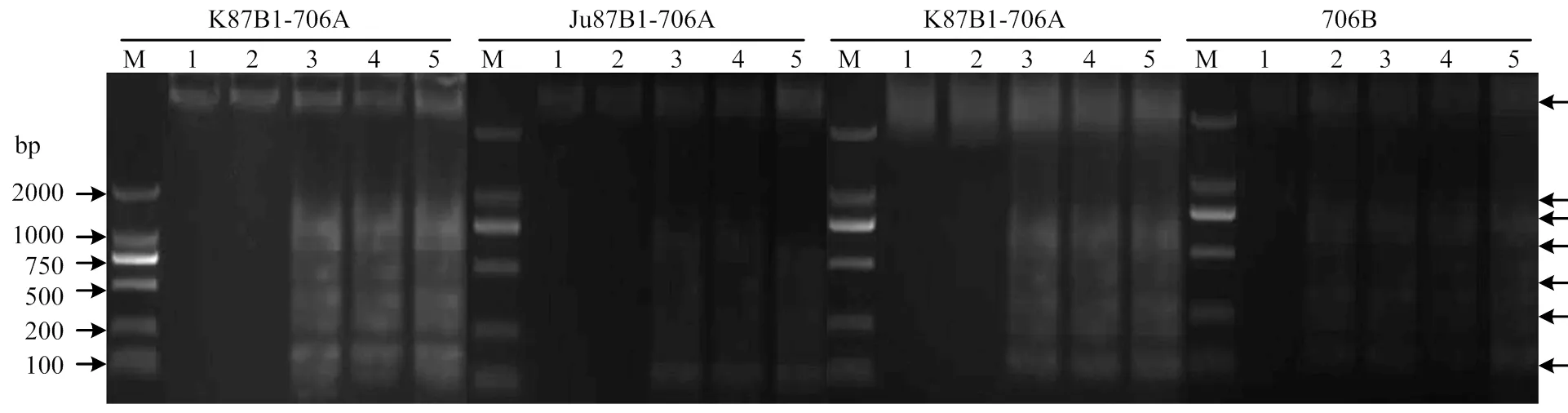
M:Marker D2000;1:四分体时期;2:单核早期;3:单核晚期;4:二核期;5:三核期

不同小写字母表示差异显著(P<0.05)。下同
2.6 抗氧化酶活性的测定
试验测定了3种细胞质雄性不育系和相应保持系5个时期花药SOD、CAT、POD、APX和GPX酶的活性(图7)。所有不育系SOD、CAT和POD酶活均比保持系高,单核晚期时与保持系之间差异显著(<0.05)。但是,在四分体和单核早期时,保持系的APX酶活性比3种不育系低。706B的GPX酶活性整个过程持续升高,直至三核期酶活性达到最高。所有不育系的GPX酶活性均呈现先下降后升高的态势。另外,保持系706B的GPX酶活在单核晚期分别高出3种不育系152%、261%和57%。说明抗氧化酶活性的增加,同样反映了在小麦雄性不育系内的ROS的过度积累,破坏了抗氧化防御系统的平衡,最终影响了小麦的雄性不育。
2.7 非酶促抗氧化物质含量的测定
通过对小麦花药发育过程中AsA和GSH的含量变化的检测(图8),3种不育系的AsA含量在单核晚期低于保持系且与保持系706B差异极显著(<0.01)。保持系706B的GSH含量先显著升高,然后连续降低,单核晚期最高。不育系Va87B1-706A的GSH含量变化趋势与保持系不同,表现为先降后升,直至三核期达到最高。而C687B1-706A和Ju87B1-706A的GSH含量先升后降再升,且在三核期达到最高。在花药发育的单核晚期,保持系706B的GSH含极显著高于所有细胞质雄性不育系(<0.01)。说明花药发育过程中AsA和GSH的含量剧烈变化,从而导致花粉败育。
2.8 D2型细胞质雄性不育系抗氧化酶相关基因的表达分析
为研究相关抗氧化酶基因、和的表达模式以及与花药绒毡层PCD的关系,对小麦细胞质雄性不育系花药、和进行半定量和定量分析(图9和图10,电子附图1)。其中,荧光定量以保持系706B四分体时期花药中的基因相对表达量为对照。结果表明,3种不育系在花药发育的各个阶段的表达量均高于保持系706B。除了Ju87B1-706A,不育系Va87B1-706A、C687B1-706A和保持系706B的表达水平与酶活性的变化基本相同。随着花药的发育,保持系706B的表达水平持续上调,但是与酶活性的变化有很大的区别。表达水平在706B上表现出持续升高的趋势。在四分体和单核早期,3种不育系的表达水平比保持系高。在二核和三核时期,不育系中的表达却明显比保持系低。
从以上结果可以推断,由于不育系花药内的活性氧在单核晚期的大量累积,防御系统为保护植物,SOD、CAT和POD酶活显著上调,而POD的上升又会导致IAA的亏损,物质运输严重受阻。APX和GPX酶的活性以及非酶抗氧化物质AsA和GSH含量的严重下调又使抗氧化防御系统更加薄弱,使活性氧进一步积累。而单核晚期ROS和抗氧化系统异常的变化以及相关酶基因的异常表达均与花药绒毡层紊乱的表型特征表现一致。
3 讨论
杂种优势被认为是提高作物产量的最有效途径,高等植物细胞质雄性不育在作物杂种利用上具有极其重要的价值,并在经济上为农业生产提供了巨大利益[37]。作为细胞质雄性不育小麦的重要胞质来源的D2型细胞质具有十分重大的应用价值[8]。本研究利用3种具有完全相同细胞核的不育系,消除核背景的影响,更加详细客观地进行比较。因此,该三种不育系和相应保持系是研究质核互作和花粉发育的一套理想材料。而雄性不育小麦败育的过程往往伴随着细胞结构的变化和细胞的程序性死亡[16]。由于不同植物不育的遗传基础不同,因而花粉败育的时期和形式也有所不同[38-41]。对于具有(D2型细胞质)细胞质的异质小麦在长日照条件时雄蕊发生了心皮化,进而导致了花粉的败育利用[42]。Murai等[43]也报道了具有细胞质的雄性不育小麦也表现出由雄蕊心皮化引起的完全雄性不育。然而,本研究通过对3种D2型细胞质雄性不育小麦形态学和细胞学分析并未发现雄蕊心皮化的发生,且进一步通过扫描电镜、体式镜和绒毡层甲苯胺蓝染色详细地观察发现花药的败育形式为表皮皱缩、细胞无规则排列、花药不开裂且没有花粉散出的败育特征。并由DAPI染色和石蜡切片观察发现,3种D2型细胞质雄性不育小麦败育的关键时期是单核晚期,细胞学特征表现为小孢子的异常皱缩和绒毡层的延迟降解,且败育特征稳定。造成这种差异的原因可能是核亲本不同,质核组合不同,地理环境的影响以及温度日照时间不同而引起的。由于植物雄性不育是一个极其复杂的过程,是多种因素共同协调导致的现象,所以造成这种差异的原因还有待更系统更全面的研究。同时,本研究拓宽了D2型细胞质雄性不育的败育类型,为进一步研究D2型细胞质雄性不育小麦的细胞学特征提供了借鉴。
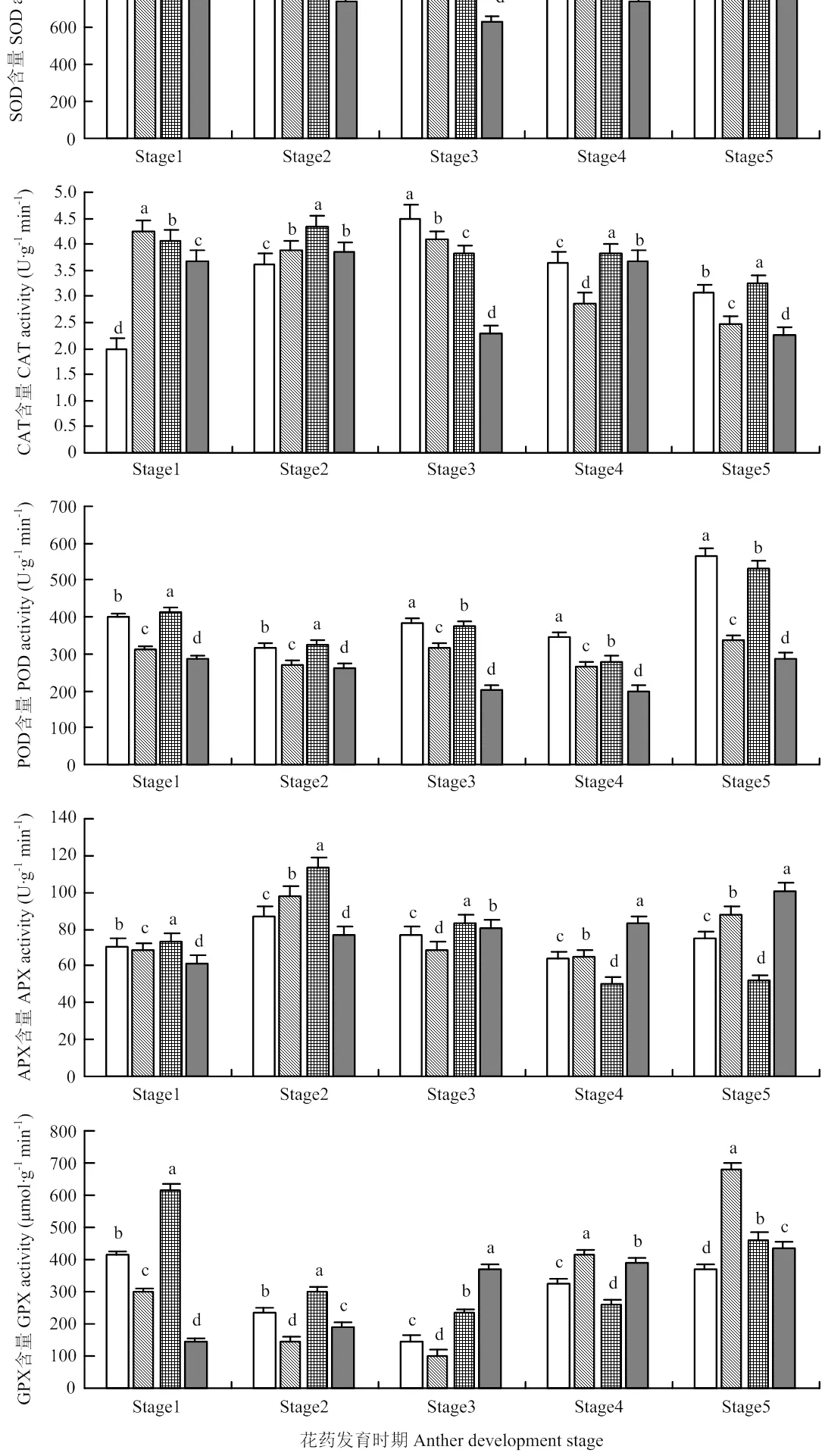
图7 不育系和保持系花药各时期抗氧化酶活性

图8 不育系和保持系花药各时期AsA和GSH的含量
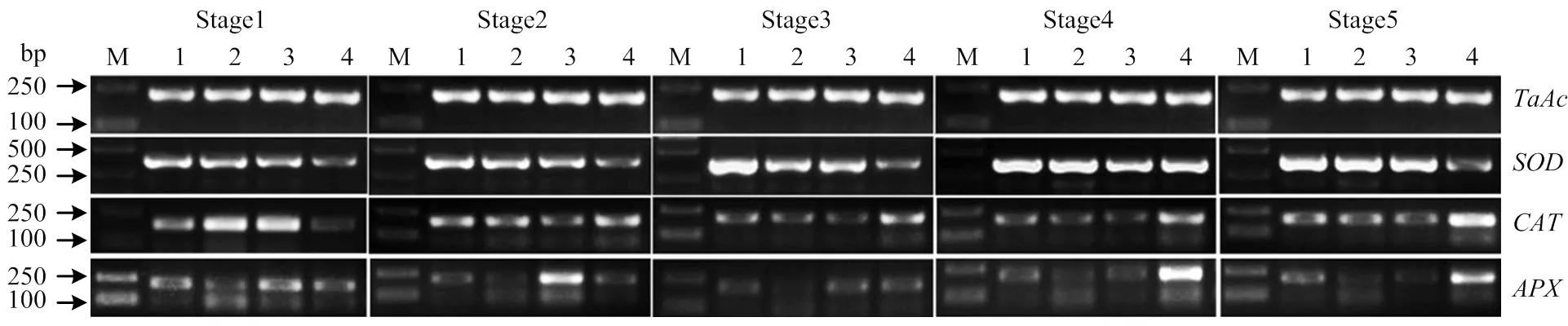
M: Marker D2000; 1: Va87B1-706A; 2: C687B1-706A; 3: Ju87B1 i-706A; 4: 706B
大量学者表明花药绒毡层的降解是一种典型的细胞程序化死亡过程,其PCD表现为细胞质的浓缩、畸形,最终解体[44-45]。本研究发现,不育系在单核晚期PCD的延迟启动可能是导致败育的细胞学原因。那么,关于细胞质雄性不育小麦花粉和小孢子的败育及细胞程序化死亡的原因,许多研究表明与活性氧的过量积累和相关抗氧化酶活性相关[46]。Li等[47]证实了红莲型水稻减数分裂时期的PCD异常与ROS的过量积累有关。也有研究表明WA352在绒毡层的积累,同时与具有清除ROS作用的COXII共同作用,能够提前启动植物的PCD过程[48]。本研究发现在单核晚期不育系活性氧过量累积并与保持系有显著差异。在花药整个发育过程中,所有不育系的SOD和POD活性均比保持系高,在单核晚期与706B有显著差异。POD在细胞的活性氧代谢中有重要作用,能够维持细胞内源库的平衡。POD酶活性的升高使细胞内代谢水平更加旺盛,IAA严重下调,造成雄性不育[49-50]。706B中CAT酶活呈现上升趋势,而不育系中的CAT酶活却逐渐下降。这种结果势必使活性氧产生的速率加快,丙二醛大量积累,最终使花粉及绒毡层的发育受阻[51]。所有不育小麦的APX酶活在二核期和706B有显著差异,而GPX酶活在单核晚期与706B有显著差异。除Ju87B1-706A外,所有不育系AsA和GSH的含量在单核晚期均极显著低于保持系,且与邓明华[52]的研究结果一致。因此,进一步明确了D2型细胞质雄性不育小麦败育的关键时期是单核晚期。在此关键期,一方面细胞质雄性不育系的ROS含量显著升高;另一方面APX与GPX酶活性以及非酶物质含量的持续降低,说明不育系ROS的清除能力降低,单核晚期抗氧化防御系统薄弱,最终造成植物体内活性氧代谢异常。从而推断延迟启动绒毡层的导致ROS的过量积累,在抗氧化系统薄弱的影响下,导致了败育的产生。

图10 不育系和保持系花药抗氧化酶基因的qRT-PCR分析
随着对mtDNA探索的不断深入,目前,越来越多的研究更注重于分子水平研究植物细胞质雄性不育。周玮等[53]研究表明表达量高的烟草均能更好的适应各种处理。李莉等[3]发现,不同发育时期FBA及Mn-SOD酶活变化与基因表达水平相符,可能直接或间接地造成了小麦的败育。Noreen等[32]通过提高谷胱甘肽转移酶基因而提高棉花细胞质雄性不育系的育性。Lim等[54]将和转入甘薯叶绿体中得到的转基因植株APX活性与对照有显著差异。本研究通过对3种D2型细胞质雄性不育小麦的抗氧化酶相关基因的表达分析,除了表达水平与酶活不相符外,、在不育系和保持系花药中的表达水平与酶活性变化是一致的。差异的原因可能是CAT家族其他基因的表达对该基因有掩盖作用[55]。本研究在分子生物学水平揭示了D2型细胞质雄性不育小麦的败育机理,推测PCD的延迟启动导致活性氧在败育关键时期的过量积累,诱导抗氧化酶基因的异常表达,从而使抗氧化系统紊乱,进而造成了花药绒毡层的延迟降解,从而引起D2型细胞质雄性不育小麦的败育。此研究为探索详细的分子不育机理提供了理论依据,更为植物PCD的研究增添了新的内涵。
4 结论
3种同核异质D2型小麦细胞质雄性不育系的花粉败育关键期均在单核晚期,在此关键时期,小孢子表皮的皱缩萌发孔的闭合以及绒毡层细胞核内DNA损伤延迟至单核晚期的现象导致了活性氧的异常积累,膜脂过氧化加剧,抗氧化代谢异常,以及不育系清除活性氧能力的降低,进而造成绒毡层细胞紊乱的表型特征,使不育系花药内花粉母细胞自单核晚期因不能满足必要的营养物质和能量而出现畸形的异常表现,最终导致败育。
[1] SCHNABLE P S, SPRINGER N M. Progress toward understanding heterosis in crop plants., 2013, 64(4): 71-88.
[2] 甘雨, 龚德华, 杨占烈, 贾先勇, 向关伦, 黄宗洪, 潘建慧. 杂交水稻新品种健优388的选育. 贵州农业科学, 2012, 40(1): 12-14.
GAN Y, GONG D H, YANG Z L, JIA X Y, XIANG G L, HUANG Z H, PAN J H. Breeding of Jianyou 388, a new hybrid rice variety., 2012, 40(1): 12-14. (in Chinese)
[3] 李莉, 张改生, 张龙雨, 李亚鑫. 小麦生理型与遗传型雄性不育相关基因锰超氧化物歧化酶(Mn-SOD)及果糖1, 6-二磷酸醛缩酶(FBA)的表达分析. 农业生物技术学报, 2012, 20(3): 225-234.
LI L, ZHANG G S, ZHANG L Y, LI Y XAnalysis of gene expression for manganese superoxide dismutase (Mn-SOD) and fructose-1, 6-bisphosphate Aldolase (FBA) in genetic and physiological male sterility lines of wheat., 2012, 20(3): 225-234. (in Chinese)
[4] 杨天章. 普通小麦种内一种细胞质变异. 作物学报, 1983, 9(4): 217- 219.
YANG T Z. Investigation on the intra specifically cytoplasmic variability in., 1983, 9(4): 217-219. (in Chinese)
[5] 宋喜悦, 马翎健, 胡银刚, 奚亚军, 刘曙东, 何蓓如. D2型山羊草细胞质对普通小麦性状影响的研究. 西北农林科技大学学报, 2001, 29(6): 27-29.
SONG X Y, MA L J, HU Y G, XI Y J, LIU S D, HE B RStudies on effects of the cytoplasm from D2 type cytoplasm on characters of wheat., 2001, 29(6): 27-29. (in Chinese)
[6] 姚盟, 叶佳丽, 杨智全, 段阳, 蒙立颖, 闫鹏娇, 刘子涵, 张玲丽, 宋喜悦. 5种细胞质雄性不育小麦败育的生物学特性及育性恢复. 麦类作物学报, 2015, 35(12): 1676-1684.
YAO M, YE J L, YANG Z Q, DUAN Y, MENG L Y, YAN P J, LIU Z H, ZHANG L L, SONG X YAbortion feature and fertility restoration of five kinds of cytoplasmic male sterile wheat lines., 2015, 35(12): 1676-1684. (in Chinese)
[7] 刘子涵, 蒙立颖, 姚盟, 宋喜悦. 牡山羊草细胞质雄性不育小麦败育的生物学特性和细胞学研究. 中国农业大学学报, 2016, 21(5): 1-9.
LIU Z H, MENG L Y, YAO M, SONG X YBiological characteristics and cytological studies on abortion ofcytoplasmic male sterile line., 2016, 21(5): 1-9. (in Chinese)
[8] 张玲丽, 赵凤霞, 许爱兰. 牡山羊草()细胞质对普通小麦的效应研究. 西北农业学报, 2002, 11(4): 19-21.
ZHANG L L, ZHAO F X, XU A L. Effective ofcytoplasm on., 2002, 11(4): 19-21. (in Chinese)
[9] 刘曙东, 宋喜悦. D2型细胞质对普通小麦籽粒品质的影响. 西北农业大学学报, 1998, 26(2): 7-11.
LIU S D, SONG X Y. Influence of the D2type alloplasm on wheat quality., 1998, 26(2): 7-11. (in Chinese)
[10] 徐洁, 陈升位, 杨德, 何蓓如. D2类山羊草细胞质普通小麦核代换系育性在不同光温条件下的差异.云南农业大学学报, 2001,16(2): 111-113.
XU J, CHEN S W, YANG D, HE B RThe reaction to phto-period and temperature of fertility the different of the wheat nucleus substitutional lines of D2genuscytoplasm., 2001, 16(2): 111-113. (in Chinese)
[11] 孙鑫博, 代小梅, 王怡杰, 韩烈保. 植物细胞程序性死亡研究进展. 生物技术通报, 2010(11): 1-6.
SUN X B, DAI X M, WANG Y J, HAN L BAdvances in programmed cell death in plant., 2010(11): 1-6. (in Chinese)
[12] WANG S P, ZHANG G S, SONG Q L, ZHANG Y X, LI Y, GUO J L, CHEN Z, NIU N, MA S C, WANG J WProgrammed cell death,antioxidant response and oxidative stress in wheat flag leaves induced by chemical hybridization agent SQ-1., 2016, 1(11): 76-86.
[13] XIE H T, WAN Z H, LI S, ZHANG Y. Spatiotemporal production of reactive oxygen species by NADPH oxidase is critical for tapetal programmed cell death and pollen development in., 2014, 26(5): 193-201.
[14] 郑岩, 李江, 杨鹏, 陈惠萍. 水稻糊粉层 PCD 过程细胞形态观察. 热带作物学报, 2016, 37(2): 298-303.
ZHENG Y, LI J, YANG P, CHEN H PThe cell morphology of rice aleurone layers during programmed cell death., 2016, 37(2): 298-303. (in Chinese)
[15] MENG L Y, LIU Z H, ZHANG L L, HU G, SONG X YCytological characterization of a thermo-sensitive cytoplasmic male-sterile wheat line having K-type cytoplasm of, 2016, 66(5): 752-761.
[16] 张虹, 梁婉琪, 张大兵. 花药绒毡层细胞程序性死亡研究进展. 上海交通大学学报, 2008, 26(1): 86-90.
ZHANG H, LIANG W Q, ZHANG D B. Research progress on tapetum programmed cell death., 2008, 26(1): 86-90. (in Chinese)
[17] WANG S P, ZHANG G S, SONG Q L, ZHANG Y X, LI Y, GUO J L, CHEN Z, NIU N, MA S C, WANG J WAbnormal development of tapetum and microspores induced by chemical hybridization agent SQ-1 in wheat., 2015, 10: 1-15.
[18] 李建军, 唐慧娟, 陈艳翠, 陈安国, 黄思齐, 李德芳. 质核互作型红麻雄性不育系细胞学形态观察. 中国麻业科学, 2015, 37(5): 229-232.
LI J J, TANG H J, CHEN Y C, CHEN A G, HUANG S Q, LI D FCytomorphological observation on cytoplasm nuclear male sterile line of Kenaf., 2015, 37(5): 229-232. (in Chinese)
[19] LI H, YUAN Z, GEMA V B, YANG C Y, LIANG W Q, ZONG J, WILSON Z A, ZHANG D BPresistent tapetal cell1 encodes a phd-finger protein that is required for tapetal cell death and pollen development in rice., 2011, 156(2): 615-630.
[20] 穆蕊, 张祖新, 张方东, 郑用琏. 玉米CMS-S小孢子败育过程中的细胞程序性死亡. 作物学报, 2006, 32(5): 666-670.
MU R, ZHANG Z X, ZHANG F D, ZHENG Y LProgrammed cell death during abortion of microspore in S-type cytoplasmically male-sterile maize., 2006, 32(5): 666-670. (in Chinese)
[21] SONG Y L, WANG J W, ZHANG G S, ZHAO X L, ZHANG P F, NIU N, MA S CMicrospore abortion and abnormal tapetal degeneration in a male-sterile wheat line induced by the chemical hybridizing agent SQ-1., 2015, 55(3): 1-12.
[22] GIANLUCA F, RENA B. Oxidative stress and programmed cell death in yeast., 2012, 2(64): 1-21.
[23] JYOTSNA M, SARMAN S. Miltefosine resistance ininvolves suppression of oxidative stress-induced programmed cell death., 2013, 135: 397-406.
[24] OMER M, AHINOAM E, AARON K. Dehydroascorbate: a possible surveillance molecule of oxidative stress and programmed cell death in the green alga., 2014, 202: 471-484.
[25] RUBERTI C, BARIZZA E, BODNER M, NICOLETTA L R, ROBERTO D M, FRANCESCO C, FIORELLA L S, MICHELA Z. Mitochondria change dynamics and morphology during grapevine leaf senescence., 2014, 9(7): 1-12.
[26] 刘齐元, 程元强, 朱肖文, 范东东, 李立新. 雄性不育烟草花蕾中 SOD、POD和CAT活性研究. 中国烟草学报, 2011, 17(5): 34-39.
LIU Q Y, CHENG Y Q, ZHU X W, FAN D D, LI L XStudies on SOD, POD and CAT activities in flower buds of tobacco of cytoplasmic male sterility., 2011, 17(5): 34-39. (in Chinese)
[27] 张悦, 井维霞, 刘修堂, 王涛, 杜宝贞, 幕卫, 曲爱军. 不同浓度安打对烟草幼苗MDA、CAT、APX和GPX的影响. 生物灾害科学, 2013, 36(1): 22-25.
ZHANG Y, JING W X, LIU X T, WANG T, DU B Z, MU W, QU A JEffects of avatar insecticide on the content of MDA and activities of antioxidant enzyme in tobacco seedlings., 2013, 36(1): 22-25. (in Chinese)
[28] 马翎健, 丁勤, 王巍, 宋喜悦, 胡银刚, 奚亚军, 何蓓如, 刘曙东. 粗厚山羊草细胞质普通小麦核代换系SOD, CAT活性研究. 西北农林科技大学学报, 2002, 30(2): 17-20.
MA L J, DING Q, WANG W, SONG X Y, HU Y G, XI Y J, HE B R, LIU S DStudy on activities of superoxide dismutase and catalase of wheat nuclear substitutional lines incytoplasm., 2002, 30(2): 17-20. (in Chinese)
[29] ZHAO W Z, HAN J R. Effect of H2O2-induced oxidative stress on sclerotial differentiation and AsA-GSH cycle ofQ1 strain., 2016, 6(6): 1-7.
[30] CAROLINE G D M, CAMILA S, JANE M L, CLAUDRIANA L.Increase of Glutathione byscott a cmremr when it is challenged by gallic acid and nisin., 2012, 1(4): 35-43.
[31] 王书平. 小麦生理型雄性不育分子机理研究及其败育分子模型的建拓[D]. 杨凌: 西北农林科技大学, 2016.
WANG S P. Establishment and extension of the molecular mechanism of physiological male sterility in wheat (.) [D]. Yangling: Northwest A&F University, 2016. (in Chinese)
[32] NOREEN B B, YUAN S, ZHU Y G, WANG XD.Improvements of fertility restoration in cytoplasmic male sterile cotton by enhanced expression of glutathione S-transferase (GST) gene., 2014, 33: 420-429.
[33] LI J X, DAI X M, JIAO Q H. Metabolism of reactive oxygen species in cytoplasmic male sterility of rice by marking upmost pulvinus., 2015, 175: 1263-1269. (in Chinese)
[34] 杨冬业, 张丽珍, 徐淑庆. 西瓜不同生长阶段的过氧化氢酶活性研究. 安徽农业科学, 2012, 40(18): 9604-9606.
YANG D Y, ZHANG L Z, XU S Q. 2012. Study on catalase activity in watermelon during its different growth periods., 2012, 40(18): 9604-9606. (in Chinese)
[35] 黄志明, 陈宇, 吴晶晶, 吴锦程. 硝普钠对低温胁迫下枇杷幼果线粒体AsA-GSH循环代谢的影响. 热带作物学报, 2011, 32(8): 1469-1474.
HUANG Z M, CHEN Y, WU J J, WU J CEffects of exogenous sodium nitroprusside on AsA-GSH circulation metabolism in mitochondria of young loquat fruits under low temperature stress., 2011, 32(8): 1469-1474. (in Chinese)
[36] 石晓艺. 5种细胞质雄性不育小麦败育的特征与生理代谢响应[D]. 杨凌: 西北农林科技大学, 2016.
SHI XY.The abortive characteristics nd physiological metabolism responses of five kinds of cytoplasmic male sterile wheats[D]. Yangling: Northwest A&F University, 2016. (in Chinese)
[37] 刘玉平, 王江浩, 赵爱菊, 陈希勇, 李亚军 , 李尔民, 柳英东. 小麦杂种优势利用体系研究进展. 河北农业科学, 2009, 13(4): 56-57.
LIU Y P, WANG J H, ZHAO A J, CHEN X Y, LI Y J, LI E M, LIU Y DReview of the heterosis utilization system of wheat., 2009, 13(4): 56-57. (in Chinese)
[38] 陈雪平, 罗双霞, 轩淑欣, 张成合, 申书兴. 茄子雄性不育系花粉败育的细胞学观察. 植物遗传资源学报, 2013, 14(4): 754-758.
CHEN X P, LUO S X, XUAN S X, ZHANG C H, SHEN S XCytological observation of pollen abortion in eggplant male-sterile lines., 2013, 14(4): 754-758. (in Chinese)
[39] SHENG Z H, TANG L Q, SHAO G N, XIE L H, JIAO G A, TANG S Q, HU P S. The rice thermo-sensitive genic male sterility gene tms9: pollen abortion and gene isolation., 2015, 203: 145-152.
[40] CAI H, IMRAN H S, ZHAO H J. Cytological evidences of pollen abortion inAit., 2011, 10(64): 14061-14066.
[41] 张建奎, 董静, 宗学凤, 余国东, 李伯群, 戴秀梅, 阮仁武. 温光敏核雄性不育小麦雄性败育的细胞学观察. 植物遗传资源学报, 2009, 10(3): 411-418.
ZHANG J K, DONG J, ZONG X F, YU G D, LI B Q, DAI X M, RUAN R WCytological analysis of pollen abortion in thermo/ photoperiod-sensitive genic male sterile wheat (L.)., 2009, 10(3): 411-418. (in Chinese)
[42] 徐道钦, 徐军生. 小麦D2型细胞质光敏雄性不育性的研究. 安徽农业通报, 2007, 13(19): 53-54.
XU D Q, XU J S. Study on D2type cytoplasm photosensitive wheat male sterility., 2007, 13(19): 53-54. (in Chinese)
[43] MURAI K, TSUTUI I, KAWANISHI Y, IKEGUCHI SDevelopment of photoperiod-sensitive cytoplasmic male sterile (PCMS) wheat lines showing high male sterility under long-day conditions and high seed fertility under short-day conditions., 2007, 159(3): 315-323.
[44] JAKYUNG Y, SUNOK M, YANG-SEOK L, ZHU L, LIANG W Q, ZHANG D B, JUNG K H, GYNHEUNG ADefective tapetum cell death 1 (DTC1) regulates ROS levels by binding to metallothionein during tapetum degeneration., 2016, 170: 1611-1623.
[45] Zhang D D, Liu D, Lü X M, WANG Y, XUN Z L, LIU Z X, LI F L, LU HThe cysteine protease CEP1, a key executor involved in tapetal programmed cell death, regulates pollen development in., 2014, 26(7): 2939-2961.
[46] 刘延忠, 王利民, 李昶. 植物细胞程序性死亡调控机制的研究进展. 山东农业科学, 2012, 44(11): 58-60.
LIU Y Z, WANG L M, LI C. Advancement of researches of plant programmed cell death regulation and mechanism., 2012, 44(11): 58-60. (in Chinese)
[47] LI S Q, WAN C X, KONG J, ZHANG Z J, LI Y S, ZHU Y G. Programmed cell death during microgenesis in a Hongllian CMS line of rice is correlated with oxidative stress in mitochondria., 2004, 31: 369-376.
[48] LUO D, XU H, LIU Z, GUO J, LI H, CHEN L, FANG C, ZHANG Q, BAI M, YAO N, WU H, WU H, JI C, ZHENG H, CHEN Y, YE S, LI X, ZHAO X, LI R, LIU Y G. A detrimental mitochondrial-nuclear interaction causes cytoplasmic male sterility in rice., 2013, 45: 573-577.
[49] ESMA H A, GULNUR A. Determination of SOD, POD, PPO and CAT enzyme activities inL.., 2016, 11(3): 1-7.
[50] 关天霞, 党占海, 张建平, 王利民, 赵丽, 田彩萍. 亚麻温敏型雄性不育系POD活性和内源激素含量比较分析. 甘肃农业大学学报, 2007, 42(6): 66-70.
GUAN T X, DANG Z H, ZHANG J P, WANG L M, ZHAO L, TIAN C P. Comparing analysis of POD activity and endogenous phytohormone contents in thermo-sensitivity male-sterile flax., 2007, 42(6): 66-70. (in Chinese)
[51] 刘丽华, 李保国, 齐国辉, 郭素萍, 赵志磊. 雄性不育板栗雄花序败育与几种酶活性及MDA含量的关系. 林业科学, 2007, 43(4): 121-124.
LIU L H, LI B G, QI G H, GUO S P, ZHAO Z LRelationships between some protective enzymes activities, MDA content and male inflorescence of male sterile chestnut., 2007, 43(4): 121-124. (in Chinese)
[52] 邓明华. 辣椒胞质雄性不育的分子生理机制及亲缘关系研究[D]. 湖南: 中南大学, 2011.
DENG M H. Studies on molecular and physiological mechanisms of pepper cytoplasmic male sterility and genetic relationship in capsicum [D]. Hunan: Central south university, 2011. (in Chinese)
[53] 周玮, 周波, 杨雪, 侯思名, 刘明求, 刘飞虎. 转SOD基因烟草中SOD酶活力对逆境的耐性及其遗传学特征. 广西植物, 2006, 26(2): 200-203.
ZHOU W, ZHOU B, YANG X, HOU S M, LIU M Q, LIU F HThe tolerance to adversity stress and its heredity characteristics of SOD activities in transgenic tobacco lines with SOD gene., 2006, 26(2): 200-203. (in Chinese)
[54] LIM S, KIM Y H, KIM S H, KWON S Y, LEE H S, KIM J S, CHO W Y, PAEK H Y, KWAK S SEnhanced tolerance of transgenic sweetpotato plants that express both Cu Zn SOD and APX in chloroplasts to methyl viologen-mediated oxidative stress and chilling., 2007, 19(3): 227-239.
[55] LUNA C M, PASTORI G M, DRISCOLL S, GROTEN K, BERNARD S, FOYER CDrought controls on H2O2accumulation, catalase (CAT)activity and CAT gene expression in wheat., 2005, 56(411): 417-423.
(责任编辑 李莉)
附表1 相关抗氧化基因荧光定量PCR引物
Table S1 Primers used for fluorescent quantitative PCR assays of antioxidant genes related to CMS

引物Primer序列Sequence (5′-3′)退火温度Tm(℃) SOD-fSOD-rAGAACCTCAAGCCTATCAGCGACAAATCACGCAAGCACT60 CAT-fCAT-rTGCCTGTGTTTTTTATCCGAACCGTCCATGTGCCTGTAGT62 APX-fAPX-rGTTCATCCCTGGAAGACGCAGAGGGTCACGAGTCCA64 Actin-fActin-rCTCCCTCACAACAACCGCTACCAGGAACTTCCATACCAAC62
1:四分体时期;2:单核早期;3:单核晚期;4:二核期;5:三核期
M: Marker D2000; 1: Tetrad stage; 2: Early uninucleate stage; 3: Late uninucleate stage; 4: Binucleate stage; 5: Trinucleate stage
附图1 不育系和保持系、、和的RT-PCR扩增电泳检测结果
Supplemental Fig. 1andgenes PCR amplification of cDNA sequences in anthers fromIAMSLs during different development stages
Tapetal Programmed Cell Death, Antioxidant Response and Oxidative Stress in Wheat Anthers Associated withD2-type Cytoplasmic Male-sterility
LIU ZiHan, SHI XiaoYi, YAN PengJiao, DUAN Yang, GENG XingXia, YE JiaLi, LI Sha, YANG XueTong, ZHANG GaoMing, JIA YuLin, ZHANG LingLi, SONG XiYue
(College of Agronomy, Northwest A&F University, Yangling 712100, Shaanxi)
D2type cytoplasm is the considerable source of cytoplasm of cytoplasmic male sterility (CMS). It is of great value to further study the cytological characteristics and mechanism of physiology and molecules in heterologous cytoplasmic male sterility (CMS) wheat for the heterosis utilization.To elucidate the abortive cytological characteristics of D2-type cytoplasmic male-sterility, the phenotypes of anthers, microspores, tapetum were analyzed by scanning electron microscope, DAPI staining, and paraffin section, as well as detectingtapetal apoptotic DNA fragmentation by DNA ladder. To further clarify that the D2-type cytoplasmic male-sterility is associated with abnormal tapetal programmed cell death and reactive oxygen species metabolism, the physiological properties, including the contents of reactive oxygen species (ROS), activities of ROS-scavenging enzymes (superoxide dismutase (SOD), peroxidase, catalase (CAT), ascorbate peroxidase (APX), and glutathione peroxidase (GPX)) and nonenzymatic antioxidants (ascorbic acid (AsA) and glutathione (GSH)), and the expression levels of antioxidant-associated genes from three D2-types of cytoplasmic male sterile lines (Va87B1-706A, C687B1-706A, Ju87B1-706A) and the maintainer 706B of wheat were compared.Compared with the maintainer line, at the trinucleate stage, the inner epidermal cells of D2-type cytoplasmic male-sterility accumulated less and more unconsolidated Ubisch bodies and the epidermis of microspores were extremely scabrous. The abortive pivotal period of pollen was initiated at the later uninucleate stage, which the delayed degradation of tapetum and abnormal structure of the microspore were related to the serious oxidative stress, disorganized activities of antioxidant enzymes, down-regulated contents of non-enzymatic antioxidants and significant difference of the expression level of some related enzyme genes in the three D2-types of cytoplasmic male sterile lines. Additionally, the expression level ofandgenes was approximated to the activities of enzymes. However, there existed a distinct difference between the expression level ofgene and the activities of enzymes resulting from multiple-gene encodinggene.It was deduced that delay of start-up of the tapetal PCD (Programmed Cell Death) results from excessive ROS accumulation, and then destroyed the balance of the antioxidant defense system, and eventually led to the abortion of D2-types of cytoplasmic male sterile lines. Therefore, in order to further explore the abortive mechanism of cytoplasmic male sterility (CMS) wheat, this study provided an important theoretical basis and application significance.
wheat (L.); D2-types cytoplasmic male sterility; tapetal programmed cell death; ROS metabolism; gene expression
2017-04-10;接受日期:2017-06-02
国家自然科学基金(31271792)
刘子涵,E-mail:liuzihan643@163.com。通信作者宋喜悦,E-mail:songxiyue@126.com
