车前子降糖活性部位的化学成分研究
2017-11-17彭庆华韩竹箴童仁超胡信权杨启明祁萌石燕红王峥涛杨莉
彭庆华 韩竹箴 童仁超 胡信权 杨启明 祁萌 石燕红 王峥涛 杨莉
[摘要]该文研究车前子降糖活性部位的化学成分。前期研究表明车前子60%乙醇提取物对高脂饲料诱导糖尿病模型小鼠的血糖及糖耐量具有一定改善作用。该文进一步应用硅胶、ODS、Sephadex LH20柱色谱,中压制备液相、薄层制备等色谱技术对车前子的60%乙醇提取物进行化学成分研究,共分离了8个化合物,并根据化合物的理化性质结合应用波谱技术鉴定了化合物结构,分别为车前子萜A(1)、iridolactone(2)、pedicularislacton(3)、rehmaglutin C(4)、京尼平苷酸(5)、phydroxylphenylglycerol(6)、4(2羟乙基)1,2苯二酚(7)、3buten2one4[3(βDglucopyranosyloxy)4hydroxyphenyl](8)。其中,化合物1~5为环烯醚萜类,6~8为酚酸类。其中化合物1为新的天然产物,化合物2~4,6,8为首次从车前科植物中分离得到。
[关键词]车前子; 化学成分; 降糖活性; 环烯醚萜; 酚酸类
[Abstract]The chemical constituents of Plantaginis Semen with hypoglycemic effect was investigated in this paper The previous results of the in vivo hypoglycemic effect showed that 60% ethanol extract of Plantaginis Semen decreased the levels of FBG and improved the glucose tolerance in high fat diet(HFD)induced diabetic C57BL/6 mice Then, in the present study, the above potential bioactive extract was separated and purified by silica gel, ODS, Sephadex LH20 column chromatography, medium pressure liquid chromatography(MPLC)and preparative HPLC The structures of isolated compounds were identified by physicochemical properties and spectral analyses Eight compounds were obtained and identified as 4, 4a, 5, 7atetrahydro7(hydroxymethyl)cyclopenta[c]pyran3(1H)one(1), iridolactone(2), pedicularislacton(3), rehmaglutin C(4), geniposidic acid(5), phydroxylphenylglycerol(6), 1, 2benzenediol4(2hydroxyethyl)(7), and 3buten2one4[3(βDglucopyranosyloxy)4hydroxyphenyl](8) Among them, compounds 15 were iridoids, and 68 were phenolic acids Compound 1 was a new natural product, and compounds 24, 6 and 8 were isolated from the Plantaginaceae family for the first time.
[Key words]Plantaginis Semen; chemical constituents; hypoglycemic; iridoid; phenolic acid
车前子为历史悠久的常用中药,始载于《神农本草经》,为车前科车前属植物车前Plantago asiatica L.或平车前P. depressa Willd.的干燥成熟种子 [1]。性寒,味甘,具有清热,利尿通淋,渗湿止渴,止泻,明目,祛痰的功效,常用于热淋湿痛、水肿胀满、暑湿泄泻、目赤肿痛和痰热咳嗽等症状。全国各地均有分布,主产于江西、河南。目前,国内外对车前子的研究表明其主要的化学成分有环烯醚萜类、苯乙醇苷类、黄酮类、生物碱类、多糖类以及三萜类、甾醇类化合物等[24]。本课题组在前期药理研究中发现车前子具有良好的降糖活性,车前子60%乙醇提取物,对高脂饲料诱导糖尿病模型小鼠的空腹血糖及糖耐量均有所改善[5]。为进一步阐明车前子的降糖活性的物质基础,本实验对车前子降糖活性提取物的化学成分进行了研究,从中分离得到8个化合物,分别鉴定为车前子萜A(1)、iridolactone(2)、pedicularislactone(3)、rehmaglutin C(4)、京尼平苷酸(5)、phydroxylphenylglycerol(6)、4(2羟乙基)1,2苯二酚(7)、3buten2one4[3(βDglucopyranosyloxy)4hydroxyphenyl](8)。其中化合物1为新的天然产物,化合物2~4,6,8为首次从车前科中分离得到。
1材料
Bruker AV400和AV600型核磁共振波谱仪(TMS为内标);LC 3000型液相色谱仪(北京创新通恒科技有限公司);YMC Pack ODSA色谱柱(10 mm×250 mm,5 μm);柱色谱硅胶(200~300 目,青岛海洋化工厂);硅胶GF254薄层板(青岛海洋化工厂);Sephadex LH20 (GEHealthcare,BioSciences AB);ODS(Sepax TechnologiesInc);H103型大孔樹脂(郑州勤实科技有限公司);电子分析天平,购自塞多利斯科学仪器有限公司(Sartorius,Germany);罗氏卓越型血糖仪及血糖试纸,购自德国罗氏诊断有限公司(Roche,Germany)。试剂均为分析纯或色谱纯(国药集团化学试剂有限公司)。endprint
实验所用车前子于2016年4月采购安徽省亳州市沪谯药业有限公司(产地江西省,批号15120306642),经上海中医药大学吴立宏研究员鉴定为车前科车前属车前草P. asiatica的干燥成熟种子,标本保存于上海中医药大学中药研究所标本室。
2提取与分离
车前子30 kg,粉碎至粗粉后用10倍60%乙醇回流提取2次,每次3 h,滤过浓缩至无乙醇味,后经大孔树脂柱色谱吸附后用乙醇溶液洗脱,收集洗脱液并浓缩干燥,得粗提物397 g。经硅胶柱色谱分离,二氯甲烷甲醇(20∶1)至二氯甲烷甲醇水(2∶1∶02)梯度洗脱得4个组分(P1~P4)。P1通过ODS(MeOHH2O,1∶19~1∶0)柱色谱梯度洗脱,得到4个组分(P11~P14),P11和P12先后经Sephadex LH20柱色谱(MeOHH2O,1∶1和1∶0)和制备薄层板色谱纯化(展开剂为ethyl acetateMeOHH2O,6∶1∶01)等得到化合物2(12 mg)和3(15 mg),P13和P14经Sephadex LH20柱色谱(MeOHH2O,1∶1)后通过薄层制备(展开剂为ethyl acetateMeOHH2O,4∶1∶01)得到化合物6(16mg)和7(17 mg)。P2经ODS(MeOHH2O,0∶1~4∶1)柱色谱梯度洗脱,再经Sephadex LH20柱色谱(MeOH)后通过薄层制备(展开剂为ethyl acetateMeOHH2O,4∶1∶01)得到化合物1(21 mg)。P3经ODS(MeOHH2O,0∶1~4∶1)柱色谱梯度洗脱,再经Sephadex LH20柱色谱(MeOHH2O,1∶1)后通过薄层制备(展开剂为ethyl acetateMeOHH2O,4∶1∶01)得到化合物4(10 mg)和8(16 mg)。化合物5(31 mg)则是由P4在甲醇溶剂中析出再经反复重结晶得到。
3结构鉴定
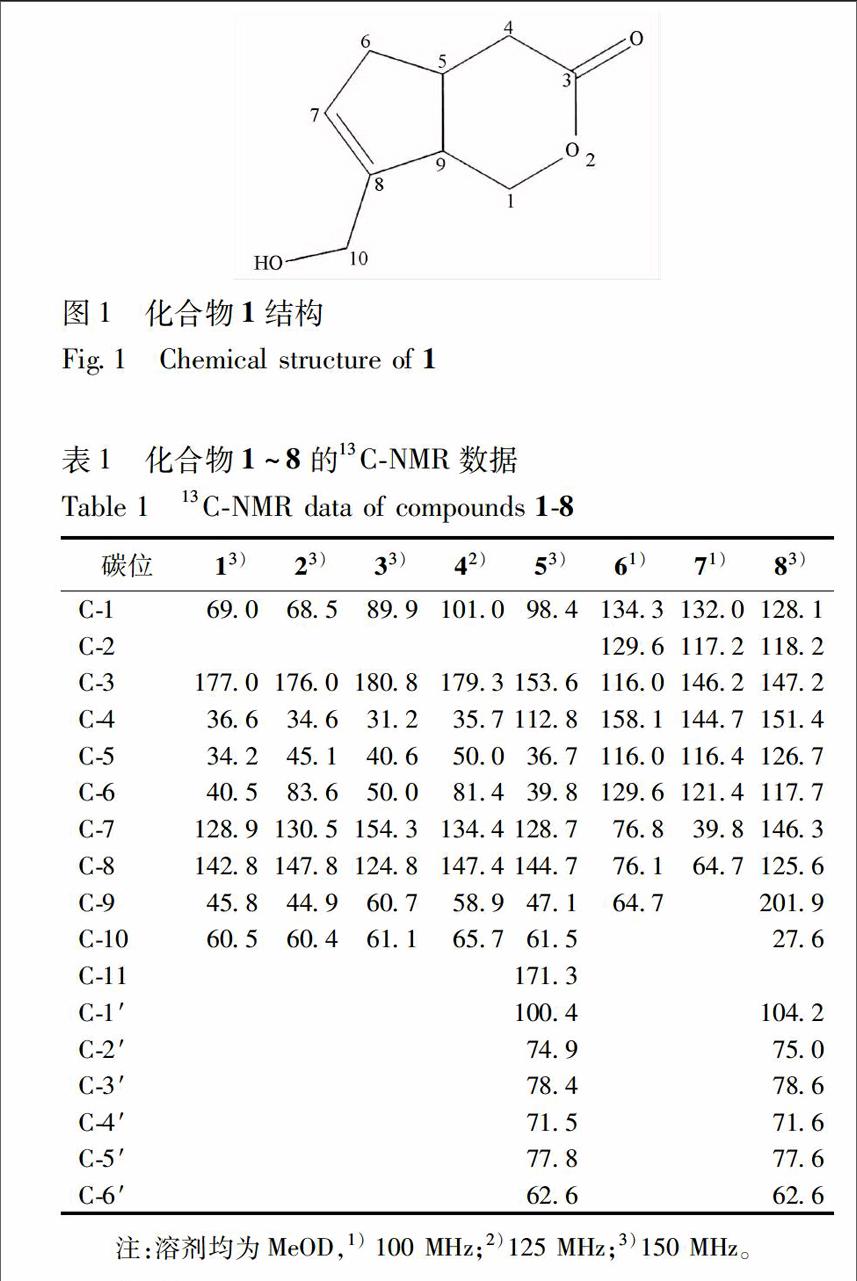
化合物1 白色无定形粉末,易溶于甲醇。HRESIMS显示准分子离子峰为m/z 167068 8 [M-H]-(计算值 C9H12O3,167070 8),结合其1H和13CNMR数据确定其分子式为C9H12O3,不饱和度为4。1HNMR谱中显示有2个连有氧原子的亚甲基信号(δH 410,1H,d,J=137 Hz,H10a; 416,1H,d,J=137 Hz,H10b; 438,1H,dd,J=40,117 Hz,H1a; 443,1H,dd,J=40,117 Hz,H1b)。根据13CNMR和DEPT谱数据,该化合物有3个次甲基、4个亚甲基和2个季碳,其中有1对双键碳(δC 1289,C7; 1428,C8),1个酯基碳(δC 1770,C3)信号。结合其不饱和度可推测该化合物具有双圆环结构。在1H1H COSY谱中,三取代双键上的质子H7与C6、C9和C10相关,而C8相对于C7偏低场,可推断连氧亚甲基C10与C8直接相连;H1与C9相关可推测C1与C9连接;H5与C4,C6,C9相关,可推测C5分别与C4,C6,C9相连。在HMBC谱中H10则与C7,C8,C9相关,所以推测C9与C8连接,C6与C7相连;H1和H4均与C9相关,C1较C4偏低场,可推测C4与C3相连,C1连接氧原子再与C3相连形成内酯。综上所述可确定该化合物结构为4,4a,5,7a tetrahydro 7(hydroxymethyl)cyclopenta[c] pyran 3(1H) one结构见图1,命名为车前子萜A。经文献查阅该化合物曾在白花败酱醇的全合成研究中得到,但并未命名[68]。因此,鉴定化合物4为新的天然产物,在本研究中进行了碳、氢波谱数据全归属并首次全面报道了其13CNMR谱数据,见表1。1HNMR(MeOD,600 MHz)δ:209(1H,d,J=173 Hz,H6a),237(1H,dd,J=41,150 Hz,H4a),277(1H,m,H4b),280(1H,m,H6b),305(1H,m,H5),324(1H,m,H9),410(1H,d,J=137 Hz,H10a),416(1H,d,J=137 Hz,H10b),438(1H,dd,J=40,117 Hz,H1a),443(1H,dd,J=40,117 Hz,H1b),569(1H,s,H7)。
化合物2白色无定形粉末,易溶于甲醇。1HNMR(MeOD,600 MHz)δ:254(1H,dd,J=43,151 Hz,H4b),268(1H,m,H5),288(1H,dd,J=76,151 Hz,H4a),3,35(1H,m,H9),414(H,d,J=150 Hz,H10a),417(H,d,J=150 Hz,H10b),431(1H,dd,J=41,118 Hz,H1b),441(1H,dd,J=41,118 Hz,H1a),442(1H,overlap,H6),575(1H,m,H7); 13CNMR(MeOD,150 MHz)數据见表1。以上波谱数据与文献[9]对比,故可鉴定该化合物为iridolactone。
化合物3白色无定形粉末,易溶于甲醇。1HNMR(MeOD,600 MHz)δ:271(2H,m,H4),303(1H,m,H6),331(1H,m,H5),372(2H,m,H10),418(1H,d,J=150 Hz,H9a),426(1H,d,J=150 Hz,H9b),546(1H,d,J=74 Hz,H1),588(1H,m,H8); 13CNMR(MeOD,150 MHz)数据见表1。以上波谱数据与文献[10] 对比,故可鉴定该化合物为pedicularislactone。
化合物4白色无定形粉末,易溶于甲醇。1HNMR(MeOD,500 MHz)δ:251(1H,dd,J=49,186 Hz,H4b),282(1H,m,H5),301(1H,dd,J=110,186 Hz,H4a),370(1H,d,J=121 Hz,H10b),393(1H,d,J=121 Hz,H10a),420(2H,s,H9),453(1H,s,H6),60(1H,s,H7); 13CNMR(MeOD,125 MHz)数据见表1。以上波谱数据与文献[11]对比,故可鉴定该化合物为rehmaglutin C。endprint
化合物5无色针状结晶,易溶于甲醇。1HNMR(MeOD,600 MHz)δ:211(1H,dd,J=77,162 Hz,H6a),273(1H,t,J=76 Hz,H9),283(1H,dd,J=84,162 Hz,H6b),325(1H,m,H5),419(1H,d,J=144 Hz,H10a),431(1H,d,J=144 Hz,H10b),516(1H,d,J=76 Hz,H1),581(1H,s,H7),752(1H,s,H3); 13CNMR(MeOD,150 MHz)数据见表1。以上波谱数据与文献[12] 对比,故可鉴定该化合物为京尼平苷酸(geniposidic acid)。
化合物6白色無定形粉末,易溶于甲醇。1HNMR(MeOD,400 MHz)δ:358(1H,m,H9a),366(1H,m,H9b),371(1H,m,H8),453(1H,d,J=64 Hz,H7),676(1H,d,J=85 Hz,H3),676(1H,d,J=85 Hz,H5),722(1H,d,J=85 Hz,H2),722(1H,d,J=85 Hz,H6); 13CNMR(MeOD,100 MHz)数据见表1。以上波谱数据与文献[13]对比,故可鉴定该化合物为phydroxylphenylglycerol。
化合物7白色无定形粉末,易溶于甲醇。1HNMR(MeOD,400 MHz)δ:267(2H,t,J=73 Hz,H7),368(2H,t,J=73 Hz,H8),653(1H,dd,J=20,89 Hz,H6),666(1H,d,J=20 Hz,H5),668(1H,d,J=80 Hz,H2); 13CNMR(MeOD,100 MHz)数据见表1。以上波谱数据与文献[14]对比,故可鉴定该化合物为4(2 羟乙基)1,2苯二酚。
化合物8白色无定形粉末,易溶于甲醇。1HNMR(MeOD,600 MHz)δ:236(3H,s,H10),668(1H,d,J=161 Hz,H8),691(1H,d,J=84 Hz,H5),725(1H,dd,J=21,84 Hz,H6),758(1H,d,J=161 Hz,H7),759(1H,d,J=21 Hz,H2); 13CNMR(MeOD,150 MHz)数据见表1。以上波谱数据与文献[15] 对比,故可鉴定该化合物为3buten2one4[3(βDglucopyranosyloxy)4hydroxyphenyl]。
4讨论
环烯醚萜类化合物是车前子药材中主要的活性成分之一,大多以九碳骨架含环戊烷结构单元的单萜化合物及其衍生物,如京尼平苷酸和大车前草苷等,具有良好的舒张血管、降低心率等药理活性[16]。本研究活性导向分离所得5个环烯醚萜类化合物中以京尼平苷酸的含量最高,且京尼平苷酸被证明有明显的降血糖作用[17],其他4个环烯醚萜类化合物与京尼平苷酸苷元结构相似,其降血糖活性与构效关系值得深入探讨。本研究获得的3个酚酸类的降血糖作用如何,也有待于进一步的阐明与揭示。
[参考文献]
[1]中国药典一部[S]. 2015:68.
[2]郑秀棉, 杨莉, 王峥涛 车前子的化学成分与药理活性研究进展[J]. 中药材, 2013(7):1190.
[3]Chiang L C, Ng L T, Chiang W, et al. Immunomodulatory activities of flavonoids, monoterpenoids, triterpenoids, iridoid glycosides and phenolic compounds of Plantago species[J]. Planta Med, 2003, 69(7):600.
[4]Nhiem N X, Tai B H, Van Kiem P, et al. Inhibitory activity of Planta go major L on angiotensin I converting enzyme[J]. Arch Pharm Res, 2011, 34(3):419.
[5]Yang Q M, Qi M, Tong R C, et al. Plantago asiatica L seed extract improves lipid accumulation and hyperglycemia in highfat dietInduced obese mice[J]. Int J Mol Sci, 2017, 18:1393.
[6]谢平 1白花败酱醇的全合成研究 2螺环天然产物的全合成研究[D]. 北京:北京协和医学院, 1997.
[7]谢平, 焦晓臻, 陈淑凤, 等 天然产物(-)patriscabrol和(+)isopatriscabrol的全合成研究[J]. 有机化学, 2005, 25(9):1094.
[8]Xie P, Chen S F, Liang X T Total synthesis of(+)villosol[J]. Chin Chem Lett, 1997, 8(2):103.
[9]Akdemir Z, Calis I, Junior P. Iridoids and phenylpropanoid glycosides from Pedicularis nordmanniana[J]. Planta Med, 1991, 57(6):584.
[10]Lin S J, Tan C H, Jiang S H, et al. C9Iridoids from Scrophularia buergeriana[J]. Helv Chim Acta, 2006, 89(11):2789.endprint
[11]Tang H Y, Bai M M, Tian J M, et al. Chemical components from the seeds of Catalpa bungei and their inhibitions of soluble epoxide hydrolase, cholinesterase and nuclear factor kappa B activities[J]. Rsc Adv, 2016, 6(47):40706.
[12]El Bitar H, Gramain A, Sévenet T, et al. Daphcalycinosidines A and B, new iridoidalkaloids from Daphniphyllum calycinum[J]. Tetrahedron Lett, 2004, 45(3):515.
[13]Zeng Q, Guan B, Cheng X, et al. Chemical constituents from Metasequoia glyptostroboides Hu et Cheng[J]. Biochem Syst Ecol, 2013, 50:406.
[14]Nishibe S, Okabe K, Tsukamoto H, et al. The structure of forsythiaside isolated from Forsythia suspense[J]. Chem Pharm Bull, 1982, 30(3):1048.
[15]Ohmura K, Miyase T, Ueno A Sesquiterpene glucosides and a phenylbutanoid glycoside from Hypochoeris radicata[J]. Phytochemistry, 1989, 28(7):1919.
[16]de Kloet A D, Krause E G, Woods S C The renin angiotensin system and the metabolic syndrome[J]. Physiol Behav, 2010, 100(5):525.
[17]Wu S, Wang G, Liu Z, et al. Effect of geniposide, a hypoglycemic glucoside, on hepatic regulating enzymes in diabetic mice induced by a highfat diet and streptozotocin[J]. Acta Pharmacol Sin, 2009, 30(2):202
[責任编辑丁广治]endprint
