黄芪和当归配伍对小鼠造血干细胞衰老模型细胞增殖的影响
2017-11-17张珂胜陈凌波黄小平邓常清
张珂胜 陈凌波 黄小平 邓常清
[摘要]研究黃芪和当归配伍对小鼠造血干细胞衰老模型细胞增殖能力的影响及其作用机制。大鼠灌胃给药制备含药血浆后,体外培养小鼠造血干细胞,实验设空白对照组、模型组、空白血浆组、芪归1∶1血浆组、芪归10∶1血浆组、单用当归血浆组、单用黄芪血浆组,以三丁基过氧化氢(tBHP)诱导小鼠造血干细胞衰老,以含药血浆作用于造血干细胞衰老模型。SAβ半乳糖苷酶染色法检测细胞衰老率,流式细胞术检测细胞周期分布,RTPCR检测Cyclin D1,P21,P53 mRNA表达,Western blot检测Cyclin D1蛋白表达。结果显示,tBHP作用于造血干细胞后,可使衰老细胞增加,细胞增殖能力降低,G0/G1期细胞增多,G2/M+S期细胞减少,同时伴Cyclin D1表达降低,P53,P21表达增强。黄芪、当归、芪归1∶1配伍、芪归10∶1配伍含药血浆可降低衰老细胞阳性率,使G0/G1期细胞减少,G2/M+S期细胞增加,细胞增殖能力增强,并使Cyclin D1基因和蛋白表达增强,P53,P21基因表达降低。以上效应以芪归1∶1配伍的作用为强。结果表明,tBHP可使造血干细胞衰老,细胞增殖能力降低。黄芪、当归及其配伍可抑制造血干细胞衰老,促进造血干细胞增殖和细胞周期转换,以芪归1∶1配伍的作用为强。其作用机制可能与其上调细胞周期正性调节因子表达,下调细胞周期负性调节因子表达,从而促进细胞由静止期进入增殖期有关。
[关键词]造血干细胞; 衰老; 细胞增殖; 黄芪; 当归; 细胞周期
[Abstract]The aim is to study the effect and its mechanism of Astragalus Radix combined with Angelicae Sinensis Radix on the proliferation of hematopoietic stem cells(HSCs) in senescence model After drugcontaining plasma of rats was prepared via intragastric administration, HSCs of mice were cultured in vitro, and then they were divided into blank control group, model group, blank plasma group, Astragalus Radix + Angelicae Sinensis Radix 1∶1 group and 10∶1 group, Angelicae Sinensis Radix plasma group, and Astragalus Radix plasma group HSCs senescence model was induced by using tertbutyl hydrogen peroxide(tBHP), and intervened by drugcontaining plasma Cells senescence rate was tested by SAβgalactosidase staining method; cell cycle distribution was determined by flow cytometry; Cyclin D1, P21, and P53 mRNA were measured with RTPCR, and Cyclin D1 protein expression was measured by Western blot Results showed that after being induced by tBHP, senescence rate of HSCs was increased; cell proliferation ability was decreased; count of G0/G1 phase cells was increased; count of G2/M+S phase cells was reduced; Cyclin D1 expression was downregulated while P53, P21 expression was upregulated, which were reversed by Astragalus Radix + Angelicae Sinensis Radix 1∶1 and 10∶1, single Angelicae Sinensis Radix, and single Astragalus Radix plasma Furthermore, the above effects were most obvious in Astragalus Radix+Angelicae Sinensis Radix 1∶1 group These results suggested that tBHP can promote HSCs senescence and reduce cell proliferation ability Angelicae Sinensis Radix, Astragalus Radix and their combinations can inhibit HSCs senescence, promote HSCs proliferation as well as cell cycle conversion; moreover, the effects of 1∶1 Astragalus Radix+Angelicae Sinensis Radix were strongest The mechanisms may be related to upregulating the expression of cell cycle positive regulator, downregulating the expression of cell cycle negative regulator, thus promoting the cells to enter the proliferation phase from the stationary phase.endprint
[Key words]hematopoietic stem cells; senescence; proliferation; Astragalus Radix; Angelicae Sinensis Radix; cell cycle
造血干细胞(hematopoietic stem cells,HSCs)是机体内具有自我更新和多向分化潜能的一类成体干细胞,是所有血细胞的始祖细胞,能分化为成熟血细胞以及某些非造血细胞[1]。既往研究表明,HSCs衰老可导致其增殖和分化功能低下,使血细胞发生失去正常调控,是多种造血功能障碍性疾病的重要原因。增龄和多种原因如放射线、抗肿瘤化疗药物等可引起骨髓HSCs衰老,导致其增殖和分化功能低下,从而使造血功能降低。因此,延缓HSCs衰老是防治骨髓造血功能低下的重要手段[2]。由李东垣创立的黄芪当归5∶1配伍的当归补血汤(Danggui Buxue Tang,DBT)是中医治疗血虚证的经典方,有益气补血的功效,具有促进造血的作用[3],可用于各种原因贫血的治疗。研究表明,当归黄芪在1∶5~5∶1配伍均对促进造血功能的恢复具有协同作用[4]。DBT的补血作用主要来源于当归 [5]。作者前期研究发现,黄芪和当归配伍比例在5∶1,25∶1,1∶1,1∶25,1∶5,1∶10时,可升高外周血细胞数,增加血清造血生长因子含量、骨髓有核细胞数和骨髓造血组织面积,降低脾指数,尤以黄芪当归1∶1,1∶25,1∶5配伍时发挥促造血的作用最强[6]。但黄芪当归配伍促造血作用的机制尚未完全弄清。为进一步明确黄芪和当归配伍促造血的作用机制,作者采用体外造血干细胞衰老模型,比较黄芪当归不同配伍对细胞增殖及其相关基因表达的影响,以明确黄芪当归配伍促造血作用的合理配伍关系,探讨其作用机制,为黄芪当归配伍的合理应用提供实验依据。
1材料
11药物黄芪,产地内蒙古。当归,产地甘肃。由湖南中医药大学第一附属医院药剂科统一购进并经左亚杰教授鉴定。
12动物清洁级SD雄性大鼠,体质量(200±20) g,动物质量合格证号SCXK(湘)20110003。C57BL/6小鼠,6~8 周龄,雌雄各半,体质量20~25 g,动物质量合格证号SCXK(湘)20120001。动物由湖南斯莱克景达实验动物有限公司提供。实验场地为湖南中医药大学动物实验中心,场地许可证号SCXK(湘)20130005。
13试剂胎牛血清(美国Hyclone,批号NWK0489);IMDM培養液(美国Hyclone,批号NAG1440);磷酸缓冲盐溶液(phosphate buffer saline,PBS,pH 74)(吉诺生物医药技术有限公司,批号GNM20012);Ficoll淋巴细胞分离液(天津灏洋生物有限公司,批号YZB/津15952011);牛血清白蛋白(bovine serum albumin,BSA,美国MP Biomedicals,批号0218054210);抗PE磁珠AntiPE MicroBeads(德国 Miltenyi 公司,批号130048701);三丁基过氧化氢(Tertbutyl hydroperoxide,tBHP)(美国Sigma,批号STBD5969V);衰老相关β半乳糖苷酶(senescence assiociated βgalactosidase,SAβgal)染色试剂盒(碧云天生物有限公司,批号CO602);细胞周期检测试剂盒(天津三箭生物技术有限公司,批号CY2001O);细胞增殖及细胞毒性检测(CCK8法)试剂盒(武汉博士德生物有限公司,批号AR1160500);Sca1PE抗体(德国 Miltenyi 公司,批号130102297);Trizol Reagent(Invitrogen Life Technologies,批号15596026);First Strand cDNA Synthesis Kit试剂盒(TOYOBO公司);Taq DNA Polymerase(Thermo scientific,批号114675526);50×TAE(ASPEN,批号114675526);琼脂糖(ASPEN,批号111860);GoldView I型核酸染色剂(Life sciences,批号20150810);6×Loading Buffer(Takara公司,批号A6701A);引物由Invitrogen Biotechnology Co LTD中国公司合成,引物序列为GAPDH:上游引物5′GAGGCCGGTGCTGAGTATGT3′,下游引物5′ACAGTCTTCTGGGTGGCAGTG3′,299 bp;Cyclin D1:上游引物5′GGATGAGAACAAGCAGACCATC3′,下游引物5′AGAAAGTGCGTTGTGCGGTA3′,186 bp;P53:上游引物5′TAAACGCTTCGAGATGTTCCG3′,下游引物5′AGCAGTTTGGGCTTTCCTCC3′,149 bp;P21:上游引物5′GCTGCCCAAGGTCTACCTGA3′,下游引物5′CAATCTGCGCTTGGAGTGATAG3′,244 bp。SDSPAGE凝胶制备试剂盒(ASPEN,批号114717460);BCA蛋白质浓度测定试剂盒(ASPEN,批号114675524);RIPA总蛋白裂解液(ASPEN,批号114675671);ECL化学发光检测试剂盒(ASPEN,批号114717172);磷酸化蛋白酶抑制剂(ASPEN,批号165482142);兔抗小鼠GAPDH单克隆抗体(Abcam公司,批号ab37168);兔抗小鼠Cyclin D1单克隆抗体(Abcam公司,批号ab134175);过氧化物酶标记羊抗兔二抗(KPL公司,批号150361);045 μm PVDF膜(MilliPore公司,批号IPVH00010);蛋白Marker(Thermo公司,批号00289411)。endprint
14仪器磁珠分选器MiniMACS Starting Kit(德国Miltenyi公司,批号130090312);流式细胞仪(美国BectonDickinson公司);酶标仪(奥地利);CO2培养箱(美国);PCR仪(杭州博日科技);电泳仪(北京六一仪器厂);转移电泳槽(北京六一仪器厂);垂直电泳槽(北京六一仪器厂);酶标仪(Diatek公司)。
2方法
21药物及含药血浆制备设立黄芪、当归、黄芪当归不同比例(10∶1,1∶1)配伍。称取药材,以水回流法提取3次,第1次加入8倍量水,加热沸腾2 h。后2次加入6倍量水,加热沸腾提取1 h,冷却后倾出水溶液。合并3次水提液过滤后浓缩成质量浓度分别为:黄芪05 g·mL-1(生药)、当归05 g·mL-1(生药)、黄芪当归不同比例配伍19 g·mL-1(生药)。各药液加入01%的苯甲酸钠,分装4 ℃冷藏备用。
含药血浆制备:参照以往的方法[7],清洁级SD大鼠50只,随机分为5组,每组10只,空白组(予等量双蒸水)、单用黄芪组(10 g·kg-1)、单用当归组(10 g·kg-1)、黄芪当归1∶1配伍组(芪19 g·kg-1 +归19 g·kg-1)、黄芪当归10∶1配伍组(芪345 g·kg-1 +归35 g·kg-1),灌胃给药,连续给药7 d后,于末次给药后2 h腹主动脉取血,以2%EDTA2Na抗凝,3 000 r·min-1离心15 min,取血浆即为含药血浆或空白血浆,将同组各动物血浆等量混合,分装后-70 ℃保存。
22小鼠Sca1+HSCs分离和培养参照文献方法[8]。小鼠处死后以75%乙醇浸泡5 min,无菌条件下取出股骨和胫骨。用PBS[含2 mmol·L-1乙二胺四乙酸(EDTA)、05%BSA]反复冲洗骨髓腔,通过4号针头制备成单细胞悬液。将细胞悬液移至离心管中离心(3 000 r·min-1,15 min)后弃上清,加PBS制成细胞悬液。将细胞悬液缓缓加入到盛有5 mL的Ficoll淋巴细胞分离液离心管中,2 000 r·min-1离心20 min,轻轻吸取中间细胞层至新离心管中,离心后以PBS洗涤3次,最后以PBS悬浮细胞,即得骨髓单个核细胞(bone marrow nucleated cells,MNCs)。
将上述分离的MNCs进行免疫标记:取MNCs加入90 μL PBS缓冲液(含2 mmol·L-1 EDTA,05%BSA,pH 74)和10 μL Anti Sca1PE抗体标记细胞,4 ℃孵育10 min。 离心弃上清,加入80 μL PBS缓冲液和20 μL AntiPE MicroBeads,4 ℃孵育20 min。离心弃上清,以05 mL PBS缓冲液重悬细胞,加入磁场分离柱内,流出道收集未标记细胞(即Sca1-细胞),05 mL缓冲液(PBS缓冲液加入2 mmol·L-1 EDTA,05%BSA,pH 72)洗柱3次,阳性细胞会留滞在柱内,其他细胞流出分选柱。取下分选柱,加入05 mL缓冲液(同上)冲出标记细胞(即Sca1+ HSCs)。分别收集分选前及分选后的细胞各1×106个,流式细胞仪检测分选前后细胞的Sca1+阳性率。分选前MNCs的Sca1+细胞为17%,分离纯化后 Sca1+ 细胞纯度为892%。表明经过磁珠分选后Sca1+HSCs纯度远高于分选前。
将洗涤后的HSCs加10 mL培养液(含10%胎牛血清的IMDM培养基,100 U·mL-1青霉素,100 g·L-1链霉素),接种培养瓶内,于37 ℃ 5%CO2孵箱培养。每2 d换液1次。
23tBHP诱导的Sca1+HSCs衰老模型的建立tBHP诱导Sca1+ HSCs衰老的时效关系:参照文獻方法[9]。实验用HSCs传代细胞4~6代。将细胞接种于96孔板,用无血清培养基培养12 h使细胞生长同步化于G0期后,换成含tBHP(终浓度100 μmol·L-1)的IMDM完全培养基,1×105个细胞/100 μL/孔,继续培养0,3,6,12,24 h后以CCK8试剂测定450 nm吸光度A,计算tBHP对HSCs生长的抑制率,抑制率(IR)=(1-A实验组/A空白组)×100%。以确定tBHP对HSCs损伤的合适时间,实验重复3次。
tBHP诱导Sca1+ HSCs衰老的量效关系:在确定tBHP诱导细胞衰老的合适时间(作用6 h)后,测定tBHP致细胞衰老的量效关系。实验用HSCs传代细胞4~6代。将细胞接种于96孔板,使细胞生长同步化于G0期后,分别换成含不同终浓度
tBHP(0,25,50,100,200,400,800 μmol·L-1)的IMDM完全培养基,1×105个细胞/100 μL/孔,继续培养6 h后,同上采用CCK8试剂测定tBHP对HSCs生长的抑制率,以确定tBHP引起HSCs衰老的合适浓度,实验重复4次。
衰老细胞的鉴定:采用衰老相关β半乳糖苷酶染色法鉴定。阳性细胞胞质呈蓝色,阴性细胞不着色[10]。计数阳性细胞并计算阳性细胞率,阳性细胞率=(阳性细胞数/细胞总数)×100%。
24各含药血浆促衰老Sca1+ HSCs增殖实验空白血浆的细胞毒实验:运用CCK8法测定细胞增殖能力以反映空白血浆对细胞的毒性。实验用传代细胞4~6代。将细胞接种于96孔培养板,1×105个/100 μL/孔,使细胞生长同步化于G0期,然后分别加入不同终浓度空白血浆(0%,1%,5%,10%,15%,20%),培养24 h后,以CCK8法测定,计算空白血浆对细胞生长的抑制率,抑制率(inhibition ratio,IR)=(1-A实验组/A空白组)×100%,取抑制率小于20%的血浆浓度作为无细胞毒性的血浆浓度[7]。
各含药血浆促HSCs衰老模型细胞增殖和细胞周期测定:在确定无细胞毒性血浆浓度(不超过10%)及tBHP诱导细胞衰老的最佳时间为6 h和最佳浓度为100 μmol·L-1后,进行各含药血浆对细胞增殖能力和细胞周期影响的实验。实验分为无血浆空白对照组、模型组、空白血浆组、芪归1∶1组、芪归10∶1组、单用当归组、单用黄芪组。同前用HSCs传代细胞4~6代。常规传代培养后,加入不同浓度含药血浆(0%,1%,5%,10%)和tBHP后培养6 h,按CCK8法测定450 nm的A以反映细胞增殖活性。endprint
各组细胞同上处理后以SAβ半乳糖苷酶染色,倒置显微镜下计数400个细胞,计算衰老细胞阳性率=(阳性细胞数/细胞总数)×100%。
运用流式细胞分选术测定细胞周期。离心收集各组细胞1×106个,PBS洗涤1次,70%冰乙醇固定过夜,100 μL牛胰核糖核酸酶(1 g·L-1)37 ℃孵育30 min。 孵育后用碘化丙啶(propidium iodide,PI)1 mL(用001 mol·L-1 PBS 配制终浓度50 mg·L-1的PI工作液)4 ℃避光30 min染色,测定样本细胞数不少于2×104个。计数G0期、G1期、S期、M期细胞百分比。
25RTPCR法测定Cyclin D1,P53,P21 mRNA的表达收集各组细胞,以Trizol试剂提取RNA,以紫外分光光度法测定A260和A280比值在18~22,说明RNA纯度高,无蛋白污染。取2 μg RNA采用First Strand cDNA Synthesis Kit试剂盒进行cDNA合成。然后进行PCR反应,循环次数40次。取10 μL PCR产物进行琼脂糖凝胶电泳,凝胶成像分析系统对各目的条带进行扫描,用Quantity One软件(BioRad公司)分析各条带OD值。计算各目的基因与内参GAPDH的OD比值作为目的基因的相对表达量。
26Western blot法测定Cyclin D1蛋白表达细胞处理同前。收集各组细胞,以PBS洗涤,以总蛋白提取试剂提取细胞总蛋白。BCA法测定蛋白浓度,将各样品蛋白浓度调整一致,加入适量5×蛋白上样缓冲液,95~100 ℃沸水浴5 min,冷却后备用。然后进行SDSPAGE电泳。电转法转膜。将完成转移的PVDF膜以封闭液封闭,再加入用TBST(含5%脱脂奶粉)稀释的兔抗鼠一抗(GAPDH一抗1∶1万稀释,Cyclin D1一抗1∶1万稀释),4 ℃孵育过夜。TBST洗3次,加入TBST(含5%脱脂奶粉)稀释的羊抗兔二抗(1∶1 000稀释),室温孵育30 min,TBST洗4次。以ECL化学发光试剂进行发光。AlPhaEaseFC图像处理系统分析目标条带的累积光密度值(integrated optical density,IOD)。以目的蛋白与GAPDH的IOD比值作为该目的蛋白的相对表达量。
27统计方法采用SPSS 160软件进行统计分析,实验结果以±s表示,多组间比较采用单因素方差分析。组间两两比较方差齐者用LSD检验,方差不齐者用Dunner T3检验。以P<005表示差异有统计学意义。
3结果
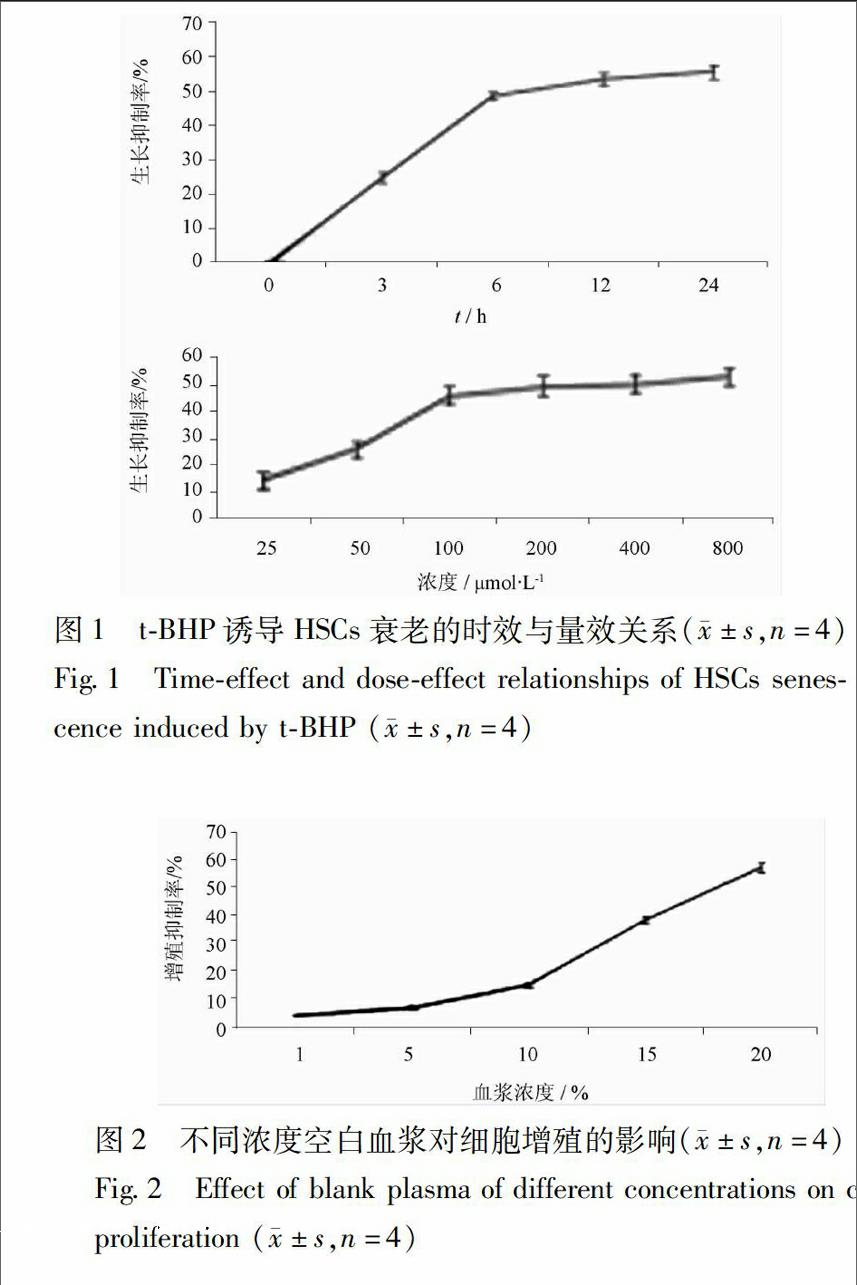
31tBHP诱导的造血干细胞衰老模型的建立tBHP诱导后,随培养时间的延长,tBHP对细胞增殖的抑制作用逐渐增强,到6 h抑制率达(4863±105)%,其后抑制率缓慢上升;随着tBHP浓度增加,细胞生长抑制率逐渐增强,当终浓度为100 μmol·L-1时,细胞生长抑制率为48%,其后生长抑制率缓慢上升。由此确定tBHP诱导细胞衰老(生长抑制)的最佳作用时间和浓度分别为6 h和100 μmol·L-1,见图1。
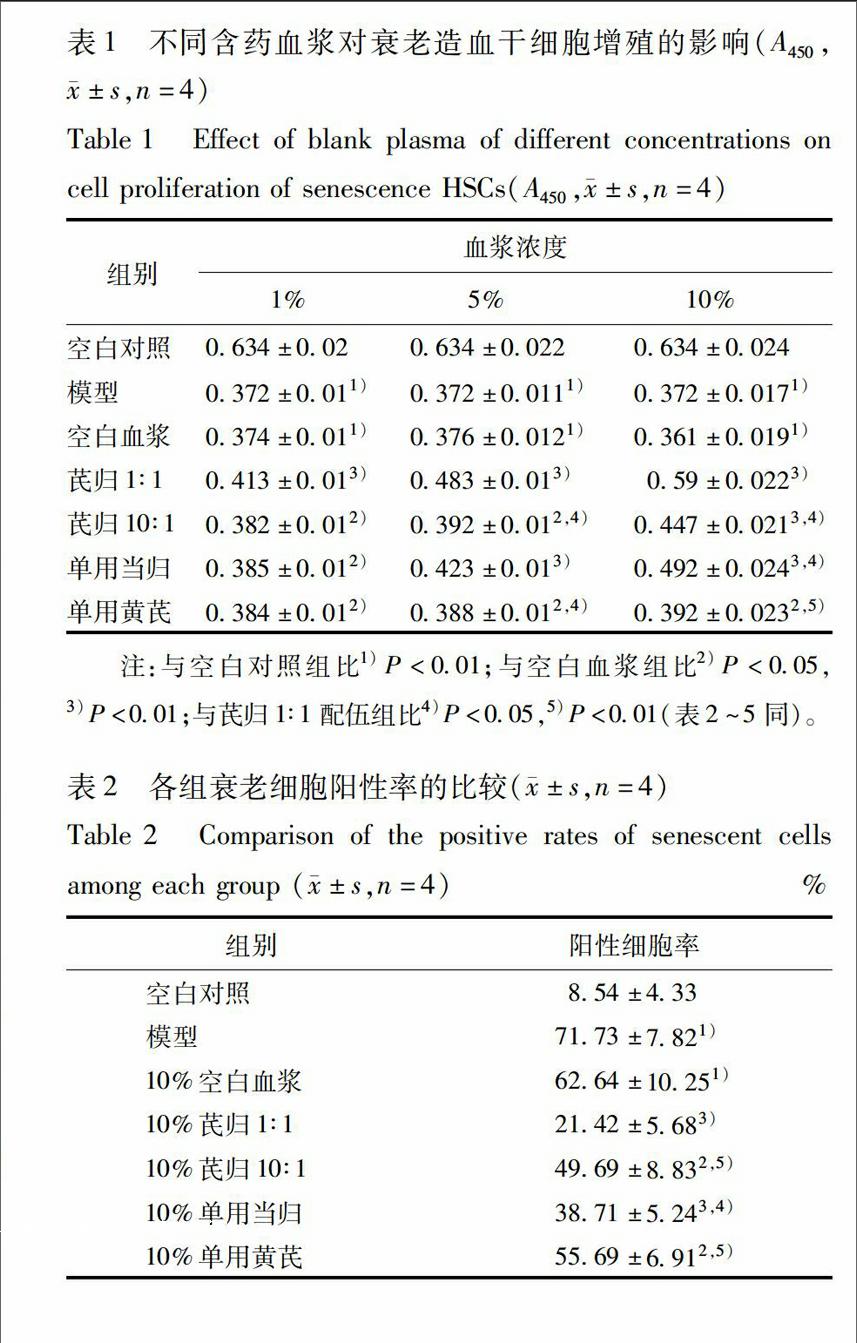
32空白血浆的细胞毒实验空白血浆浓度低于10%时细胞增殖抑制率小于20%。因此,取抑制率小于20%的血浆浓度(1%,5%,10%)作为无细胞毒性的血浆浓度,见图2。
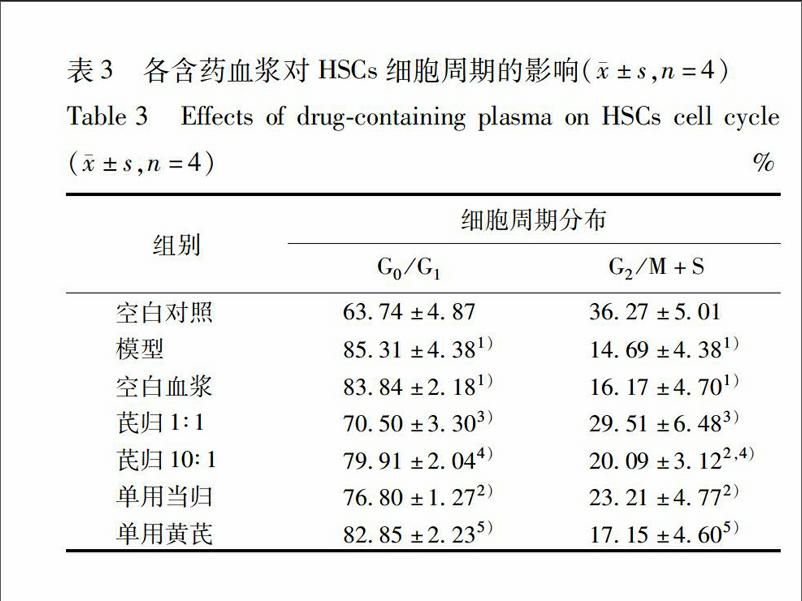
33各含药血浆对细胞增殖的影响随着含药血浆浓度的增加,其促进细胞增殖活性逐渐增强,呈量效关系。与空白对照组比较,模型组细胞增殖活性显著降低(P<001)。与空白血浆组比较,芪归1∶1配伍组、10∶1配伍组、单用黄芪组、单用当归组不同浓度含药血浆细胞增殖活力显著增强(P<005,P<001),尤其在含药血浆浓度为10%时,其细胞增殖力顯著高于空白血浆组(P<001)。与芪归1∶1配伍组比较,芪归10∶1配伍组、单用黄芪组、单用当归组在5%~10%含药血浆浓度时,细胞增殖活性显著低于芪归1∶1配伍组(P<005,P<001),表明芪归1∶1配伍组含药血浆促衰老造血干细胞增殖的活性强于芪归10∶1配伍组、单用黄芪组与单用当归组,见表1。
34各含药血浆对细胞衰老的影响与空白对照组比较,模型组和空白血浆组衰老细胞阳性率显著高于空白对照组(P<001)。与空白血浆组比较,芪归1∶1配伍、10∶1配伍、单用黄芪、单用当归10%含药血浆衰老细胞阳性率显著降低(P<005,P<001)。与芪归1∶1比较,芪归10∶1配伍、单用黄芪、单用当归组衰老细胞阳性率显著增加(P<005,P<001),见表2。
35各含药血浆对细胞周期的影响与空白对照组比较,模型组和空白血浆组G0/G1期细胞显著增多(P<001),G2/M+S期细胞显著减少(P<001)。与空白血浆组比较,芪归1∶1配伍组G0/G1期细胞显著减少(P<001),G2/M+S期细胞显著增加(P<001)。与芪归1∶1配伍组比较,芪归10∶1配伍组和单用黄芪组G0/G1期细胞显著增多(P<005,P<001),G2/M+S期细胞显著减少(P<005,P<001),单用当归组与芪归1∶1配伍组比较,差异无显著性,见表3。
36各含药血浆对Cyclin D1,P53,P21 mRNA表达的影响与空白对照组比较,模型组和空白血浆组Cyclin D1表达显著降低(P<001),P53,P21表达显著增强(P<001)。与空白血浆组比较,芪归1∶1配伍组、芪归10∶1配伍组、单用黄芪组、单用当归组Cyclin D1表达均显著增强(P<001),P53,P21表达均显著降低(P<005,P<001)。与芪归1∶1配伍组比较,芪归10∶1配伍组、单用当归组、单用黄芪组Cyclin D1表达均显著低于芪归1∶1配伍组(P<001),P53,P21表达均显著高于芪归1∶1配伍组(P<001),见表4,图3。
37各含药血浆对Cyclin D1蛋白表达的影响与空白对照组比较,模型组和空白血浆组Cyclin D1蛋白表达显著降低(P<001)。与空白血浆组比较,芪归1∶1配伍组、芪归10∶1配伍组、单用当归组、单用黄芪组Cyclin D1蛋白表达均显著增强(P<001)。与芪归1∶1配伍组相比较,芪归10∶1配伍组、单用当归组、单用黄芪组Cyclin D1蛋白表达均显著低于芪归1∶1组(P<005,P<001),见表5,图4。endprint
MMarker;1空白对照组;2模型组;3空白血浆组;4芪归1∶1组;5芪归10∶1组;6单用当归组;7单用黄芪组。
4讨论
骨髓造血干细胞(hematopoietic stem cell,HSCs)是血液谱系中最重要的细胞,具有高度的自我更新、多向分化、跨系分化与重建长期造血的潜能,其作为一种组织特异性干细胞,通过不对称分裂一方面维持自身数量的相对稳定,另一方面生成多系或和单系造血祖细胞,以维持机体的正常造血功能。机体代谢过程中产生的活性氧分子、紫外线照射、电离辐射以及大多数化疗药物均可诱导造血干细胞DNA损伤,这些损伤最终导致造血干细胞的衰老[11]。造血干细胞衰老可导致机体造血功能障碍,且组织修复能力降低、免疫功能下降。tBHP在体外可诱导HSC衰老,表现为细胞增殖和多向分化能力降低,处于细胞周期活跃增殖的细胞数量减少,细胞衰老重要标志SAβgal表达增加[9]。本研究采用tBHP在体外成功诱导了HSCs衰老,与文献报道一致。
DBT是补气生血的经典方,由黄芪当归5∶1配伍而成,对多种原因的造血功能障碍具有良好的治疗作用。现代药理也表明,DBT组成药物黄芪和当归有效成分黄芪多糖与当归多糖可延缓造血干细胞衰老。黄芪多糖可通过调节CDK4,Cyclin D,P16等细胞周期相关蛋白的表達起到延缓HSCs衰老的作用[12]。在放射损伤的Sca1+ HSCs体内衰老模型,当归多糖显著降低了SAβ半乳糖苷酶染色阳性细胞百分率,抑制G1期细胞比例增加以及S期细胞比例减少,抑制衰老造血干细胞混合集落形成单位(mixed colony forming unit,CFUMix)数量的减少,其机制与抑制氧化损伤、调控细胞周期蛋白相关基因与蛋白的表达、抑制端粒损伤以及端粒酶活性下调有关[1315]。提示抑制HSCs衰老促进造血功能的恢复可能是DBT促造血作用的重要机制。以往的研究表明,在骨髓造血功能抑制模型,黄芪和当归5∶1,25∶1,1∶1,1∶25,1∶5,1∶10配伍时,可升高外周血细胞数,增加血清造血生长因子含量和骨髓有核细胞数,促进造血祖细胞增殖,尤以黄芪当归1∶1,1∶25,1∶5配伍时发挥促造血的作用最强。提示黄芪和当归配伍促造血作用并不是经典的5∶1配伍,而是在一定的范围配伍均具有促进造血作用。因此,本研究采用血浆药理学方法,选择黄芪和当归1∶1配伍(促造血作用最强)和10∶1配伍(促造血作用弱)2个配伍比例,进一步从HSCs衰老研究了黄芪和当归配伍的促造血作用机制。结果表明,黄芪、当归、芪归1∶1、芪归10∶1配伍可促进衰老的造血干细胞增殖,降低衰老细胞阳性率,减少细胞周期G0/G1期细胞数,增加G2/M和S期细胞数,其中以芪归1∶1配伍的作用最强。提示黄芪当归及其配伍可延缓HSCs衰老,通过促进细胞周期转换促进了HSCs增殖,从而发挥其促造血作用。
细胞生命活动的基本过程体现在细胞周期中。在细胞周期时相变化过程中,细胞由静止进入增殖、分化、衰老、凋亡和死亡等生理状态,细胞周期关键调控因子,如INK4 家族(包括P16,P15,P18,P19)及CIP/KIP 家族(包括P21,P27,P57等)发生改变时,细胞将发生衰老或绕过衰老程序继续增殖[16]。细胞周期蛋白Cyclin是正性调节因子,其表达上调可以促进细胞周期启动复制,由G1期进入S期。P53基因是一种抑癌基因,其编码蛋白P53参与细胞对DNA损伤的应答,在维持细胞基因组的稳定性中起“分子警察”的作用。细胞衰老与细胞周期的停滞有关。P53可使P21的表达增强,结果一方面抑制CDK4/6Cyclin D1 复合物对Rb蛋白的磷酸化,另一方面抑制CDK2Cyclin E 复合物的活性,使细胞停滞于G1期,最终诱发细胞衰老的特征性改变[17]。P21能够广泛结合并抑制各种CyclinCDK复合物,包括Cyclin D/CDK4,Cyclin E/CDK2和 Cyclin A/CDK2,使Rb低磷酸化,不能释放E2F,DNA合成受抑制,导致细胞不能进入S期,停滞在G期,从而诱发细胞衰老[18]。本研究表明,tBHP作用于造血干细胞后,可使Cyclin D1表达降低,P53和P21表达上调,从而诱导了细胞衰老,细胞增殖能力下降。黄芪、当归、芪归1∶1配伍、芪归10∶1配伍使Cyclin D1基因和蛋白表达上调,P53和P21基因表达下调。而且芪归1∶1配伍的作用强于黄芪、当归和芪归10∶1配伍。提示黄芪当归配伍延缓造血干细胞衰老、促进细胞增殖的作用与其上调细胞周期正性调节因子表达,下调细胞周期负性调节因子表达,从而促进细胞由静止期进入增殖期有关。也表明黄芪和当归在合理的配伍下(如1∶1配伍)可发挥较好的延缓造血干细胞衰老、促进细胞增殖的作用。
[参考文献]
[1]Rossi D J, Bryder D, Weissman I L Hematopoietic stem cell aging:mechanism and consequence[J]. Exp Gerontol, 2007, 42(5):385.
[2]Nijnik A, Woodbine L, Marchetti C, et al. DNA repair is limiting for hacmatopoietic stem cells during ageing[J]. Nature, 2007, 447(7145):686.
[3]Yang X, Huang C G, Du S Y, et al. Effect of Danggui Buxue Tang on immunemediated aplastic anemia bone marrow proliferation mice[J]. Phytomedicine, 2013, 21(5):640.endprint
[4]Shi X Q, Shang E X, Tang Y P, et al. Interaction of nourishing and tonifying blood effects of the combination of Angelicae Sinensis Radix and Astragali Radix studied by response surface method[J]. Acta Pharm Sin, 2012, 47(10):1375.
[5]范颖,陈信义当归补血汤源流及配伍效用关系研究进展[J]. 中国实验方剂学杂志, 2006, 12(10):62.
[6]Li F, Tang R, Chen L B, et al. Effects of Astragalus combined with Angelica on bone marrow hematopoiesis suppression induced by cyclophosphamide in mice[J]. Biol Pharm Bull, 2017, 40(5):598.
[7]Chen G, Wu L, Deng C Q The effects of Bu Yang Huan Wu Decoction and its effective components on proliferationrelated factors and ERK1/2 signal transduction pathway in cultured vascular smooth muscle cells[J]. J Ethnopharmacol, 2011, 135(1):7.
[8]Zhou Y, Yang B, Yao X, et al. Establishment of an aging model of Sca1+ hematopoietic stem cell and studies on its relative biological mechanisms[J]. In Vitro Cell Dev Biol Anim, 2011, 47(2):149.
[9]周玥,姜蓉,王萍,等三丁基过氧化氢通过调控细胞周期诱导Sca1+造血干祖细胞衰老[J]. 第三军医大学学报, 2011, 33(18):1893.
[10]Lee B Y, Han J A, Im J S, et al. Senescenceassociated betagalactosidase is lysosomal betagalactosidase[J]. Aging Cell, 2006, 5(2):187.
[11]李德冠,孟爱民造血干细胞衰老机制研究[J]. 中国药理学通报, 2008,32(6):701.
[12]王乾兴,金华,何国平,等黄芪多糖对衰老小鼠造血干细胞细胞周期调控蛋白的影响[J]. 遵义医学院学报, 2014, 40(2):144.
[13]张先平,王乾兴,陈斌,等当归多糖抑制氧化损伤延缓造血干细胞衰老[J]. 中国中药杂志,2013,38(3):407.
[14]张先平,刘俊,徐春燕,等当归多糖对小鼠衰老造血干细胞端粒、端粒酶及P53的影响[J]. 中国中药杂志,2013,38(14):2354.
[15]张先平,王乾兴,陈斌,等当归多糖对小鼠衰老造血干细胞细胞周期蛋白的调控[J]. 基础医学与临床,2013, 21(3):320.
[16]Noda S, Ichikawa H, Miyoshi H Hematopoietic stem cell aging is associated with functional decline and delayed cell cycle progression[J]. Biochem Biophys Res Commun, 2009, 383(2):210.
[17]Dumble M, Moore L, Chambers S M, et al. The impact of altered P53 dosage on hematopoietic stem cell dynamics during aging[J]. Blood, 2007, 109(4):1736.
[18]Yu H, Yuan Y, Shen H, et al. Hematopoietic stem cell exhaustion impacted by P18 INK4C and P21 CiP1/Waf1 in opposite manners[J]. Blood, 2006, 107(3):1200
[責任编辑张宁宁]endprint
