广西富硒区土壤耐硒菌株的分离及鉴定
2017-11-16梁潘霞黄太庆刘永贤江泽普
廖 青,梁潘霞,邢 颖,黄太庆,刘永贤,江泽普
(广西农业科学院农业资源与环境研究所,广西 南宁 530007)
广西富硒区土壤耐硒菌株的分离及鉴定
廖 青,梁潘霞,邢 颖,黄太庆,刘永贤,江泽普*
(广西农业科学院农业资源与环境研究所,广西 南宁 530007)
【目的】从广西富硒区土壤中分离出多株耐硒菌株,为土壤硒资源开发利用提供参考。【方法】在广西主要富硒区永福、巴马、玉林寒山、桂平、藤县等地采集田间土样,利用稀释平板法并通过加硒培养对耐硒微生物进行分离、筛选。【结果】筛选得到8株耐硒能力较强的菌株,其在固体培养基中对硒的耐受浓度均在10 000 μg/mL以上。8株耐硒菌株中,YLB1-33耐硒能力最强,其在含硒量为29000 μg/mL的固体培养基中仍能微弱生长。经16S rDNA序列分析和系统发育分析,鉴定结果表明,YLB1-6为蜡质芽孢杆菌、BMB2-1和TXB1-8为短小芽孢杆菌、GPB2-5为苏云金芽孢杆菌、YLB1-26和YLB1-33为地衣芽孢杆菌、YLB1-2和YFB1-8为粘质沙雷氏菌。【结论】耐硒菌株的发现对广西土壤硒资源利用、富硒农产品开发具有潜在的应用价值。
富硒土壤;耐硒;菌株;鉴定;广西
【研究意义】硒(Se)是人体必需的15种微量元素之一,适度开发利用土壤硒资源,生产天然富硒农产品,对于满足人们日常补硒的需求尤为重要。广西是富硒大省区,富硒土壤面积达212万hm2,为目前全国圈定出的特大面积连片富硒土壤区域[1],土壤硒含量最高可达2.29 mg/kg[2]。然而,由于广西富硒土壤在中酸性土壤区分布较多,硒易与铁形成溶解性极低的氧化物和水合氧化物,硒有效硒大大降低[3],土壤硒资源优势得不到充分地发挥。研究如何提高土壤有效硒含量,对土壤硒资源优化利用具有重要意义。【前人研究进展】微生物在硒的地球化学循环和形态转化中发挥着重要的作用[4-6],它可以通过氧化、还原、同化、甲基化等多种方式代谢硒[7]。研究发现,许多微生物可以耐受高浓度的亚硒酸盐,如假单胞菌 (Pseudomonassp.)、戴尔福特菌(Delftiatsuruhatensis)、球形芽孢杆菌(Bacillussphaericus),其耐亚硒酸盐的浓度高达600 mM[8]。高硒环境是超耐硒微生物种群的潜在来源,一些学者从湖北恩施渔塘坝筛选出多株超耐硒细菌,彭祚全等[9]所筛选的鲍氏不动杆菌(Acinetobacterbaumannii)、地衣芽孢杆菌(Bacilluslicheniformis)和枯草芽孢杆菌(Bacillussubtilis),其耐硒能力高达25 000 μg/mL;袁永强等[10]筛选到的3株具有还原亚硒酸盐能力的细菌,其耐硒浓度高达800 mM,这是目前细菌耐受四价硒的最高浓度之一。研究表明,高硒胁迫下细菌会产生应激反应,将毒性高的四价硒或六价硒转化成低毒的元素硒。因此,利用微生物对硒的转化作用有可能实现土壤硒的生物活化。【本研究切入点】目前,我国高硒地区如湖北恩施州开展耐硒微生物研究起步较早,而广西关于土壤硒转化相关微生物的研究未见相关报道。【拟解决的关键问题】从广西富硒地区采集多个土壤样品并进行耐硒微生物筛选,以期为后继获取天然富硒微生物进行土壤硒活化奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌种 从广西永福、巴马、玉林寒山、桂平、藤县等多个富硒区采集土壤样品中分离、纯化。
1.1.2 试剂 亚硒酸钠(Na2SeO3,AR 98 %)购自山东西亚化学工业有限公司为,磷酸盐缓冲液(Phosphate Buffered Saline,PBS)购自上海生工生物工程技术服务有限公司;其他化学药品均为国内生产的分析纯产品。
硒液制备:称取22.35 g Na2SeO3,溶于去离子水中并定容至100 mL,此溶液硒浓度为100 mg/mL,使用无菌滤头(0.22 μm)过滤后备用,存于避光处。
1.1.3 培养基 包括细菌、放线菌、真菌的液体培养基和固体培养基。
细菌液体培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,蒸馏水1000 mL,pH 7.3±0.2;
放线菌液体培养基:可溶性淀粉20 g,氯化钠0.5 g,硫酸亚铁 0.01 g,硝酸钾1 g,磷酸氢二钾0.5 g,硫酸镁0.5 g,蒸馏水1000 mL,pH 7.3±0.2;
真菌液体培养基:20 %马铃薯浸出液1000 mL,蔗糖20 g。马铃薯浸出液的制备:称取去皮马铃薯切块200 g,加蒸馏水1000 mL煮沸0.5 h,用纱布过滤取汁,补足原来的水量。
细菌、放线菌、真菌固体培养基:营养琼脂、高氏合成I号培养基、马铃薯葡萄糖琼脂均购自广东环凯微生物科技有限公司。
所有培养基均在121 ℃灭菌20 min后使用。
1.2 试验方法
1.2.1 微生物的分离 在广西永福、巴马、玉林寒山、桂平、藤县等多个富硒区采集土壤样品进行微生物的分离。取10 g土样加入到预先装有10颗玻璃珠的90 mL的无菌PBS中,30 ℃、200 r/min振荡30 min,静置5 min,收集土壤悬液,于5000 r/min离心15 min,沉淀用10 mL PBS悬浮,4 ℃保存备用。取2 mL制备好的样品加入到100 mL含硒浓度为100 μg/mL的液体培养基中进行筛选培养,然后用梯度稀释法制备10-2~10-6系列稀释液,取100 μl分别涂布到固体培养基中,30 ℃下培养至菌落长好,挑取单个菌落,采用平板划线法获得菌株纯培养物。
1.2.2 耐硒能力筛选 将分离纯化得到的菌株接种到液体培养基中培养,取5 μl 24~48 h培养液接种不同硒浓度的固体培养基中。含硒固体培养基中硒的浓度递增梯度为100、200、300、400、500、600、700、800、900和1000 μg/mL,经过前10轮加硒培养基淘汰后,能存活下来的菌株再进行更高硒浓度筛选。
1.2.3 耐硒菌株的分子生物学鉴定 菌株16S rDNA序列由南宁国拓生物科技有限公司进行测定。所得序列提交至GenBank,用BLAST软件与GenBank库中已知序列进行相似性比对,并利用MEGA 5.0软件构建系统进化树,确定菌株的种属类别。
2 结果与分析
2.1 菌株分离
本试验采用加硒液体培养基进行耐硒菌株初筛,利用梯度稀释涂板,从多个广西富硒土壤样品中共分离到具有不同菌落特征的微生物菌株62株,其中细菌32株,放线菌9株,霉菌10株,酵母菌11株。采用平板划线法将这些菌株进行纯化,菌株纯化后于试管斜面上4 ℃保藏。
2.2 耐硒能力筛选
经过前10轮加硒浓度递增筛选,能够在硒浓度1000 μg/mL的固体培养基上存活的菌株有38株,其中细菌26株,霉菌5株,酵母菌7株,这些菌株均能将亚硒酸钠还原成红色单质硒,在含硒平板上呈现红色菌落。所筛菌株中,放线菌对硒的耐受性最差,其中2株对硒的耐受最高耐硒浓度也仅为900 μg/mL,当硒浓度达到1000 μg/mL所有放线菌均不能生长;7株酵母菌虽然能耐受1000 μg/mL硒,但生长很弱,在平板上菌落呈点状;霉菌在1000 μg/mL硒的平板上,生长也有不同程度的减弱,表现为菌丝生长受抑制;细菌对硒的耐受性相对较强,所筛细菌中,80 %能在硒浓度为1000 μg/mL的平板上生长,且大多数细菌生长良好。
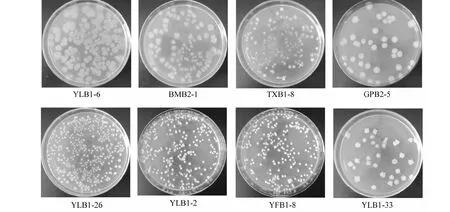
图1 耐硒菌株菌落形态Fig.1 Colony morphology of strains with high Se tolerance
能耐受1000 μg/mL硒的菌株再进行更高耐硒能力测定,平板硒浓度从1000~30 000 μg/mL,硒梯度按500 μg/mL递增。随着培养基中硒浓度逐渐提高,菌株生长受到抑制,高于其耐受能力即不能生长。结果表明,酵母菌最高耐受硒浓度为1500 μg/mL,霉菌为3000 μg/mL,细菌为29 000 μg/mL。其中,耐10 000 μg/mL硒以上的细菌一共有8株(图1),其中3株耐硒浓度为11 000 μg/mL(分别命名为YLB1-6、BMB2-1、TXB1-8),1株耐硒11 500 μg/mL(GPB2-5),1株耐硒15 000 μg/mL(YLB1-26),2株耐硒20 000 μg/mL(分别命名为YLB1-2、 YFB1-8),1株耐硒29 000 μg/mL(YLB1-33)。
2.3 菌株鉴定结果
2.3.1 菌落形态特征 营养琼脂培养基37 ℃培养24 h后,各菌株菌落形态如图1所示。菌株YLB1-6生长良好,菌落呈灰白色,圆形或近圆形,边缘呈放射融蜡状,菌落中央稍隆起,不透明,质地软,稍有光泽;菌株BMB2-1近似圆形,淡黄色,扁平,边缘不整齐,半透明,表面光滑、湿润;菌株TXB1-8近圆形,淡黄色,扁平,边缘不整齐,不透明,表面湿润、光滑、有黏性;菌株GPB2-5菌落呈圆形,白色,不透明,边缘整齐、光滑;菌株YLB1-26和YLB1-33呈白色,圆形,白色,扁平,不透明,边缘呈锯齿状,表面粗糙皱褶;菌株YLB1-2和YFB1-8菌落圆形,中间凸起,不透明,表面光滑,边缘整齐,较粘稠,易挑起。
2.3.2 16S DNA扩增结果 挑选耐10 000 μg/mL硒以上的8株细菌通过PCR扩增出其16S rDNA(图2),这些菌株的16S rDNA序列长度均在1450 bp左右。
2.3.3 16S DNA序列同源性及系统发育分析结果 BLAST分析结果(表1)表明,这8株耐硒细菌与其同源菌株相似性均在99 %以上,YLB1-6可初步鉴定为蜡状芽孢杆菌(Bacilluscereus),BMB2-1和TXB1-8为短小芽孢杆菌(Bacilluspumilus),GPB2-5为苏云金芽孢杆菌(Bacillusthuringiensis),YLB1-26和YLB1-33为地衣芽孢杆菌(Bacilluslicheniformis),YLB1-2和YFB1-8为粘质沙雷氏菌(Serratiamarcescens)。
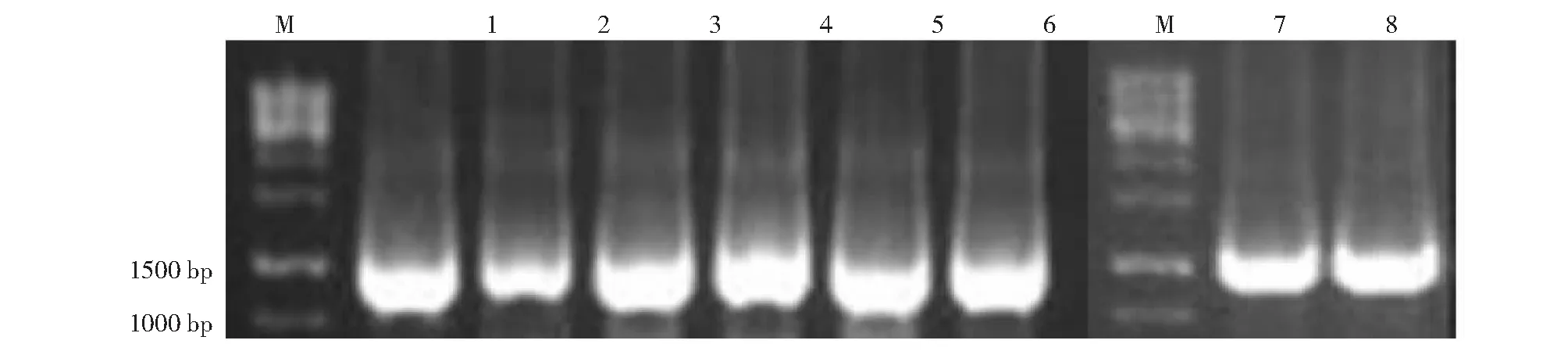
M: Marker; 1: YLB1-26; 2: TXB1-8; 3: YLB1-6; 4: BMB2-1; 5: YLB1-33; 6: GPB2-5; 7: YLB1-2; 8:YFB1-8图2 16S rDNA的PCR扩增产物Fig.2 PCR amplified products of 16S rDNA

菌株Strains同源菌株Thenearesttypestrain相似性(%)IdentityYLB1-6蜡质芽孢杆菌BacilluscereusDS1699BMB2-1短小芽孢杆菌BacilluspumilusMTCC7514100TXB1-8短小芽孢杆菌BacilluspumilusRHS/T-38499GPB2-5苏云金芽孢杆菌BacillusthuringiensisBAPE199YLB1-26地衣芽孢杆菌BacilluslicheniformisCCMMB92799YLB1-2粘质沙雷氏菌SerratiamarcescensSYJ1-999YFB1-8粘质沙雷氏菌SerratiamarcescensSM3999YLB1-33地衣芽孢杆菌BacilluslicheniformisXJ-P9599
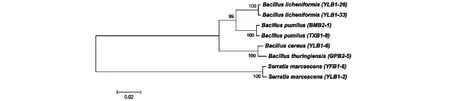
图3 基于16S rDNA序列的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA sequences
以N-J法(MEGA 5.0软件)构建了广西富硒地区耐硒细菌16S rDNA序列的系统发育树(图3)。在系统发育树中,本研究所得耐硒细菌聚集为2个大分支,一个分支为Bacillus,另一分支为Serratia。其中,Bacillus为优势菌群。结合菌株16S DNA序列分析和系统发育树分析,可将YLB1-6鉴定为蜡状芽孢杆菌,BMB2-1和TXB1-8鉴定为短小芽孢杆菌,GPB2-5鉴定为苏云金芽孢杆菌,YLB1-26和YLB1-33鉴定为地衣芽孢杆菌,YLB1-2和YFB1-8为粘质沙雷氏菌。
3 讨 论
本研究通过对广西富硒区耐硒菌株进行筛选,发现土壤细菌耐硒能力最强,放线菌耐硒能力最差;所筛8株耐硒菌株均为细菌,经16S rDNA序列及系统发育综合分析,6株属于常见耐受硒的芽孢杆菌纲(Bacill),另外2株属于真细菌纲(Eubacteriae),粘质沙雷氏菌具有高耐硒能力为首次报道;这些菌株在加硒固体培养基上均能耐受硒浓度10 000 μg/mL以上,其中YLB1-33耐硒能力最强,达29 000 μg/mL,这在广西富硒地区(非高硒区)极为罕见。
关于微生物耐硒机理存在多种假说。目前较为认可的一种假说是,微生物通过自身还原作用将高浓度硒酸盐或亚硒酸盐转化为低毒的红色单质硒[11-13]从而降低高硒环境对菌体的毒害作用。这种红色单质硒其实是一种易溶于水的红色元素硒-蛋白复合物[14],因其毒性小,对热稳定,被认为是硒生物解毒的方式[15]。耐硒微生物还原产生的红色单质硒在护肝、免疫调节、抑瘤等方面具有较好的生物活性[16],因而可直接用作保健补硒制剂。另一方面,耐硒微生物在硒的代谢中可实现硒的不同价态的转化,并且能将无机硒转化成有机硒,在土壤硒活化方面具有巨大的应用潜力。广西富硒土壤以酸性红壤和赤红壤居多,土壤硒以亚硒酸盐为主,易被铁的氧化物和粘土矿物吸附,但在耐硒微生物的作用下,强吸附态的亚硒酸盐有可能转化为可溶性有机硒[17],被吸附固定的硒获得释放,土壤硒的有效性得以提高。
耐硒微生物尽管在土壤硒活化方面有巨大的应用潜力,但还是要对其作进一步筛选以获得有效硒转化效率高的菌株,并开展天然富硒微生物活化条件研究及在富硒土壤的定殖能力研究,这对广西土壤硒资源利用、富硒农产品开发更有重要的现实意义。
4 结 论
本研究从广西多个富硒区分离鉴定出8株耐硒微生物,分别是:1株蜡质芽孢杆菌、2株短小芽孢杆菌,2株地衣芽孢杆菌,1株苏云金芽孢杆菌,2株粘质沙雷氏菌,说明耐硒微生物具有种群多样性。耐硒微生物的发现对土壤资源利用、富硒农产品开发具有潜在的应用价值。
[1]邓 萍. 广西几多“硒”再摸“富”家底—我区对“长寿元素”硒开展再调查纪事[N]. 广西日报,2014-01-15:011.
[2]刘永贤,阳继辉,石玫莉,等. 广西富硒功能农产品开发前景分析[J]. 农业与技术,2015,35(1):176-178.
[3]耿建梅. 海南省稻田土壤硒的化学特征及水稻吸收累积硒的基因型差异与机理[D]. 海南大学博士学位论文,2010:7.
[4]Stolz J,Basu P,Oremland R. Microbial transformation of elements:The case of arsenic and selenium[J]. International Microbiology,2002,5(4):201-207.
[5]Stolz J,Basu P,Santini J M,et al. Arsenic and selenium in microbial metabolism[J]. Annual Review of Microbiology,2006(60):107-130.
[6]徐巧林,吴文良,赵桂慎,等. 微生物硒代谢机制研究进展[J]. 微生物学通报,2017,44(1):207-216.
[7]Nancharaiah Y V,Lens P N L. Ecology and Biotechnology of Selenium-Respiring Bacteria[J]. Microbiology and Molecular Biology Reviews,2015,79(1):61-80.
[8]Ghosh A,Mohod A M,Paknikar K M,et al. Isolation and characterization of selenite-and selenate-tolerant microorganisms from selenium-contaminated sites[J]. World Journal of Microbiology & Biotechnology,2008,24(8):1607-1611.
[9]彭祚全,樊 俊,向德恩,等. 3株超耐硒细菌的分离、筛选与鉴定[J]. 微量元素与健康研究,2012,29(3):4-6.
[10]袁永强,朱建明,刘丛强,等. 高硒碳质泥岩中的3株高还原耐受亚硒酸盐菌[J]. 地学前缘,2014,21(2):331-341.
[11]Tomei F A,Barton L L,Lemanski C L,et al. Transformation of selenate and selenite to elemental selenium byDesulfovibriodesulfuricans[J]. Journal of Industrial Microbiology,1995,14(3/4):329-336.
[12]Ike M,Takahash K,Fujita T,et al. Selenate reduction by bacteria isolated from aquatic environment free from selenium contamination[J]. Water Research,2000,34(11):3019-3025.
[13]Li B Z,Liu N,Li Y Q,et al. Reduction of selenite to red elemental selenium byRhodopseudomonaspalustrisstrain N[J]. PLoS One,2014,9(4):e95955.
[14]高学云,张劲松,张立德. 纳米红色元素硒的急性毒性和生物利用性[J]. 卫生研究,2000,29(1):57-58.
[15]王东亮,肖 敏,钱 卫,等. 细菌还原氧化态硒产生红色单质硒的研究进展[J]. 微生物学报,2007,47(3):554-557.
[16]张劲松,高学云,张立德,等. 纳米红色元素硒的护肝、抑瘤和免疫调节作用[J].营养学报,2001,23(1):32-35.
[17]沈燕春,周 俊. 土壤硒的赋存状态与迁移转化[J]. 安徽地质,2011,21(3):186-191.
IsolationandIdentificationofSe-toleranceStrainsfromSe-richSoilinGuangxi
LIAO Qing, LIANG Pan-xia, XING Ying, HUANG Tai-qing, LIU Yong-xian, JIANG Ze-pu*
(Agricultural Resource and Environmental Research Institute, Guangxi Academy of Agricultural Sciences, Guangxi Nanning 530007, China)
【Objective】To provide reference for Se resource exploitation of soil, many strains of Se-tolerance were isolated from Se-rich soil in Guangxi.【Method】The dilution spread plate method and Se-added culture method were used to screen the Se-tolerance strains from the soils which were sampled from the main Se-rich areas such as Yongfu, Bama, Yulin Hanshan, Guiping and Tengxi.【Result】8 strains with high Se-tolerance capacity were obtained. These strains could tolerate the Se concentration above 10000μg/mL in solid medium. Among the 8 strains, YLB1-33 showed the highest Se-tolerance. It could still grow weakly in the solid medium with Se concentration 29000 μg/mL. Based on the sequencing of 16S rDNA and phylogenetic analysis, results showed that YLB1-6 was identified asBacilluscereus, BMB2-1 and TXB1-8 were identified asBacilluspumilus, GPB2-5 was identified asBacillusthuringiensis, YLB1-26 and YLB1-33 were identified asBacilluslicheniformis, and YLB1-2 and YFB1-8 were identified asSerratiamarcescens.【Conclusion】The finding of Se-tolerance strains had potential application value on promoting the utilization of Se soil resources and the development of Se-rich agricultural products in Guangxi.
Se-rich soil; Se-tolerance; Strains; Identification; Guangxi
1001-4829(2017)10-2303-05
10.16213/j.cnki.scjas.2017.10.024
2017-06-28
广西科学研究与技术开发计划项目(桂科合4151040 01-22);广西科技计划项目(桂科攻1598006-5-13);广西富硒特色作物试验站项目(桂TS201611);广西农业科学院科技发展基金和科研业务费项目(桂农科2015JM23,2017JM01,2017JM03)
廖 青(1981-),女,广西梧州人,硕士,副研究员,主要从事土壤生态和高值农业研究,E-mail:liaoqing81@163.com,*为通讯作者:江泽普,E-mail:lzjeep@163.com。
S153.6
A
(责任编辑 汪羽宁)
