水药金耳环多糖对实验性2型糖尿病模型大鼠糖脂代谢、肾功能及氧化应激的影响Δ
2017-11-16周多强李溥罗良琦杨再波王其丽贵州省黔南布依族苗族自治州中医医院内分泌科贵州都匀558000黔南民族师范学院贵州省高校民族药用植物资源开发工程研究中心贵州都匀558000
周多强,李溥,罗良琦,杨再波,王其丽(.贵州省黔南布依族苗族自治州中医医院内分泌科,贵州都匀558000;.黔南民族师范学院/贵州省高校民族药用植物资源开发工程研究中心,贵州都匀558000)
水药金耳环多糖对实验性2型糖尿病模型大鼠糖脂代谢、肾功能及氧化应激的影响Δ
周多强1*,李溥1,罗良琦1,杨再波2,王其丽1(1.贵州省黔南布依族苗族自治州中医医院内分泌科,贵州都匀558000;2.黔南民族师范学院/贵州省高校民族药用植物资源开发工程研究中心,贵州都匀558000)
目的:研究水药金耳环多糖对实验性2型糖尿病模型大鼠糖脂代谢、肾功能及氧化应激的影响,为金耳环多糖的开发利用提供参考。方法:将60只SD大鼠随机分为正常对照组、模型对照组、阳性对照组(厄贝沙坦片,0.02 g/kg)和金耳环多糖低、中、高剂量组(以生药计分别为2、4、8 g/kg),每组10只。除正常对照组外,其余各组大鼠均ip链脲佐菌素75 mg/(kg·d)复制糖尿病大鼠模型。成模后,各给药组大鼠ig相应药物,正常对照组和模型对照组大鼠ig等体积5%羧甲基纤维素钠溶液,每天2次,连续42 d。给药结束后,采用紫外分光光度计检测肝组织中肝糖原含量;采用全自动生化分析仪检测大鼠24 h尿量、24 h尿蛋白含量,血清中三酰甘油(TG)、胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、肌酐(Cr)、尿素氮(BUN)水平,以及肾组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、超氧化物歧化酶(ROS)、丙二醛(MDA)水平。结果:与正常对照组比较,模型对照组大鼠肝组织中肝糖原含量减少(P<0.05);24 h尿量、24 h尿蛋白量增加(P<0.05);血清中TG、TC、LDL-C水平升高(P<0.05),HDL-C水平降低(P<0.05);肾组织中SOD、CAT、GSH-Px水平降低(P<0.05),ROS、MDA水平升高(P<0.05)。与模型组比较,除肝组织中肝糖原含量、血清中HDL-C水平以及金耳环多糖低剂量组大鼠24 h尿量改善不显著外,其余各给药组大鼠上述指标均得到明显改善(P<0.05)。结论:金耳环多糖可调节实验性2型糖尿病模型大鼠的血脂代谢紊乱、改善大鼠肾功能和提高肾抗氧化能力。
水药;金耳环多糖;2型糖尿病;血糖;血脂;肾损伤;氧化应激;大鼠
糖尿病是一种由于胰岛素分泌缺陷或胰岛素作用障碍所致的以高血糖为特征的代谢性疾病,在血糖升高的同时,胰岛素抵抗造成的糖脂代谢紊乱可引起胰岛β细胞的氧化应激损伤[1]。长期高血糖的环境下易产生大量的活性氧簇(ROS),ROS激活可引起糖尿病肾病晚期糖基化终末产物(AGEs)形成[2]。AGEs使清除自由基的各种抗氧化酶的活性下降,引起机体自由基增多,进而导致肾组织损伤[3]。改善糖尿病患者的氧化应激状态,能有效缓解糖尿病患者病程进展,对其并发症的防治有积极的作用。
金耳环是贵州省水族民间常用药材,为马兜铃科植物金耳环(Asarum insigne Diels)的全草,水药记载名为“骂广瓦”,具有温经散寒、散瘀止痛的功效,主要用于风寒痹痛、跌打损伤、糖尿病、急性肠胃炎、风寒感冒、慢性支气管炎等病症的治疗[4-5]。据报道,金耳环多糖具有镇痛、抗炎的作用[6],能明显延长浓氨水、二氧化硫诱发的小鼠咳嗽潜伏期,减少小鼠3 min内的咳嗽次数,有明显的止咳、祛痰作用[7]。目前,国内尚未见有关金耳环多糖降血糖、降血脂、抗氧化等方面的实验研究报道。故本研究拟建立2型糖尿病模型,观察金耳环多糖对模型大鼠血糖、血脂、抗氧化指标及尿蛋白的影响,为金耳环多糖后期开发研究提供实验依据。
1 材料
1.1 仪器
AL204电子天平(上台钰电子有限公司);AODPHS25精密pH计(北京爱欧德仪器设备有限公司);TGL-24MC高速冷冻离心机(长沙湘锐离心机有限公司);GTR16-2低温离心机(北京时代北利离心机有限公司);GT-1640血糖仪(日本爱科来株式会社);752Pro紫外-可见光分光光度计(上海棱光技术有限公司);LC 20AB液相色谱仪(日本岛津公司);AU-2700全自动生化分析仪(日本奥林巴斯公司)。
1.2 药材、药品与试剂
金耳环药材采自贵州省三都水族自治县九阡镇,经贵阳中医学院生药学教研室李江教授鉴定为真品;厄贝沙坦片(扬子江药业集团北京海燕药业有限公司,批号:161019,规格:75 mg/片);链脲佐菌素(STZ,美国Sigma公司);空腹血糖(FBG)、三酰甘油(TG)、胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、肌酐(Cr)、尿素氮(BUN)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)、ROS、肝糖原和考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所,批号:20160721、20160827、20160827、20160827、20160827、20160925、20160925、20160918、20160920、20160928、20161017、20161122、20161022、20161127);其余试剂均为分析纯。
1.3 动物
SPF级SD大鼠60只,♂,体质量为(200±20)g,购自原第三军医大学实验动物中心[动物生产许可证号:SCXK(渝)2012-008]。所购大鼠于温度为(20±2)℃、湿度为(50±15)%、12 h/12 h明暗循环的环境下饲养7 d后开始实验,饲养期间予以标准饮食。
2 方法
2.1 金耳环多糖的制备
取金耳环药材100 g,洗净,放入消毒锅内121℃加热30 min灭酶,60℃烘干,粉碎后过80目筛得干粉。将干粉用80%乙醇充分浸渍,回流提取2次,每次1 h,合并滤液并浓缩,加入无水乙醇使含醇量至80%,静置24 h。倾去上清液,沉淀用去离子水溶解,反复冻融除杂至无沉淀,Sevage法除蛋白质至无游离蛋白(多糖溶液在280 nm波长处无紫外吸收)。15%H2O2脱色,过滤,加入无水乙醇使含醇量至80%,静置24 h,倾去上清液,沉淀依次用无水乙醇、丙酮、无水乙醚多次洗涤,除去其脂溶性成分。于60℃减压干燥,制得灰白色的粉末,即为金耳环粗多糖(苯酚-浓硫酸法测得金耳环多糖的含量为43.57%,按葡萄糖含量计)[8-9]。将金耳环粗多糖粉末用5%羧甲基纤维素钠溶液制备成质量浓度为1 g/mL的浓缩液,备用。
2.2 分组、造模与给药
2.2.1 分组将60只大鼠随机分成6组,分别为正常对照组、模型对照组、阳性对照组(厄贝沙坦片,0.02 g/kg,以成人临床剂量的20倍换算)和金耳环多糖低、中、高剂量组(以生药计分别为2、4、8 g/kg,分别以成人临床剂量的20、40、80倍换算),每组10只。以每组大鼠体质量、体温为基础值,采用SAS 9.4统计软件进行LSD检验分组均衡性。
2.2.2 造模确认分组均衡后,除正常对照组外,其余各组大鼠均复制糖尿病模型。造模前称体大鼠质量,禁食不禁水12 h后ip STZ 75 mg/(kg·d)(以1%柠檬酸-柠檬酸纳缓冲液为溶剂),连续注射2 d。注射后大鼠自由饮食,7 d后称大鼠体质量。然后,大鼠在自由饮水的情况下禁食5 h,取尾血,分离血清,采用血糖仪试纸法测FBG值,FBG值<16.7 mmol/L的大鼠再注射2 d。7 d后所有实验大鼠再次测定FBG值,以FBG>16.7 mmol/L为成模标准[10-11]。正常对照组大鼠注射1%柠檬酸-柠檬酸纳缓冲液(75 mg/kg)作安慰剂。
2.2.3 给药造模成功后,各给药组大鼠分别按“2.2.1”项下剂量ig相应药物,正常对照组和模型对照组大鼠ig 5%羧甲基纤维素钠溶液,每天2次,连续42 d。观察大鼠一般情况。
2.3 标本采集
(1)尿液:实验第42天,采用代谢鼠笼收集各组大鼠24 h尿液量。(2)血清:断头取血5 mL,以1 435×g离心10 min,吸取血清2.0 mL于EP管中,置于-80℃条件下保存,待测。(3)肝组织:取大鼠新鲜肝组织,置于-80℃条件下保存,待用。(4)肾组织匀浆液:取出大鼠肾组织后,按照1∶10的比例(g∶mL)加入4℃、pH 7.2的磷酸缓冲液(PBS),置于冰块中,XHF-D高速分散器匀浆(7 500 r/min,0.6 s),连续3次。匀浆液用1.5 mL离心管分装后,再在4℃条件下以730×g离心10 min,吸取上清液,待测。
2.4 指标检测
2.4.1 肝糖原含量测定取新鲜肝组织适量,洗净称质量后,加碱液沸水浴20 min,浓硫酸-蒽醌法显色,紫外-可见光分光光度计检测吸光度[12],按试剂盒说明书计算肝糖原含量。
2.4.2 生化指标测定大鼠血清中TG、TC、LDL-C、HDL-C、Cr、BUN水平和肾组织中MDA、SOD、CAT、GSH-Px、ROS水平以及24 h尿蛋白量均采用全自动生化分析仪进行测定,具体操作严格按照试剂盒说明书进行。
2.5 统计学方法
3 结果
3.1 金耳环多糖对大鼠一般情况的影响
造模后给药前,与正常对照组比较,模型对照组、阳性对照组和金耳环多糖低、中、高剂量组大鼠体质量均显著下降(P<0.05),外观呈毛发松散、精神较萎靡状态,同时出现了多饮、多食、多尿等典型的糖尿病症状。给药42 d后,正常对照组大鼠体质量较给药前显著增加(P<0.05);模型对照组大鼠体质量较正常对照组显著下降(P<0.05),但其给药前、后体质量下降不明显(P>0.05),一般状态未有明显改善;与模型对照组比较,阳性对照组和金耳环多糖低、中、高剂量组大鼠多饮、多尿等症状及精神状态均有一定程度的改善。
3.2 金耳环多糖对大鼠FBG的影响
造模后给药前,与正常对照组比较,其余各组大鼠FBG均显著升高(P<0.05)。给药42 d后,与模型对照组比较,金耳环多糖各剂量组大鼠FBG均显著降低(P<0.05),且呈剂量依赖性,结果见表1。
3.3 金耳环多糖对大鼠肝组织中肝糖原含量的影响
与正常对照组比较,模型对照组大鼠肝组织中肝糖原含量明显减少(P<0.05)。与模型对照组比较,各给药组大鼠肝组织中肝糖原含量无明显改变(P>0.05);正常对照组、模型对照组、阳性对照组和金耳环多糖低、中、高剂量组大鼠肝组中肝糖原含量分别为(4.98±0.95)、(4.31±0.23)、(4.34±0.99)、(4.31±0.36)、(4.35±0.45)、(4.39±0.38)mg/g(n=10)。
表1 各组大鼠FBG的测定结果(±s,n=10)Tab1 Determination results of rats’FBG in each group(±s,n=10)

表1 各组大鼠FBG的测定结果(±s,n=10)Tab1 Determination results of rats’FBG in each group(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05Note:vs.normal control group,*P<0.05;vs.model control group,#P<0.05
FBG,mmol/L给药42 d后7.38±1.32 29.65±2.67*28.25±4.22 24.58±4.05#21.63±4.42#16.67±5.48#组别正常对照组模型对照组阳性对照组金耳环多糖低剂量组金耳环多糖中剂量组金耳环多糖高剂量组造模后给药前6.38±1.25 21.42±2.57*21.35±3.44*21.87±2.27*20.37±5.23*20.99±5.45*
3.4 金耳环多糖对大鼠血脂的影响
与正常对照组比较,模型对照组大鼠血清中TG、TC和LDL-C水平显著升高(P<0.05),HDL-C水平显著降低(P<0.05)。与模型对照组比较,各给药组大鼠血清中HDL-C水平无明显改变(P>0.05),TG、TC和LDL-C水平显著降低(P<0.05),结果见表2。
表2 各组大鼠血脂相关指标测定结果(±s,n=10,mmol/L)Tab2 Determination results of blood lipid-related inde-xes of rats in each group(±s,n=10,mmol/L)

表2 各组大鼠血脂相关指标测定结果(±s,n=10,mmol/L)Tab2 Determination results of blood lipid-related inde-xes of rats in each group(±s,n=10,mmol/L)
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05Note:vs.normal control group,*P<0.05;vs.model control group,#P<0.05
LDL-C 0.68±0.07 1.13±0.22*0.81±0.15#0.63±0.16#0.58±0.22#0.51±0.37#组别正常对照组模型对照组阳性对照组金耳环多糖低剂量组金耳环多糖中剂量组金耳环多糖高剂量组TG 0.75±0.21 1.59±0.46*0.84±0.19#1.14±0.34#1.09±0.43#0.98±0.64#TC 1.98±0.21 3.08±0.19*2.57±0.28#2.35±0.52#2.24±0.67#2.15±0.52#HDL-C 1.67±0.35 0.61±0.18*0.66±0.09 0.48±0.19 0.52±0.32 0.59±0.41
3.5 金耳环多糖对大鼠肾功能相关指标的影响
与正常对照组比较,模型对照组大鼠血清中BUN和Cr水平、24 h尿量、24 h尿蛋白量显著升高(P<0.05)。与模型对照组比较,各给药组大鼠血清中BUN和Cr水平、24 h尿量、24 h尿蛋白量均显著降低(P<0.05),结果见表3。
3.6 金耳环多糖对大鼠肾氧化应激相关指标的影响
与正常对照组比较,模型对照组大鼠肾组织中SOD、CAT、GSH-Px水平显著降低(P<0.05),而ROS、MDA水平显著升高(P<0.05)。与模型对照组比较,各给药组大鼠肾组织中SOD、CAT、GSH-Px水平均显著升高(P<0.05),而ROS、MDA水平均显著降低(P<0.05),结果见表4。
表3 各组大鼠肾功能相关指标的测定结果(±s,n=10)Tab3 Determination results of renal function-related indexes of rats in each group(±s,n=10)
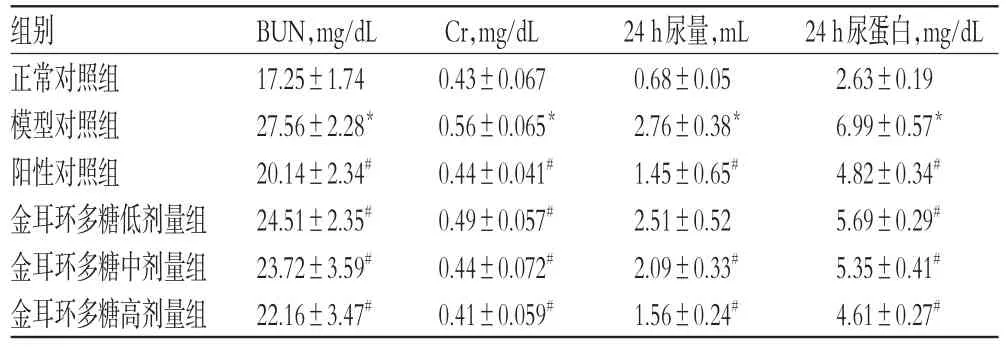
表3 各组大鼠肾功能相关指标的测定结果(±s,n=10)Tab3 Determination results of renal function-related indexes of rats in each group(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05Note:vs.normal control group,*P<0.05;vs.model control group,#P<0.05
24 h尿蛋白,mg/dL 2.63±0.19 6.99±0.57*4.82±0.34#5.69±0.29#5.35±0.41#4.61±0.27#组别正常对照组模型对照组阳性对照组金耳环多糖低剂量组金耳环多糖中剂量组金耳环多糖高剂量组BUN,mg/dL 17.25±1.74 27.56±2.28*20.14±2.34#24.51±2.35#23.72±3.59#22.16±3.47#Cr,mg/dL 0.43±0.067 0.56±0.065*0.44±0.041#0.49±0.057#0.44±0.072#0.41±0.059#24 h尿量,mL 0.68±0.05 2.76±0.38*1.45±0.65#2.51±0.52 2.09±0.33#1.56±0.24#
表4 各组大鼠肾氧化应激相关指标的测定结果(±s,n=10)Tab4 Determination results of renal oxidative stress-related indexes of rats in each group(±s,n=10)

表4 各组大鼠肾氧化应激相关指标的测定结果(±s,n=10)Tab4 Determination results of renal oxidative stress-related indexes of rats in each group(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05Note:vs.normal control group,*P<0.05;vs.model control group,#P<0.05
MDA,mmol/g 6.84±1.21 15.97±3.15*8.64±3.63#12.34±4.02#10.52±2.73#9.02±4.17#组别正常对照组模型对照组阳性对照组金耳环多糖低剂量组金耳环多糖中剂量组金耳环多糖高剂量组SOD,U/g 318.52±23.57 190.75±14.53*279.65±31.24#208.33±30.82#219.68±25.48#263.22±28.51#CAT,U/g prog 11.39±1.62 6.25±1.43*13.21±2.95#8.65±1.97#10.95±2.01#13.05±2.48#GSH-Px,U/g 673.65±115.34 487.42±101.82*628.31±124.37#509.71±99.54#549.83±125.76#619.75±122.57#ROS,U/L 208.89±31.54 398.72±35.41*251.31±32.87#390.52±22.72#337.76±25.62#285.65±29.37#
4 讨论
金耳环为贵州三都水族自治县及都匀市水族地区广泛应用的民族药材,文献报道大多是关于金耳环多糖提取工艺优选和含量测定方面的研究[8-9,13],但没有考察其对血糖、血脂、抗氧化指标及尿蛋白的影响。本研究中,笔者以常用的2型糖尿病大鼠模型考察金耳环多糖对糖尿病大鼠血糖、肝糖原、血脂、肾功能的影响及抗氧化应激作用,通过观察糖尿病大鼠FBG及血清中TG、TC、LDL-C、HDL-C、Cr、BUN水平,肝组织中肝糖原含量,肾组织中SOD、GSH-Px、CAT、MDA、ROS水平以及24 h尿蛋白量等指标的变化,证实了金耳环多糖对糖尿病大鼠有降血糖、降血脂、改善肾功能及抗氧化应激作用。并且为了客观地评价金耳环多糖的作用效果,笔者选用了目前临床治疗糖尿病肾病应用广泛的血管紧张素Ⅱ受体阻滞剂厄贝沙坦片为阳性对照。
糖尿病由于胰岛素的生物调节作用发生障碍,在血糖升高的同时,常伴有脂质代谢异常,患者出现严重的代谢紊乱易导致并发症发生,与机体的氧化应激反应密切相关[14-16]。另一方面,糖尿病患者在高糖状态下,可使细胞内还原型辅酶1(NADH)/NAD+比例增加和ROS产生增加[17],导致抗氧化酶活性下降、清除氧自由基能力下降,使体内ROS的积聚增多,最终导致肾小球基底膜损伤[18]。SOD、GSH-Px、过氧化氢酶(CAT)共同组成体内的抗氧化酶促系统,整体水平是代表机体对自由基的清除能力和机体健康情况,其中MDA可反映机体脂质过氧化程度,间接反映出细胞膜氧化的严重程度[14]。本研究结果显示,低、中、高剂量的金耳环多糖均可降低大鼠血清FBG、TG、TC、LDL-C、Cr、BUN水平和尿蛋白含量,升高肾组织中抗氧化酶SOD、GSH-Px的活性,以及降低肾组织中ROS、MDA含量,这提示金耳环多糖有明显的降血糖、调节血脂代谢紊乱、改善肾功能及减轻氧化应激对肾组织的损伤等作用。
综上所述,金耳环多糖对实验性2型糖尿病模型大鼠有降低血糖作用,对血脂代谢紊乱有一定的调节作用,能降低血清中Cr、BUN的水平,升高肾组织中抗氧化因子SOD、GSH-Px活性及CAT的含量,降低肾组织中MDA、ROS含量及促进尿蛋白的排出,缓解氧化应激对肾组织所造成的损伤,从而发挥对糖尿病模型大鼠肾损伤的防治作用。但金耳环多糖具体的降血糖、降血脂及保护肾脏的作用机制靶点有待于进一步的研究。
[1] 陈善源,徐勤.2型糖尿病中胰岛β细胞氧化应激损伤机制与相关治疗药物的研究进展[J].中国药房,2011,22(37):3533-3536.
[2] 万静,刘丽梅.氧化应激:抗氧化系统与糖尿病肾病[J].国际内分泌代谢杂志,2006,4(26):18-20.
[3] 李晓博,牟忠卿,陈丽,等.糖尿病大鼠肾脏组织氧化应激及其在糖尿病肾病发病中的意义[J].中国病理生理杂志,2006,22(4):806-809.
[4] 司有奇,陆龙辉.中国水族医药宝典[M].贵阳:贵州民族出版社,2007:318-319.
[5] 中华本草编委会.中华本草:第8卷[M].上海:上海科学技术出版社,1999:504-505.
[6] 夏亚兰,姚欣凯,许义红,等.水药骂广瓦镇痛抗炎作用的实验研究[J].重庆医学,2013,42(23):2762-2764.
[7] 夏亚兰,魏学军,林先燕,等.水药骂广瓦提取液对小鼠止咳祛痰作用的实验研究[J].重庆医学,2012,41(10):966-968.
[8] 魏学军,林先燕,李雪营,等.金耳环总多糖的提取工艺优选[J].中国实验方剂学杂志,2012,18(10):41-44.
[9] 魏学军,林先燕,夏亚兰,等.民族药金耳环多糖的提取和含量测定[J].井冈山大学学报(自然科学版),2012,33(6):86-88.
[10] 焦士蓉,唐远谋,冯慧,等.石榴皮提取物对实验性糖尿病小鼠肝脏抗氧化防御功能的影响研究[J].西华大学学报(自然科学版),2014,33(1):35-38.
[11] 林心君,王麒又,辛金钟,等.高成模率和高稳定性的糖尿病大鼠模型制备:高脂高糖膳食+STZ体重联合体表面积法构建糖尿病大鼠模型[J].中国老年学杂志,2013,33(9):2051-2054.
[12] 植飞,邢琪昌,汪莹,等.佛手山药多糖对2型糖尿病大鼠糖脂代谢及氧化应激的影响[J].食品科学,2017,38(5):262-266.
[13] 魏学军,夏亚兰,林先燕,等.贵州产金耳环不同采收期多糖的含量变化及止血作用[J].医药导报,2015,34(5):606-608.
[14] Banerjee M,Vats P.Reactive metabolites and antioxidant gene polymorphisms in type 2 diabetes mellitus[J].Redox Biology,2014,2(1):170-177.
[15] 陈敏,程丽霞.抗氧化应激治疗糖尿病肾病研究进展[J].青岛医药卫生,2016,48(4):292-294.
[16] 宋光耀,任路平.血脂紊乱对糖尿病心血管并发症的影响及处理[J].中国糖尿病杂志,2016,8(3):135-137.
[17] 王臻,陆利民.糖代谢紊乱致肾小球内皮细胞损伤机制进展[J].基础医学与临床,2012,32(11):1360-1363.
[18] 郭福团,许雄伟,潘建峰,等.桑枝多糖对糖尿病肾病小鼠肾皮质氧化应激作用的影响[J].中国药理学通报,2016,32(8):1148-1152.
Effect of Shui Medicine Asarum insigne Polysaccharide on Glycolipid Metabolis,Renal Function and Oxidative Stress in Model Rats with Experimental Type 2 Diabetes
ZHOU Duoqiang1,LI Pu1,LUO Liangqi1,YANG Zaibo2,WANG Qili1(1.Dept.of Endocrine,Guizhou Qiannan Buyi and Miao Autonomous Prefecture Hospital of TCM,Guizhou Duyun 558000,China;2.Qiannan Normal College for Nationalities/Guizhou Province College Research Centre of Ethnical Medicinal Plant Resources Exploitation Engineering,Guizhou Duyun 558000,China)
OBJECTIVE:To study the effect of Shui medicine Asarum insigne polysaccharide on glycolipid metabolism,renal function and oxidative stress in rats with experimental type 2 diabetes,and provide reference for its development and use.METHODS:60 SD rats were randomly divided into normal control group,model control group,positive control group(Irbesartan tablets,0.02 g/kg)and A.insigne polysaccharide low-dose,medium-dose,high-dose groups(calculated by crude drug as 2,4,8g/kg),10 in each group.Except for normal control group,rats in other groups were intraperitoneally injected streptozotocin 75mg/(kg·d)to induce model with diabetes.After modeling,rats in each administration group were intraperitoneally injected relevant medicines,and rats in normal control group and model control group were intragastrically administrated 5%carboxymet hylcellulose sodium solution,twice a day,for 42 d.After administration,UV spectrophotometer was used to detect the glycogen content in liver tissue.Automatic biochemical analyzer was used to detect 24 h urine output,24 h urinary protein content of rats,levels of triglyceride(TG),cholesterol(TC),low-density lipoprotein cholesterol(LDL-C),high-density lipoprotein cholesterol(HDL-C),creatinine(Cr),urea nitrogen(BUN)in serum,and levels of superoxide dismutase(SOD),glutathione peroxidase(GSH-Px),catalase(CAT),superoxide dismutase(ROS),malondialdehyde(MDA)in kidney tissue.RESULTS:Compared with normal control group,glycogen content in liver tissue of rats in model control group was decreased(P<0.05);24 h urine output and 24 h urinary protein content were increased(P<0.05);levels of TG,TC,LDL-C in serum were increased(P<0.05),and HDL-C level was decreased(P<0.05);levels of SOD,CAT,GSH-Px in kidney tissue were decreased(P<0.05),and levels of ROS,MDA were increased(P<0.05).Compared with model group,except that there were no significant differences in the improvement of urinary protein content,HDL-C level in serum,24 h urine output in A.insigne polysaccharide low-dose group,above-mentioned indexes in each administration group were obviously improved(P<0.05).CONCLUSIONS:A.insigne polysaccharide can regulate lipid metabolic disorders,and improve renal function andantioxidant capacity of rats.
Shui medicine;Asarum insigne polysaccharide;Type 2 diabetes;Blood glucose;Blood lipid;Renal injury;Oxidative stress;Rats
R285
A
1001-0408(2017)31-4415-05
DOI 10.6039/j.issn.1001-0408.2017.31.25
贵州省黔南州科技局资助项目(No.黔南科合社字〔2016〕19号)
*副主任医师,硕士。研究方向:糖尿病的基础与临床治疗。电话:0854-8253432。E-mail:dyzhouduoqiang7788@163.com
2017-05-22
2017-08-25)
(编辑:林静)
