徐长卿-二妙散-三藤方对蛋白聚糖诱导关节炎模型小鼠血清中TNF-α和DKK-1含量的影响Δ
2017-11-16吴琪周晓红杨德才何敢想任婕胡燕芬湖北中医药大学临床技能实训中心武汉4006湖北中医药大学针灸骨伤学院武汉4006湖北中医药大学第一临床学院武汉4006
吴琪,周晓红,杨德才,何敢想,任婕,胡燕芬(.湖北中医药大学临床技能实训中心,武汉4006;.湖北中医药大学针灸骨伤学院,武汉4006;.湖北中医药大学第一临床学院,武汉4006)
徐长卿-二妙散-三藤方对蛋白聚糖诱导关节炎模型小鼠血清中TNF-α和DKK-1含量的影响Δ
吴琪1*,周晓红2,杨德才3,何敢想1#,任婕1,胡燕芬1(1.湖北中医药大学临床技能实训中心,武汉430061;2.湖北中医药大学针灸骨伤学院,武汉430061;3.湖北中医药大学第一临床学院,武汉430061)
目的:研究徐长卿-二妙散-三藤方对关节炎模型小鼠血清中肿瘤坏死因子α(TNF-α)和骨化相关因子DKK-1含量的影响,探讨该方治疗关节炎的作用机制。方法:将60只BALB/c小鼠随机分为正常组、模型组、柳氮磺吡啶组(阳性对照,9 mg/kg)和徐长卿-二妙散-三藤方低、中、高剂量组(以生药量计分别为11.25、22.5、45 g/kg),每组10只。除正常组外的其余50只小鼠均采用完全弗氏佐剂+蛋白聚糖ip法建立关节炎模型。成模后,各给药组小鼠ig相应药物,正常组和模型组小鼠ig等体积生理盐水,每天1次,连续20 d。给药结束后,采用酶联免疫吸附法检测各组小鼠血清中TNF-α和DKK-1含量,透射电镜下观察小鼠骶髂关节滑膜细胞超微病理结构变化。结果:与正常组比较,模型组小鼠血清中TNF-α含量明显升高、DKK-1含量明显降低(P<0.05);镜下可见小鼠骶髂关节滑膜细胞发生增生肥大、胞质内细胞器变形、线粒体肿胀等病理损伤。与模型组比较,各给药组小鼠血清中TNF-α含量均明显降低(P<0.05或P<0.01),除柳氮磺吡啶组外的其余各给药组小鼠血清中DKK-1含量均明显升高(P<0.05);镜下可见各给药组小鼠骶髂关节滑膜细胞的病理损伤均有不同程度减轻,且徐长卿-二妙散-三藤方组小鼠的病理损伤好转程度较柳氮磺吡啶组更显著。结论:徐长卿-二妙散-三藤方可能通过降低血清中TNF-α含量和升高DKK-1含量,从而抑制关节炎模型小鼠的骶髂关节炎症和病理性骨化。
徐长卿-二妙散-三藤方;关节炎;肿瘤坏死因子α;骨化相关因子DKK-1;BALB/c小鼠
蛋白聚糖诱导的小鼠关节炎(Proteoglycan-induced arthritis,PGIA)模型是目前研究强直性脊柱炎(Ankylosing spondylitis,AS)的主要动物模型之一[1]。当前治疗AS的药物如非甾体类抗炎药(NSAIDs)、抗风湿药物(DMARDs)和肿瘤坏死因子(TNF)受体拮抗药等,通常只能改善或控制症状,不能从根本上逆转AS的自然病理演变过程[2],并普遍存在很多副作用[3],骨侵蚀与骨赘形成依然存在,且某些药品价格昂贵也限制了其广泛和长期使用[4]。因此,探索具有抗炎作用并能有效抑制病理性新骨形成、副作用小且价格低廉的方药,是AS防治的重要课题。
徐长卿-二妙散-三藤方为湖北省中医院骨伤科熊昌源教授的经验方。熊昌源教授是全国第三、四批师带徒名老中医,从事中医骨伤临床教学科研40余年,在AS的诊治方面积累了丰富的经验。AS的临床辩证众说不一,熊昌源教授从“湿、瘀、虚”论治AS,认为湿、瘀贯穿于AS发生发展的整个过程,采用徐长卿-二妙散-三藤方为基本方,可祛湿逐瘀、通督伸筋、兼顾补虚。现代药理研究表明,徐长卿的主要有效成分丹皮酚具有与NSAIDs相似的药理作用[5-7],且副作用小。二妙散(由黄柏和苍术组成)见于《丹溪心法》,主治湿热下注证,临床上治疗湿热痹阻型活动期类风湿性关节炎[8]和急性痛风性关节炎[9]疗效较好。实验研究表明,二妙散通过抑制类风湿性关节炎大鼠炎症细胞因子的作用发挥其抗炎效应,并且以黄柏、苍术比例为1∶1配伍时效果最明显[10]。督脉夹脊抵腰中,行于背正中总督一身之阳,此脉一通,则百脉皆通,熊昌源教授认为腰骸胸背和外周骨节病变与督脉有密切关系。因藤能入络,络能通脉,鸡血藤活一身之血络,络石藤通一身之筋脉,海风藤祛一身之风湿,“三滕”合用共奏通督伸筋之效。
本研究拟在给予PGIA模型小鼠徐长卿-二妙散-三藤方后,采用透射电镜观察各组小鼠骶髂关节滑膜细胞超微病理结构变化,并运用酶联免疫吸附技术检测血清中炎症相关细胞因子肿瘤坏死因子α(TNF-α)和Wnt信号通路病理性骨化相关因子DKK-1的含量,从分子水平揭示该方治疗AS的作用机制,为将该方广泛应用于临床提供实验依据。
1 材料
1.1 仪器
HT-7700透射电镜(日本日立高新技术公司);C2500-R-230V微型高速离心机(美国Labnet公司);ICV-450电热恒温培养箱(日本Asone科学仪器公司);Multiskan MK3全自动酶标仪(美国Thermo科技公司)。
1.2 饮片、药品与试剂
徐长卿(批号:160601)、黄柏(批号:170601)、苍术(批号:160301)、鸡血藤(批号:160501)、络石藤(批号:160301)、海风藤(批号:160101)饮片均购自湖北强康中药饮片有限公司;柳氮磺吡啶肠溶片(上海信谊天平药业有限公司,批号:H31020557,规格:每片0.25 g);蛋白聚糖(PG,美国西格玛奥德里奇公司,批号:D-8428,纯度:>99%);完全弗氏佐剂(美国MP Bio公司,批号:642857,纯度:99%);小鼠TNF-α(批号:E-EL-M0049c)、小鼠DKK-1(批号:E-EL-M0024c)酶联免疫吸附(ELISA)试剂盒(武汉伊莱瑞特生物科技有限公司);试剂均为分析纯,水为蒸馏水。
1.3 动物
清洁级BALB/c小鼠60只,♂,鼠龄(20±4)周,体质量(22±2)g,由武汉大学实验动物中心提供,动物生产合格证号:SCXK(鄂)2008-0004。
2 方法
2.1 徐长卿-二妙散-三藤方的制备
方药组成:徐长卿20 g、黄柏12 g、苍术12 g、鸡血藤10 g、络石藤10 g、海风藤10 g。将以上5种中药按2∶1.2∶1.2∶1∶1∶1的比例放置在套式恒温器中,加入10倍量水,武火煮沸后,改文火煎煮1 h,滤出药液;药渣加8倍量水继续煎煮1 h;合并2次滤液,将滤液浓缩至以生药量计终质量浓度分别为1.125、2.25、4.5 g/mL,各120 mL[11],作为徐长卿-二妙散-三藤方给药的低、中、高剂量药液,密封灭菌,4℃冰箱冷藏,备用。
2.2PGIA小鼠模型的制备
将60只小鼠随机分为正常组、模型组、柳氮磺吡啶组(阳性药物)和徐长卿-二妙散-三藤方低、中、高剂量组,每组10只。除正常组外,其余50只小鼠均复制PGIA模型,即将完全弗氏佐剂100 μL和PG 100 μL混合后,分别在实验第0、3、6周分3次注入小鼠腹腔。在第3次抗原注射结束后,每周观察3次关节炎发病情况,主要观察免疫后小鼠足趾、踝关节红肿程度和关节功能受限程度。按照0~4分/爪对小鼠进行外周关节进行评分[12]:无任何炎性肿胀为0分,单个爪受累肿胀为1分,大于1个爪受累为2分,关节活动受限为3分,踝关节肿胀僵直为4分,总评分在0~16分之间。
2.3 分组与给药
从造模成功的第1天起开始给药,正常组和模型组小鼠ig等体积蒸馏水,氮磺吡啶组小鼠ig 9 mg/kg的氮磺吡啶蒸馏水溶液(相当于成人临床用量的等效剂量),徐长卿-二妙散-三藤方低、中、高剂量组小鼠ig按生药量计分别为11.25、22.5、45 g/kg的中药溶液(分别按成人临床用量的6、12、24倍换算),每天给药1次,连续20 d。
2.4 ELISA法检测小鼠血清中TNF-α和DKK-1含量
给药结束后,于小鼠眼眶后静脉丛取血并分离血清,采用ELISA法检测血清中TNF-α和DKK-1,具体操作按照相应试剂盒说明书进行。
2.5 小鼠骶髂关节滑膜细胞超微结构的观察
将小鼠处死,取双侧骶髂关节面约2 mm厚的滑膜组织标本,以2.5%戊二醛前固定,0.1 mol/L磷酸缓冲液(PBS)漂洗3次,1%锇酸后固定,梯度酒精(50%、70%、80%、95%、100%)脱水2次,每次15 min;环氧树脂包埋,纯丙酮脱水2次,每次15 min;环氧树脂包埋剂EPON812-丙酮(1∶1)浸透30 min,纯包埋液浸透1 h,纯包埋液在37℃固化24 h后,升温至60℃再固化48 h;超薄切片机切片,铀、铅(醋酸双氧铀、枸橼酸铅)染色后,透射电镜观察滑膜细胞超微结构变化。
2.6 统计学方法
3 结果
3.1 小鼠一般情况和外周关节变化
在第2次抗原免疫后(实验第4周),各造模组小鼠出现进食量减少、体型消瘦、皮毛无光泽并伴轻微脱毛、易怒的情况;在第3次抗原免疫后(实验第6周),各造模组小鼠的上述表现加重,并出现脊柱活动受限的情况。在整个实验期间,造模小鼠均未出现踝、足趾关节红肿等外周关节炎表现。
3.2 小鼠血清中TNF-α和DKK-1含量变化
与正常组比较,模型组小鼠血清中TNF-α含量明显升高,DKK-1含量明显降低,差异均有统计学意义(P<0.01)。与模型组比较,徐长卿-二妙散-三藤方低、中、高剂量组小鼠血清中TNF-α含量均明显降低(P<0.01或P<0.05),DKK-1含量均明显升高(P<0.05),且作用效果与该方剂量无明显相关性;柳氮磺吡啶组小鼠血清中TNF-α含量较模型组明显降低(P<0.05),而DKK-1含量较模型组差异无统计学意义(P>0.05),结果见表1。
表1 各组小鼠血清中TNF-α和DKK-1含量的测定结果(±s,n=10,ng/mL)Tab1 Determination results of the contents of TNF-α and DKK-1 in serum of mice in each group(±s,n=10,ng/mL)
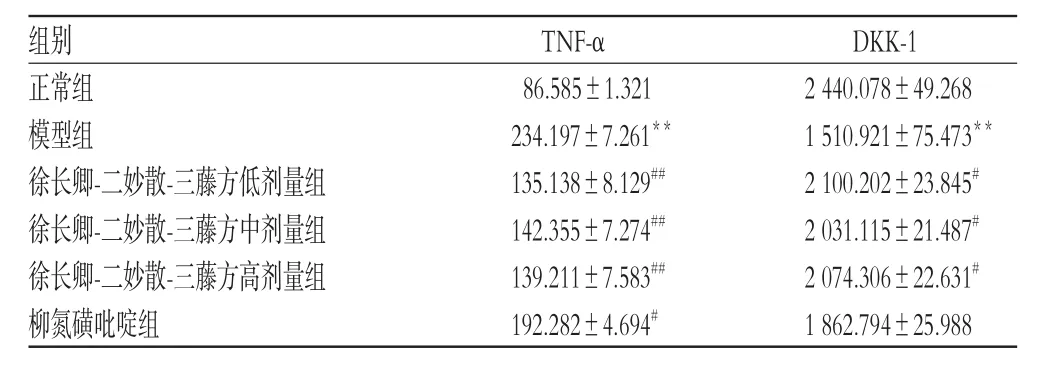
表1 各组小鼠血清中TNF-α和DKK-1含量的测定结果(±s,n=10,ng/mL)Tab1 Determination results of the contents of TNF-α and DKK-1 in serum of mice in each group(±s,n=10,ng/mL)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,#P<0.05,##P<0.01
?
3.3 小鼠骶髂关节滑膜细胞超微病理结构变化
正常组小鼠骶髂关节滑膜层由薄的细胞层和内膜下层构成,可见绒毛,内含胶原性纤维;滑膜细胞有A、B两型,均无异常;巨噬细胞样A型细胞的细胞质内含丰富的线粒体、囊泡和溶酶体;成纤维细胞样B型细胞含有高浓度的内质网、少量线粒体和空泡。模型组小鼠骶髂关节滑膜细胞增生肥大,细胞质内细胞器变形,线粒体肿胀明显,内质网扩张,可见少许散在溶酶体颗粒,胞核内染色质分布不均。柳氮磺吡啶组小鼠骶髂关节滑膜层细胞性内膜增生,B型细胞的细胞质内线粒体肿胀,粗面内质网扩张,有大量空泡形成,核周间隙增宽。徐长卿-二妙散-三藤方低、中、高剂量组小鼠滑膜细胞层无增厚,可见疏松平行排列的滑膜细胞;A型细胞的细胞质内线粒体轻度肿胀,初级溶酶体多见;B型细胞的细胞质内有丰富的粗面内质网,胞核内染色质分布均匀。各组小鼠滑膜细胞的电镜图见图1。

图1 各组小鼠骶髂关节滑膜细胞超微结构的电镜图(×5 000)Fig1 Electron micrographs of ultrastructure of sacroiliac joint synovial cells of mice in each group(×5 000)
4 讨论
PGIA模型是目前唯一侵犯中轴骨系统的系统性自身免疫小鼠模型[13],已成为脊柱关节炎动物模型研究的热点。在本研究中,造模组小鼠在免疫后第2、4、8周均未出现踝、足趾关节红肿等外周关节炎表现,说明AS发病隐匿,中轴关节炎症及骨化的累积可能无明显临床表型,需借助病理及影像学方法进行观察。这与临床AS主要表现为中轴骨骼系统炎症和过度骨化相符。
电镜观察滑膜细胞分为含有较多溶酶体、有吞噬能力的M细胞(Macrophage-like cells)和含粗面内质网、可分泌黏蛋白和透明质酸的F细胞(Fibroblast-like cells)[14]。本研究通过对各组A、B型滑膜细胞超微病理结构观察,发现模型组小鼠骶髂关节滑膜细胞中分泌活性细胞器变形、分泌亢进;徐长卿-二妙散-三藤方低、中、高剂量组小鼠骶髂关节滑膜细胞的粗面内质网丰富、线粒体轻度肿胀,说明徐长卿-二妙散-三藤方可减轻骶髂关节滑膜细胞损伤。
研究表明,自身免疫介导的炎症是AS发展的起始环节,骨赘形成是AS致残的主要因素[15]。TNF-α是触发AS“炎症因子风暴”级瀑布效应的关键因子之一,其与AS韧带骨化有密切的联系[16]。Fujita K等[17]研究发现,Wnt信号通路在调节成骨细胞功能及骨形成中发挥着重要作用,而DKK-1是Wnt信号的重要抑制因子[18],阻断DKK-1激活Wnt通路也可使骨破坏变为骨赘生成。DKK-1介导的抑制作用减弱可能是成骨过度的主要机制。柳氮磺吡啶作为目前治疗AS的主要药物之一,在改善AS结构破坏方面的作用并不确定[3]。本研究结果显示,与模型组比较,徐长卿-二妙散-三藤方低、中、高剂量组和柳氮磺吡啶组小鼠血清中TNF-α含量均明显降低(P<0.05),且低、中、高剂量徐长卿-二妙散-三藤方的作用优于柳氮磺吡啶;低、中、高剂量徐长卿-二妙散-三藤方均能使小鼠血清中DKK-1含量明显升高(P<0.05),而柳氮磺吡啶对DKK-1含量无明显影响(P>0.05)。这提示徐长卿-二妙散-三藤方可通过上调血清中DKK-1的含量从而抑制Wnt信号通路介导的新骨形成,而柳氮磺吡啶可能没有抑制AS病理性骨化的作用。
综上所述,徐长卿-二妙散-三藤方能显著降低PGIA小鼠血清中TNF-α含量、升高DKK-1含量,从而抑制PGIA小鼠骶髂关节炎症和病理性骨化。
[1] Ishikawa LL,Colavite PM,Darosa LC,et al.Commercial bovine proteoglycan is highly arthritogenic and can be used as an alternative antigen source for PGIA model[J].Biomed Res Int,2014,doi:10.1155/2014/148594.
[2] Gyurcsik Z,Bodnar N,Szekanecz Z,et al.Treatment of ankylosing spondylitis with biologics and targeted physical therapy:positive effect on chest pain,diminished chest mobility,and respiratory function[J].Z Rheumatol,2013,72(10):997-1004.
[3] 徐鹏慧,高冠民,张蕾蕾,等.TNF抑制剂和非甾体抗炎药治疗强直性脊柱炎疗效分析[J].医学与哲学,2015,36(4B):37-42.
[4] 温晓宏,郑毅,陈珊珊.短期抗肿瘤坏死因子-α治疗不影响强直性脊柱炎患者血清Dickkopf-1水平[J].中华风湿病学杂志,2015,19(1):21-25.
[5] Daoussis D,Liossis SNC,Solomou EE,et al.Evidence that Dkk-1 is dysfunctional in ankylosing spondylitis[J].Arthritis Rheum,2010,62(1):150-158.
[6] 孙言才,沈玉先,孙国平.丹皮酚的主要药理活性研究进展[J].中成药,2012,26(7):579-582.
[7] 吴琪,何敢想,胡燕芬,等.丹皮酚致兔膝骨性关节炎软骨细胞凋亡及相关蛋白Bcl-2、Bax mRNA表达的时间与剂量效应研究[J].中国药房,2016,27(10):1337-1339.
[8] 郭燕芬,吴宽裕,赵钟文,等.中医药优化方案治疗湿热痹阻型类风湿关节炎的不良反应观察[J].风湿病与关节炎,2014,3(11):15-19.
[9] 曹会波,李永祥,潘传义.二妙散加味治疗急性痛风性关节炎疗效观察[J].中医药临床杂志,2012,24(5):415-416.
[10] 考希良,董嘉琪.二妙散不同配伍对大鼠佐剂性关节炎的抗炎效应[J].中医药学报,2013,41(3):107-109.
[11] 黄继汉,黄晓辉,陈志扬.药理实验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[12] Lories RJ,Derese I,Luyten FP.Modulation of bone morphogenetic protein signaling inhibits the onset and progression of ankylosing enthesitis[J].J Clin Invest,2005,115(6):1571-1579.
[13] 童文文,李甲,徐卫东.蛋白聚糖诱导小鼠关节炎模型的研究进展[J].第二军医大学学报,2015,36(5):530-535.
[14] 陈晓宇,李俊,程文明,等.野菊花总黄酮对佐剂性关节炎大鼠滑膜细胞超微结构及分泌功能的影响[J].解剖学杂志,2008,31(4):504-507.
[15] Tam LS,Gu J,Yu D.Pathogenesis of ankylosing spondylitis[J].Nat Rev Rheumatol,2010,6(7):399-405.
[16] Jacques P,Mielants H,De Vos M,et al.Spondyloarthropathies:progress and challenges[J].Best Pract Res Clin Rheumatol,2012,22(2):325-337.
[17] Fujita K,Janz S.Attenuation of WNT signaling by DKK-1 and-2 regulates BMP2-induced osteoblast differentiation and expression of OPG,RANKL and M-CSF[J].Mol Cancer,2011,doi:10.1186/1476-4598-6-71.
[18] Lories RJ,Derese I,de Bari C,et al.Evidence for uncoupling of inflammation and joint remodeling in a mouse model of spondylarthritis[J].Arthritis Rheum,2012,56(2):489-497.
Effect of Xuchangqing-ermiaosan-santeng Formula on the Contents of TNF-α and DKK-1 in Serum of Model Mice with Proteoglycan-induced Arthritis
WU Qi1,ZHOU Xiaohong2,YANG Decai3,HE Ganxiang1,REN Jie1,HU Yanfen1(1.Teaching and Demonstration Center of Clinical Skill,Hubei University of TCM,Wuhan 430061,China;2.College of Acupuncture and Orthopaedics-traumatology,Hubei University of TCM,Wuhan 430061,China;3.First Clinical College,Hubei University of TCM,Wuhan 430061,China)
OBJECTIVE:To study the effect of Xuchangqing-ermiaosan-santeng formula on the contents of tumor necrosis factor α(TNF-α)and ossification-related factor DKK-1 in serum of model mice with arthritis,and reveal its mechanism in the treatment of arthritis.METHODS:60 BALB/c mice were randomly divided into normal group,model group,sulfasalazine group(positive control,9 mg/kg)and Xuchangqing-ermiaosan-santeng formula low-dose,medium-dose,high-dose groups(calculated by crude drug as 11.25,22.5,45 g/kg),10 in each group.Except for normal group,other 50 mice were intraperitoneallly injected complete Freund’s adjuvant+proteoglycans to induce model with arthritis.After modeling,mice in each administration group were intragastrically administrated relevant medicines,mice in normal group and model group were intragastrically administrated equal volume of normal saline,once a day,for 20 d.After administration,enzyme-linked immunosorbent assay was used to detect the contents of TNF-α and DKK-1 in serum of mice in each group,and ultrastructural changes of sacroiliac joint synovial cells were observed by transmission electron microscopy.RESULTS:Compared with normal group,TNF-α content in serum in model group was obviously increased,DKK-1 content was obviously decreased(P<0.05);sacroiliac joint synovial cells showed hyperplasia,organellar deformation,mitochondrial swelling and other pathologic damage.Compared with model group,TNF-α contents in serum in each administration group were obviously decreased(P<0.05 orP<0.01);except for sulfasalazine group,the DKK-1 content of mice in other administration groups were obviously increased(P<0.05).Pathologic damages of sacroiliac joint synovial cells in each administration group were reduced to varying degrees,and improvement degree in Xuchangqing-ermiaosan-santeng formula groups was higher than sulfasalazine group.CONCLUSIONS:Xuchangqing-ermiaosan-santeng formula may inhibit the sacroiliac arthritis and pathological ossification of model mice with arthritis by decreasing TNF-α content and increasing DKK-1 content in serum.
Xuchangqing-ermiaosan-santeng formula;Arthritis;Tumor necrosis factor α;Ossification-related factor DKK-1;BALB/c mice
R285.5
A
1001-0408(2017)31-4369-04
DOI 10.6039/j.issn.1001-0408.2017.31.13
湖北省教育厅科学研究计划资助项目(No.Q20162011)
*高级实验师,博士。研究方向:骨关节病的中医药防治。电话:027-68889070。E-mail:wuqi111@163.com
#通信作者:主任医师,硕士。研究方向:中医外科。电话:027-68889070。E-mail:25272965@qq.com
2017-03-30
2017-09-11)
(编辑:林静)
