HPLC 法测定兔眼角膜中艾沙康唑的浓度Δ
2017-11-16周静静周天洋张俊杰锦州医科大学河南省人民医院研究生培养基地郑州450000河南省眼科研究所郑州450000
周静静,周天洋,张俊杰#(1.锦州医科大学河南省人民医院研究生培养基地,郑州450000;.河南省眼科研究所,郑州450000)
HPLC 法测定兔眼角膜中艾沙康唑的浓度Δ
周静静1,2*,周天洋2,张俊杰2#(1.锦州医科大学河南省人民医院研究生培养基地,郑州450000;2.河南省眼科研究所,郑州450000)
目的:建立测定兔眼角膜中艾沙康唑浓度的方法。方法:采用高效液相色谱(HPLC)法。色谱柱为Waters X-Bridge C18,流动相为0.2%冰乙酸-乙腈(49∶51,V/V),流速为0.7 mL/min,柱温为40℃,检测波长为284 nm,进样量为10 μL。取日本大耳白兔15只,双眼分别滴加0.2%艾沙康唑混悬液50 μL,于给药后5、15、30、60、90 min分别处死3只兔并剖取其角膜样品,处理后进样测定艾沙康唑浓度。结果:角膜样品中的艾沙康唑在0.031 2~2.24 μg/mL质量浓度范围内线性关系良好(r2=0.999 9),方法回收率为91.7%~105.6%(RSD≤6.88%,n=5),提取回收率为100.50%~106.10%(RSD≤2.16%,n=3),日内(n=5)、日间(n=3)精密度和稳定性(n=5)试验的RSD均小于10%。结论:本方法专属性强、准确度高、重现性好,可快速、准确地测定兔眼角膜中艾沙康唑的浓度。
高效液相色谱法;艾沙康唑;角膜;兔
艾沙康唑是一种新的三唑类抗真菌药,主要通过抑制麦角甾醇的生物合成干扰真菌细胞膜的形成,从而发挥较强的抑菌和杀菌作用[1]。近年的研究表明,艾沙康唑的抗菌谱广,对临床大多数致病真菌,包括曲霉菌属、念珠菌属、镰孢菌属、接合菌、隐球菌等均具有较高的敏感性[2-6],主要用于深部侵袭性真菌感染的治疗[7-9],而对于眼部真菌感染的治疗尚未见报道。鉴于艾沙康唑的广谱抗真菌性及较高敏感性,其有望用于眼部真菌感染的治疗。我国真菌性角膜炎的致病菌主要为曲霉菌属和镰孢菌属[10-12]。体外药敏试验表明,艾沙康唑对临床上常见曲霉菌属表现出很强的抑菌和杀菌作用,对曲霉菌属耐药菌株也具有较高活性[4],在治疗眼部真菌感染方面表现出了很好的应用前景。
艾沙康唑在角膜中的吸收和分布是治疗真菌性角膜炎的关键,但角膜组织中艾沙康唑浓度的测定方法未见报道。血液中艾沙康唑浓度测定多采用超高效液相色谱法(UPLC)、高效液相色谱-质谱联用法(HPLCMS)、超高效液相色谱-质谱联用法(UPLC-MS)[13-15]。在此基础上,笔者对测定方法进行了改进和优化,建立了一种特异性强、灵敏度高、重现性好的方法,用以检测兔眼角膜中的艾沙康唑的浓度。
1 材料
1.1 仪器
Waters 2695 HPLC系统,包括2695分离单元、2487检测器、Empower2色谱工作站(美国Waters公司);AE260电子分析天平(瑞士Mettler Toledo公司);Eppendorf高速离心机(德国Abbott公司)。
1.2 药品与试剂
艾沙康唑原料药(大连美仑生物技术有限公司,批号:A1130A,纯度:98%);0.2%艾沙康唑混悬液(河南省眼科研究所药剂室自制,主要含艾沙康唑和聚乙二醇400,批号:20160704);甲醇、乙腈为色谱纯,其余试剂均为分析纯。
1.3 动物
日本大耳白兔15只,健康无眼疾,♂,体质量2.2~2.6 kg,购自河南康达实验动物有限公司,动物生产许可证号:SCXK(豫)2016-0001。动物房温度为(25±2)℃,标准颗粒饲料饲养,自由饮水。
2 方法与结果
2.1 色谱条件
色谱柱:Waters X-Bridge C18(150 mm×3 mm,3.5 μm);流动相:0.2%冰乙酸-乙腈(49∶51,V/V);流速:0.7 mL/min;柱温:40℃;检测波长:284 nm;进样量:10 μL。
2.2 角膜样品的处理
取角膜样品,精密称量后剪碎,边长约1~2 mm,加入400 μL甲醇,密封,2~8℃浸泡24 h,12 000 r/min离心(离心半径为5.7 cm)8 min,即得浸出液,取上清液,进样测定。
2.3 专属性考察
取空白角膜、空白角膜+艾沙康唑(0.373 μg/mL)、给药5 min后的角膜,按“2.2”项下方法处理后,按“2.1”项下色谱条件进样测定。结果,艾沙康唑的保留时间约为3.3 min,空白角膜样品对艾沙康唑的测定无干扰,色谱图见图1。
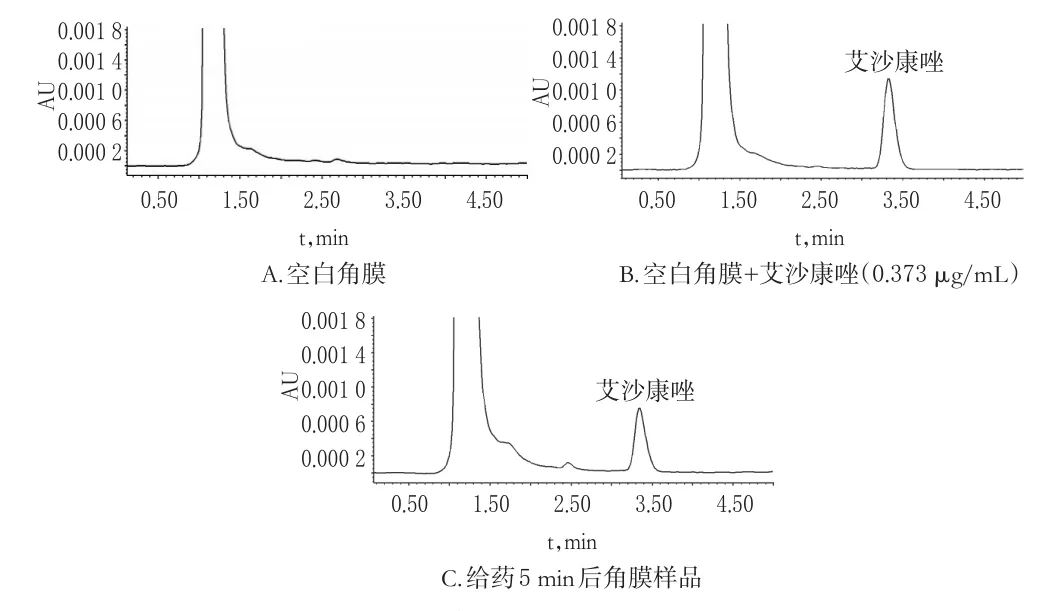
图1 高效液相色谱图Fig1 HPLC chromatograms
2.4 线性范围考察
称取低温干燥的艾沙康唑原料药0.008 6 g于50 mL量瓶中,加入甲醇溶解、定容,振摇均匀,得到质量浓度为168 μg/mL的艾沙康唑贮备液。精密量取贮备液,用甲醇依次稀释制备成质量浓度为2.24、1.12、0.373、0.187、0.062 3、0.031 2 μg/mL的艾沙康唑系列标准液。分别量取系列标准液100 μL,置于相应的尖头玻璃试管中,40℃下氮气吹干,分别加入100 μL按“2.2”项下方法处理的空白角膜浸出液,涡旋振荡2 min,溶解,混匀,得到质量浓度为2.24、1.12、0.373、0.187、0.062 3、0.031 2 μg/mL的工作液,进样测定。以艾沙康唑的质量浓度为横坐标(x)、色谱峰面积为纵坐标(y)进行线性回归,得回归方程为y=2.27×10-5x-0.014 6(r2=0.999 9),表明其在0.031 2~2.24 μg/mL质量浓度范围内线性关系良好,检测限为0.010 4 μg/mL(信噪比为3)。
2.5 准确度与精密度考察
量取“2.4”项下质量浓度为1.12、0.373、0.062 3 μg/mL的艾沙康唑标准液各100 μL,40℃下氮气吹干,分别加入100 μL的空白角膜浸出液,涡旋震荡2 min,混合均匀,得到高、中、低质量浓度(1.12、0.373、0.062 3 μg/mL)的质控样品,各5份。进样测定并计算方法回收率,考察日内精密度;3 d内连续测定3次,考察日间精密度;以方法回收率表示准确度。结果,高、中、低质量浓度质控样品的平均方法回收率分别为101.2%~104.7%、98.9%~105.6%、91.7%~101.0%(RSD≤6.88%,n=5),日内(n=5)、日间(n=3)精密度RSD均小于10%,表明试验准确度和精密度较好。
2.6 提取回收率考察
量取“2.4”项下质量浓度为1.12、0.373、0.062 3 μg/mL的艾沙康唑标准液各100 μL,加入剪碎的空白角膜约0.015 g,密封,2~8℃浸泡24 h,12 000 r/min离心(离心半径为5.7 cm)8 min,取上清液,得提取回收率试验样品(ES),每个质量浓度平行制备3份。另取相应质量浓度的标准液各100 μL,加入相对应角膜质量的同体积生理盐水,混匀,得到提取回收率的对照样品(EC),每个质量浓度平行制备3份。取以上样品进样测定,得到各样品的峰面积(A),计算提取回收率(AES/AEC×100%)。结果,高、中、低质量浓度的艾沙康唑在角膜中的提取回收率分别为(106.10±1.35)%、(103.80±1.67)%、(100.50±2.17)%,RSD分别为1.27%、1.61%、2.16%(n=3),表明提取效果较好,能满足试验的要求。
2.7 浸出效率的考察
取日本大耳白兔3只,双眼分别滴加0.2%艾沙康唑混悬液50 μL,5 min后处死,剖取角膜组织,精密称定质量后剪碎,加400 μL甲醇浸泡。分别于24、48、96 h后以12 000 r/min离心(离心半径为5.7 cm)8 min,取上清液100 μL进样测定6次,对比各时间点测定的样品浓度,计算浸出效率(即各时间点测得的药物浓度)。采用SPSS 17.0软件分析,两时点间样品浓度差异性的比较采用独立样本t检验。结果,24 h测定的样品浓度与48 h、96 h相比差异均无统计学意义(P>0.05,n=6),表明生物样品浸泡24 h与浸泡48、96 h相比,提取药物的量没有显著变化,即经过甲醇浸泡24 h,生物样品中的艾沙康唑即可提取完全。
2.8 稳定性考察
取高、中、低质量浓度(1.12、0.373、0.062 3 μg/mL)的质控样品,考察-20℃放置1个月、2~8℃放置96 h和室温下放置24 h后的稳定性。结果,上述条件下各质量浓度样品的RSD均小于10%(n=5),表明角膜浸出液中的样品在考察期间均稳定。
2.9 兔眼角膜中艾沙康唑浓度的测定
将15只日本大耳白兔随机分为5个时间组,每组3只,双眼各滴入0.2%艾沙康唑混悬液50 μL(相当于药物100 μg,给药剂量根据预实验确定),轻轻闭合眼睑约30 s。分别于给药5、15、30、60、90 min后于耳缘静脉iv 4%戊巴比妥钠2 mL/kg处死动物,以生理盐水(10 mL/眼)冲洗眼表,用无菌干棉球蘸去水分。剖取角膜组织,以生理盐水(5 mL/眼)冲洗,用滤纸吸去附着水分,置于EP管中。将提取的角膜样品置于-20℃冰箱保存,备用。测定时,取角膜样品按“2.2”项下方法处理后进样测定。记录艾沙康唑色谱峰面积,计算角膜浸出液中的药物浓度(c角膜浸出液)和角膜样品中的药物浓度(c角膜)[c角膜=c角膜浸出液×(0.4+m角膜)/m角膜,m角膜为角膜质量],并绘制浓度-时间曲线,结果见图2。

图2 0.2%%艾沙康唑混悬液滴眼后兔眼角膜中艾沙康唑的浓度-时间曲线Fig2 Concentration-time curve of isavuconazole in rabbit cornea after dropping 0.2%%isavuconazole suspension into eyes
由图2可知,给药60 min后角膜中的平均药物浓度由给药5 min后的1.964 μg/g下降至0.368 μg/g。
3 讨论
艾沙康唑的抗真菌谱广、抗真菌效力强,在治疗深部真菌感染方面已有广泛的应用,同时也为治疗常见的曲霉菌以及其他难治性真菌引起的角膜病提供了新的选择。艾沙康唑在血液中的药动学研究报道较少[13-15],而在眼部真菌感染的治疗及眼部药动学研究方面尚未见报道。笔者在文献的基础上探索出一种简便可靠的方法来测量角膜中艾沙康唑的浓度,用以研究艾沙康唑眼局部给药系统在角膜中的药物浓度,为其在眼部的应用提供重要的参考。本方法采用甲醇静置浸泡法处理样品,HPLC法检测角膜浸出液中的药物浓度。结果证明,只需用400 μL甲醇,密封、冷藏(2~8℃)、静置浸泡24 h即可完全提取兔眼角膜中的艾沙康唑。甲醇量过少则会导致其无法完全浸没角膜组织,过多则会导致角膜浸出液中药物浓度过低。本方法流动相采用0.2%冰乙酸-乙腈,在预试验中发现其与甲醇系统相比灵敏度更高、检测限更低。在冻存条件下,角膜生物样品在1个月内稳定,在冷藏和室温条件下,浸出液中的艾沙康唑在96 h和24 h内稳定,完全可满足试验测定的需求。值得注意的是,甲醇浸出液也无需进行再次处理,离心后上清液可直接进样分析,干扰少、提取效率高、重现性好。本方法检测提取液中艾沙康唑的检测限在0.01 μg/mL左右,相当于角膜中的药物浓度0.2~0.3 μg/g,而艾沙康唑对曲霉菌属的最小抑菌浓度(MICs)大部分在0.5 μg/mL以上[16],因此本方法的灵敏度完全可满足生物样品的测定需求。
综上所述,本研究建立的检测兔眼角膜中艾沙康唑浓度的HPLC法专属性强、灵敏度和重现性好,能够方便准确地测定兔眼角膜中艾沙康唑的浓度,可进一步用于艾沙康唑的眼部药动学研究。
[1] 叶丽娟,王辂,朱辉.抗真菌药物作用机制及真菌耐药机制的研究进展[J].国外医药:抗生素分册,2006,27(5):221-227.
[2] Donnelley MA,Zhu ES.Isavuconazole in the treatment of invasive aspergillosis and mucormycosis infections[J].Infect Drug Resist,2016,9:79-86.
[3] Illnait-Zaragozi M,Martinez G,Curfs-Breuker I,et al.In vitro activity of the new azole isavuconazole(BAL4815)compared with six other antifungal agents against 162 cryptococcus neoformans isolates from Cuba[J].Antimicrob Agents Chemother,2008,52(52):1580-1582.
[4] Warn PA,Sharp A,Denning DW.In vitro activity of a new triazole BAL4815,the active component of BAL8557(the water-soluble prodrug),against Aspergillus spp[J].J Antimicrob Chemother,2006,57(1):135-138.
[5] Seifert H,Aurbach U,Stefanik D,et al.In vitro activities of isavuconazole and other antifungal agents against Candida bloodstream isolates[J].Antimicrob Agents Chemother,2007,51(5):1818-1821.
[6] Recio S,Torresnarbona M,Bouza E.In vitro antifungal activities of isavuconazole(BAL4815),voriconazole,and fluconazole against 1 007 isolates of Zygomycete,Candida,Aspergillus,Fusarium,and Scedosporium species[J].Antimicrob Agents Chemother,2008,52(4):1396-400.
[7] Rybak JM,Marx KR,Nishimoto AT,et al.Isavuconazole:pharmacology,pharmacodynamics,and current clinical experience with a new triazole antifungal agent[J].Pharmacother-apy,2015,35(11):1037-1051.
[8] Mccarthy MW,Aguilar-Zapata D,Petraitis V,et al.Diagnosis,classification,and therapeutic interventions for sinopulmonary Aspergillosis[J].Expert Rev Respir Med,2017,11(3):229-238.
[9] Tissot F,Agrawal S,Pagano L,et al.ECIL-6 guidelines for the treatment of invasive Candidiasis,Aspergillosis and Mucormycosis in leukemia and hematopoietic stem cell transplant patients[J].Haematologica,2017,102(3):433-444.
[10] 钟文贤,孙士营,赵靖,等.1 054例化脓性角膜炎的回顾性分析[J].中华眼科杂志,2007,43(3):245-250.
[11] Wang L,Sun S,Jing Y,et al.Spectrum of fungal keratitis in central China[J].Clin Exp Ophthalmol,2009,37(8):763-771.
[12] 翟华蕾,谢立信.真菌性角膜炎的临床研究进展[J].中华医学杂志,2007,87(33):2372-2374.
[13] Schmitt-Hoffmann A,Roos B,Spickermann J,et al.Effect of mild and moderate liver disease on the pharmacokinetics of isavuconazole after intravenous and oral administration of a single dose of the prodrug BAL8557[J].Antimicrob Agents Chemother,2009,53(11):4885-4890.
[14] Wissen CP,Burger DM,Verweij PE,et al.Simultaneous determination of the azoles voriconazole,posaconazole,isavuconazole,itraconazole and its metabolite hydroxy-itraconazole in human plasma by reversed phase ultra-performance liquid chromatography with ultraviolet detection[J].J Chromatogr B Analyt Technol Biomed Life Sci,2012,887/888(3):79-84.
[15] Toussaint B,Lanternier F,Woloch C,et al.An ultra performance liquid chromatography-tandem mass spectrometry method for the therapeutic drug monitoring of isavuconazole and seven other antifungal compounds in plasma samples[J].J Chromatogr B Analyt Technol Biomed Life Sci,2017,1046:26-33.
[16] Howard SJ,Lassflörl C,Cuencaestrella M,et al.Determination of isavuconazole susceptibility of Aspergillus and Candida species by the EUCAST method[J].Antimicrob Agents Chemother,2013,57(11):5426-5431.
Concentration Determination of Isavuconazole in Rabbit Cornea by HPLC
ZHOU Jingjing1,2,ZHOU Tianyang2,ZHANG Junjie2(1.Postgraduate Culture Base of Henan Province People’s Hospital,Jinzhou Medical University,Zhengzhou 450000,China;2.Henan Eye Institute,Zhengzhou 450000,China)
OBJECTIVE:To establish a method for the concentration determination of isavuconazole in rabbit cornea.METHODS:HPLC was performed on column of Waters X-Bridge C18with mobile phase of 0.2%glacial acetic acid-acetonitrile(49∶51,V/V)at flow rate of 0.7 mL/min,column temperature was 40℃,detection wavelength was 284 nm,and injection volume was 10 μL.Fifteen Japanese white rabbits with big ears were selected,50 μL of 0.2%isavuconazole suspension was dropped into eyes,then every 3 rabbits were executed after 5,15,30,60,90 min of administration and cornea samples were taken respectively.The determination of isavuconazole were determined after treating.RESULTS:The isavuconazole in leaching solution showed good linear range in 0.031 2-2.24 μg/mL(r2=0.999 9);oethod recovery rate was 91.7%-105.6%(RSD≤6.88%,n=5);extraction recovery rate was 100.50%-106.10%(RSD≤2.16%,n=3);and RSDs of inter-day(n=3)and intra-day(n=3)precision and stability(n=5)tests were lower than 10%.CONCLUSIONS:The method shows strong specificity,high accuracy,good reproducibility,and can rapidly and accurately determine the concentration of isavuconazole in rabbit cornea.
HPLC;Isavuconazole;Cornea;Rabbits
R927.2
A
1001-0408(2017)31-4362-04
DOI 10.6039/j.issn.1001-0408.2017.31.11
国家自然科学基金资助项目(No.U1404832)
*硕士研究生。研究方向:真菌性角膜炎。电话:0371-65580919。E-mail:1515204280@qq.com
#通信作者:研究员,硕士生导师,博士。研究方向:眼科药理及眼部给药系统。电话:0371-65580919。E-mail:Zhangjj66@126.com
2017-03-16
2017-09-11)
(编辑:刘明伟)
