胃腺癌组织中TRAF2 mRNA、蛋白的表达变化及其意义
2017-11-14石晓虹王明娟程玉齐洁敏
石晓虹,王明娟,程玉,齐洁敏
(承德医学院,河北承德067000)
胃腺癌组织中TRAF2 mRNA、蛋白的表达变化及其意义
石晓虹,王明娟,程玉,齐洁敏
(承德医学院,河北承德067000)
目的观察胃腺癌组织中肿瘤坏死因子受体相关因子2(TRAF2)mRNA、蛋白的表达变化,并探讨其临床意义。方法取胃腺癌组织60例份(胃癌组)、癌旁正常胃黏膜组织55例份(对照组)。采用qRT-PCR法检测两组中的TRAF2 mRNA。分别采用免疫组化SP法和Western blotting法检测两组中的TRAF2蛋白。分析TRAF2 mRNA及蛋白表达与胃腺癌临床病理参数的关系。结果胃癌组、对照组TRAF2 mRNA相对表达量分别为6.36(2.05)、0.68(0.95),胃癌组TRAF2 mRNA相对表达量高于对照组(P<0.05)。胃癌组和对照组TRAF2蛋白阳性表达率分别为76.70%、32.10%,TRAF2蛋白相对表达量分别为1.41±0.59、0.48±0.10,胃癌组TRAF2蛋白阳性表达率和相对表达量均高于对照组(P均<0.05)。胃腺癌组织中TRAF2 mRNA、蛋白表达与分化程度、淋巴结转移、TNM分期及浸润深度有关(P均<0.05)。结论胃腺癌组织中TRAF2 mRNA及蛋白表达增高,TRAF2异常高表达可能参与了胃腺癌的发生、发展。
胃肿瘤;胃腺癌;肿瘤坏死因子受体相关因子2
对细胞凋亡的获得性抵抗是恶性肿瘤的标志之一[1],抵抗细胞凋亡也是肿瘤逃脱免疫监视的机制之一。细胞凋亡调节主要有内源性线粒体及外源性死亡受体两种途径。细胞凋亡调节失调可导致细胞凋亡抵抗,其机制复杂。Karl等[2]研究发现,在宫颈癌HeLa细胞中肿瘤坏死因子受体相关因子2(TRAF2)可通过激活NF-κB通路及抑制Caspase-8活化来抵抗TRAIL诱导的细胞凋亡,促进HeLa细胞增殖。TRAF2是肿瘤坏死因子受体(TNFR)等死亡受体信号通路的重要因子,可介导调节TNFR家族的信号传导,对NF-κB通路激活有重要作用[3]。NF-κB通路激活后可诱导某些抗凋亡基因表达,从而产生对细胞凋亡的抵抗。现已发现结直肠癌[4]、宫颈癌[5]等组织中TRAF2表达异常,且TRAF2与恶性肿瘤的发生、进展有关。本研究观察了胃腺癌组织中TRAF2 mRNA、蛋白的表达变化,并分析其与胃腺癌临床病理参数的关系,探讨TRAF2在胃腺癌发生、发展中的作用。
1 材料与方法
1.1 组织标本 收集胃癌手术切除的肿瘤标本60例份(胃癌组),术后经病理检查证实为胃腺癌组织;另取癌旁(距病灶边缘>5 cm)正常胃黏膜组织55例份作为对照组。胃癌组患者中,男35例、女25例,年龄26~80岁;对照组患者中,男30例、女25例,年龄20~78岁。两组一般资料具有可比性。
1.2 TRAF2 mRNA检测 将所收集新鲜标本从-80 ℃低温冰箱内取出,称取约0.1 g组织放入经过无RNA酶处理的匀浆器中,向新鲜组织中加入TRIzol,充分研磨提取组织总RNA,测RNA浓度,将总RNA反转录成稳定的cDNA,使用cDNA进行qRT-PCR反应。TRAF2基因上游引物序列为5′-GATGGAGGCATCCACCTACGA-3′,下游引物序列为5′-GCCGTTCAGGTAGATACGCAGAC-3′。内参GAPDH上游引物序列为5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物序列为5′-TGGTGAAGACGCCAGTGGA-3′。按说明书将引物、cDNA等加入无酶八连排管中,每种cDNA设3个复孔,轻弹混匀后放入qRT-PCR仪中,反应参数为95 ℃、30 s,95 ℃、5 s,60 ℃、30 s,共44个循环。所有实验重复3次,以2-ΔΔCt表示目的基因相对表达量。
1.3 TRAF2蛋白检测 ①免疫组化SP法:将所收集标本制成蜡块,切5 μm切片,随后参照试剂盒说明书操作。将已知阳性的切片设为阳性对照,空白对照切片以PBS代替一抗。以细胞膜和细胞质出现棕黄色颗粒为TRAF2蛋白阳性细胞。依次在低倍、高倍显微镜下观察每张切片,随机选取每张切片的10个高倍视野,依据染色强度及阳性细胞百分比综合判定结果。按染色强度计分,未着色计0分、淡黄色计1分、棕黄色计2分、棕褐色计3分;按阳性细胞百分比计分,<5%计0分、5%~<25%计1分、25%~<50%计2分、≥50%计3分;上述两项得分相乘,0~1为蛋白表达阴性,≥2为蛋白表达阳性[6]。②Western blotting法:称取约0.1 g新鲜组织置于匀浆器中,加入裂解液1 mL后置于冰上充分研磨、裂解,离心后取上清,测蛋白浓度,蛋白变性后取蛋白上样量30 μg,经12% SDS-PAGE凝胶电泳、湿转法转膜、封闭剂封闭后加入一抗。兔抗人TRAF2抗体浓度为1∶200,内参β-actin抗体浓度为1∶3 000,4 ℃过夜。次日复温、洗膜后加入二抗(1∶10 000),摇床孵育,洗膜后ECL发光,采集图像。用Image J软件进行灰度值分析,以目的条带灰度值与内参条带灰度值的比值表示目的蛋白相对表达量。
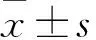
2 结果
2.1 两组TRAF2 mRNA及蛋白表达比较 胃癌组、对照组TRAF2 mRNA相对表达量分别为6.36(2.05)、0.68(0.95),胃癌组TRAF2 mRNA相对表达量高于对照组(P<0.05)。免疫组化染色显示TRAF2蛋白阳性表达为弥漫分布于胞膜和胞质的棕黄色颗粒(图1)。胃癌组和对照组TRAF2阳性表达率分别为76.70%(44/60)、32.10%(19/55),胃癌组高于对照组(P<0.05)。Western blotting检测结果显示胃癌组和对照组TRAF2蛋白相对表达量分别为1.41±0.59、0.48±0.10,胃癌组TRAF2蛋白相对表达量高于对照组(P<0.05)。详见图2。

注:A为正常胃黏膜组织;B为高、中分化胃腺癌组织;C为低分化胃腺癌组织。
图1胃癌组与对照组TRAF2蛋白表达情况(免疫组化法)
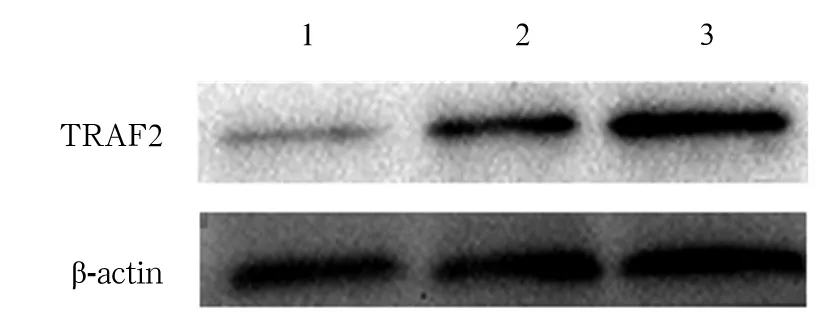
注:1为正常胃黏膜组织;2为高、中分化胃腺癌组织;3为低分化胃腺癌组织。
图2胃癌组与对照组TRAF2蛋白表达情况(Westernblotting法)
2.2 TRAF2 mRNA及蛋白表达与胃腺癌临床病理参数的关系 胃腺癌组织中TRAF2 mRNA及蛋白表达与患者性别、年龄无关(P均>0.05),与分化程度、淋巴结转移、TNM分期及浸润深度有关(P均<0.05)。详见表1。
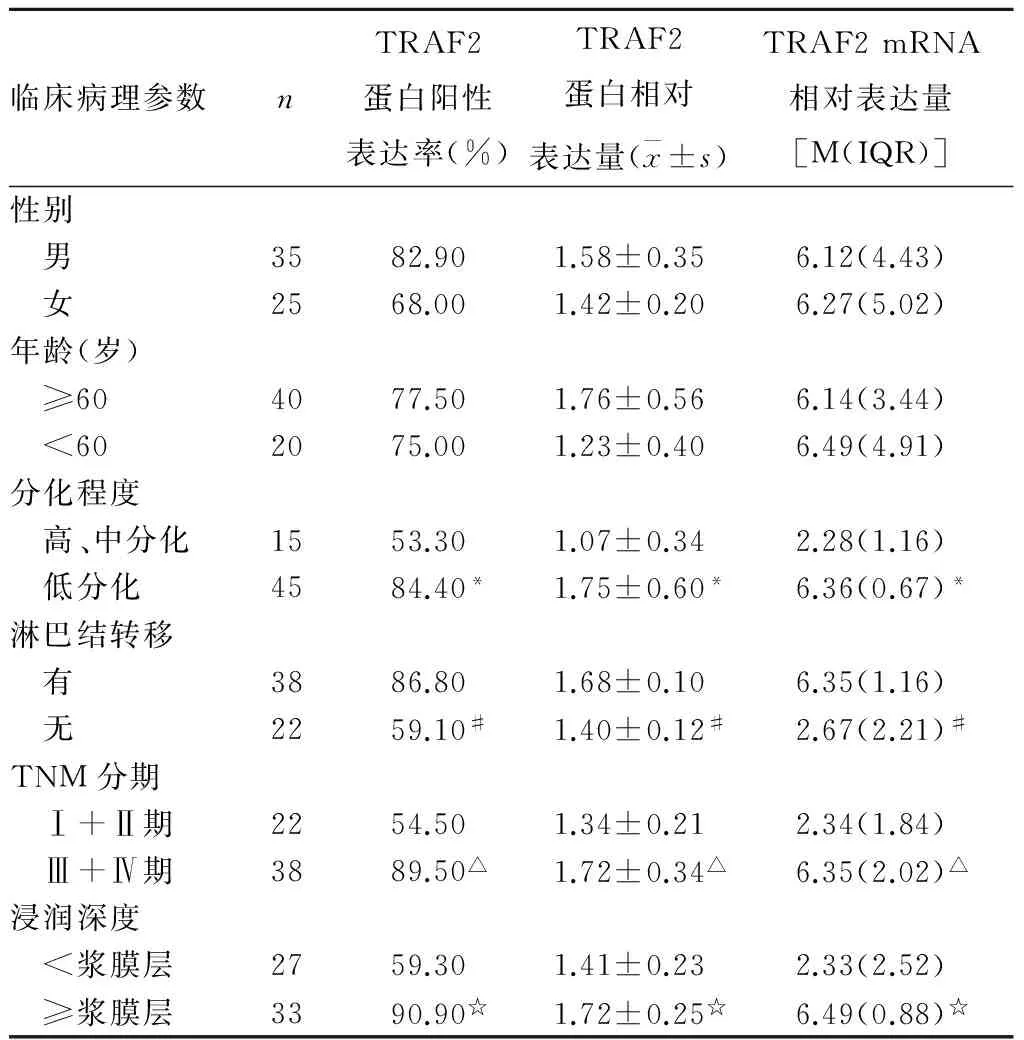
表1 TRAF2 mRNA及蛋白表达与胃腺癌临床病理参数的关系
注:与高、中分化组织相比,*P<0.05;与有淋巴结转移组织相比,#P<0.05;与Ⅰ+Ⅱ期组织相比,△P<0.05;与浸润深度<浆膜层组织相比,☆P<0.05。
3 讨论
胃癌是常见的消化系统恶性肿瘤,尽管目前胃癌的诊断技术及治疗水平不断提升,胃癌发病人数及死亡病例逐年减少,但由于胃癌分化程度差、起病隐匿等特点,患者的预后仍不理想[7]。胃癌的病理分型有很多种,但目前临床最常见的仍是胃腺癌。胃腺癌是来源于胃腺上皮细胞的恶性肿瘤,分化程度低,预后不佳。胃腺癌的发生、发展过程复杂,与环境、饮食、炎症等均有关,还涉及多种分子机制及复杂的信号转导系统,其中重要的因素是肿瘤细胞的无限增殖和凋亡抵抗[8]。
细胞凋亡是一种程序化的死亡方式,可维持机体正常功能。研究[9]表明TRAF2蛋白是一个抗细胞凋亡因子,TRAF2蛋白是TRAF家族的重要成员,广泛表达于各种组织。研究[10]发现TRAFs在炎症反应、免疫反应及恶性肿瘤浸润等过程中扮演重要角色。TRAF2蛋白可与其他蛋白如TNFR、Caspase-8和c-IAP1等相互结合,介导TNF等细胞因子的信号转导,最终调节NF-κB通路、JNK通路等的活化[11]。在上皮细胞癌中,TRAF2被认为是激活NF-κB的原癌基因[12]。TRAF2还存在泛素化作用[13],被认为是细胞存活与凋亡平衡的一个关键调控分支点。有学者[14]在HCT116细胞实验中发现TRAF2通过泛素化降解Caspase-8,发挥抗凋亡功能。幽门螺旋杆菌(HP)感染被认为与胃腺癌有关。研究[15]发现感染HP后的胃癌细胞可通过TRAF2途径激活NF-κB通路,说明TRAF2与HP感染相关的胃腺癌发生有关。现已发现TRAF2蛋白在乳腺癌、胰腺癌等恶性肿瘤中表达上调[16,17],且与前列腺癌预后明显相关[18]。
本研究观察了胃腺癌组织中TRAF2 mRNA、蛋白的表达变化,并分析其与胃腺癌临床病理参数的关系,结果显示,胃癌组TRAF2 mRNA相对表达量高于对照组,胃癌组TRAF2蛋白阳性表达率和相对表达量均高于对照组,提示TRAF2过表达与胃腺癌的发病有关。Zhang等[19]研究发现TRAF2 mRNA在胃癌组织中表达上调可能与DNA低甲基化有关。本研究结果还显示,胃腺癌组织中TRAF2 mRNA及蛋白表达与胃腺癌分化程度、淋巴结转移、TNM分期及浸润深度有关,进一步提示TRAF2异常表达参与了胃腺癌的发生和进展。
综上所述,胃腺癌组织中TRAF2 mRNA及蛋白表达增高,TRAF2异常高表达可能参与了胃腺癌的发生、发展。TRAF2有望成为评估胃腺癌预后的新指标,但这需要更大样本、更深入的研究来验证。关于TRAF2促进胃腺癌发生发展的具体机制,以及TRAF2与Caspase-8、c-IAP1、NF-κB的相互作用关系,都需要做更进一步的研究。
[1] Hanahan D, Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell, 2011,144(5):646-674.
[2] Karl I, Jossberger WM, Schmidt N, et al. TRAF2 inhibits TRAIL- and CD95L-induced apoptosis and necroptosis[J]. Cell Death Dis, 2014,5(10):1444-1456.
[3] Zhang L, Blackwell K, Workman LM, et al. TRAF2 exerts opposing effects on basal and TNFα-induced activation of the classical IKK complex in hematopoietic cells[J]. J Cell Sci, 2016,129(7):1455-1467.
[4] 罗斌,王世夫,应香岚,等.NOD2和TRAF2在结直肠癌中的表达[J].中国中西医结合外科杂志,2012,18(1):30-33.
[5] 张怡,叶佩卿,袁秋玮,等.宫颈癌组织TRAF2表达及其临床意义[J].浙江中西医结合杂志,2012,22(4):297-299.
[6] 杨静,王明娟,程玉,等.胃癌组织中Caspase-3、Caspase-9的表达及其临床意义[J].临床与实验病理学杂志,2016,32(10):1159-1161.
[7] Toore LA, Bray F, Siegel RL, et al. Global Cancer Statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[8] Low KC, Tergaonkar V. Telomerase: central regulator of all of the hallmarks of cancer[J]. Trends Biochem Sci, 2013,38(9):426-434.
[9] Petersen SL, Chen TT, Lawrence DA, et al. TRAF2 is a biologically important necroptosis suppressor[J]. Cell Death Differ, 2015,22(11):1846-1857.
[10] Borqhi A, Verstrepen L, Beyaert R. TRAF2 multitasking in TNF receptor-induced signaling to NF-κB, MAP kinases and cell death[J]. Biochem Pharmacol, 2016,116(8):1-10.
[11] Oh YT, Yue P, Sun SY. DR5 suppression induces sphingosine-1-phosphate-dependent TRAF2 polyubiquitination, leading to activation of JNK/AP-1 and promotion of cancer cell invasion[J]. Cell Commun Signal, 2017,15(1):18-28.
[12] Shen RR, Zhou AY, Kim E, et al. TRAF2 is an NF-κB activating oncogene in epithelial cancers[J]. Oncogene, 2015,34(2):209-216.
[13] Zhang LQ, Blackwell K, Shi ZH, et al. The RING domain of TRAF2 plays an essential role in the inhibition of TNFα-induced cell death but not in the activation of NF-κB[J]. J Mol Biol, 2010,396(3):528-546.
[14] Gonzalvez F, Lawrence D, Yang B, et al. TRAF2 Sets a threshold for extrinsic apoptosis by tagging Caspase-8 with a ubiquitin shutoff timer[J]. Mol Cell, 2012,48(6):888-899.
[15] Chang WJ, Du Y, Zhao X, et al. Inflmmation-related factors predicting prognosis of gastric cancer[J]. World J Gastroenterol, 2014,20(16):4586-4596.
[16] Zhao ZJ, Ren HY, Yang F, et al. Expression, correlation, and prognostic value of TRAF2 and TRAF4 expression in malignant plural effusion cells in human breast cancer[J]. Diagn Cytopathol, 2015,43(11):897-903.
[17] Trauzold A, Roder C, Sipos B, et al. CD95 and TRAF2 promote invasiveness of pancreatic cancer cells[J]. FASEB J, 2005,19(6):620-622.
[18] Wei BB, Liang JB, Hu JM, et al. TRAF2 is a Valuable Prognostic Biomarker in Patients with Prostate Cancer[J]. Med Sci Monit, 2017,23(5):4192-4204.
[19] Zhang J, Dai WJ, Yang XZ. Methylation status of TRAF2 is associated with the diagnosis and prognosis of gastric cancer[J]. Int J Clin Exp Pathol, 2015,8(11):14228-14234.
10.3969/j.issn.1002-266X.2017.39.014
R735.2
B
1002-266X(2017)39-0048-03
河北省高校重点学科建设项目(冀教高2013-4);承德医学院校级重点课题项目(201711)。
齐洁敏(E-mail: qijiemin@126.com)
2017-07-17)
