马铃薯抗旱性研究进展
2017-11-14王彧超
王彧超,郭 妙
(1.山西省农业科学院高寒区作物研究所,山西 大同 037001;2.大同市园林局城墙带状公园管理处,山西 大同 037008)
马铃薯抗旱性研究进展
王彧超1,郭 妙2
(1.山西省农业科学院高寒区作物研究所,山西 大同 037001;2.大同市园林局城墙带状公园管理处,山西 大同 037008)
干旱胁迫作为目前制约我国农业发展的主要环境因素之一,一直受到众多研究者的关注。而马铃薯作为我国主要的粮食作物,其抗旱性也一直是研究热点。综述了干旱胁迫对马铃薯的影响、马铃薯抗旱生理机制研究进展以及马铃薯抗旱的分子机制,期望为今后马铃薯抗旱研究提供研究方向和理论依据,为进一步提高马铃薯产量和质量奠定理论基础。
马铃薯;干旱胁迫;研究进展
干旱胁迫是目前制约我国农业发展的主要环境因素之一,旱灾灾情严重可给农业生产带来巨大损失。据统计,1981—2010年仅山西地区旱灾受灾面积就达143.8万hm2,成灾面积达77.3万hm2[1]。因此,提高作物抗旱性成为发展农业的关键所在,而通过生物技术手段提高作物抗逆性和产量成为国内外研究热点。
马铃薯(Solanum tuberosum L.)为茄科一年生草本植物,既可作为粮食也可作为蔬菜,具有营养价值高、适应性强等特点,是我国仅次于小麦、水稻、玉米的第四大粮食作物[2]。而且马铃薯栽培范围较广,北纬71°至南纬40°均有栽培。但当马铃薯在生长发育过程中遭受干旱胁迫时,对其产量和薯块品质均会造成严重影响。有研究者指出,马铃薯对高温和水分亏缺极为敏感,常因干旱导致严重减产[3]。
干旱胁迫会抑制马铃薯生长,降低其光合速率,损伤膜系统,并使马铃薯的能量代谢和营养代谢失调,从而使马铃薯的产量及品质降低。因此,关于马铃薯耐旱机理的研究及抗旱品种的筛选和培育便显得尤为重要。
本文对马铃薯在干旱胁迫条件下的生理代谢以及马铃薯抗旱生理机制的相关研究进行了总结,旨在为开展马铃薯抗旱性研究提供理论基础。
1 干旱胁迫对马铃薯的影响
植物受到干旱胁迫通常是非常易于观察的,如植株出现萎蔫的情况,而造成萎蔫实质是植株缺水导致其内部的组织、细胞等结构发生了物理或化学变化。膜的结构和透性改变就是非常典型的变化,而且膜结构改变后可能会导致植株的代谢过程受阻,如光合作用、呼吸作用被抑制,某些蛋白质被分解,大量脯氨酸积累,核酸代谢途径受阻,激素代谢途径发生改变等[4-5]。这种植物体内水分异常分配会导致植物生长受到抑制,若胁迫严重更会引起植株机械性损伤,最终导致植株死亡[6]。
1.1 干旱胁迫对马铃薯生长发育的影响
干旱对植物的生长发育及生理生化代谢都会产生巨大影响,主要表现在破坏膜透性、降低膨压、导致气孔关闭、内源激素中促进生长的激素减少、蛋白质合成减少、活性氧积累增多等6个方面[7]。同样,马铃薯作为典型的温带气候作物,在不同的生长发育阶段均对干旱胁迫非常敏感[8-9]。焦志丽等[10]研究了不同程度干旱胁迫下马铃薯幼苗的生长情况,结果表明,马铃薯幼苗在受到中度和重度干旱胁迫时生长会受到显著影响,且随着受胁迫时间的增加,其株高、茎粗、单株叶面积以及地上部分鲜质量都明显降低,同时伴有萎蔫的现象。DEBLONDE等[11]研究指出,在马铃薯块茎形成前,若受到干旱胁迫,其茎高、叶片数、叶长等都会受到影响,出现植株生长缓慢、叶片蒸腾作用下降等现象,直接影响到马铃薯产量和块茎数。若是在马铃薯结块期受到干旱胁迫,则会对马铃薯块茎的品质和产量产生影响[12-14]。有研究指出,干旱胁迫会造成马铃薯块茎中还原糖、干物质含量等下降[15]。
1.2 干旱胁迫对马铃薯生理代谢的影响
作物的一些生理指标如叶绿素荧光、叶绿素含量、电导率、过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量等能够反映作物的受胁迫情况,因此,常被作为抗旱性鉴定的指标[16-17]。抗艳红等[18]对冀张薯8号和夏波蒂2个马铃薯品种不同生育期进行干旱处理后发现,马铃薯在各生育期受到干旱胁迫后均会导致其丙二醛、脯氨酸含量增加,超氧化物歧化酶活性降低。MESCHT等[19]对12个品种的马铃薯叶片在干旱胁迫下的多胺浓度进行了测定,结果表明,多胺浓度也能反映马铃薯受胁迫程度。高占旺等[20]对坝薯9号、坝薯10号以及乌盟851等3个品种在干旱胁迫下叶片的相对含水量、叶水势和叶绿素含量等相关生理指标进行了检测,结果发现,胁迫强度越大,叶片相对含水量和叶水势下降越明显,而且植株高度、茎粗等均降低,但随胁迫强度的增加块茎干物质含量、叶绿素含量增加,坝薯9号和乌盟851体现出更强的耐旱性。
2 马铃薯抗旱机制研究进展
随着科学技术的不断发展,马铃薯抗旱研究从起初对表观生理指标的描述到干旱胁迫下的生理生化变化,至今已发展到对其生理机制和分子机制的深入研究。
2.1 马铃薯抗旱生理机制研究进展
马铃薯抗旱生理机制方面的研究主要集中在渗透调节机制、抗氧化机制、光合作用和脱水保护蛋白等多个方面。其中,渗透调节是抵抗干旱胁迫过程中较为重要的一种机制,主要是通过增加水分吸收、保持膨压来改变细胞水分状况,同时通过改善水分胁迫植物的生理功能,维持植物的光合作用和生长[21]。脯氨酸是渗透调节物质中研究较多的,MENKE等[22]在马铃薯保卫细胞中发现一个高表达的新基因StGCPPRP,该基因可编码脯氨酸丰富蛋白并受干旱等环境因子调控,在干旱条件下,StGCPPRP基因表达水平呈下调趋势。但除脯氨酸外,还有很多其他参与干旱胁迫的渗透调节物质,如胺类物质,有研究者用PEG处理马铃薯悬浮细胞后发现,细胞中的亚精胺和腐胺含量明显增加,S-腺苷甲硫氨酸脱羧酶(SAMDC)和二胺氧化酶(DAO)的活力提高2倍,并且细胞中的乙烯含量也有所增加[23]。
在植物受到干旱胁迫后,体内活性氧和抗氧化系统之间的平衡将会被破坏,因此,会造成一系列生理代谢的变化,对这些变化的研究也逐渐深入。有研究者得到了纯化后的马铃薯线粒体抗坏血酸过氧化物酶(APX),研究发现,APX定位在线粒体内部,并参与清除线粒体中多余活性氧的过程[24]。马铃薯在受到干旱胁迫后,其类囊体受干旱诱导可产生一种大小为34 kDa的蛋白,推测其功能是增加叶绿体的稳定性[25]。后续又有学者对马铃薯的叶绿体蛋白CDSP32和CDSP34进行了细胞免疫学定位,发现这2个蛋白均受干旱胁迫诱导,主要在叶绿体基质和类囊体片层中分布,主要起维持叶绿体稳定的作用[26]。
干旱胁迫除了对马铃薯渗透机制和抗氧化机制有影响外,对马铃薯光合反应过程的影响也不可小觑,人们对其进行了详细研究,发现干旱胁迫会使植物光合作用电子传递链紊乱,从而导致植物受到活性氧的伤害。BUSH等[27]研究发现,在干旱胁迫下,马铃薯净光合速率、光化学能电子产量、相对电子输出率和光化学猝灭均明显受到抑制。此外,植物在受到干旱胁迫时,通常会诱导产生一系列抗逆蛋白,可以对植物适应逆境环境起到保护作用。KIRCH等[28]在马铃薯中发现可编码脱水素的基因ci7,并且受干旱胁迫诱导表达。脱水素是植物中广泛存在的一类LEA蛋白,在植物遭到逆境胁迫时可以起到保护作用,如稳定生物膜和蛋白质结构[29]。
2.2 马铃薯抗旱分子机制研究进展
随着分子生物学的不断发展,近年来对植物抗旱分子机制的研究不断深入,许多抗旱性基因不断被挖掘,BLUM[30]研究表明,至2014年,已在487种植物中发现104个与抗旱有关的基因,其中有68个基因已在拟南芥和主要农作物中得到验证,确实具有抗旱功能。其中,拟南芥中被证实的可提高抗旱能力的基因共15种,水稻中有14个,小麦中有9个,玉米中有7个,而马铃薯中已经被发现的与抗旱相关的基因只有WRKY1,DREB1和SnRK2[31]。
植物抗旱的主要分子机理大致可以概括为以下几个过程(图1):植物在遭到外界干旱胁迫时会产生许多不良反应,而这一过程也是一个信号感知的过程;在感受到外界刺激后,通过信号传导的过程调节相关的转录因子;转录因子调控基因的激活与应答,通过渗透调节、清除多余的活性氧、诱导合成生物大分子功能性蛋白、改变一些新陈代谢途径实现抗旱[32]。
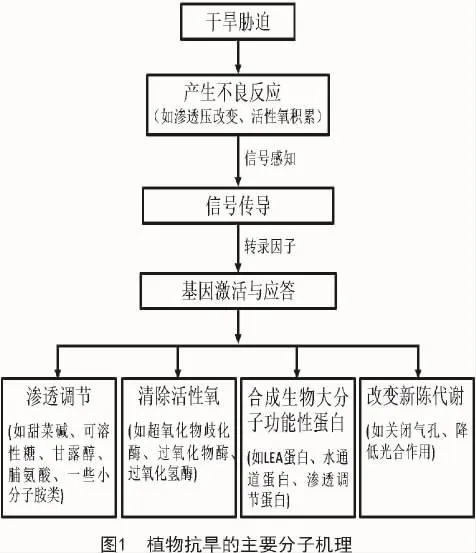
马铃薯作为温带气候性作物,对干旱也十分敏感,所以,干旱是影响马铃薯产量及品质的主要环境因子之一。目前,国内外研究者对马铃薯抗旱分子机制的研究也逐渐深入,很多学者致力于用现代分子生物学技术以及生物化学技术来提高马铃薯的抗旱性。贾小霞等[33]将拟南芥中的转录因子DREB1A基因与诱导性启动子rd29重新构建载体,并将其转入马铃薯中,发现转入DREB1A基因的陇薯10号的抗旱能力显著增强。SHIN等[34]为了探究马铃薯中胁迫相关的基因,采用反向Northern杂交技术对马铃薯在非生物环境胁迫条件下进行了遗传筛选,发现一个MYB-like基因StMYB1R-1过表达后可使马铃薯的抗旱能力增强。近年来,关于植物抗性QRT鉴定的研究比较多,金黎平[35]研究指出,抗性QRT在第12号染色体上分布较多,而抗性基因簇在第5,11号染色体上分布较多。ANITHAKUMARI等[36]研究发现,马铃薯47个QTL中与抗旱性相关的有28个,与干旱胁迫恢复能力相关的共有17个。
3 展望
到目前为止,关于提高马铃薯抗旱能力的研究并不多见,而且马铃薯作为主要收获块茎的农作物,培育具有发达根系的马铃薯优良品种有望提高其产量,因此,加强对马铃薯根系的研究显得尤为重要。植物根系不仅是吸收营养和水分的直接器官,而且植物根系是否发达与其抗旱能力也有直接关系,抗旱性强的品种其根系较为发达,根系生物量较大,总根长及总根系表面积也较大[37]。能够促进植物根系在干旱胁迫下仍可正常生长的基因有Drol,HAR-DY和ATHB6。转Drol基因可使作物根系空间结构变大,根系更为发达,增强干旱条件下的吸水能力,使作物的抗旱性得到有效提高[38]。转HAR-DY基因可使作物根系数量明显增多、根系体积变大,从而提高其水分利用率以抵抗干旱[39]。转ATHB6基因则会增强主根和侧根细胞的分裂,提高植物的抗旱能力,将该基因转到拟南芥中后发现,转基因植株比野生型的耐旱性强[40]。因此,可以对这些基因转入马铃薯中的功能进行深入研究,为研究具有发达根系的马铃薯新品种提供新思路。
干旱胁迫对马铃薯的产量和品质都会产生巨大影响,而马铃薯的产量和品质与其新陈代谢等生理过程有着密切的联系,因此,对于马铃薯抗旱的生理机理和相关的分子机制研究也不容忽视,可以通过转基因技术、分子标记等新的生物分子技术来提高马铃薯的抗旱性[41]。据统计,目前马铃薯中已有几十个抗旱性状被标记,为以后马铃薯的抗旱育种提供了有力的理论依据[42]。在之后的研究工作中,应对马铃薯抗旱相关的基因进行挖掘,并用先进的分子生物学技术将这些优良的抗旱基因运用到马铃薯育种的生产实践中,以期培育出抗旱性强且品质优良的马铃薯新品种。
[1]肖大伟,陈志钢.最近30年水旱灾害对中国大陆地区粮食减产的影响分析 [J].东北农业大学学报(社会科学版),2012(4):6-9.
[2]张琨,袁利兵,彭志红,等.马铃薯转基因工程研究现状[J].湖南农业科学,2011(5):6-8,11.
[3]王芳.马铃薯抗旱性评价相关研究进展[C]//中国作物学会马铃薯专业委员会.马铃薯产业与现代可持续农业(2015).北京:中国作物学会马铃薯专业委员会,2015.
[4]GILL S S,TUTEJA N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology&Biochemistry,2010,48(12):909.
[5] ZHANG Y J,XIE Z K,WANG Y J,et al.Effect of water stress on leaf photosynthesis,chlorophyll content,and growth of oriental lily[J].Russian Journal ofPlant Physiology,2011,58(5):844-850.
[6]王小菁.植物生理学[M].北京:科学技术文献出版社,2006.
[7]刘祖祺.植物抗性生理学[M].北京:中国农业出版社,1994.
[8] PMK D,HAVERKORT A J,LEDENT J F.Responses of early and late potato cultivars to moderate drought conditions:agronomic parameters and carbon isotope discrimination[J].European Journal of Agronomy,1999,11(2):91-105.
[9]BELANGER G,WALSH J R,RICHARDS J E,et al.Tuber growth and biomass partitioningoftwopotatocultivars grown under different Nfertilization rates with and without irrigation[J].American Journal ofPotatoResearch,2001,78(2):109-117.
[10]焦志丽,李勇,吕典秋,等.不同程度干旱胁迫对马铃薯幼苗生长和生理特性的影响[J].中国马铃薯,2011,25(6):329-333.
[11] DEBLONDE P M K,LEDENT J F.Effects of moderate drought conditions on green leaf number,stemheight,leaf length and tuber yield of potato cultivars [J].European Journal of Agronomy,2001,14(1):31-41.
[12] SCHAFLEITNER R,GUTIERREZ R,ESPINO R,et al.Field screening for variation of drought tolerance in Solanum tuberosum L.by agronomical,physiological and genetic analysis[J].Potato Research,2007,50(1):71-85.
[13]MACKERRONDKL,JEFFERIESR A.The influence ofearlysoil moisture stress on tuber numbers in potato[J].Potato Research,1986,29(3):299-312.
[14]BUSTANA,SAGI M,MALACH YD,et al.Effects ofsaline irrigation water and heat waves on potato production in an arid environment[J].Field Crops Research,2004,90(2/3):275-285.
[15]孙慧生.马铃薯育种学[M].北京:中国农业出版社,2003.
[16] BANSAL K C,NAGARAJAN S,SUKUMARAN N P.A rapid screening technique for drought resistance in potato(Solanum tuberosum L.)[J].PotatoResearch,1991,34(3):241-248.
[17]VANDMA,ROSSOUWF T.Drought-tolerant potatoes?Astrategy for the development of a screening method[J].South African Journal ofScience,1997,93(6):257-258.
[18]抗艳红,龚学臣,赵海超,等.不同生育时期干旱胁迫对马铃薯生理生化指标的影响 [J].中国农学通报,2011,27(15):97-101.
[19]MESCHTAVD,RONDE J AD,MERWE TVD,et al.Changes in free proline concentrations and polyamine levels in potato leaves duringdrought stress[J].South African Journal ofScience,1998,94(7):347-350.
[20]高占旺,庞万福,宋伯符.水分胁迫对马铃薯的生理反应[J].中国马铃薯,1995(1):1-6.
[21]范敏,金黎平,刘庆昌,等.马铃薯抗旱机理及其相关研究进展[J].中国马铃薯,2006,20(2):101-107.
[22] MENKE U,RENAULT N,MUELLERROEBER B.StGCPRP,a potato gene strongly expressed in stomatal guard cells,defines a novel type ofrepetitive proline-rich proteins[J].Plant Physiology,2000,122(3):677-686.
[23] SCARAMAGLI S,BIONDI S,LEONE A,et al.Acclimation to low-water potential in potato cell suspension cultures leads to changes in putrescine metabolism[J].Plant Physiology&Biochemistry,2000,38(4):345-351.
[24] LEONARDIS S D,DIPIERRO N,DIPIERRO S.Purification and characterization of an ascorbate peroxidase from potato tuber mitochondria[J].Plant Physiology&Biochemistry,2000,38(10):773-779.
[25]PRUVOTG,MASSIMINOJ,PELTIER G,et al.Effects oflowtemperature,high salinityand exogenous ABA on the synthesis of two chloroplastic drought-induced proteins in Solanum tuberosum[J].Physiologia Plantarum,2010,97(1):123-131.
[26]EYMERYF,REYP.Immunocytolocalization ofCDSP 32 and CDSP 34,two chloroplastic drought-induced stress proteins in Solanum tuberosum plants[J].Plant Physiology&Biochemistry,1999,37(4):305-312.
[27]BASU P S,SHARMA A,SUKUMARAN N P.Changes in net photosynthetical rate and chlorophyll fluorescence in potato leaves induced bystress[J].Photosynthetica,1998,35(1):13-19.
[28]KIRCH H H,BERKEL J V,GLACZINSKI H,et al.Structural organization,expression and promoter activity of a cold-stress-inducible gene ofpotato(Solanum tuberosum L.)[J].Plant Molecular Biology,1997,33(5):897-909.
[29]孙歆,雷韬,袁澍,等.脱水素研究进展 [J].植物科学学报,2005,23(3):299-304.
[30]BLUMA.Genomics for drought resistance-gettingdown toearth[J].Functional Plant Biology,2014,41(11):1191-1198.
[31]王晓斌,胡开明,范阿琪,等.作物抗旱基因研究进展及在马铃薯抗旱种质创新中的应用 [J].干旱地区农业研究,2017,35(1):248-257.
[32] YANG S J,VANDERBELD B,WAN J X,et al.Narrowing down the targets:towards successful genetic engineering of drought-tolerant crops[J].Molecular Plant,2010,3(3):469-490.
[33]贾小霞,齐恩芳,王一航,等.转录因子DREB 1 A基因和Bar基因双价植物表达载体的构建及对马铃薯遗传转化的研究[J].草业学报,2014,23(3):110-117.
[34] SHIN D,MOON S J,HAN S,et al.Expression of StMYB1R-1,a novel potato single MYB-like domain transcription factor,increases drought tolerance[J].Plant Physiology,2011,155(1):421-432.
[35]金黎平.二倍体马铃薯加工品质及重要农艺性状的遗传分析[D].北京:中国农业科学院,2006.
[36]ANITHAKUMARI A M,DOLSTRA O,VOSMAN B,et al.In vitro screening and QTL analysis for drought tolerance in diploid potato[J].Euphytica,2011,181(3):357-369.
[37]丁红,张智猛,戴良香,等.不同抗旱性花生品种的根系形态发育及其对干旱胁迫的响应 [J].生态学报,2013(17):5169-5176.
[38]ZHANG X,WANG L,MENG H,et al.Maize ABP9 enhances tolerance tomultiple stresses in transgenic Arabidopsis bymodulating ABA signaling and cellular levels of reactive oxygen species[J].Plant Molecular Biology,2011,75(4/5):365-378.
[39] KITOMI Y,KANNO N,KAWAI S,et al.QTLs underlying natural variation of root growth angle among rice cultivars with the same functional allele of DEEPER ROOTING 1[J].Rice,2015,8(1):1-12.
[40] ZHANG L,XIAO S,LI W,et al.Overexpression of a Harpin-encoding gene hrf1 in rice enhances drought tolerance[J].Journal of Experimental Botany,2011,62(12):4229-4238.
[41] OTTOMAN R J,HANE D C,BROWN C R,et al.Validation and implementation ofmarker-assisted selection(MAS)for PVYresistance(Ryadggene)in a tetraploid potato breeding program[J].American Journal ofPotatoResearch,2009,86(4):304-314.
[42]张永芳.马铃薯分子育种研究进展[J].山西大同大学学报(自然科学版),2010,26(3):56-59.
Research Progress on Drought Resistance of Potato
WANGYuchao1,GUOMiao2
(1.Institute ofthe Crops in High Latitude & Cold Climate Area,Shanxi AcademyofAgricultural Sciences,Datong037001,China;2.DatongMunicipal Landscape Bureau Linear Park Service,Datong037008,China)
Drought stress,one of the main environmental factors which restrict the development of agriculture in China,has been paid close attention to by many researchers.The potato is the main grai crop in China,so its drought resistance has been a research hotspot.This paper reviews some progresses in effects of drought stress,the mechanism of drought resistance,and the molecular mechanism of drought resistance in potato.It is expected to provide the research direction and theoretical basis for the study of potato drought resistance in the future,and laya theoretical foundation for further improvingpotatoyield and quality.
potato;drought stress;research progress
S532
A
1002-2481(2017)11-1890-05
10.3969/j.issn.1002-2481.2017.11.38
2017-08-17
山西省农业科技成果转化与示范推广项目(2016CGZH15)
王彧超(1984-),男,山西阳高人,助理研究员,主要从事玉米栽培与育种研究、马铃薯高产技术推广工作。
