南极适冷菌Psychrobacter sp.G假定蛋白基因PSYCG_10180对温度和盐度胁迫的应答特征分析
2017-11-14林学政
张 良,李 阳,张 政,林学政*
(1.国家海洋局第一海洋研究所,山东青岛266061;2.国家海洋局海洋生物活性物质重点实验室,山东青岛266061)
南极适冷菌Psychrobacter sp.G假定蛋白基因PSYCG_10180对温度和盐度胁迫的应答特征分析
张 良1,2,李 阳1,2,张 政1,2,林学政1,2*
(1.国家海洋局第一海洋研究所,山东青岛266061;2.国家海洋局海洋生物活性物质重点实验室,山东青岛266061)
根据南极适冷菌Psychrobacter sp.G的基因组完成图,对其假定蛋白基因PSYCG_10180全长进行了基因克隆、序列分析与异源表达,并利用qRT-PCR和western blotting技术对其在不同温度/盐度胁迫条件下的表达特征进行了研究。序列分析表明,与蛋白PSYCG_10180相似性较高的均为假定蛋白;相似性最高的已知功能蛋白为蓝光传感蛋白(WP_010201745.1),二者的相似性仅有37%。在m RNA水平上,基因PSYCG_10180的表达被低温(0℃)显著诱导,在2,12 h均被不同盐度显著抑制;在温度/盐度协同胁迫下,2 h内低温均能诱导其表达,而高温低盐(30℃,15)则抑制其表达。在蛋白水平上,不同温度胁迫下,蛋白PSYCG_10180的表达量在2 h变化不大,12 h时均被诱导;在不同盐度胁迫下,该蛋白的表达在12 h均被诱导;在温/盐协同胁迫下,除在2 h被高温低盐(30℃,15)诱导外,其余条件下该蛋白的表达均被抑制。比较分析表明,在m RNA水平上,基因PSYCG_10180的表达更容易受温度的影响;在蛋白水平上,盐度对该基因表达的影响则要大于温度;在温盐协同胁迫时,盐度起主导作用。冻融试验表明,表达该假定蛋白可显著提高重组菌株的冻融存活率。本研究表明,假定蛋白基因PSYCG_10180可能在菌株Psychrobacter sp.G的低温等环境适应性中起着重要作用。
Psychrobacter;PSYCG_10180;胁迫表达;qRT-PCR;western blotting
假定蛋白通常是指那些未知结构和功能的蛋白质[1]。任何测序的基因组中至少包含25%的假定蛋白,即使像简单的模式生物如大肠杆菌、枯草芽孢杆菌和酿酒酵母也不例外[2]。假定蛋白可能在微生物细胞生理中起着重要作用,假定蛋白基因及其ORFs的预测有助于蛋白质组学及表达分析的研究[3]。随着测序技术的快速发展,越来越多的基因组序列可以在GenBank等数据库中找到,尤其是全基因组序列的测通对生命科学有着根本意义上的改变[2]。到目前为止,GenBank数据库已有超过10 000株细菌的基因组序列;然而,这些基因组中有高达50%的基因被标记为“未知”,“未表征”或“假定”,这极大地限制了我们对其功能的理解[4-5],也限制了对这些数据的利用,使得数据丰富而信息量差。因此,后基因组时代的主要任务是对基因组的注释,通过氨基酸序列的分析和实验验证其基因产物的功能,然而对假定蛋白的生物学功能注释仍然是一个巨大的挑战,这是因为其与已知功能蛋白的氨基酸序列只有较低的相似性[6]。
南极适冷菌Psychrobacter sp.G的全基因组为3.11 M,G+C含量为42.44%,由1条环形染色体(CP006265)和3个质粒(CP006266,CP006267,CP006268)组成,假定蛋白分别占染色体和质粒开放阅读框(Open Reading Frame,ORF)的26.3%和72.2%[7],可能在菌株的环境适应性中发挥着重要作用[8-9],需要利用多种手段对其功能进行预测及验证[10]。
对假定蛋白的功能预测可以结合多种方法。Retief[11]和Hall[12]发现,可以通过构建系统发育树的方法来预测假定蛋白的可能功能,同时可以用Tree View和PhyloDraw两种软件对系统发育树进行直观化视图,以期更好地预测假定蛋白的功能[13-14]。Oany等[10]对菌株Alteromonas macleodii AltDE1的假定蛋白amad1_06475的氨基酸序列分析表明,该蛋白与冷激蛋白和RNA分子伴侣有很高的同源性,并通过多序列比对分析确定了该假定蛋白中冷激蛋白保守区域的存在;同时结构预测也表明该假定蛋白具有冷激蛋白和RNA伴侣的蛋白结构特征。Kanayama等[15]对从桃树中克隆的基因Pp AKR1进行了氨基酸序列分析,并通过构建系统发育树,发现该基因属于醛酮还原酶家族,进一步通过实验验证发现其可参与非生物胁迫耐受性过程。Rajnish等[16]通过同源性比对发现Zymomonas mobilis中的一种假定内切葡聚糖酶(ZMO1086)与已知的内切葡聚糖酶的相似度虽仅为40%,但通过异源表达证实了其具有内切葡聚糖酶的活性。
已有的转录组比较分析表明,南极适冷菌Psychrobacter sp.G经冷激(0℃,2 h)后,假定蛋白基因PSYCG_10180的表达量显著上升,其表达量的log2FC(L/C)值为对照的4.1倍[17]。本文对其进行了基因克隆和蛋白结构分析,并利用q RT-PCR和Western blotting技术分别从mRNA水平和蛋白水平研究了其在不同温度、盐度以及温盐协同胁迫下的表达情况,以期探讨该基因在菌株G环境适应性中的作用。
1 材料和方法
1.1 菌株、培养基及生长条件
南极适冷菌Psychrobacter sp.G分离自南极乔治王岛西南部的海水并保存于本实验室。感受态细胞Escherichia coli DH5α(D9057),克隆载体p MD18-T(D101A)均购买于TaKaRa(大连)。其最适生长温度是20℃,最适生长NaCl浓度是45‰(w/v);最适盐度培养基:胰蛋白胨5 g,酵母粉1 g,NaCl 14 g,溶解于1 L过滤后的青岛近海海水(盐度约为31)中,并于1×105Pa下湿热灭菌20 min,所使用不同盐度培养基的成分参照文献[17]。
1.2 假定蛋白基因PSYCG_10180原核表达体系的构建
1.2.1 基因PSYCG_10180的克隆及生物信息学分析
根据菌株G的基因组完成图,选取目的基因的ORF序列,利用Primer 5.0软件设计特异性引物,在引物5'端分别引入相应的限制性内切酶Nde I和Xho I的酶切位点(表1)。

表1 扩增假定蛋白基因PSYCG_10180全长的特异性引物Table 1 Specific primers used to amplify the full length of the hypothetical protein gene PSYCG_10180
特异性引物由博尚生物技术有限公司合成。以菌株G的基因组为模板,进行PCR扩增。PCR条件如下:95℃5 min;95℃45 s,52℃30 s,72℃20 s,35个循环;72℃延伸10 min。PCR产物经纯化后连接到p MD18-T载体上,转入大肠杆菌DH5α感受态细胞,挑取单克隆经PCR初步验证后送交南京金斯瑞有限公司测序。
测序结果通过EditSeq软件查找该序列的开放阅读框,通过Basic Local Alignment Search Tool(BLAST)(http:∥www.ncbi.nlm.nih.gov)与GenBank中已有的序列进行比对分析。启动子序列(-35区、-10区)、核糖体结合位点(ribosome binding sequence,RBS)由Softberry网站(http:∥linux1.softberry.com/berry.phtml)分析获得[18]。氨基酸多序列比对采用DNAMAN软件;蛋白等电点(pI)、分子量(MW)由Lasergene-EditSeq(v.1.02;DNASTAR Inc.)计算得出;系统发育树通过软件Mega 5.1中的邻接法(Neighbor-Joining Method,NJ)构建。
1.2.2 表达载体的构建
将重组质粒p MD18-T-PSYCG_10180与表达质粒p ET22b同时用NdeI和XhoI进行双酶切并纯化目的片段,并使用T4 DNA连接酶于16℃连接过夜,随后转化感受态细胞E.coli BL21(DE3),用终浓度为100μg/m L Amp的LB培养基筛选阳性克隆并经PCR初步验证后送交南京金斯瑞有限公司测序。
1.2.3 假定蛋白的表达与多克隆抗体的制备
将经测序验证正确的表达菌E.coli BL21(DE3)-p ET22b+PSYCG_10180进行培养,并用终浓度为1 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(Isopropylβ-D-Thiogalactoside,IPTG)对重组菌进行了诱导表达。重组后的表达型载体p ET22b+PSYCG_10180表达出的目的蛋白主要在包涵体中,由于该蛋白C端带有较强的疏水区域并且有明显的跨膜区域,因此其并不适合使用Ni+亲和层析的方法纯化。我们将表达出的包涵体直接送至南京钟鼎生物公司进行切胶纯化获得目的蛋白,利用此目的蛋白制备多克隆抗体。
1.3 胁迫处理
参照文献[19],对菌株G进行培养和胁迫处理,以进行m RNA水平和蛋白水平上的差异表达分析。
1.4 qRT-PCR分析
利用RNA提取试剂盒(DP430,天根,北京)提取经不同胁迫处理与不同胁迫时间的菌株G的总RNA,其质量通过测定其A260/A280值确定。利用反转录试剂盒PrimeScript RT Reagent Kit(RR047A,Takara,大连)将得到的1 000 ng RNA反转录为cDNA,使用SYBR Premix Ex Taq TM II试剂盒(RR820A,Takara,大连)进行q RT-PCR分析。
利用软件Primer 5.0设计获得假定蛋白基因PSYCG_10180进行qRT-PCR的引物(F:5'-CCAGTAATGCCAGATCTATG-3';R:5'-TTCTGCGATATCATTAAGAGCG-3'),内参基因为GAPDH(F:5'-AGTCAGGCACATTTAGCG-3';R:5'-GGCATAGCCCCATTCATT-3')[20-21]。qRT-PCR条件:95℃3 min;95℃30 s,退火温度(PSYCG_10180:55℃,GAPDH:52℃)20 s,72℃20 s,40个循环。所有实验均重复3次。基于临界循环值(C t)对基因PSYCG_10180的mRNA进行定量,采用相对C t值法(2-ΔΔCt)处理所得数据,对照组基因表达量标准化为1,并对样本的重复性以及样本间的差异进行方差分析、显著性差异分析[22]。
1.5 Western blotting检测
根据李阳等[19]利用利用western blotting技术对假定蛋白基因PSYCG_10180不同胁迫条件下在翻译水平上的表达情况进行了检测与分析。
1.6 重组菌株p ET22b+PSYCG_10180的抗冻融活性测定
将经IPTG(终浓度为1 mmol/L)诱导的含p ET22b+PSYCG_10180的E.coli BL21菌液取1 m L装于1.5 m L EP管中,于-20℃冷冻,2 h后取出放于冰上1 h使其融化,融化后再将其放于-20℃冷冻2 h,之后再取出放于冰上1 h使其溶化,之后按之前方法再重复冻融1次。分别将反复冻融0,1,2和3次的菌液以1%的接种量接种于5 m L含Amp的LB液体培养基中,37℃,150 r/min培养4 h后测OD600,重复3次。以仅含质粒p ET22b的E.coli BL21的存活率作为对照组(反复冻融处理同上)[23]。
2 结果与分析
2.1 假定蛋白基因PSYCG_10180的克隆及序列分析
根据菌株G基因组完成图[7]和基因克隆测序结果分析表明,假定蛋白基因PSYCG_10180的ORF长624 bp,编码207个氨基酸,理论蛋白分子量为23.12 k Da,等电点(p I)值为4.80。启动子序列-35区(5'-TTTAAT-3')和-10区(5'-TTTTATTCT-3')分别位于起始密码子ATG上游436 bp和415 bp处,转录起始位点(transcription start site,TSS)位于-10区下游6 bp处;起始密码子上游7 bp处有一个典型的核糖体结合位点(ribosome binding site(RBS),5'-GGAG-3'),长14 bp的下游框(downstream box(DB),5'-ATTGATTCTACAAA-3')位于起始密码子ATG下游10 bp处。

图1 假定蛋白基因PSYCG_10180及调控序列分析Fig.1 Analysis of hypothetical protein gene PSYCG_10180 and its regulatory sequences
利用BLASTP对假定蛋白PSYCG_10180进行了比对分析并构建了系统发育树(图2)。可以看出,检索到了两类与假定蛋白PSYCG_10180相关的蛋白,一类为假定蛋白,二者的相似性较高,与假定蛋白(WP_041753194.1,Psychrobacter cryohalolentis)的相似性可达97%;另一类为蓝光传感蛋白,但二者的相似性均很低,如该假定蛋白与其中相似性最高的Psychrobacter sp.PRwf-1的蓝光传感蛋白(WP_010201745.1)的相似度也仅有37%。
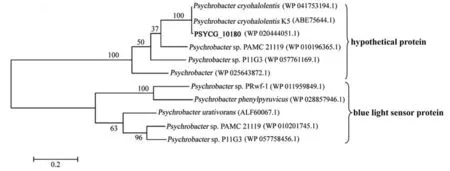
图2 假定蛋白PSYCG_10180的系统发育分析Fig 2 Phylogenetic analysis of hypothetical protein PSYCG_10180
2.2 对温度胁迫的应答
由图3可见,在m RNA水平上,假定蛋白基因PSYCG_10180的表达显著被低温(0℃)诱导,该温度下基因的表达于2 h表达量达到最大,约为对照组的12倍。高温(30℃)条件下,其先被抑制,随后(6 h)升高,之后表达量又显著下降,于12 h时受到显著的抑制,表达量仅约为对照组的0.2倍。

图3 假定蛋白基因PSYCG_10180对温度胁迫的应答特征Fig.3 Expression patterns of hypothetical protein gene PSYCG_10180 in response to temperature stress
Western blotting结果经灰度扫描后分析表明(图4),在蛋白水平上,假定蛋白PSYCG_10180的表达量在较短时间(2 h)内变化不大,于6 h时均被抑制,较长时间(12 h)内均被诱导,并于10℃时其表达量最大,约为对照组的4.6倍。

图4 温度胁迫下假定蛋白PSYCG_10180的表达分析Fig.4 Expression analysis of hypothetical protein PSYCG_10180 in response to temperature stress
2.3 对盐度胁迫的应答
由图5可见,在m RNA水平上,基因PSYCG_10180的表达在较短时间(2 h)内被抑制,6 h被诱导,12 h被显著抑制状态。在低盐(0,15)条件下,基因PSYCG_10180的表达量于12 h时均为对照组的0.3倍;在高盐(90,120)条件下,基因PSYCG_10180的表达量分别为对照组的0.8倍和0.3倍。
Western blotting结果经灰度扫描后分析表明(图6),在蛋白水平上,假定蛋白PSYCG_10180的表达在较短时间(2 h)内除被高盐(90)抑制外,可被其他盐度诱导,并于高盐(120)时蛋白表达量达到最大,约为对照组的2.5倍;6 h无论盐度高低,该蛋白的表达均被抑制,并在高盐(90)时表达量最低,在2和6 h时蛋白的表达均可被高盐(90)抑制;12 h时假定蛋白的表达均可被诱导。

图5 假定蛋白基因PSYCG_10180对盐度胁迫的应答特征Fig.5 Expression patterns of hypothetical protein gene PSYCG_10180 in response to salinity stress

图6 盐度胁迫下假定蛋白PSYCG_10180的表达分析Fig.6 Expression analysis of hypothetical protein PSYCG_10180 in response to salinity stress
2.4 对温度/盐度协同胁迫的应答
由图7可见,在温度/盐度协同胁迫条件下,在2 h假定蛋白基因PSYCG_10180的表达都可被低温诱导,尤其是被低温低盐(0℃,15)显著诱导,其表达量约为对照组的8.2倍。在3个试验时间点均可被高温低盐(30℃,15)抑制,表达量分别为对照组的0.4,0.3和0.3倍。
Western blotting结果经灰度扫描后分析表明(图8),在温度/盐度协同胁迫条件下,在蛋白水平上,假定蛋白PSYCG_10180的表达只有在2 h被高温低盐(30℃,15)诱导(表达量约为对照组的1.3倍),其余条件下均被抑制。

图7 假定蛋白基因PSYCG_10180对温/盐协同胁迫的应答特征Fig.7 Expression patterns of hypothetical protein gene PSYCG_10180 in response to combined stresses of temperature and salinity

图8 温盐胁迫下假定蛋白PSYCG_10180的表达分析Fig.8 Expression analysis of hypothetical protein PSYCG_10180 in response to combined stresses of temperature and salinity
2.5 重组菌株的抗冻融活性
重组菌株经反复抗冻融后,其存活率结果见图9。可以看出,对表达假定蛋白PSYCG_10180的重组菌与仅含p ET22b的重组菌进行反复冻融后,其存活率均不断下降,但前者的存活率始终高于后者。在冻融3次以后表达假定蛋白PSYCG_10180的重组菌的存活率约为对照组的15倍。此结果可初步说明,假定蛋白PSYCG_10180的异源表达可提高宿主菌E.coli BL21的抗冻融能力。

图9 PSYCG_10180重组菌株的抗冻融实验Fig.9 Freezing and thawing resistance of PSYCG_10180-overexpressing strain
3 讨 论
本文根据已有的对南极适冷菌Psychrobacter sp.G温度胁迫转录组的比较分析,对其中一个低温胁迫后表达显著升高的假定蛋白基因PSYCG_10180进行了基因克隆与序列分析,并利用q RT-PCR和western blotting技术分别从m RNA水平和蛋白水平研究了其在不同温度/盐度胁迫条件下的表达情况,以期揭示菌株G对南极极端环境的分子适应机制。
序列分析表明,在假定蛋白基因PSYCG_10180的起始密码子ATG下游10 bp处发现长14 bp的下游框的存在。有研究表明,下游框对冷激后处于生长停滞期细胞的翻译过程是必需的[24],这初步说明,该假定蛋白可能在菌株G的低温适应性中起着重要作用。BLASTP检索到了两类与该假定蛋白相近的蛋白,相似性最高的是假定蛋白,相似度可达97%;与已知功能的Psychrobacter sp.PRwf-1的蓝光传感蛋白(WP_010201745.1)的相似度仅为37%。这说明,有必要通过试验进一步验证该基因的功能。
温度胁迫对基因PSYCG_10180在m RNA和蛋白水平表达的影响存在着明显差异。在mRNA水平上,在0℃时基因PSYCG_10180的表达先被诱导然后被抑制,在10和30℃该基因的表达仅在6 h受到诱导,这表明该基因具有冷激蛋白基因对温度胁迫应答的典型特征;而在蛋白水平上,假定蛋白PSYCG_10180无论温度高低,其表达均先被抑制后诱导。Etchegaray等[25]研究发现,当大肠杆菌的培养温度低于其最适温度时,冷激蛋白Csp A的表达量会在短时间内迅速升高。Song等[20]研究表明,冷激蛋白基因Csp 2039在m RNA水平上的表达可显著被低温诱导;在蛋白水平上,冷激蛋白Csp2039的表达亦可被低温诱导,这与本文研究结果基本一致。当大肠杆菌从其最适生长温度37℃下降到10℃时,其Csp A蛋白家族的表达量为总蛋白的13%[26],这与本文假定蛋白PSYCG_10180在低温(10℃)条件下其蛋白表达量最大的趋势相一致。
盐度胁迫对基因PSYCG_10180在m RNA和蛋白水平的表达的影响也存在着明显差异。在m RNA水平上,该基因在6 h被诱导,其余时间(2,12 h)被抑制,尤其在12 h时所有盐度均会显著抑制其表达,但总体来看该基因对盐度的应答特征并不明显;在蛋白水平上,该假定蛋白的表达无论盐度高低在6 h均受到抑制,而在其余时间内(2,12 h)除在2 h的高盐度(90)外,该假定蛋白的表达均受到诱导。研究表明,当向单增李斯特菌(Listeria monocytogenes)的培养基中加入3%的NaCl后,冷激蛋白Csp A的表达量会显著升高,相对表达量达到对照组的2.8倍[27]。然而,车帅等[17]对冷激蛋白Csp2039在m RNA水平在盐度胁迫下的研究中发现,高盐(90,120)显著抑制冷激蛋白基因Csp 2039的表达,这可能与Csp 2039基因的5'-UTR中不存在AT-rich UP element有关[20]。
在自然条件下,Psychrobacter sp.G通常需要同时面对多种环境压力,如温度变化通常伴随着盐度变化[28],因此本文对温/盐协同胁迫下假定蛋白基因PSYCG_10180的表达情况也进行了分析。结果表明,温/盐协同胁迫对该假定基因在m RNA水平和翻译水平的表达的影响也并不完全一致。在m RNA水平上,该基因的表达在2 h除被(30℃,15)抑制外,可被其他条件所诱导,尤其是在低温低盐(0℃,15)条件下。在蛋白水平上,该假定蛋白的表达除被在2 h时被高温低盐(30℃,15)诱导以外,其余条件下均被抑制。
通过对基因PSYCG_10180在不同温度、盐度以及温度/盐度胁迫条件下的表达特征研究表明,在m RNA水平上,温度和盐度分别胁迫时,温度对PSYCG_10180基因的诱导表达明显高于盐度对基因的诱导增加倍数,在温度/盐度协同胁迫时,低温占据了主导作用;而在蛋白水平上,温度和盐度分别胁迫时,温度对PSYCG_10180蛋白表达的影响作用稍高于盐度,在温度/盐度协同胁迫时,盐度占据了主导作用,温度对其影响较小。
对表达假定蛋白PSYCG_10180的宿主菌E.coli BL21进行的反复冻融实验表明,表达假定蛋白PSYCG_10180的重组菌的存活率远远高于仅含p ET22b的重组菌;在反复冻融3次以后,其存活率约为对照组p ET22b重组菌的15倍。此结果说明,假定蛋白PSYCG_10180的异源表达提高了宿主菌E.coli BL21的抗冻融能力。Jung等[21]对含有冷激蛋白Csp Apa的宿主大肠杆菌进行的反复冻融实验也表明,过量表达冷激蛋白Csp Apa使宿主大肠杆菌的耐寒能力增强了10倍以上。此结果表明假定蛋白PSYCG_10180具有冷激蛋白可提高宿主菌细胞抗冻融活性的类似特性。
4 结 论
根据南极适冷菌Psychrobacter sp.G的基因组完成图,通过设计特异性引物对假定蛋白基因PSYCG_10180进行了克隆,对其进行序列分析,研究了该基因在m RNA水平和蛋白水平上对温度/盐度胁迫的响应,并对假定蛋白PSYCG_10180的宿主大肠杆菌进行了冻融试验,得出以下结论:
1)通过克隆得到假定蛋白基因PSYCG_10180的全长基因进行序列分析得到-10、-35、TSS、RBS等调控区域以及起始密码子ATG下游10 bp处长14 bp的下游框。系统发育分析表明,与假定蛋白PSYCG_10180相似性最高的为Psychrobacter cryohalolentis的假定蛋白(WP_041753194.1),相似性可达97%;与其相似性最高的已知功能的蛋白为Psychrobacter sp.PRwf-1的蓝光传感蛋白(WP_010201745.1),相似性仅有37%。
2)温度胁迫对基因PSYCG_10180在mRNA水平和蛋白水平表达的影响存在着明显差异:在m RNA水平上,低温(0℃)使基因PSYCG_10180的表达先被诱导然后被抑制,这表明该基因具有冷激蛋白基因对温度胁迫应答的典型特征;而在蛋白水平上,假定蛋白PSYCG_10180无论温度高低,其表达均先被抑制后诱导;盐度胁迫对基因PSYCG_10180在m RNA水平和蛋白水平上表达的影响也存在着明显差异:在m RNA水平上,该基因在6 h被诱导,其余时间(2,12 h)被抑制;在蛋白水平上,该基因在6 h被抑制,其余时间内(2,12 h)除在2 h的高盐度(90)外,该假定蛋白的表达均受到诱导。温度/盐度协同胁迫下,在m RNA水平和蛋白水平上,该基因的表达同时受温度和盐度影响。
3)通过异源表达假定蛋白PSYCG_10180,其宿主大肠杆菌的抗冻融能力得到明显提高。
[1] BORK P.Powers and pitfalls in sequence analysis:the 70%hurdle[J].Genome Research,2000,10(10):398-400.
[2] GALPERIN M Y,KOONIN E V.‘Conserved hypothetical’proteins:prioritization of targets for experimental study[J].Nucleic Acids Research,2004,32(18):5452-5463.
[3] RAJADURAI C P,SUBAZINI T K,KUMAR G R.An integrated re-annotation approach for functional predictions of hypothetical proteins in microbial genomes[J].Current Bioinformatics,2011,6(4):45-461.
[4] MAZANDU G K,MULDER N J.Scoring protein relationships in functional interaction networks predicted from sequence data[J].Plos One,2011,6(4):e18607.
[5] ENAULT F,SUHRE K,CLAVERIE J M.Phydbac“gene function predictor”:a gene annotation tool based on genomic context analysis[J].BMC Bioinformatics,2005,6(1):247.
[6] ROBERTS R J.Identifying protein function-a call for community action[J].PLoS Biology,2004,2(3):293-294.
[7] CHE S,SONG L,SONG W Z,et al.Complete genome sequence of Antarctic bacterium Psychrobacter sp.strain G[J].Genome Announcements.2013,1(5):e00725-13.
[8] WATKINS J.Predicting the function of a putative uncharacterized hypothetical protein from Leishmania major[J].Internet Journal of Genomics&Proteomics.2012,6(2):1-5.
[9] MAO S J,KLUGE K,SQUILLACE SJ,et al.Functional insight into putative conserved proteins of Rickettsia rickettsii and their vibrulence characterization[J].Current Proteomics,2015,132(2):289-292.
[10] OANY A R,AHMAD S A,KIBRIA K K,et al.A hypothetical protein of Alteromonas macleodii AltDE1(amad1_06475)predicted to be a cold-shock protein with RNA chaperone activity[J].Gene Regulation&Systems Biology,2013,8(8):141-147.
[11] RETIEF J D.Phylogenetic analysis using PHYLIP[J].Methods in Molecular Biology,2000,132(132):243-258.
[12] HALL B G.Comparison of the accuracies of several phylogenetic methods using protein and DNA sequences[J].Molecular Biology and Evolution,2005,22(3):792-802.
[13] PAGE R D.Tree View:an application to display phylogenetic trees on personal computers[J].Bioinformatics,1996,12(4):357-358.
[14] CHOI J H,JUNG H Y,KIM H S,et al.PhyloDraw:a phylogenetic tree drawing system[J].Bioinformatics,2000,16(11):1056-1058.
[15] KANAYAMA Y,MIZUTANI R,YAGUCHI S,et al.Characterization of an uncharacterized aldo-keto reductase gene from peach and its role in abiotic stress tolerance[J].Phytochemistry,2014,104(3):30-36.
[16] RAJNISH K N,KISHORE CHOUDHARY G M,GUNASEKARAN P.Functional chara cterization of a putative endoglucanase gene in the genome of Zymomonas mobilis[J].Biotechnology Letters,2008,30(8):1461-1467.
[17] CHE S.Trancriptomic analysis of the Antarctic psychrotrophic bacterium Psychrobacter sp.G and expression characteristics of heat shock protein gene(Hsp 845)/cold shock protein gene(Csp 2039)[D].Qingdao:The First Institute of Oceanography,2014.车帅.南极适冷菌Psychrobacter sp.G的转录组学研究与热激蛋白基因Hsp 845/冷激蛋白基因的Csp 2039表达分析[D].青岛:国家海洋局第一海洋研究所,2014.
[18] PANICKER G,MOJIB N,NAKATSUJI T,et al.Occurrence and distribution of cap B in Antarctic microorganisms and study of its structure and regulation in the Antarctic biodegradative Pseudomonas sp.30/3[J].Extremophiles,2010,14(2):171-183.
[19] LI Y,CHE S,WANG Z,et al.Expression characteristics of cold shock protein gene Csp 2039 of the Antarctic psychrotrophic bacterium Psychrobacter sp.G[J].Advances in Marine Science,2016,34(1):85-94.李阳,车帅,王桢,等.南极适冷菌Psychrobacter sp.G冷激蛋白基因Csp 2039的表达分析[J].海洋科学进展,2016,34(1):85-94.
[20] SONG W Z,LIN X Z,HUANG X H.Characterization and expression analysis of three cold shock protein(CSP)genes under different stress conditions in the Antarctic bacterium Psychrobacter sp.G[J].Polar Biology,2012,35(10):1515-1524.
[21] CHE S,SONG W Z,LIN X Z.Response of heat-shock protein(HSP)genes to temperature and salinity stress in the Antarctic psychrotrophic bacterium Psychrobacter sp.G[J].Current Microbiology,2013,67(5):601-608.
[22] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCT method[J].Methods,2001,25(4):402-408.
[23] JUNG Y H,YI J Y,LEE Y K,et al.Overexpression of cold shock protein a of Psychromonas arctica KOPRI 22215 confers cold-resistance[J].The Protein Journal,2010,29(2):136-142.
[24] MITTA M,FANG L,INOUYE M.Deletion analysis of csp A of Escherichia coli:requirement of the AT-rich UP element for csp A transcription and the downstream box in the coding region for its cold shock induction[J].Molecular Microbiology,1997,26(2):321-335.
[25] ETCHEGARAY J P,JONES P G,INOUYE M.Differential thermoregulation of two highly homologous cold-shock genes,csp A and csp B,of Escherichia coli[J].Genes to Cells,1996,1(2):171-178.
[26] GOLDSTEIN J,POLLITT N S,INOUYE M.Major cold shock protein of Escherichia coli.[J].Proceedings of the National Academy of Sciences of the United States of America,1990,87(1):283-287.
[27] SCHMID B,KLUMPP J,RAIMANN E,et al.Role of cold shock proteins in growth of Listeria monocytogenes under cold and osmotic stress conditions[J].Applied&Environmental Microbiology,2009,75(6):1621-1627.
[28] THOMAS D N,DIECKMANN G S.Antarctic Sea ice-a habitat for extremophiles[J].Science,2002,295(5555):641-644.
Analysis of the Response of Hypothetical Protein Gene PSYCG_10180 to Temperature and Salinity Stress in the Antarctic Psychrotrophic Bacterium Psychrobacter sp.G
ZHANG Liang1,2,LI Yang1,2,ZHANG Zheng1,2,LIN Xue-zheng1,2
(1.The First Institute of Oceanography,SOA,Qingdao 266061,China;2.Key Lab of Marine Bioactive Substances,SOA,Qingdao 266061,China)
According to the complete genome sequence,a hypothetical protein gene PSYCG_10180 was cloned from the Antarctic psychrotrophic bacterium Psychrobacter sp.G and it sequences was analyzed.The expression characteristics of gene PSYCG_10180 under different temperature and salinity stresses were investigated by quantitative real-time PCR(qRT-PCR)and western blotting.Sequence analysis showed that the proteins with relatively high similarity to PSYCG_10180 were unknown proteins,and the highest similarity of the known functional proteins(blue light sensor protein,WP_010201745.1)was only 37%.At the mRNA level,the expression of hypothetical gene PSYCG_10180 was induced by low temperature(0℃);under different salinity stresses,the expression was inhibited at 2 h and 12 h;in the combined stress treatment,the expression was induced by low temperature at 2 h,and it was inhibited by high temperature,low salinity(30℃,15).At the protein level,the expression level had little changes at 2 h,and it was induced at 12 h upon temperature stress investigated;in the combined stress treatment,the expression was inhibited except induced at 2 h by high temperature and low salinity(30℃,15).Comparative analysis showed that,at the m RNA level,the expression of gene PSYCG_10180 was more sensitive to high temperature;at the protein level,the expression of hypothetical protein PSYCG_10180 was more sensitive to high salinity;in the combined stress treatment,the effect of salinity was dominative.Freezing and thawing test showed that the survival rate of the recombinant strain expressing the hypothetical protein was significantly enhanced compared with the control group.The study indicates that hypothetical protein PSYCG_10180 may play an important role in environmental adaptability of Psychrobacter sp.G.
Psychrobacter;PSYCG_10180;Stress expression;q RT-PCR;western blotting
February 21,2017
Q751
A
1671-6647(2017)04-0547-12
10.3969/j.issn.1671-6647.2017.04.011
2017-02-21
国家自然科学基金项目——南极适冷菌Psychrobacter sp.G温度与盐度胁迫下基因表达谱分析及冷/热激基因应答机制研究(41176174);南北极环境综合考察与评估专项——北极海域海洋生物和生态考察(CHINARE2016-03-05)和北极微生物资源多样性与功能评估(CHINARE2016-04-03)
张 良(1990-),男,山东潍坊人,硕士研究生,主要从事极地微生物学方面研究.E-mail:1172627930@qq.com
*通讯作者:林学政(1971-),男,山东栖霞人,研究员,博士,主要从事海洋极端环境微生物学方面研究.E-mail:linxz@fio.org.cn
(王佳实 编辑)
