TritonX-100对液体深层发酵桦褐孔菌产活性多糖的影响
2017-11-14,,
,,
(浙江理工大学理学院,杭州 310018)
TritonX-100对液体深层发酵桦褐孔菌产活性多糖的影响
陈翠,全丽丽,徐向群
(浙江理工大学理学院,杭州 310018)
探讨表面活性剂TritonX-100对桦褐孔菌液体深层发酵产活性多糖的影响,利用醇沉法得到胞外多糖和胞内多糖,通过测定菌丝体量和胞内外多糖产量,明确TritonX-100对多糖的促进作用。进一步探讨TritonX-100的最佳添加时间及浓度,得出在第0 d添加0.1% TritonX-100,促进效果最显著。多糖的DPPH自由基清除率测定结果表明,TritonX-100也促进桦褐孔菌多糖的抗氧化活性。通过对多糖化学成分以及单糖组成的分析,证明多糖中的糖、蛋白含量及单糖的组成与DPPH自由基清除率具有一定关联性。以上结果为进一步深入研究桦褐孔菌多糖奠定理论基础,从而建立一种桦褐孔菌发酵多糖的高产、高活性的液体深层发酵制备技术。
桦褐孔菌;多糖;TritonX-100;抗氧化活性
0 引 言
桦褐孔菌(Inonotusobliquus)作为一种珍贵食药兼用真菌,具有很高药用价值,在俄罗斯、波兰和芬兰等地应用广泛,民间常用桦褐孔菌的菌核来防治癌症[1]。桦褐孔菌多糖是桦褐孔菌中主要化学成分,具有降血糖、抗肿瘤、抗氧化等生物活性,对糖尿病有很好的治疗作用,已成为当前的研究热点之一[2-3]。桦褐孔菌的生长环境苛刻,野生资源稀少,人工培育技术还不成熟。通过液体深层发酵技术大规模培养,既可缩短桦褐孔菌生长周期,也能提高多糖产量[4]。
为了提高多糖的产量,可对桦褐孔菌的液体深层发酵的条件进行优化,或不断对培养基中的氮源、碳源进行改进[5-6]。表面活性剂Tween80能够改变菌丝体细胞膜的通透性,促进对发酵液中营养物质的吸收利用,从而提高多糖的产量[7]。本文首次研究表面活性剂TritonX-100对桦褐孔菌液体深层发酵胞外多糖(exopolysaccharide, EPS),胞内多糖(intrecellular polysaccharide,IPS)IPS1和IPS2积累和活性的影响。通过测定胞内外多糖的产量和菌丝体生物量,并对TritonX-100的添加浓度及时间进行优化,以期达到最佳促进作用。
1 材料和方法
1.1 实验材料
1.1.1 原始菌种
用于液体深层发酵的桦褐孔菌的原始菌种购自于徐州师范大学。
1.1.2 主要试剂
TritonX-100,天津永大化学试剂有限公司;α-淀粉酶,北京奥伯丁生物技术有限公司;蛋白胨,杭州百思生物技术有限公司;糖化酶,北京奥伯丁生物技术有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),Sigma公司;其他试剂均为国产分析纯。
1.2 实验方法
1.2.1 胞外多糖(EPS)的提取
首先采用布氏漏斗抽滤液体深层发酵液得到滤液,真空浓缩滤液至20 mL,再加入4倍体积95%的乙醇补齐至100 mL,搅拌均匀,在4 ℃条件下沉淀过夜。倾倒出上层液体保留沉淀,加入95%乙醇,然后离心(6500 r/min,10 min),最后冷冻干燥4~5 h,即得EPS。
1.2.2 胞内多糖(IPS)的提取
称取1 g干燥菌丝体并研成粉末后,在离心管中按体积比1∶5加入粉末和去离子水,超声破壁5 min(超声时间5 s,间歇时间3 s),95 ℃水浴加热2 h,冷却后离心(6500 r/min,10 min),收集上清液,向离心管中加入去离子水,重复上述操作,合并两次上清液,定容至50 mL。收集两次操作剩余的沉淀,加少量去离子水,在水浴锅中控制温度为121 ℃加热时间1.5 h,冷却后离心(6500 r/min,10 min),保留上清液定容至50.0 mL。分别取0.1 mL上述两种溶液加入去离子水补齐至1.0 mL,采用真空浓缩滤液至20.0 mL后,再加入4倍体积95%乙醇至100 mL,玻璃棒充分搅拌,在温度4 ℃下沉淀时间24 h,然后离心(6500 r/min,10 min)、冷冻干燥得胞内多糖。上述操作分别得到两种胞内多糖,95 ℃条件下的IPS1,121 ℃条件下的IPS2。
1.2.3 菌丝体生物量的测定
从摇床中随机取出摇瓶,进行抽滤操作,用去离子水反复冲洗菌丝体,直至最后冲洗液呈无色;然后将漏斗中的菌丝体放到表面皿中,置于烘箱中恒温(60 ℃)干燥至恒重;最后,采用电子天平称重干燥后的菌丝体。
1.2.4 DPPH自由基清除率的测定
本文采用Xu等[8]的方法来测定多糖样品的DPPH自由基清除活性,操作步骤为:配制不同浓度的多糖样品溶液,在试管中加入0.8 mL的DPPH溶液(0.4 mmol/L),加入2.4 mL多糖溶液,充分振荡摇匀,在暗室中静置30 min;在517 nm下有最大吸收,测定吸光度值OD1。用0.8 mL甲醇溶液代替DPPH溶液,重复上述操作,测定吸光度值OD2。对照组采用0.8 mL的甲醇溶液与2.4 mL的DPPH溶液反应,测定吸光度值OD0。计算方程式为:
1.2.5 化学组成的分析
多糖样品的蛋白含量采用BCA蛋白定量试剂盒进行,根据牛血清蛋白标准曲线,在562 nm下测定。多糖样品含量的测定通常采用苯酚-硫酸法[9],根据葡萄糖标准曲线,在490 nm下测定;采用气相色谱GC分析多糖样品中单糖的组成[10]。
2 结果与讨论
2.1 TritonX-100对多糖产量及菌丝体生物量的影响
在桦褐孔菌菌种发酵培养初期的摇瓶中加入0.1%(V/V)TritonX-100,经过9 d时间的发酵培养,测定最终菌丝体的生物量及胞内外多糖的产量来判断桦褐孔菌的生长情况。TritonX-100对桦褐孔菌菌丝体生物量、胞内外多糖量的影响见图1。TritonX-100对菌丝体生长起到抑制作用,对胞外多糖的产生起到促进作用,促进率为42.86%(p<0.05);TritonX-100同时促进IPS1和IPS2的产生,促进率分别为6.08%和12.29%(p<0.05),其可能机理为:TritonX-100作为表面活性剂,通过抑制细胞膜磷脂双分子层的合成,增大细胞膜通透性,从而分泌出更多的多糖,同时还具有加强供氧运输能力来增加次级代谢产物的积累[11];在桦褐孔菌液体深层发酵过程中,摇瓶中的发酵环境逐渐发生变化,氧气的减少,厌氧细菌的产生等都不利于桦褐孔菌生长,从而抑制菌丝体的生物量[12]。
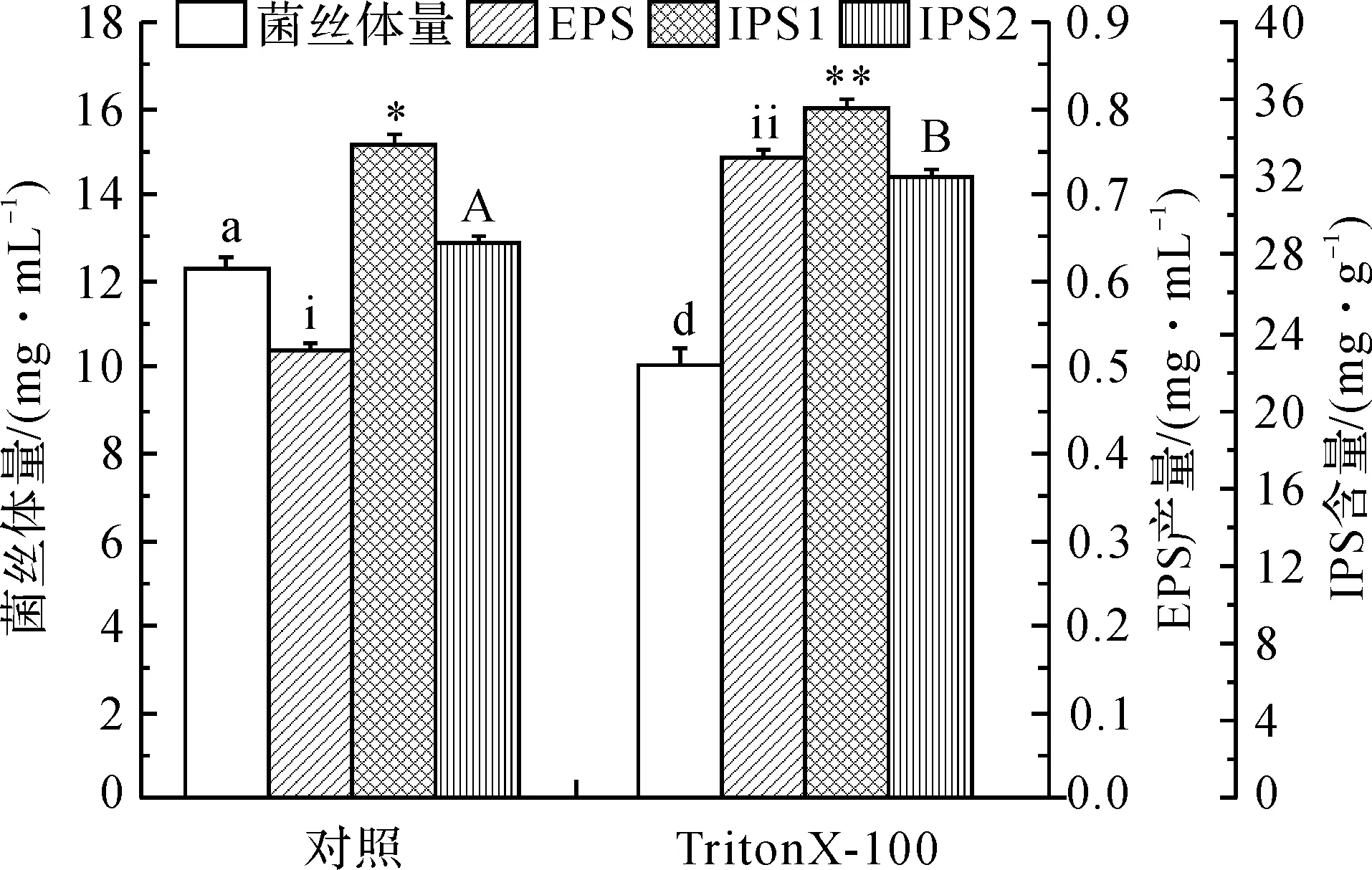
图1 TritonX-100对桦褐孔菌菌丝体生物量及胞内外多糖量的影响注:不同字母表明数据之间有显著性差异,相同字母代表差别不显著(p<0.05)。
2.2 最佳添加时间和浓度的确定
TritonX-100不同添加时间对菌丝体生物量和胞内外多糖的影响见表1,观察表1得出,桦褐孔菌的生长情况随着TritonX-100的不同添加时间而改变,在后期添加的TritonX-100,菌丝体的生物量大于前期,生长情况较好。当添加时间定为第1 d的时候,EPS产量达到最高,与对照相比提高53.85%。IPS1添加时间为第0 d时,促进率为9.45%,促进作用最明显。IPS2在第0 d的促进率为11.17%,促进作用也最明显(p<0.05)。

表1 TritonX-100不同添加时间对菌丝体生物量和胞内外多糖的影响
注:同一列中相同字母代表差别不显著,不同字母表明数据之间有显著性差异(p<0.05)
不同浓度TritonX-100对菌丝体生物量和胞内外多糖的影响测定结果如表2所示,菌丝体生物量随着TritonX-100浓度增加而减少,TritonX-100的浓度为0.1%(V/V),对EPS和IPS1的产量促进作用最明显,促进率分别为50.00%和9.45%(p<0.05)。添加浓度为0.05%,IPS2有最高产量,达到33.83 mg/g,增长率为27.34%(p<0.05)。因此在第0d添加0.1%的TritonX-100,对胞内外多糖的促进效果最好。

表2 TritonX-100不同添加浓度对菌丝体生物量和胞内外多糖的影响
注:同一列中相同字母代表差别不显著,不同字母表明数据之间有显著性差异(p<0.05)
2.3 多糖的抗氧化活性分析
图2是来源于对照培养基、TritonX-100培养基的胞内外多糖对DPPH自由基的清除率,多糖浓度梯度为0.5~5.0 mg/mL。从图2中发现,TritonX-100-EPS的DPPH清除率高于对照。当多糖浓度为2 mg/mL时,TritonX-100-EPS的清除率接近对照;当浓度为5 mg/mL,TritonX-100-EPS清除率达到最高,与对照-EPS相接近。低浓度时,对照培养基来源的IPS1的DPPH清除率高于TritonX-100-IPS1。相反,TritonX-100-IPS2的清除率整体显著高于对照,浓度高于4 mg/mL,与对照的差异减小;浓度为5 mg/mL,TritonX-100-EPS清除率达到最高,与对照-EPS相接近。
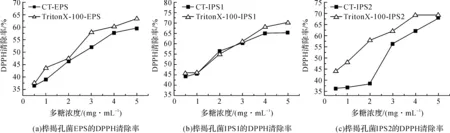
图2 不同来源桦褐孔菌胞外多糖(EPS)、胞内多糖(IPS1、IPS2)的DPPH清除率注:来源于对照培养基、TritonX-100培养基的桦褐孔菌胞内外多糖分别表示为CT-IPS1、CT-IPS2、CT-EPS、TritonX-100-IPS1、TritonX-100-IPS2、TritonX-100-EPS。
表3是来源于对照、TritonX-100培养基的胞内外多糖的对DPPH自由基清除率的半数抑制浓度(IC50),结果显示:IPS比EPS具有较小的IC50,说明胞内多糖的抗氧化活性要高于胞外多糖;添加有TritonX-100培养基的多糖的IC50比对照组低,TritonX-100有增强多糖DPPH清除率的作用。因此,TritonX-100添加可能使多糖的结构或化学成分发生改变。

表3 不同来源的桦褐孔菌多糖的半抑制浓度
注:同一列中相同字母代表差别不显著,不同字母表明数据之间有显著性差异(p<0.05)
2.4 多糖的化学成分及单糖组成分析
自然界中的多糖大多结合游离蛋白,不易除去,本文采用BCA试剂盒法测定醇沉法得到的多糖中的蛋白含量。大部分真菌多糖的结构极其复杂,为了进一步探讨的多糖的初级结构,采用气相色谱法测定单糖的组成。表4为不同来源桦褐孔菌EPS、IPS1、IPS2、蛋白含量及单糖组成的实验结果。从表4中得出,TritonX-100-EPS中糖含量显著高于对照-EPS,蛋白含量相近。TritonX-100-IPS1蛋白含量低于对照-IPS1,糖含量则较低。TritonX-100-IPS2的糖含量高于对照-IPS2,比例均很高。对照组的胞内外多糖的糖含量均低于TritonX-100培养基来源的多糖,蛋白含量则略低。另外,胞内多糖与胞外多糖相比较,蛋白含量更低,糖含量更高。单糖组成分析中,其中葡萄糖、甘露糖和半乳糖共占60%以上。TritonX-100-IPS1拥有最高含量的半乳糖,为40.8%,TritonX-100-IPS2有最高含量的甘露糖,达到34.2%。部分真菌多糖提取出来之后以糖蛋白的形式存在,多糖中蛋白质的含量与抗氧化活性具有一定关系,蛋白质含量越高,多糖的DPPH清除活性也高[13]。Quan等[4]发现在多糖组成中,较高的糖含量对多糖的生物活性是有提高作用的,有更低的IC50值。多糖的DPPH清除率及IC50结果保持一致,因此多糖的化学成分与抗氧化活性具有一定关联。

表4 不同来源桦褐孔菌多糖的化学成分和单糖组成
注:-表示未发现。同一栏中相同字母表明数据之间差别不显著(p<0.05)。来源于对照培养基、TritonX-100培养基的桦褐孔菌胞内外多糖表示为CT-IPS1、CT-IPS2、CT-EPS、TritonX-100-IPS1、TritonX-100-IPS2、TritonX-100-EPS。
3 结 论
表面活性剂TritonX-100作为一种新的多糖生物合成的调控方法,不仅提高了多糖的产量、抗氧化活性,同时,TritonX-100的添加对多糖的结构也产生一定影响。因此,添加TritonX-100是一种获得高产量和高抗氧化活性多糖的有效途径,真菌多糖作为一种珍贵稀有的物质,为其大规模生产多糖提供可能性。本文仅对多糖的初级结构进行研究,还需要将多糖进行分离纯化,采用NMR、FTIR分析确定多糖的高级结构以及多糖中单糖的连接方式和糖苷键的构型。
[1] SONG Y, HUI J, KOU W, et al. Identification ofInonotusobliquusand analysis of antioxidation and antitumor activities of polysaccharides[J]. Current Microbiology,2008,57(5):454-462.
[2] DU X, MU H M, ZHOU S, et al. Chemical analysis and antioxidant activity of polysaccharides extracted fromInonotusobliquussclerotia[J]. International Journal of Biological Macromolecules,2013,62(12),691-696.
[3] ZHENG W, MIAO K, LIU Y, et al. Chemical diversity of biologically active metabolites in the sclerotia ofInonotusobliquusand submerged culture strategies for up-regulating their production[J]. Applied Microbiology and Biotechnology,2010,87(4):1237-1254.
[4] XU X, QUAN L, SHEN M. Effect of chemicals on production, composition and antioxidant activity of polysaccharides ofInonotusobliquus[J]. International Journal of Biological Macromolecules,2015,77(3):143-150.
[5] CHEN H, XU X Q, ZHU Y. Optimization of hydroxyl radical scavenging activity of exo-polysaccharides fromInonotusobliquusin submerged fermentation using response surface methodology[J]. Journal of Microbiology and Biotechnology,2010,20(4):835-843.
[6] MALINOWSKA E, KRZYCKOWSKI W, LAPIENIS G, et al. Improved simultaneous production of mycelial biomass and polysaccharides by submerged culture ofHericiumerinaceumoptimization using a central composite rotatable design (CCRD)[J]. Journal of Industrial of Microbioloy and Biotechnology,2009,36(12):1513-1527.
[7] ZHANG B B, CHEUNG P C K. A mechanistic study of the enhancing effect of Tween 80 on the mycelial growth and exopolysaccharide production by Pleurotus tuber-regium[J]. Bioresource Technology,2011,102(17):8323-8326.
[8] XU X, HU Y, QUAN L. Production of bioactive polysaccharides byInonotusobliquusunder submerged fermentation supplemented with lignocellulosic biomass and their antioxidant activity[J]. Bioprocess and Biosystems Engineering,2014,37(12):2483-2492.
[9] CHEN H, ZHANG M, QU Z, et al. Antioxidant activities of different fractions of polysaccharide conjugates from green tea (CamelliaSinensis)[J]. Food Chemistry,2008,106(2):559-563.
[10] MAN B, CHIDEWE C. Some properties of polysaccharide preparation that is isolated from the fruit ofCordiaabyssinica[J]. Food Chemistry,2002,76(3):343-347.
[11] PARK J P, KIM S W, HWANG H J, et al. Stimulatory effect of plant oils and fatty acids on the exo-biopolymer production inCordycepsmilitaris[J]. Enzyme and Microbial Technology,2002,31(3):250-255.
[12] CAI Y J, LIAO X R, LIANG X H, et al. Induction of hypocrellin production by TritonX-100 under submerged fermentation with Shiraia sp. SUPER-H168[J]. New Biotechnology,2011,28(6):588-592.
[13] POHONG L, ZHAO S, KWOKPING H, et al. Chemical properties and antioxidant activity of exopolysaccharides from mycelial culture ofCordycepssinensisfungus Cs-HK1[J]. Food Chemistry,2009,114(4):1251-1256.
EffectofTritonX-100ontheProductionofActivePolysaccharidesofInonotusObliquusunderSubmergedLiquidFermentation
CHENCui,QUANLili,XUXiangqun
(School of Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, China)
This study aims to discuss the effect of surfactant TritonX-100 on the production of active polysaccharides produced fromInonotusobliquusunder submerged liquid fermentation. Extracellular polysaccharide(EPS) and intracellular polysaccharide (IPS1, IPS2) were obtained with the alcohol precipitation method, and the promoting effect of TritonX-100 on polysaccharide was determined by measuring the mycelium quantity and yield of extracellular and intracellular polysaccharides. The best time and concentration for adding TritonX-100 were further studied. It is found that the promoting effect is most significant by adding 0.1% TritonX-100 on Day 0. The measurement result of DPPH free radical clearance ratio of polysaccharide indicates that TritonX-100 also can promote the antioxidant activity ofI.obliquuspolysaccharide. The analysis of polysaccharide chemical components and monosaccharide composition indicates that the saccharide, protein content and monosaccharide composition of polysaccharide have certain relevance to DPPH free radical clearance ratio. The conclusions presented above lay a theoretical foundation for further study oninonotusobliquuspolysaccharide, based on which a submerged liquid fermentation technology ofinonotusobliquuspolysaccharide of high yield and high activity can be developed.
Inonotusobliquus; polysaccharide; TritonX-100; antioxidant activity
10.3969/j.issn.1673-3851.2017.11.021
2016-04-18 网络出版日期: 2017-08-07
浙江省自然科学基金项目(LY16B020013)
陈 翠(1993-),女,安徽六安人,硕士研究生,主要从事生物技术和生物分析化学方面的研究。
徐向群,E-mail:xuxiangqun@zstu.edu.cn
Q538
A
1673- 3851 (2017) 06- 0888- 05
(责任编辑:唐志荣)
