生物材料的3D打印研究进展
2017-11-13钰方
, , , 钰方
(上海理工大学 材料科学与工程学院,上海 200093)
生物材料的3D打印研究进展
朱敏,黄婷,杜晓宇,朱钰方
(上海理工大学 材料科学与工程学院,上海200093)
在生物医药领域,通过对生物材料或活细胞进行3D打印,可构建复杂生物三维结构如个性化植入体、可再生人工骨、体外细胞三维结构体、人工器官等,因而基于生物3D打印在个性化定制及复杂结构调控制造上的独特优势,综述了生物3D打印技术的基本工艺、应用领域与研究进展.重点针对3D打印生物材料这一研究热点,全面讨论了喷墨打印和注射挤出打印两种路径,分析总结了3D打印相关生物材料并应用于体外模型、医疗器械和植入体的制造以及可降解组织支架、细胞三维结构体的构建,最后对该技术未来发展趋势和研究重点提出展望.
生物材料;3D打印; 生物医学应用; 研究进展
1 生物3D打印技术概述
3D打印技术(three-dimensional printing,3DP),又名快速成型、实体自由成型、增材制造等,是基于离散-堆积原理,在计算机辅助下通过层层堆积形成三维实体的有别于传统减材制造的先进制造方法[1-2].因高精度、个性化制造及复杂形状构建上的独特显著优势,3D打印渗入了各行各业并引领创新,引发全球制造业产生革命性变革[3-6].
在生物医药领域,3D打印技术通过对生物材料或活细胞进行3D打印,可构建复杂生物三维结构如个性化植入体、可再生人工骨、体外细胞三维结构体、人工器官等[7-9].以3D打印技术为基础的组织工程支架和器官打印技术的发展[6]是目前3D打印技术研究的最前沿领域,也是3D打印技术中最具活力和发展前景的方向之一.当前以组织器官修复与重建为目的,国际上开发了各种生物3D打印技术,包括用于组织工程支架构建的熔融挤出技术、基于喷墨技术的细胞打印、细胞和细菌的激光直写以及T细胞和细菌的微接触印刷等[6-10].
生物3D打印涵盖的内容十分广泛[11],根据打印材料的不同可将其划分为4个层次的应用:
a. 个性化体外模型制造.材料为无需生物相容性和降解性的工程材料,主要为手术规划、假肢设计、测试标准等制造体外的模型[12-13].
b. 个性化植入体制造材料.为具有良好生物相容性且不易降解的生物材料,如钛合金[14]、聚氨酯类聚合物[15-16]等,用于制造人工假肢植入物、组织缺损部位支撑和替代,以及整形外科.
c. 可降解组织工程支架制造.针对组织工程应用,要求材料既具有良好的生物相容性又有匹配的降解性能,避免自体或异体组织移植中的问题.以支架模拟细胞外基质,相应细胞在支架上经体外培养后植入体内,诱导组织再生与修复[17-18].
d. 细胞三维结构体的人工构建.材料为活细胞及其外基质材料,如肝细胞-明胶、干细胞-胶原等,用于构建三维细胞结构体、体外三维细胞模型及组织或器官胚体等[19-22].
这4个层次的生物3D打印对生物医学领域的基础研究、药物筛选和临床应用都具有重要的促进作用.
通常,生物3D打印的实施包含3个步骤:(影像)数据获取与三维模型设计、打印墨水(材料和细胞)选择和组织构架的3D打印工艺.
1.1(影像)数据获取与三维模型设计
为实现打印组织或器官最终的功能性及复杂结构的精确复制,在打印之前采用医学影像检查方法收集组织结构和组成信息以构建打印模型是至关重要的.最常见的两种影像学手段是CT(计算机X射线断层成像)和MRI(磁共振成像).牙科领域为获得图像数据还会使用锥形束计算机断层扫描(CBCT).这3种技术均可获得二维截面的解剖信息,通过专业软件对系列截面的三维重构建模即可得3D打印机接受的STL格式图形文件,继而最终制造出生物产品三维实体[23].
近十多年来,欧美等发达国家科研机构对于医学图像三维重建技术的研究相当活跃,其技术水平正从后处理向实时跟踪和交互处理发展,并且已经将超级计算机、光纤高速网、高性能工作站和虚拟现实结合起来,代表着这一技术领域未来的发展方向.在市场应用领域,如表1所示,目前已有多个较为成熟的商品化三维医学影像处理系统.
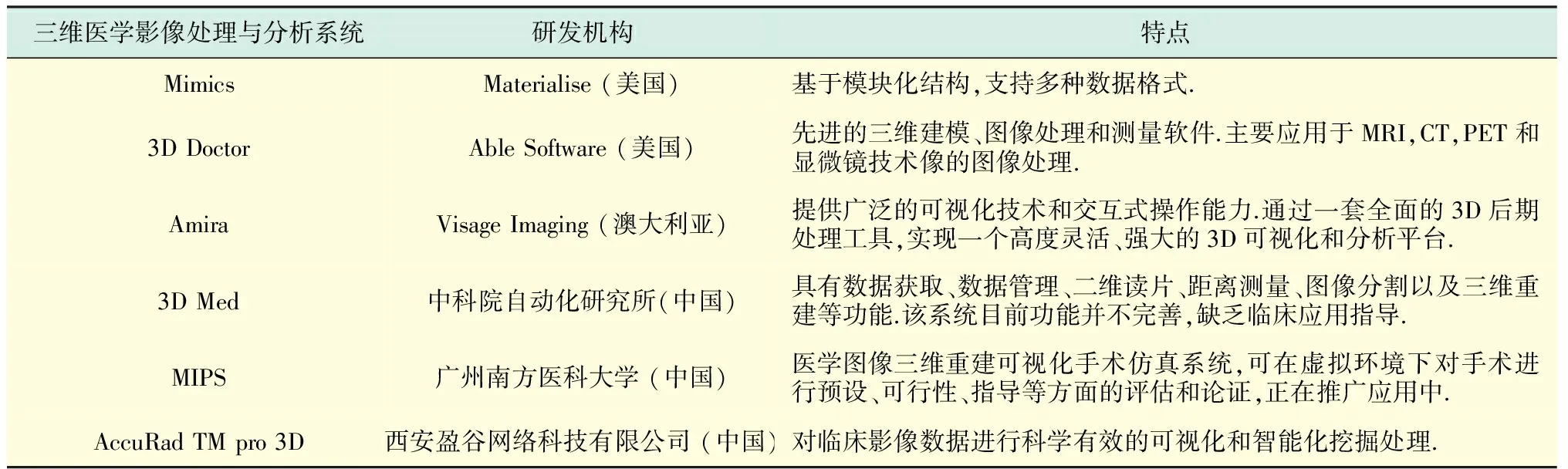
表1 常见商品化三维医学影像处理与分析系统[24]Tab.1 Common 3D medical image analysis and processing systems
1.2生物材料打印墨水的选择
基于生物应用指向的3D打印技术,其打印材料组成与其他领域3D打印材料相比具有更多特殊要求.例如,高温烧结、有机溶剂、紫外辐照和交联剂等条件在生物3D打印过程中往往须尽量避免[25].具体来说,根据应用目的须考虑以下要求:
a. 可打印性.材料的黏度、流变和凝胶化等性能直接影响到3D打印的可操作性,决定打印制品的空间和时间分辨率[26].
b. 生物相容性.包含生物安全性和生物功能性.材料不仅要求很低的毒性及不引起机体的任何不良反应,而且也要求材料在特定的应用中激发机体的相应功能[27].
c. 降解性.包括材料的降解速度可控性、与组织再生速度的匹配性、降解产物安全性、材料的溶胀和收缩特性等[28].
d. 结构与机械性能.3D打印的材料往往具有支撑细胞和组织三维结构的作用.针对特定的组织类型,从皮肤、肌肉、软骨到硬骨,材料打印后须具有不同的力学强度和微结构,尤其是材料的孔隙[29].
e. 仿生学特性.材料仿生学特性有利于刺激细胞响应.在生物材料中掺入生物活性组分可对内源或外源细胞的粘附、迁移、增殖及功能表达产生积极作用[30-31].另外,材料表面性质如化学基团的修饰、粗糙度、亲疏水性、微纳米结构等直接影响到细胞的铺展形状、分化过程、运动、取向、细胞骨架的组装,甚至是细胞内部的相关信号通路[32].
1.3生物材料3D打印工艺
用于生物材料,包括材料/细胞复合体材料的3D打印技术手段主要有两种类型:喷墨生物打印和注射式生物打印.两者在打印产品的表面分辨率、细胞存活率以及生物活性材料选用等方面具有不同特点[7],其工作原理和技术方法如图1所示.
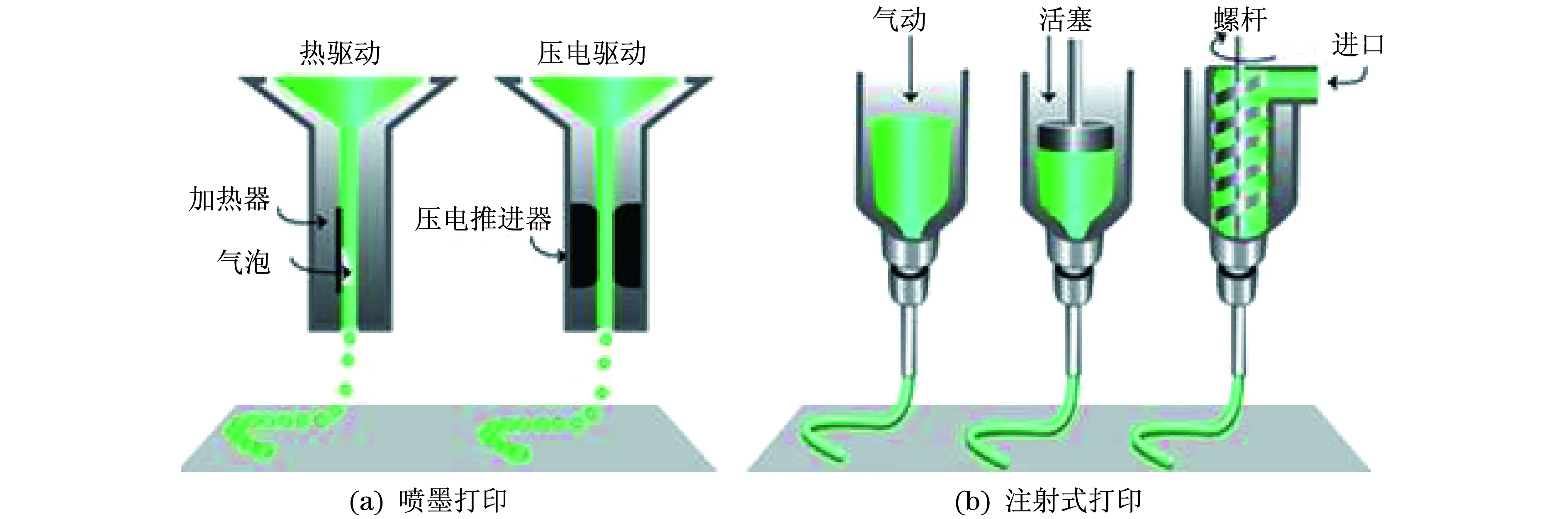
图1 “生物墨水”的3D打印技术方法 [7]Fig.1 Two strategies of 3D-printing “Bioinks”
喷墨式3D打印机是目前生物3D打印领域最常见的打印机类型,可实现连续和按需喷射.实际上,3D喷墨打印机是从传统的2D打印机发展而来,其原理差别不大,只是利用生物材料替代打印墨水,利用一个可升降的平台替代纸张,是低成本和经济性的3D打印机.目前,多个研究团队正致力于研究开发能够实现高分辨率和高精确度的含细胞液滴的3D打印,打印液滴体积可控制在1~300 pl,每秒喷射速度可在1~10 000滴范围内调节,可以准确地打印成宽约50 μm的图案[33-35].
目前,喷墨式3D打印机挤出墨水的方式有热驱动和声驱动两种.热驱动式打印喷头通过局部电阻加热产生气泡,挤压喷头内液体获得液滴[36].这种热泡挤压打印喷头尽管使用范围较广,打印速度较快,但是其在液滴方向、均匀性和尺寸控制上表现得不尽如人意,且喷射过程中产生的热应力、喷头堵塞、细胞裸露等问题往往对打印产生不利影响.为克服以上问题,可通过压电器件的逆压电效应造成材料变形,使喷头内液体体积和压力发生变化而挤出液体.声驱动打印喷头以声波配合超声场来喷射液滴,挤压出的液滴大小和挤压速度可由超声强度、时间、脉冲等参数实现控制[37].喷墨式3D打印在挤出墨水时产生的剪切力容易对细胞造成损伤,而且要求挤出的材料必须是液态的形式,极大地限制其应用[38].因此,提高喷墨式3D打印细胞存活率及优化打印工艺仍然面临挑战.
与喷墨式生物3D打印相比,注射式生物3D打印直接采用压缩空气或通过压缩空气直线电动机推动的活塞将注射筒中的材料连续挤出,对于黏度较大的“生物墨水”的打印优势更为明显[33].目前已有文献报道的注射式3D打印材料种类相当丰富,黏度范围30~6×107mP·s,可同时涵盖打印所需的高强度支撑材料和低黏度含活细胞材料[39-43].注射式的喷头设计可处理高浓度的细胞悬浮液,具有构建高细胞浓度的组织和器官的潜能[44].含多种细胞的细胞团在被挤出沉积后得到的细胞团聚体,在一定程度上具有了类似细胞外基质材料的力学性能和功能,因而可作为自组装的单元在粘弹性能驱动下发生融合和自组装,形成3D结构[45].这种细胞团自组装打印技术对器官打印时内部血管网络的构建具有独到之处[46].
2 生物3D打印的应用领域
2.1诊断与手术规划
近年来,医学方面的3D打印技术发展主要在于继续发展医疗成像技术、开发虚拟外科手术规划工具、生产针对特殊患者的器械以及可以直接植入人体的金属植入物等. 3D打印的模型提供直观的、可触摸的信息,有效地提高诊断和手术水平,便于医生与患者之间的沟通,避免了可能的医患矛盾.国内外临床医学领域已有多例借助3D打印技术进行术前规划和模拟的事例.例如2015年,美国心血管外科医生通过3D打印精细还原一例“完全型肺静脉畸形引流”的心脏模型,成功实施一个细节清晰、过程复杂的矫正手术.
3D打印还可制作精准贴合的术中导航模板,主要应用在颅颈交界、上颈椎、上胸椎、脊柱侧弯、肿瘤等手术上[12].临床上因为这些区域较复杂,手术风险、难度大,通过3D打印导航模板来指导手术会大大增加其安全性[47-48].例如华山医院利用3D打印手部手术导板实现辅助舟状骨骨折精确经皮内固定手术.
2.2个性化体外模型制造
牙冠、内冠固定桥金属修复体以及可摘局部义齿的金属支架等,其形状精细、复杂,要求精度误差要控制在微米级.传统的金属修复体制作工序复杂,需要数次模型的浇筑、复制,尤其是蜡型的制作只能依赖于技工手工完成,效率和精度低[49].为解决上述问题,近年来出现了口腔金属修复体蜡型直接3D打印成形的方法.目前,加拿大Cynovad公司用于义齿修复体数据采集和蜡型制作的Pro50数字制造系统、美国Solidscape公司preXacto系列以及3D Systems公司ProJet系列三维蜡型打印机就是其中的佼佼者.用陶瓷材料替代金属进行3D打印制作口腔修复体是该领域的主流趋势,也是21世纪牙科修复的发展方向[50].3D打印陶瓷修复体所采用的陶瓷材料除目前临床常用的IPS Empress铸造陶瓷和氧化铝陶瓷外,氧化锆结构陶瓷材料因强度高、韧性好而被广泛研究.例如Ebert等[51]利用喷射喷头进行了氧化锆牙冠的直接喷墨打印成形,打印的成品陶瓷件的咬合面细节清晰,壁厚可小至100 μm,强度可高达1 200 MPa.当采用多喷头打印,还可以成形具有空腔结构的整个牙冠和支架.
基于3D打印技术的假肢制造也为截肢者和医生带来了全新的高度定制化.例如,Bespoke公司采用3D打印技术设计制造假肢,通过对患者“健康”的腿和他们目前假肢的扫描,并进行扫描数据建模以确定肢体能够保持身体对称,从而打印出与患者的身体和生活方式充分吻合并迎合审美的假肢[52].
2.3个性化植入体制造
目前,国内外已有报道开始临床使用的3D打印植入体仍多应用于硬组织和关节替代或修复.通常骨内植入物刚度过高会产生应力遮挡,自体骨与原松质骨得不到合适的力学刺激,从而引起植入物的松动;而刚度过低又会使植入物断裂,欠缺力学强度.利用3D打印技术能通过不同人的骨模量来制造个体化植入物,各种生物力学均与人体相近,因而具有广阔的应用前景和传统技术不可比拟的优势[48].更具体地来说,3D打印的人工骨在组成、形状、结构等方面可控,与病灶或缺损能够准确匹配,产生与人体组织相似的生物学特性,有效避免了并发症的出现,如植入物的沉降、塌陷甚至临近组织的退变[53].3D打印的人工骨可以制作丰富多变的孔隙结构,使得打印骨与自体骨通过孔隙牢固结合,大大缩短康复时间.北京三院的刘忠军等率先尝试了在颈椎、脊柱原发恶性肿瘤患者体内直接植入3D打印的人工椎体和人工骨骼,取得了不错的效果[54].该团队在2016年成功为一名骨科脊索瘤患者切除五节段脊椎肿瘤,并利用世界首个3D打印多节段胸腰椎植入物完成长达19 cm大跨度椎体重建手术.
从材料上来说,金属钛、生物陶瓷及其复合材料,尤其是功能性梯度材料都可以3D打印制作骨植入物.3D打印通过对多种材料的组合,对构成的局域要素(如组分的组成和分布、微结构、孔隙率、物性参数)的控制,乃至在多个特定方向上材料功能及特性的(准)连续性变化,可充分满足工件各部位不同的特性要求[25].例如,常见牙种植体要求由生物金属(Ti或不锈钢)和生物陶瓷(HA)组成,体部即下端100%金属,台部即上端100%陶瓷,而两者之间沿种植体垂直方向具有连续的梯度成分变化[55].3D打印个体化的钢板、钢钉等内固定物一直被设想,但由于工艺和技术上极大的困难目前仍未见报道.
除骨内或关节植入体外,美国密歇根大学于2013年运用3D打印技术制造了用于治疗气管支气管软化症的夹板,成功挽救3名婴幼儿的生命.该夹板采用可随时间变形的PCL材料,能够被人体吸收并再生出相关组织和细胞[56].如图2所示,图(a)是病患在夹板植入前的气管最小密度投影成像;图(b)表示计算机复制设计为病患量身定制的夹板模型(红色);图(c)和图(d)则是三维打印的气管夹板;图(e)和图(f)是在病患左主支气管软化段处手术植入打印的气管夹板;图(g)显示了夹板植入手术后1年的气管扩张情况.
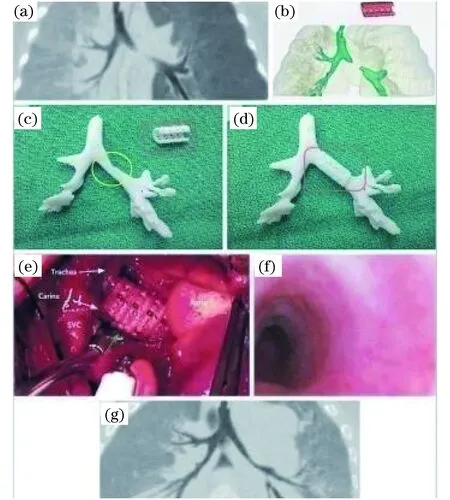
图2 三维打印气道夹板 [56]Fig.2 3D printing of airway clamp
2.4再生医学
传统组织再生和损伤修复的方法包括了自体移植、异体移植与人工合成产品的替代3条途径[57].然而,来源有限、免疫排斥、生物相容性差等问题极大地限制了这些方法的应用,难以真正达到修复或长期替代的效果.组织工程技术适时出现,给组织再生与修复带来新的生机.常见基于生物材料支架的组织工程方法原理是,在体外要首先制作模仿组织器官形状结构的多孔支架,然后再结合种子细胞形成复合物植入体内进一步增殖、分化[58].其中,多孔组织工程支架的制作是至关重要的一步.
组织工程用支架是一种多孔隙三维结构体,它要求有合适的孔隙尺寸和高连通的孔道结构,以提供细胞足够和连续的生长通道,同时也保证了水分、无机盐、营养物质和排泄废物的流通.很多已经发展的支架制备方法有溶液浇注/颗粒滤取法、气体发泡法、纤维编织法等,但这些方法的共同问题是难以对支架孔隙的形状、大小、连接形态、空间分布等进行有效的精确控制,不能满足组织工程对支架的复杂结构要求,不能使不同细胞在支架的空间结构中准确定位等[59-60].3D打印技术的高度灵活性和可定制性恰好能够解决上述问题,并且在材料打印同时可将各种生长因子、蛋白质乃至细胞混合至支架结构中.因此,3D打印在组织工程技术尤其是组织工程用支架构建上体现出无可比拟的优势[61].
目前,3D打印技术应用于组织工程再生/修复的组织包含骨、软骨、神经、肌肉、血管等,并且已经取得了较为理想的研究成果,对临床应用展现出极大的潜力.
2.4.1骨修复
骨组织修复支架的3D打印是目前研究深入、发表成果最多的生物3D打印应用,不同结构与组成的骨修复支架被打印出来.例如,Castilho等[62]通过挤出式3D打印制备了孔径在100~1 000 μm范围内可精确调控的TCP/HA复合陶瓷支架,准确度可达96.5%.Serra等[63]采用PLA/磷酸钙的有机无机复合材料,以挤出3D打印方式制备了四方和双层交错结构的多孔支架,研究结果表明结构上细微的差异就能导致迥异的生物力学性能.Almeida等[64]按照同样的打印参数分别3D打印了PLA和壳聚糖支架,在植入家兔体内后考察了两者的免疫应答与炎症反应情况,结果与支架的组成和结构均息息相关.Jakus等[65]采用挤出式3D打印制备含有90%HA和10%PCL或PLGA的弹性人工骨,弹性应变达32%~67%,弹性模量4~11 MPa可调;植入老鼠体内35天后的生物相容性良好,8周内新骨生成,体内实验没有显示负面的免疫反应,血管生成并与周围组织很好地结合.Tumbleston等[66]在Science发表封面文章,介绍了一种革命性的3D打印技术——连续液面生产技术,这项技术成千倍地提高了传统3D打印的速度和精度,因而对复杂且细节丰富的组织修复支架的打印具有巨大的优势.
2.4.2软骨修复
软骨组织的自我再生和愈合能力有限,结合支架材料、干细胞和相关因子的组织工程技术是目前最具潜力的软骨缺损修复手段[67].Lee等[68]通过混合打印技术,以PEG作为支撑材料,能够打印具有复杂外形的软骨修复支架特殊结构,如碗状、倒金字塔状等,因而可直接用于耳朵、鼻子等软骨组成器官的修复.另外,软骨细胞、脂肪细胞同时与材料进行打印后,体外培养显示出良好的存活率以及成软骨和成脂肪性能.
用于打印软骨修复支架的生物材料目前常为海藻酸盐、壳聚糖、透明质酸等生物相容的水凝胶[69-70],但是水凝胶材料缺乏较高的机械强度,真正实现应用具有一定的困难.Hutmacher等[59]结合熔体静电纺丝和3D打印技术,制备出了超细纤维网络增强的蛋白聚糖水凝胶,具有与人类膝关节软骨类似的强度和韧性.这种增强水凝胶可以很好地支持人类软骨细胞的生长和软骨三维组织的形成,因而有望用于乳房组织和心脏瓣膜组织的重建.Hung等[72]合成了水溶性PU弹性纳米粒子并与透明质酸混合打印多孔支架,而且还可在支架打印过程中添加生物活性分子或替代小分子药物.该支架可实现活性分子的持续可控释放,诱导MSCs细胞向成软骨方向分化并抑制新生软骨过度生长,能有效地修复兔子关节软骨缺损.
2.4.3神经修复
运用组织工程手段进行神经再生的过程中,仿生支架的结构和组成可构建出具有不同动态功能的细胞微环境,从而影响到体内神经干细胞(NSCs)的命运[73].通过3D打印技术灵活打印不同结构支架,可模拟细胞外基质并满足神经再生和修复的支架结构要求[73].Wüst等[74]通过不同3D打印路径在长方体支架中分别构造出了L,T,S,U和X形通道,系统研究了各种通道曲线上的材料聚集情况、神经干细胞在不同形状的凹槽和通道内具有的迁移、增殖和分化特性,为阐明神经修复机制提供技术基础.Wong等[75]研究了支架内部结构对大脑皮质损伤修复的影响,如图3所示.以聚己内酯为材料,3D打印了内部含有纵向微沟单向通道及水平与垂直方向正交叉通道的圆柱体支架(图3(a)~(i)).结果表明,两种支架分别植入大鼠的大脑皮质缺损部位,如图3(j)中4周后组织再生情况和图3(k)中苏木精-伊红染色照片显示,正交叉形支架中向内生长的组织总量与星形细胞的渗透率均明显增高.

图3 3D打印含内部通道支架用于大脑皮质损伤修复[75]Fig.3 Scaffolds with channels and microgrooves manufactured by 3D printing technique for brain cortex regeneration
另外,3D打印定制硅胶导板可应用于帮助受损的复杂神经再生其感觉和运动功能.通过3D打印设计定制导板,赋予导板物理和化学诱导因素(包括沟槽设计和生物化学组份的添加),已成功应用于老鼠的坐骨神经结构缺损修复,促进了其运动和感觉神经的再生[76].
2.4.4心血管修复
3D打印技术在心血管研究和应用方面具有重要价值.目前在组织工程心肌、组织工程心脏瓣膜、组织工程大血管及血管网的构建上都已有突破性进展,3D打印方案也逐渐完善,其应用已从实验室研究走向临床应用.
心肌组织:Petrochenko等[77]采用激光烧结3D打印技术,使用生物可降解脲烷和丙酸盐基材料打印出心肌组织材料,材料表现出良好的可塑性、弹性及生物活性,有利于骨髓干细胞生长.Pati等[78]采用液滴材料,3D打印出质地与大脑脂肪类似的网状细胞外基质,打印的液滴大小约与5个心肌细胞相当,因此打印出的组织结构整体性和精细度大大提高.
血管:构建大血管与毛细血管也是组织工程中的重要方面[79].大血管可提供管腔结构,血液通过官腔结构运输至靶器官[80].毛细血管的构建能改善血液微循环,更好地实现血细胞的功能[81].Lee等[80]以水凝胶、胶原和脐带静脉血内皮细胞为材料,3D打印出直径为1 mm、长5 mm、具有血管动力学特性和功能的微血管床模型.研究结果表明脐带静脉血内皮细胞可自然生长和增殖,并形成血管分支结构,实现小血管微循环、靶器官的血液供应等功能.Miller等[82]利用可去除的糖玻璃为原料进行3D打印纤维网络支架,可用于进行血管内皮细胞的灌注以形成血管网络,如图4所示.由图4(a)和(b)可见,3D打印的糖玻璃纤维支架具有可控的网络结构,各打印纤维相交处易融合形成连通交联.图4(c)和(d)显示了活细胞灌注至纤维支架中之后的发展情况,红色表示沿空管腔分布的血管内细胞,绿色表示支架网格之间灌注的成纤维细胞.Zhao等[83]以3D打印技术构建具有内连接通道的生物降解聚合物骨架结构,再将脂肪干细胞引入骨架结构,诱导脂肪干细胞分化成为内皮细胞和平滑肌细胞,从而形成血管.

图4 3D打印的糖玻璃支架用于血管内皮细胞灌注成型三维组织[82]Fig.4 3D printed vascular networks for endothelialization and perfusable engineered extravascular tissues
多样化心脏瓣膜:Lueders等[84]以心脏半月瓣为模型研究了其在3D打印中的热力学、材料学特性及移植细胞的功能,发现3D打印构建心脏瓣膜的主要影响因素取决于瓣膜骨架材料和种子细胞种类.其中,瓣膜骨架材料的韧性、耐久度等达到长期的心脏瓣膜活动时具备的功能结构.因此,与3D打印血管结构相比,心脏瓣膜的3D打印在材料和打印方式上均有较高要求.
2.5个性化药物缓释装置
为克服传统药剂效率低下、副作用大、作用时间短等缺陷,缓释型给药系统近年来受到广泛关注.缓释药物系统指的是通过一定方法控制药物释放的时间、速度和位置,改善药物在体内的释放、吸收和分布代谢的过程,从而达到延长药物作用、减少药物不良反应的一类药剂[85].美国麻省理工学院基于3D打印技术,提出了一种层层铺粉、喷墨粘结的3D打印药片制剂的方法获得可控缓释药物的系统[86].由于3D打印成形的高度灵活性,喷墨过程及参数可以随意控制,不同组成和类型的材料可以通过不同喷头打印,因此可以很容易地控制局部材料组成、微观结构和表面特性,从而精确控制药物释放行为.目前常见的3D打印缓释药片有多层片、多腔室、核壳结构、包裹结构等类型[87-88],药剂偏差量小于1%[89].
植入式的药物缓释系统进一步改善单纯口服缓释片剂不能靶向给药的缺点,能做到通过手术植入或注射等手段直接导入病灶部位,从而实现定位给药,植入局部药物浓度高,而进入血液的药物浓度低,减少用药次数和用药量.目前,3D打印可降解材料制作植入式药物制剂是主要方向.Huang等[90]采用聚乳酸3D打印了庆大霉素的植入式药剂,聚乳酸的不断降解使包藏的药物得以逐步完全释放.与传统的溶剂浇注压制法相比,3D打印制剂的初始爆发释放量低,缓释过程中维持释放浓度更平稳.Wu等[91]3D打印了具有多层结构的载药聚乳酸植入式支架,植入家兔体内的药物释放研究表明,各层结构中的药物可以分阶段控制释放,极大地避免了全身用药导致的毒性.朱钰方研究团队[23,92-94]通过材料表面化学改性,利用3D打印有机无机复合支架,在实现骨修复支架构建的同时,获得了抗生素、DNA、地塞米松、DMOG、阿霉素等多类型多尺寸药物分子的局部缓释和控制释放.
2.6肿瘤治疗
3D打印技术目前对肿瘤诊断和治疗的意义主要在于体外肿瘤三维模型的构建.早在2003年,Cho等报道,乳腺癌细胞在3D环境中通过合适的诱导因子添加可恢复到良性细胞的状态,而这是在2D平面培养中无法实现的[95].因此,构建3D体外肿瘤模型对于肿瘤诊疗的研究具有重要的意义.Zhao等[96]运用自主开发的细胞3D打印技术,在世界上首次构建出由明胶、藻酸盐和纤维素组成的Hela细胞的体外三维肿瘤模型.与2D培养相比,3D模型具有与肿瘤生理环境更相似的特征,肿瘤细胞在其中表现出较高的扩散效率,更高的蛋白表达和对抗肿瘤药物更好的抗性,从而便于研究肿瘤的发展、侵袭、转移和治疗.Huang等[97]采用3D打印技术制备了仿生支架,深入研究了良性细胞和不同肿瘤细胞在支架中的迁移情况,并通过打印不同粗细的血管网络研究肿瘤细胞在抗癌转移药物作用下的运动行为和分布.
另外,众多研究人员开始采用3D打印技术精确设计仿生组织药物病理作用模型,可以使人们在短时间内大规模高通量筛选新型高效药物[24],更重要的是,3D打印的病理模型具有极高的可重复性,对新型药物或者药物输送系统的筛选测试也就具有了可靠性.近来,Gou等通过3D打印设计了一款肝组织结构药物解毒模型,受到全世界关注[98].
3 结束语
生物材料3D打印具有个性化、精准化生物医学应用,越来越受到重视.目前,生物材料3D打印研究已经在医疗与手术设计模型、手术导板、体外医疗器械,及非降解永久植入物等方面取得重要进展,并已经开展临床应用.但是,生物材料3D打印更为优势的应用,应该向可降解组织工程支架、3D打印体外仿生三维生物结构体、器官及器官再生等领域发展.个性化可降解的组织工程支架将为包括骨/软骨组织、皮肤组织等修复提供新的途径;生物3D打印体外仿生生物结构体的研发对短时间大规模高通量的新药筛选具有重大价值;生物3D打印器官再生如能实现,对器官移植具有深远意义.另外,由于3D打印机的局限,目前合适的3D打印生物材料有限,质量也有待于进一步提高.因此,3D打印生物材料问题的解决才能助力生物材料3D打印技术的临床应用,从而造福人类.
[1] PELTOLA S M,MELCHELS F P W,GRIJPMA D W,et al.A review of rapid prototyping techniques for tissue engineering purposes[J].Annals of Medicine,2008,40(4):268-280.
[2] JANG J,YI H G,CHO D W.3D printed tissue models:present and future[J].ACS Biomaterials Science & Engineering,2016,2(10):1722-1731.
[3] 潘周娴,陈适,刘巍,等.医学三维打印材料分类及应用介绍[J].基础医学与临床,2015,35(5):702-706.
[4] 王雪莹.3D打印技术与产业的发展及前景分析[J].中国高新技术企业,2012(9):3-5.
[5] 黄健,姜山.3D打印技术将掀起“第三次工业革命”[J].新材料产业,2013(1):62-67.
[6] 周长春,王科峰,谢鹏飞,等.生物三维打印技术的研究现状及发展趋势[J].科技与企业,2014(13):381-382.
[7] MURPHY S V,ATALA A.3D bioprinting of tissues and organs[J].Nature Biotechnology,2014,32(8):773-785.
[8] CALVERT P.Printing cells[J].Science,2007,318(5848):208-209.
[9] DERBY B.Printing and prototyping of tissues and scaffolds[J].Science,2012,338(6109):921-926.
[10] SEARS N A,SESHADRI D R,DHAVALIKAR P S,et al.A review of three-dimensional printing in tissue engineering[J].Tissue Engineering Part B:Reviews,2016,22(4):298-310.
[11] 顾奇,郝捷,陆阳杰,等.生物三维打印的研究进展[J].中国科学:生命科学,2015,45(5):439-449.
[12] KAWAGUCHI Y,NAKANO M,YASUDA T,et al.Development of a new technique for pedicle screw and Magerl screw insertion using a 3-dimensional image guide[J].Spine,2012,37(23):1983-1988.
[13] 黄轩,李凤宁,张帆,等.三维打印个体化导航模板在枕骨髁螺钉固定技术中的应用研究[J].中国脊柱脊髓杂志,2014,24(5):440-446.
[14] XIONG Y Y,QIAN C,SUN J.Fabrication of porous titanium implants by three-dimensional printing and sintering at different temperatures[J].Dental Materials Journal,2012,31(5):815-820.
[15] CHEN Q Y,MANGADLAO J D,WALLAT J,et al.3D printing biocompatible polyurethane/poly(lactic acid)/graphene oxide nanocomposites:anisotropic properties[J].ACS Applied Materials & Interfaces,2017,9(4):4015-4023.
[17] INZANA J A,OLVERA D,FULLER S M,et al.3D printing of composite calcium phosphate and collagen scaffolds for bone regeneration[J].Biomaterials,2014,35(13):4026-4034.
[18] PEI P,QI X,DU X Y,et al.Three-dimensional printing of tricalcium silicate/mesoporous bioactive glass cement scaffolds for bone regeneration[J].Journal of Materials Chemistry B,2016,4(46):7452-7463.
[19] KIM Y B,LEE H,KIM G H.Strategy to achieve highly porous/biocompatible macroscale cell blocks,using a collagen/genipin-bioink and an optimal 3D printing process[J].ACS Applied Materials & Interfaces,2016,8(47):32230-32240.
[20] GAETANI R,FEYEN D A M,VERHAGE V,et al.Epicardial application of cardiac progenitor cells in a 3D-printed gelatin/hyaluronic acid patch preserves cardiac function after myocardial infarction[J].Biomaterials,2015,61:339-348.
[21] CHOI Y,PATI F,DAS S,et al.Development of novel silk fibroin-gelatin bioink for 3d cell printing technology[J].Tissue Engineering Part A,2014,20:S116.
[22] BILLIET T,GEVAERT E,DE SCHRYVER T,et al.The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability[J].Biomaterials,2014,35(1):49-62.
[23] ZHANG J H,ZHAO S C,ZHU Y F,et al.Three-dimensional printing of strontium-containing mesoporous bioactive glass scaffolds for bone regeneration[J].Acta Biomaterialia,2014,10(5):2269-2281.
[24] 周长春,王科峰,肖占文,等.3D打印技术在生物医学工程中的研究及应用[J].科技创新与应用,2014(21):41-42.
[25] GUVENDIREN M,MOLDE J,SOARES R M D,et al.Designing biomaterials for 3D printing[J].ACS Biomaterials Science & Engineering,2016,2(10):1679-1693.
[26] JOSE R R,BROWN J E,POLIDO K E,et al.Polyol-silk bioink formulations as two-part room-temperature curable materials for 3D printing[J].ACS Biomaterials Science & Engineering,2015,1(9):780-788.
[27] NI S Y,LI X H,YANG P A,et al.Enhanced apatite-forming ability and antibacterial activity of porous anodic alumina embedded with CaO-SiO2-Ag2O bioactive materials[J].Materials Science and Engineering C,2016,58:700-708.
[28] SHAO H F,HE Y,FU J Z,et al.3D printing magnesium-doped wollastonite/β-TCP bioceramics scaffolds with high strength and adjustable degradation[J].Journal of the European Ceramic Society,2016,36(6):1495-1503.
[29] PEI P,WEI D X,ZHU M,et al.The effect of calcium sulfate incorporation on physiochemical and biological properties of 3D-printed mesoporous calcium silicate cement scaffolds[J].Microporous and Mesoporous Materials,2017,241:11-20.
[30] ZHU W,XU C,MA B P,et al.Three-dimensional printed scaffolds with gelatin and platelets enhanceinvitropreosteoblast growth behavior and the sustained-release effect of growth factors[J].Chinese Medical Journal,2016,129(21):2576-2581.
[31] STERNER E,MASUKO S,LI G Y,et al.Fibroblast growth factor-based signaling through synthetic heparan sulfate blocks copolymers studied using high cell density three-dimensional cell printing[J].Journal of Biological Chemistry,2014,289(14):9754-9765.
[32] PAGE H,FLOOD P,REYNAUD E G.Three-dimensional tissue cultures:current trends and beyond[J].Cell and Tissue Research,2013,352(1):123-131.
[33] DERBY B.Inkjet printing of functional and structural materials:fluid property requirements,feature stability,and resolution[J].Annual Review of Materials Research,2010,40(1):395-414.
[34] DEMIRCI U,MONTESANO G.Single cell epitaxy by acoustic picolitre droplets[J].Lab on a Chip,2007,7(9):1139-1145.
[35] NAKAMURA M,KOBAYASHI A,TAKAGI F,et al.Biocompatible inkjet printing technique for designed seeding of individual living cells[J].Tissue Engineering,2005,11(11/12):1658-1666.
[36] KADOR K E,GROGAN S P,DORTHÉ E W,et al.Control of retinal ganglion cell positioning and neurite growth:combining 3D printing with radial electrospun scaffolds[J].Tissue Engineering Part A,2016,22(3/4):286-294.
[37] FANG Y,FRAMPTON J P,RAGHAVAN S,et al.Rapid generation of multiplexed cell cocultures using acoustic droplet ejection followed by aqueous two-phase exclusion patterning[J].Tissue Engineering Part C:Methods,2012,18(9):647-657.
[38] CHENG E,YU H R,AHMADI A,et al.Investigation of the hydrodynamic response of cells in drop on demand piezoelectric inkjet nozzles[J].Biofabrication,2016,8(1):015008.
[39] FERRIS C J,GILMORE K J,BEIRNE S,et al.Bio-ink for on-demand printing of living cells[J].Biomaterials Science,2013,1(2):224-230.
[40] HEO E Y,KO N R,BAE M S,et al.Novel 3D printed alginate-BFP1 hybrid scaffolds for enhanced bone regeneration[J].Journal of Industrial and Engineering Chemistry,2017,45:61-67.
[41] WANG Q,XIA Q Q,WU Y,et al.3D-printed atsttrin-incorporated alginate/hydroxyapatite scaffold promotes bone defect regeneration with TNF/TNFR signaling involvement[J].Advanced Healthcare Materials,2015,4(11):1701-1708.
[42] JEON H,KANG K,PARK S A,et al.Generation of multilayered 3D structures of HepG2 cells using a bio-printing technique[J].Gut and Liver,2017,11(1):121-128.
[43] JANG J,PARK H J,KIM S W,et al.3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair[J].Biomaterials,2017,112:264-274.
[44] XU T,KINCAID H,ATALA A,et al.High-throughput production of single-cell microparticles using an inkjet printing technology[J].Journal of Manufacturing Science and Engineering,2008,130(2):021017.
[45] LI S J,XIONG Z,WANG X H,et al.Direct fabrication of a hybrid cell/hydrogel construct by a double-nozzle assembling technology[J].Journal of Bioactive and Compatible Polymers,2009,24(3):249-265.
[46] ZHAO Y,LI Y,MAO S S,et al.The influence of printing parameters on cell survival rate and printability in microextrusion-based 3D cell printing technology[J].Biofabrication,2015,7(4):045002.
[47] AHMED R,MENEZES A H.Management of operative complications related to occipitocervical instrumentation[J].Neurosurgery,2013,72(2S):ons214.
[48] 禤天航,曹正霖,王刚.三维打印技术在脊柱外科的研究与应用[J].海南医学,2015,26(12):1807-1809.
[49] 石静,钟玉敏.组织工程中3D生物打印技术的应用[J].中国组织工程研究,2014,18(2):271-276.
[50] SUN J,ZHANG F Q.The application of rapid prototyping in prosthodontics[J].Journal of Prosthodontics:Implant,Esthetic,and Reconstructive Dentistry,2012,21(8):641-644.
[51] EBERT J,ÖZKOL E,ZEICHNER A,et al.Direct inkjet printing of dental prostheses made of zirconia[J].Journal of Dental Research,2009,88(7):673-676.
[52] Emma,INDEX.3D打印定制假肢[J].设计,2013,(12):24.
[53] ZHU M,ZHAO S C,XIN C,et al.3D-printed dimethyloxallyl glycine delivery scaffolds to improve angiogenesis and osteogenesis[J].Biomaterials Science,2015,3(8):1236-1244.
[54] 朱建平.3D打印骨骼进入临床观察阶段[J].健康博览,2013(8):9.
[55] CARRADA,PERRIN-SCHMITT F,LE Q V,et al.Nanoporous hydroxyapatite/sodium titanate bilayer on titanium implants for improved osteointegration[J].Dental Materials,2017,33(3):321-332.
[56] MORRISON R J,HOLLISTER S J,NIEDNER M F,et al.Mitigation of tracheobronchomalacia with 3D-printed personalized medical devices in pediatric patients[J].Science Translational Medicine,2015,7(285):285ra64.
[57] WEI G B,MA P X.Structure and properties of nano-hydroxyapatite/polymer composite scaffolds for bone tissue engineering[J].Biomaterials,2004,25(19):4749-4757.
[58] LANGER R,VACANTI J P.Tissue engineering[J].Science,1993,260(5110):920-926.
[59] HUTMACHER D W.Scaffolds in tissue engineering bone and cartilage[J].Biomaterials,2000,21(24):2529-2543.
[60] 赵瑾,袁晓燕,姚康德.组织工程多孔支架制备技术进展[J].化工进展,2002,21(9):644-648.
[61] RICHARDS D J,TAN Y,JIA J,et al.3D printing for tissue engineering[J].Israel Journal of Chemistry,2013,53(9/10):805-814.
[62] CASTILHO M,MOSEKE C,EWALD A,et al.Direct 3D powder printing of biphasic calcium phosphate scaffolds for substitution of complex bone defects[J].Biofabrication,2014,6(1):015006.
[63] SERRA T,MATEOS-TIMONEDA M A,PLANELL J A,et al.3D printed PLA-based scaffolds:a versatile tool in regenerative medicine[J].Organogenesis,2013,9(4):239-244.
[64] ALMEIDA C R,SERRA T,OLIVEIRA M I,et al.Impact of 3-D printed PLA and chitosan-based scaffolds on human monocyte/macrophage responses:unraveling the effect of 3-D structures on inflammation[J].Acta Biomaterialia,2014,10(2):613-622.
[65] JAKUS A E,RUTZ A L,JORDAN S W,et al.Hyperelastic “bone”:a highly versatile,growth factor-free,osteoregenerative,scalable,and surgically friendly biomaterial[J].Science Translational Medicine,2016,8(358):358ral127.
[66] TUMBLESTON J R,SHIRVANYANTS D,ERMOSHKIN N,et al.Continuous liquid interface production of 3D objects[J].Science,2015,347(6228):1349-1352.
[67] VISSCHER D O,BOS E J,PEETERS M,et al.Cartilage tissue engineering:preventing tissue scaffold contraction using a 3D-printed polymeric cage[J].Tissue Engineering Part C:Methods,2016,22(6):573-584.
[68] LEE J S,HONG J M,JUNG J W,et al.3D printing of composite tissue with complex shape applied to ear regeneration[J].Biofabrication,2014,6(2):024103.
[69] YOU F,WU X,CHEN X B.3D printing of porous alginate/gelatin hydrogel scaffolds and their mechanical property characterization[J].International Journal of Polymeric Materials and Polymeric Biomaterials,2017,66(6):299-306.
[70] KIRCHMAJER D M,GORKIN III R,PANHUIS M I H.An overview of the suitability of hydrogel-forming polymers for extrusion-based 3D-printing[J].Journal of Materials Chemistry B,2015,3(20):4105-4117.
[71] VISSER J,MELCHELS F P W,JEON J E,et al.Reinforcement of hydrogels using three-dimensionally printed microfibres[J].Nature Communications,2015,6:6933.
[72] HUNG K C,TSENG C S,DAI L G,et al.Water-based polyurethane 3D printed scaffolds with controlled release function for customized cartilage tissue engineering[J].Biomaterials,2016,83:156-168.
[73] 符锋,李晓红,张赛.三维打印技术在神经修复中的应用[J].中国医药指南,2016,11(1):138-141.
[74] WÜST S,MÜLLER R,HOFMANN S.3D Bioprinting of complex channels-Effects of material,orientation,geometry,and cell embedding[J].Journal of Biomedical Materials Research Part A,2015,103(8):2558-2570.
[75] WONG D Y,KREBSBACH P H,HOLLISTER S J.Brain cortex regeneration affected by scaffold architectures[J].Journal of Neurosurgery,2008,109(4):715-722.
[76] CHANG C C,BOLAND E D,WILLIAMS S K,et al.Direct-write bioprinting three-dimensional biohybrid systems for future regenerative therapies[J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2011,98B(1):160-170.
[77] PETROCHENKO P E,TORGERSEN J,GRUBER P,et al.Laser 3D printing with sub-microscale resolution of porous elastomeric scaffolds for supporting human bone stem cells[J].Advanced Healthcare Materials,2015,4(5):739-747.
[78] PATI F,JANG J,HA D H,et al.Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink[J].Nature Communications,2014,5:3935.
[79] 王璐,胡为杰,聂昊,等.3D打印与组织工程心肌、心脏瓣膜、大血管及血管网的构建[J].中国组织工程研究,2015,19(43):7029-7034.
[80] LEE V K,KIM D Y,NGO H,et al.Creating perfused functional vascular channels using 3D bio-printing technology[J].Biomaterials,2014,35(28):8092-8102.
[81] CHRISTENSEN K,XU C X,CHAI W X,et al.Freeform inkjet printing of cellular structures with bifurcations[J].Biotechnology and Bioengineering,2015,112(5):1047-1055.
[82] MILLER J S,STEVENS K R,YANG M T,et al.Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues[J].Nature Materials,2012,11(9):768-774.
[83] ZHAO X R,LIU L B,WANG J Y,et al.Invitrovascularization of a combined system based on a 3D printing technique[J].Journal of Tissue Engineering and Regenerative Medicine,2016,10(10):833-842.
[84] LUEDERS C,JASTRAM B,HETZER R,et al.Rapid manufacturing techniques for the tissue engineering of human heart valves[J].European Journal of Cardio-Thoracic Surgery,2014,46(4):593-601.
[85] ZHU M,ZHANG J H,TAO C L,et al.Design of mesoporous bioactive glass/hydroxyapatite composites for controllable co-delivery of chemotherapeutic drugs and proteins[J].Materials Letters,2014,115:194-197.
[86] GOOLE J,AMIGHI K.3D printing in pharmaceutics:a new tool for designing customized drug delivery systems[J].International Journal of Pharmaceutics,2016,499(1/2):376-394.
[87] KHALED S A,BURLEY J C,ALEXANDER M R,et al.3D printing of tablets containing multiple drugs with defined release profiles[J].International Journal of Pharmaceutics,2015,494(2):643-650.
[88] KHALED S A,BURLEY J C,ALEXANDER M R,et al.3D printing of five-in-one dose combination polypill with defined immediate and sustained release profiles[J].Journal of Controlled Release,2015,217:308-314.
[89] LEE K J,KANG A,DELFINO J J,et al.Evaluation of critical formulation factors in the development of a rapidly dispersing captopril oral dosage form[J].Drug Development and Industrial Pharmacy,2003,29(9):967-979.
[90] HUANG Y Y,CHUNG T W.Microencapsulation of gentamicin in biodegradable PLA and/or PLA/PEG copolymer[J].Journal of Microencapsulation,2001,18(4):457-465.
[91] WU W G,ZHENG Q X,GUO X D,et al.The controlled-releasing drug implant based on the three dimensional printing technology:fabrication and properties of drug releasinginvivo[J].Journal of Wuhan University of Technology-Materials Science Edition,2009,24(6):977-981.
[92] ZHU M,LI K,ZHU Y F,et al.3D-printed hierarchical scaffold for localized isoniazid/rifampin drug delivery and osteoarticular tuberculosis therapy[J].Acta Biomaterialia,2015,16:145-155.
[93] ZHAO S C,ZHU M,ZHANG J H,et al.Three dimensionally printed mesoporous bioactive glass and poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) composite scaffolds for bone regeneration[J].Journal of Materials Chemistry B,2014,2(36):6106-6118.
[94] ZHANG J H,ZHAO S C,ZHU M,et al.3D-printed magnetic Fe3O4/MBG/PCL composite scaffolds with multifunctionality of bone regeneration,local anticancer drug delivery and hyperthermia[J].Journal of Materials Chemistry B,2014,2(43):7583-7595.
[95] CHO H S,MASON K,RAMYAR K X,et al.Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab[J].Nature,2003,421(6924):756-760.
[96] ZHAO Y,YAO R,OUYANG L L,et al.Three-dimensional printing of Hela cells for cervical tumor modelinvitro[J].Biofabrication,2014,6(3):035001.
[97] HUANG T Q,QU X,LIU J,et al.3D printing of biomimetic microstructures for cancer cell migration[J].Biomedical Microdevices,2014,16(1):127-132.
[98] GOU M L,QU X,ZHU W,et al.Bio-inspired detoxification using 3D-printed hydrogel nanocomposites[J].Nature Communications,2014,5:3774.
Progressofthe3DPrintingTechnologyforBiomaterials
ZHU Min,HUANGTing,DUXiaoyu,ZHUYufang
(SchoolofMaterialsandEngineering,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China)
In biomedical fields,the 3D printing of either biomaterials or living cells is capable to construct complex 3D bio-structures,such as customized implants,engineered bone grafts,ex vivo 3D cellular aggregates and artificial organs,etc.Therefore,considering its remarkable superiorities over the individual fabrication and complex structure building,the paper affords a meaningful review of the basis technological process,application areas and developments of 3D bio-printing.The discussions based on the 3D printing of biomaterials were then presented according to current research hotspots,including the two strategies of inkjet printing and dispensing printing techniques.Its applications in manufacturing medical models,devices and implants with biomaterials were focused.In addition,tissue engineering scaffolds and three-dimensional cell aggregates fabricated via 3D bio-printing were summarized.The outlooks about the future 3D bio-printing technique were put forward.
biomaterial; 3Dprinting;biomedicalapplications;progress
1007-6735(2017)05-0473-11
10.13255/j.cnki.jusst.2017.05.011
2017-05-05
上海理工大学科技发展基金资助项目(2016KJFZ011,2017KJFZ010)
朱 敏(1985-),女,副研究员.研究方向:生物材料.E-mail:mzhu@usst.edu.cn
朱钰方(1976-),男,教授.研究方向:生物材料.E-mail:yfzhu@usst.edu.cn
TP391.7;R318.1
A
(编辑:丁红艺)
