产絮凝剂菌种的筛选及其在猪场污水净化中的应用
2017-11-13张鲁新李吕木徐雅芫丁维民
张鲁新,鲁 陈,李吕木,,徐雅芫,梁 君,刁 欢,丁维民
产絮凝剂菌种的筛选及其在猪场污水净化中的应用
张鲁新1,鲁 陈2,李吕木1,2※,徐雅芫1,梁 君1,刁 欢1,丁维民3
(1. 安徽农业大学生命科学学院,合肥 230036; 2. 安徽农业大学动物科技学院,合肥 230036; 3. 安徽安泰农业集团,广德242200)
分离高效絮凝剂产生菌以有效絮凝猪场污水中的悬浮物。通过稀释平板法和筛选培养基及以发酵液对猪场污水的絮凝率为指标复筛,从猪场污水沉淀池污泥中筛选获得一株产絮凝剂的细菌FD-14,并进行16S rDNA鉴定,然后以絮凝效果为标准,采用La(34)正交设计对其培养条件进行优化;采用单因素试验对其碳氮源进行优化。以最优培养条件下菌株的发酵液实际絮凝猪场污水,与化学絮凝剂的絮凝效果进行比较。分离得到一株高效絮凝剂产生菌FD-14,分子生物学鉴定为解淀粉芽孢杆菌(),其产絮凝剂最适条件为温度33 ℃,pH值6.6,转速150 r/min,培养时间42 h。菌株FD-14利用淀粉作为其廉价碳源替代发酵培养基的絮凝率为80.80%,与原标准培养基差异不显著(>0.05);对猪场实际应用结果表明,微生物絮凝剂和化学絮凝剂对猪场污水絮凝率分别为79.0%和62.7%,微生物絮凝剂比化学絮凝剂对猪场污水絮凝率高16.3%。解淀粉芽孢杆菌FD-14是生物絮凝剂高效产生菌,其产生的絮凝剂可用于猪场污水悬浮物絮凝。
筛选;污水;净化;解淀粉芽孢杆菌;絮凝剂;絮凝特性
0 引 言
随着国家对畜牧场环境污染控制措施的逐步落实到位,畜牧场污水的安全高效净化处理问题已经引起集约化畜牧业经营者的高度重视。由于猪场污水中悬浮物含量高,为了减轻后续生化处理的压力,现在常使用化学合成絮凝剂如聚丙烯酰胺(polyacrylamide,PAM)和聚合氯化铝(PAC)[1-2]对猪场污水的悬浮物进行絮凝。但大多数化学合成絮凝剂难以降解,且由化学合成絮凝剂衍生的许多单体对人体有害[3-5]。例如从PAM衍生的丙烯酰胺单体对人类是一种强烈的致癌物质和神经毒素[6],PAC所含的铝离子可导致神经性病变如阿尔茨海默氏症[7]。因而,目前一些国家已禁止或限制使用这类絮凝剂[8]。此外化学合成絮凝剂处理畜牧场污水时添加量大,成本高[9]。微生物絮凝剂(microbial flocculants,MF)是微生物产生的代谢产物,主要由多糖、蛋白质、核酸和脂质组成[10]。它可以诱导悬浮液中的固体颗粒、细菌、细胞和胶体粒子絮凝并沉淀。MF不但具有絮凝沉淀性能,还具有安全无毒,易于生物降解的显著优点[11-12]。目前主要通过水生植物以及化学处理等途径对猪场污水进行净化,而利用微生物处理猪场废水的研究报道还较少[1-2,13]。因此,猪场污水悬浮物的高效微生物絮凝剂产生菌的分离筛选备受重视。为此,本研究从猪场污水沉淀池污泥中分离高效絮凝剂产生菌,研究其生物絮凝剂的絮凝特性及絮凝猪场污水悬浮物的效果,以期获得猪场养殖污水的高效微生物絮凝剂,为绿色生猪产业发展做出积极贡献。
1 材料和方法
1.1 主要仪器
SW-CJ-2D超净工作台(苏州净化设备有限公司);FZQ-F160A高低温恒温振荡培养箱(上海一恒科学仪器有限公司);752紫外可见分光光度计(上海浦东物理光学仪器厂);HC-2518高速离心机;GRJ-10D全自动发酵控制系统(江苏省镇江格瑞生物工程有限公司);微孔板紫外可见光度计(spectra MAX190,美谷分子仪器(上海)有限公司)。
1.2 筛选材料和培养基
筛选材料:猪场污水沉淀池污泥。
富集培养基:1)牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,水1 000 mL,pH值7.2~7.4;2)PDA培养基:马铃薯200 g、葡萄糖20 g、水1 000 mL,pH值7.0~7.2;
分离培养基:1)PDA固体培养基(g/L):马铃薯200 g、葡萄糖20 g、琼脂15~20 g、水1 000 mL,pH值7.0~7.2;2)细菌分离培养基[14]:脲0.5 g,酵母膏5.0 g,蔗糖20 g,K2HPO45.0 g,KH2PO42.0 g,MgSO42.0 g,NaCl 10 g,琼脂15 g,水1 000 mL,pH 值7.0~7.2;
标准发酵培养基[14]:葡萄糖20 g,酵母粉5.0 g,牛肉膏2.0 g,KH2PO45.0 g,KH2PO42.0 g,MgSO42.0 g,NaCl 10 g,水1000 mL。
1.3 菌株的筛选
1.3.1初筛
取2 g污泥和2 mL污水样品,分别加入到98 mL牛肉膏蛋白胨液体培养基和PDA液体培养基中,分别于37 ℃,150 r/min和30 ℃,150 r/min摇床振荡富集培养24 h。取富集培养液,用无菌水适当稀释后,取0.1 mL分别涂布于分离培养基上,于富集培养温度条件下培养48 h,观察菌落形态,并挑选表面光滑且大而带黏性的菌落,随后采用平板划线法进行分离纯化,于4 ℃冰箱保存备用。
1.3.2复筛
将初筛得到的菌株接入到100 mL标准发酵培养基中,并分别于相对应的筛选温度下,150 r/min摇床振荡培养72 h 后取菌液。以菌液对猪场污水的絮凝率为依据,选出具有生产高效絮凝剂的菌株。选择絮凝活性高的菌株送大连宝生物进行16S rDNA序列鉴定,使用NCBI中的blast软件分析菌株测序结果,使用Maga4.0 软件的N-J法绘制系统发育树。
1.3.3发酵菌液添加量对絮凝率的影响
准确量取0.1、0.5、1、2和3 mL发酵液添加到100 mL猪场污水中,并以氯化钙为助凝剂,以对猪场污水絮凝率为指标,研究絮凝剂添加量对污水絮凝率的影响。
CaCl2添加量对絮凝率的影响:准确量取1 mL发酵液添加到100 mL猪场污水中,分别添加质量分数1%的CaCl21、2、3、4和5 mL,以对猪场污水絮凝率为指标,研究絮凝剂添加量对污水絮凝率的影响。
1.3.4 絮凝率的测定
取100 mL猪场污水,加入2 mL 1% CaCl2作为助凝剂,再加入1 mL发酵菌液,常温条件下,100 r/min振荡10 min,静置30 min,取上清液,使用分光光度计测定波长680 nm处的吸光度OD680。絮凝率计算公式如下:
絮凝率(%)=[(−)/]×100%
式中是添加发酵液后污水在680 nm处吸光度;为原污水在680 nm处吸光度。
1.3.5 菌株生长曲线
将菌种接种到标准发酵培养基中,于37 ℃、150 r/min恒温振荡培养。每6 h取样,以未接菌种的培养基为对照,分别测定发酵液pH值、菌体生长量OD600及发酵液对猪场污水的絮凝率,以发酵液pH值、菌体生长量OD600及发酵液对猪场污水的絮凝率为纵坐标,并以时间为横坐标进行生长曲线的绘制。
1.4 菌株培养条件及碳氮源优化
1.4.1 培养条件优化
首先进行单因素试验,分别确定培养时间、温度、pH值和转速4因素对絮凝活性的影响。培养时间对絮凝活性的影响:试验方法参照1.5节。
正交试验:根据单因素试验结果,采用L9(34)正交试验方法,利用10 L全自动发酵罐对温度()、pH值()、转速()、培养时间():4因素3水平进行优化。
1.4.2 碳氮源优化
旨在利用廉价碳氮源替代优选菌种的标准培养基碳氮源的可能性,以便降低工业化生产成本。碳源的优化:分别以麸皮、玉米粉和淀粉代替标准培养基中的葡萄糖,其他成分不变。氮源的优化:分别以尿素、氯化铵和豆粕代替标准培养基中的酵母粉和牛肉膏。替代碳氮源的低浓度水平为其对应的等碳和等氮替代。碳氮源的适宜替代水平确定,以絮凝效果与原标准发酵培养基絮凝效果差异不显著(<0.05)为标准。
1.5 絮凝剂在絮凝猪场养殖污水中的应用
于安徽安泰农业集团肥东种猪育种公司污水处理站进行。利用污水处理站絮凝反应装置进行微生物絮凝剂的应用研究,并以猪场现行的化学絮凝方法为对照。具体试验步骤如下:
化学絮凝:第1步,彻底排空絮凝反应罐原有污水;第2步,放入新鲜的厌氧处理过的猪场污水3 t搅拌均匀并取样500 mL,作为处理前的污水样带回实验室分析;第3步,添加猪场使用的化学絮凝剂(0.05 g/mL PAC和0.001 g/mL PAM,0.05 g/mL NaOH)搅拌反应10 min,搅拌转速为100 r/min;第4步:静置30 min后取上清液500 mL,作为化学絮凝后的水样带回实验室分析。
生物絮凝:第1步和第2步同化学絮凝;第3步,添加0.02 g/mL助凝剂氯化钙并搅拌均匀;第4步,添加体积分数1%优选菌株扩培菌液,搅拌反应10 min,搅拌转速为100 r/min;第5步,静置30 min后取上清液500 mL,作为生物絮凝后的水样带回实验室分析。
每种方法处理两批,水样均用棕色玻璃瓶盛装,并保存于4 ℃阴暗处,其中测定COD和氨氮的样品加浓硫酸酸化到pH值为2以下后于4 ℃冷藏保存。
1.6 菌株FD-14所产絮凝剂的提取及分析
将发酵液8 000×离心30 min去除菌体和杂质,上清液用旋转蒸发仪旋转蒸发至原体积的1/5,装入3 000 Da透析袋中,透析3次每次6 h。加入3倍体积的预冷(4 ℃)无水乙醇,充分搅拌后,于4 ℃静置24 h。8 000×离心30 min,收集沉淀。将沉淀重新溶解在100 mL蒸馏水中,加1:1的氯仿和正丁醇混合液(氯仿与正丁醇体积比5:2),室温静置1 d,取有机溶剂层加入2倍体积污水乙醇,于4 ℃静置24 h,8000×离心30 min,收集沉淀。冷冻干燥,得到生物絮凝剂。
紫外光谱分析:1 g/L的絮凝剂样品溶液在190~800 nm波长范围内进行扫描。根据吸收峰判定样品是否含蛋白质和核酸。红外光谱分析:取1 mg絮凝剂,使用红外光谱仪进行扫描分析,测定红外吸收光谱,分析其官能团组成。多糖含量测定:采用苯酚-硫酸法测定絮凝剂中的多糖[15]。需利用葡萄糖做标准曲线,每个重复所需絮凝剂约为0.01 g。蛋白质含量测定:考马斯亮蓝法测定蛋白质含量[16],每个重复约需10 mg絮凝剂。
1.7 数据统计与分析
采用Microsoft Excel软件对试验数据初步整理,采用SAS8.0软件对培养条件优化、培养基碳氮源优化试验结果进行单因素方差分析,对微生物絮凝水质和化学絮凝后水质指标进行单因素方差分析和多重比较,并以邓肯新复极差法对培养条件进行差异显著性多重比较,<0.05表示差异显著,<0.01表示差异极显著。
2 结果和分析
2.1 菌株的筛选
分别在30和37 ℃条件下分离得到18株和23株表面光滑比较黏稠的菌株,对其进行絮凝活性的测定,其中37 ℃下得到的菌株FD-14絮凝率最高可达80.1%。为此,本研究以其为出发菌株进行后续研究。
2.1.1 发酵液添加量对絮凝率的影响
发酵液添加量从0.1 mL增加到1 mL时,对猪场污水的絮凝率随发酵液添加量的增加快速提高。当发酵液添加量为1 mL时絮凝效果最好,絮凝率可以达到80.95%(图1)。然后,随着发酵液添加量的继续增加,发酵液对猪场污水絮凝率出现下降,说明发酵液添加量在适宜范围才会表现较高絮凝性能。

图1 絮凝剂添加量对絮凝率的影响
2.1.2 助凝剂氯化钙添加量对絮凝率的影响
在本研究中,加入氯化钙可以提高对猪场污水的絮凝率(图2)。1%氯化钙添加量在1~2 mL之间时,絮凝率随氯化钙添加量的增加而提高。当氯化钙添加量为2~3 mL时絮凝效果最好,絮凝率可以达到80.49%以上(图2),然后,随着氯化钙添加量的增加,絮凝率出现下降,说明氯化钙添加量也存在一个合适的范围。

图2 氯化钙添加量对絮凝率的影响
2.2 菌种鉴定
经鉴定,菌株FD-14的16S rDNA 基因全序列总长1463 bp,与芽孢杆菌属的多个菌株具有同源性,与(KP059106.1)的同源性达到99%,说明菌株FD-14为解淀粉芽孢杆菌()。
2.3 菌株生长曲线与絮凝曲线
由菌株FD-14发酵液的絮凝活性与菌体生长量关系可以看出,可以确定该菌发酵动力学类型属于II型,即发酵时间与产物合成部分偶联。生长曲线(图3)表明,菌株于6 h进入对数生长期,12 h后进入稳定期上升缓慢,78 h后其OD600开始降低;发酵液絮凝率在24 h前随着菌的生长而缓慢上升;在24~42 h絮凝活性快速增加,随后增加缓慢;在42~72 h时絮凝活性维持在较高水平,48 h达到最高值79.8%,72 h后絮凝活性快速下降。发酵液pH值在前6 h下降到5.8,6~24 h时维持在5.8附近,30 h时pH值上升到6.7左右,36~66 h维持在6.9上下,66~72 h时pH值下降到6.0并维持在6.0附近。

图3 菌株FD-14生长曲线与絮凝曲线
2.4 培养条件优化
2.4.1 培养条件优化
由表1可见,培养时间显著影响絮凝率(<0.05),在0~48 h之间,絮凝活性随着培养时间延长而增大,48 h絮凝活性最大,达77.93%,48~72 h为稳定期,絮凝活性维持在70%以上,菌株在稳定期大量分泌絮凝产物,72 h后进入衰亡期,絮凝活性下降,衰亡期由于培养基中营养物质被大量消耗,絮凝产物可能也被降解造成衰亡期絮凝率降低。
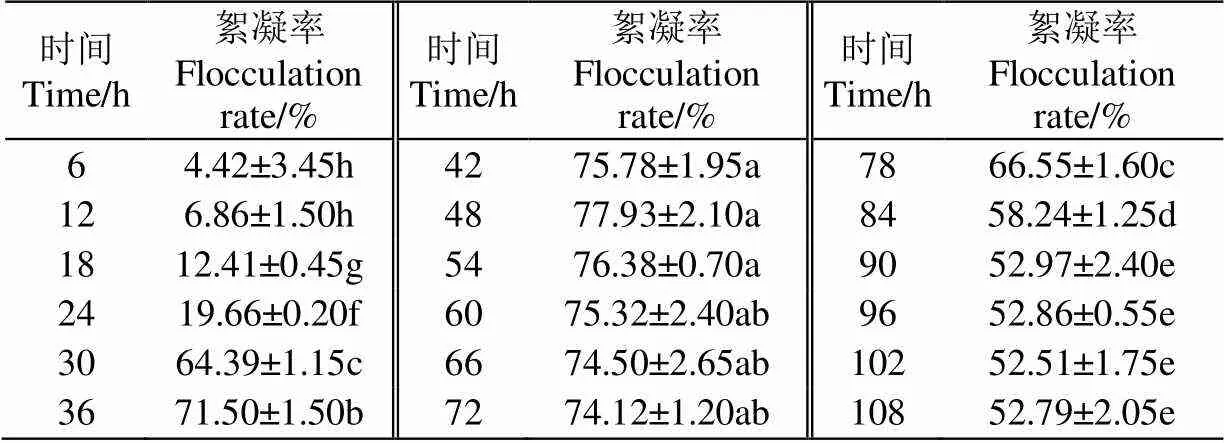
表1 培养时间单因素结果
注:同一列中肩标字母不同表示差异显著(0.05),下同。
Note: The data with different letters in same column show significant difference (<0.05), the same as below.
由表2可知,培养温度对絮凝率有显著的影响(<0.05),培养温度为33 ℃时,絮凝率最高为80.54%,随着培养温度的升高,絮凝率逐渐降低。培养基初始pH值对絮凝率也影响显著(<0.05),开始时随着培养基初始pH的上升,絮凝率逐渐加大,当培养基初始pH值为7时絮凝率最大为80.62%,此后,当培养基初始pH值继续上升絮凝率随之降低。转速对絮凝率的影响趋势与pH值相似,转速主要是通过改变培养基的溶氧量来影响菌株生长,进而影响菌株对微生物絮凝剂合成代谢。过快或过低的转速均不利于生物絮凝剂的合成,当转速为150 r/min时,絮凝率最高为80.35%,因此,最佳转速确定为150 r/min。

表2 培养温度、转速和pH单因素结果
正交试验结果(表3)表明对絮凝率影响最大的是转速,其次是pH值,然后是温度和时间,即转速>pH值>培养温度>培养时间。且转速、pH值和培养温度对絮凝率的影响均达到了极显著水平(<0.01),培养时间对菌株絮凝率影响不显著,因此,选择最少的培养时间D1(42 h)为其最佳培养时间,得出最优组合为A2B1C2D1培养温度33 ℃,pH值6.6,搅拌转速150 r/min,培养时间42 h。验证试验絮凝率为83.01%,絮凝率高于正交试验组合,表明正交试验优化结果为产絮凝剂最佳培养条件。
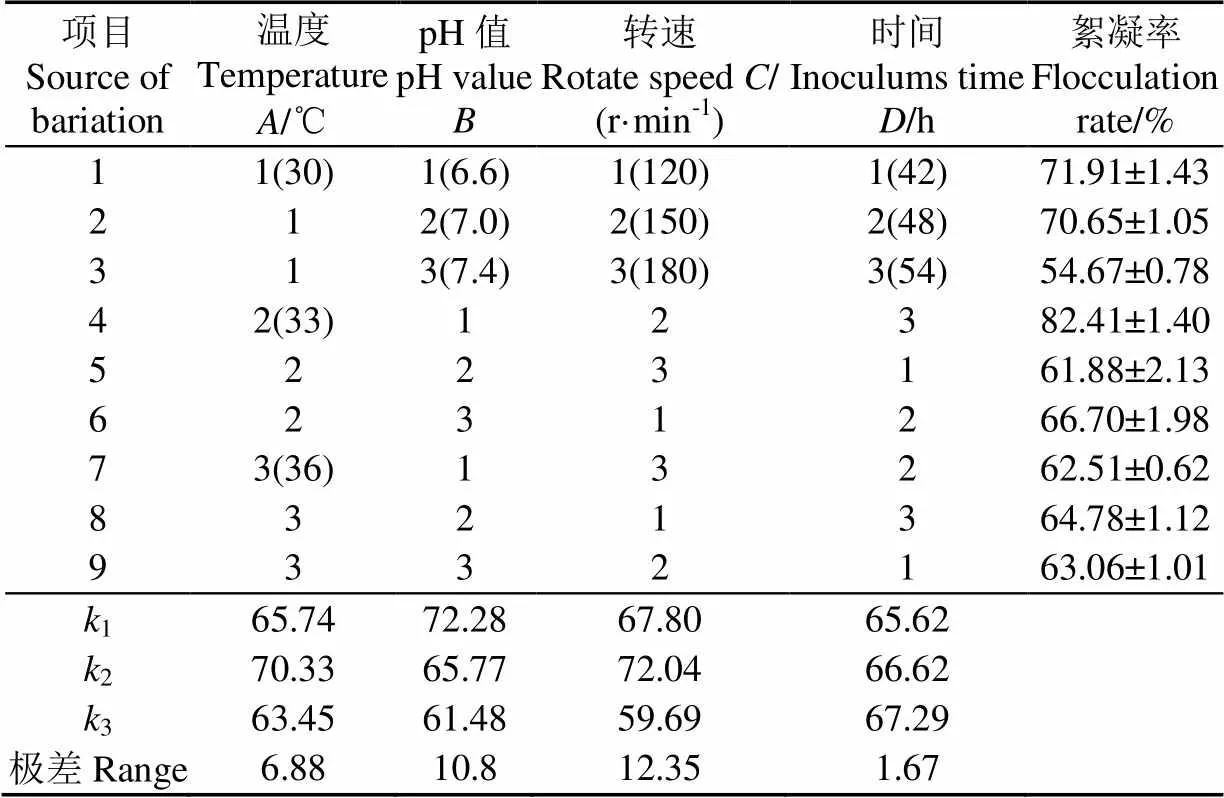
表3 正交试验结果与分析

表4 Duncan多重比较结果
注:**表示变量各水平多重比较时差异极显著(<0.01)同一行肩标不同字母表示差异显著(<0.05),下同。
Note: ** signifies the difference of variable at each level is very significant during multiple comparison at<0.01, the data with different letters on the same line show significant difference (<0.05), the same as follow.
2.4.2 培养基碳氮源优化
发酵培养基的碳源是影响絮凝剂产生的关键因素,它直接影响絮凝剂的生产成本,从而限制其市场化。培养基不同碳源对发酵产絮凝剂的研究结果(表5)表明,淀粉为碳源时絮凝率均大于75.18%,麸皮为碳源时絮凝率非常低,最高不超22.41%,玉米粉为碳源时相较麸皮较好,但絮凝率最高也仅为39.79%。不同含量的淀粉对产絮凝剂的影响也不同(表5),适宜的淀粉浓度有利于菌株生长及代谢产物的积累,淀粉添加量过多时,菌株在生长过程中分解淀粉为葡萄糖,大量的葡萄糖导致pH值降低,胞外渗透压上升。其中以添加20 g/L的淀粉效果最好,与标准的对照组差异不显著(>0.05)。
氮源优化结果表明(表5),随着无机氮NH4Cl浓度增加,絮凝率呈现提高趋势,当其质量浓度为3.5 g/L时絮凝率最大为67.38%,但仍显著低于对照组(<0.05)。当以尿素为氮源时,添加量为1.5 g/L时絮凝率最高为60.08%。而豆粕作为氮源时絮凝率最高仅为47.82%。

表5 不同碳源、氮源及其浓度对絮凝率的影响
2.5 微生物絮凝剂与化学絮凝剂在猪场污水中的应用
生物絮凝和化学絮凝对水质的影响见表6。可以看出微生物絮凝剂对猪场污水的絮凝效果显著优于化学絮凝剂。经计算两者的絮凝率分别为79.0%和62.7%。
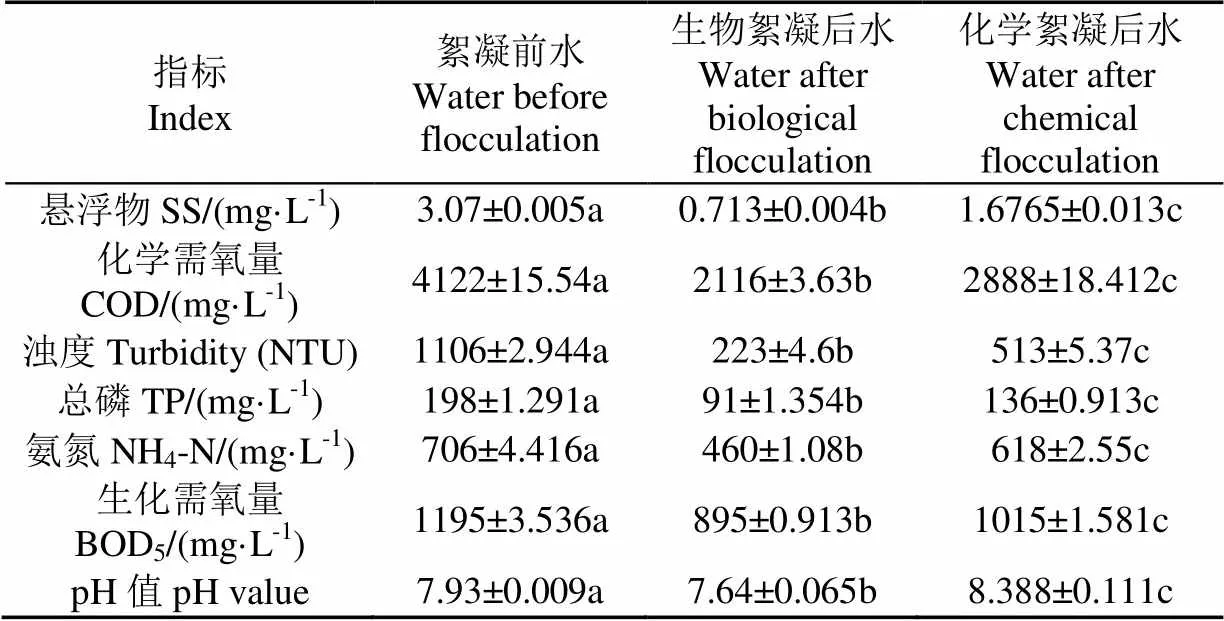
表6 生物絮凝与化学絮凝对水质的影响
2.6 絮凝剂成分组成
提纯后的微生物絮凝剂紫外扫描图谱如图4所示,可以看出吸收曲线较光滑,260 nm有小的吸收峰,260 nm处无特征吸收峰,说明微生物絮凝剂中含微量蛋白,不含核酸[17]。

图4 絮凝剂紫外光谱分析
由红外光谱图(图5)可见,提纯后的微生物絮凝剂具有多糖特征。因为3 100~3 700 cm-1内有一强且宽的吸收峰,波峰在3 423.39 cm-1处为O-H键;2 937.03 cm-1处有一较弱的吸收峰,为饱和C-H伸缩振动的信号;在1 651.78 cm 的吸收峰是-COOH伸缩震动所致;1 400~1 500 cm-1有一吸收峰,最大吸收波长在1 408.12 cm-1,为C=C伸缩振动的吸收峰;1 200~1 400 cm-1的振动峰为C-H变角振动的吸收峰;950~1 250之间的吸收峰是2种C-O的伸缩振动引起,一种是糖环的醚键C-O-C,另一种是糖环中C-O-H振动引起[16,18],而1 000~1 200 cm-1处的强吸收峰为糖类衍生物的特征峰。1 mg/mL絮凝剂溶液中絮凝剂多糖质量分数测定为65.96%。絮凝剂中含微量蛋白,含量为0.020 11 g/L。

图5 絮凝剂红外光谱分析
3 讨 论
3.1 絮凝菌的分离筛选与鉴定
针对特定絮凝目标分离筛选絮凝微生物是一项复杂的工作,选择合适分离样本并设计好筛选模型可大大提高筛选效率[19]。评价絮凝菌效果的重要指标是其对污水悬浮物的絮凝沉降能力,一般原始生长环境中的微生物对它的生长环境具有适应能力,因此,本研究采集猪场沉淀池污泥样品筛菌。本试验以对猪场污水悬浮物絮凝能力为指标,在41株细菌中筛选到6株能有效絮凝场污水悬浮物的细菌,说明有针对性的采集样本,可以提高筛选效率。
3.2 培养条件的优化
每一种絮凝剂均存在最佳添加量,过多过少的添加量都会减弱絮凝效果。本试验中,发酵液添加量过少时,可能导致絮凝剂分子不能有效吸附污水悬浮颗粒形成架桥[20];当发酵液添加量过高时,过多的絮凝剂之间存在较强的斥力抑制絮体生成[21]。因此最佳添加量为1%,絮凝率达80.95%。
絮凝过程中添加金属离子有助凝作用,比如金属钙离子,这主要是因为钙离子通过库仑引力靠拢到带负电荷的悬浮物颗粒形成Ca2+悬浮物复合物。通过减少相邻悬浮物颗粒双扩散层厚度,减少了颗粒之间的距离,进而促进絮凝沉淀的发生[22]。本试验1% CaCl2的添加量小于1 mL时,随着添加量增加,絮凝率逐渐上升,大于1 mL时,絮凝率逐渐下降,可见CaCl2的添加量对絮凝率影响较大,添加量增大能压缩胶体双电层,降低静电斥力,促进絮凝剂的絮凝与吸附,因此,添加量最好为1 mL。
正交试验结果表明转速对絮凝率的影响最大。转速不仅和发酵培养基中溶解氧的浓度有关,也可影响菌株对营养物质的吸收和细胞内代谢反应[23]。转速过高时,发酵培养基中溶解氧充足,微生物细胞快速增殖消耗掉大量养分,导致絮凝产物的生成较少;转速过低时,发酵培养基中溶解氧不足,微生物竞争氧气,影响细胞正常代谢反应和对养分的吸收,从而对菌株FD-14的生长和代谢产物的合成造成不利影响[24]。摇床转速为130 r/min时奇异变形杆菌TJ-1的絮凝产物的絮凝率最高,转速为160 r/min时地衣芽孢杆菌X14合成的微生物絮凝剂絮凝率最高[25]。菌株FD-14合成絮凝剂的最佳转速为150 r/min,与其他研究报道中最佳转速相比较低[26]。
培养基初始pH值对生物絮凝剂的生产具有重要影响[27]。培养基初始pH值决定了表面电荷和氧化还原电位,进而影响微生物营养吸收和酶反应[28]。pH值不仅影响微生物的生长和絮凝产物的生成和积累,还能影响絮凝产物的表面电荷,进而影响其絮凝活性。当微生物絮凝剂在一定pH值范围内,胶体颗粒表面电荷有所降低,使得颗粒之间的相互斥力减弱,从而有利于絮凝剂与颗粒之间的桥联作用,此pH值即为该絮凝剂的最佳酸碱环境。培养基初始pH值为7时絮凝率最大为80.62%,而正交试验结果表明pH 值6.6时,絮凝率为83.01%,此后,当培养基初始pH值继续上升絮凝率随之降低。说明该菌所产絮凝剂在碱性环境下絮凝效果较差,在中性近酸性环境条件下有较高的絮凝活性。
培养温度是絮凝率的第三影响因素。培养温度不仅能对微生物的生长和新陈代谢有影响,而且影响微生物细胞内酶的活性[23]。不同的微生物生成絮凝剂的最适温度不一样,如奇异变形杆菌TJ-1产微生物絮凝剂的最佳温度为25 ℃[29],地衣芽孢杆菌X14产微生物絮凝剂的最佳温度为37 ℃[25]。本试验获得的菌株FD-14产絮凝剂的最佳温度为33 ℃,温度过高导致菌株体内酶的活性降低甚至丧失,影响菌株的生长代谢,造成菌株FD-14发酵液絮凝率低:温度过低,菌株生长缓慢并导致体内酶活性降低,从而减少菌体内代谢产物的生成和积累,降低MF的产生,减少积累量,絮凝率降低。
3.3 微生物絮凝剂与化学絮凝剂在猪场污水中的应用
微生物絮凝剂与化学絮凝剂对猪场污水絮凝效果对比(表6)表明,微生物絮凝剂显著优于化学絮凝剂。化学絮凝剂絮凝污水主要是电中和作用[30]。微生物絮凝剂具有链状结构,分子上的活性基团(羟基和羧基基团)为污水悬浮物提供吸附位点[31],相对于无机絮凝剂,微生物絮凝剂可以更有效的絮凝猪场污水。此外,污水处理厂大规模应用无机絮凝剂如聚合氯化铝会引发健康风险[25]。微生物絮凝剂产生菌FD-14来自猪场沉淀池污泥,所产絮凝剂对如污泥pH值、盐度等特性,具有良好的适应性,且具有易生物降解、高效无毒等突出优点,是具有广阔的应用前景的新型高效絮凝剂。
本试验获得的絮凝剂产生菌适应猪场污水原始pH值,絮凝前所取水样pH值7.93,微生物絮凝后所取水样pH值7.64,絮凝率达79.0%。同时,对猪场污水浊度和COD的去除率分别达到80%和48.6%,而崔亚楠筛选的菌株xn17所产絮凝剂需调节猪场污水pH值到9.5时,对猪场污水浊度和COD的去除率分别为80%和47%[31-32]。微生物絮凝剂产生菌FD-14不需要调节pH值就能达到相似的絮凝结果从而降低处理成本,是一株较好的絮凝猪场污水悬浮物的絮凝菌。
3.4 絮凝剂成分分析
通过紫外光谱分析、红外光谱分析、苯酚-硫酸法、考马斯亮蓝法对絮凝剂成分进行分析,发现该絮凝剂是富含羟基和羧基的多糖类絮凝剂,这与文献中微生物絮凝剂多半以多糖为主,且富含的羟基和羧基对絮凝效果有重要作用的报道一致[16-17,33]。
4 结 论
1)从污泥中筛选到一株高效絮凝剂产生菌FD-14,经分子生物学鉴定为解淀粉芽孢杆菌。其产生的具有絮凝活性的发酵液,在助凝剂氯化钙最佳添加量为0.02 g/mL条件下,优选菌株添加体积分数为1%,对猪场污水的絮凝率可达80%。
2)菌株FD-14产生物絮凝剂的最优培养条件为pH值6.6,温度33 ℃,搅拌转速150 r/min,培养时间42 h。工业化生产最优培养基为:淀粉2 g/mL,酵母粉0.5 g/mL和牛肉膏0.2 g/mL,硫酸镁0.2 g/mL,氯化钠1g/mL,磷酸氢二钾0.5g/mL,磷酸二氢钾0. g/mL。
3)菌FD-14分泌产生的主要物质是多糖,含微量蛋白,因此具有很强的热稳定性,多糖质量分数为65.96%。
[1] 段妮娜,董滨,何群彪,等. 规模化养猪废水处理模式现状和发展趋势[J]. 净水技术,2008,27(4):9-15.
Duan Nina, Dong Bin, He Qunbiao, et al. Current status and advances in swine wastewater treatment technology for scaled hoggery[J]. Water Purification Technology, 2008, 27(4): 9-15. (in Chinese with English abstract)
[2] 成文. 养猪场废水的化学混凝后处理[J]. 华南师范大学学报:自然科学版,2000(1):82-86.
Cheng Wen. Post-treatment of chemical coagulation in piggery wastewater[J]. Journal of South China Normal University, 2000(1): 82-86. (in Chinese with English abstract)
[3] Salehizadeh H, Shojaosadati S A. Extracellular biopolymeric flocculants. Recent trends and biotechnological importance[J]. Biotechnology Advances, 2001, 19(5): 371-385.
[4] Xia S, Zhang Z, Wang X, et al. Production and characterization of a bioflocculant byTJ-1[J]. Bioresource Technology, 2008, 99(14): 6520.
[5] Gong W X, Wang S G, Sun X F, et al. Bioflocculant production by culture ofand its application in wastewater treatment[J]. Bioresour Technol, 2008, 99(11): 4668-4674.
[6] Li J, Li D, Yang Y, et al. Acrylamide induces locomotor defects and degeneration of dopamine neurons in Caenorhabditis elegans.[J]. Journal of Applied Toxicology, 2016, 36(1): 60-67.
[7] Zawilla N H, Taha F M, Kishk N A, et al. Occupational exposure to aluminum and its amyloidogenic link with cognitive functions[J]. Journal of Inorganic Biochemistry, 2014, 139: 57.
[8] Xiong Y, Wang Y, Yu Y, et al. Production and Characterization of a Novel Bioflocculant from Bacillus licheniformis[J]. Applied & Environmental Microbiology, 2010, 76(9): 2778-2782.
[9] 黄海波. 高浓度养猪废水处理工艺研究[D]. 杨凌:西北农林科技大学,2013.
Huang Haibo. Study on High Concentration of Piggery Wastewater Treatment Process[D]. Yangling: Northwest A&F University, 2013.
[10] Flemming H C, Wingender J. The biofilm matrix[J]. Nature Reviews Microbiology, 2010, 8(9): 623.
[11] Salehizadeh H, Vossoughi M, Alemzadeh I. Some investigations on bioflocculant producing bacteria[J]. Biochemical Engineering Journal, 2000, 5(1): 39-44.
[12] Wang L, Ma F, Lee D J, et al. Bioflocculants from hydrolysates of corn stover using isolated strainW2[J]. Bioresource Technology, 2013, 145(19): 259.
[13] 刘林林,黄旭雄,危立坤,等. 15株微藻对猪场养殖污水中氮磷的净化及其细胞营养分析[J]. 环境科学学报,2014,34(8):1986-1994.
Liu Linlin, Huang Xuxiong, Wei Likun, et al. Removal of nitrogen and phosphorus by 15strains of microalgae and their nutritional values in piggery sewage[J]. Acta Scientiae Circumstantiae, 2014, 34(8): 1986-1994. (in Chinese with English abstract)
[14] 郭俊元. 微生物絮凝与改性沸石吸附联合处理猪场废水的研究[D]. 长沙:湖南大学,2013.
Guo Junyuan. Treatment of swine wastewater using bioflocculation and adsorption with chemically modified zeolite[D]. Changsha: Hunan University, 2013.
[15] 张云波,李政,刘其友,等. 微生物絮凝剂产生菌KJ-10的絮凝性能及絮凝成分分析[J]. 环境工程学报,2011,5(4):951-955.
Zhang Yunbo, Li Zheng, Liu Qiyou . Flocculating property and ingredient analysis of the microbial flocculant-producing strain KJ-10[J]. Chinese Journal of Environmental Engineering, 2011, 5(4): 951-955. (in Chinese with English abstract)
[16] 朱富坤,刘彬彬,闫永胜,等. 微生物絮凝剂PF-2的成分分析及絮凝机制研究[J]. 环境污染与防治,2008,30(2):37-40.
Zhu Fukun, Liu Binbin, Yan Yongshen. Composition and flocculating mechanism of microbial flocculant PF-2[J]. Environmental Pollution & Control, 2008, 30(2): 37-40. (in Chinese with English abstract)
[17] 唐静,王兰. 微生物絮凝剂XM09活性成分分析及应用[J]. 环境工程学报,2011,5(4):939-944.
Tang Jing, Wang Lan. Application and analysis of active ingredient of microbial flocculant XM09[J]. Chinese Journal of Environmental Engineering, 2011, 5(4): 939-944. (in Chinese with English abstract)
[18] 张晓辉,李双石,杨国伟,等. 产絮凝剂微生物的制备及其絮凝成分分析[J]. 安全与环境工程,2008,15(4):39-42. Zhang Xiaohui, Li Shuangshi,Yang Guowei, et al. Preparation of flocculant-producing microorganism and property analysis of microbial flocculant[J]. Safety & Environmental Engineering, 2008, 15(4): 39-42. (in Chinese with English abstract)
[19] 齐爱勇,魏东盛,刘大群,等. 番茄灰霉病拮抗细菌的筛选[J]. 中国农学通报,2006,22(6):311-313.
Qi Aiyong, Wei Dongshen, Liu Daqun, et al. Screening of antagonistic bacteria against botrytis cinerea[J]. Chinese Agricultural Science Bulletin, 2006, 22(6): 311-313. (in Chinese with English abstract)
[20] Zhang Z Q, Si Q, Xia S Q, et al. Production and application of a novel bioflocculant by multiple-microorganism consortia using brewery wastewater as carbon source[J]. Journal of Environmental Sciences(China), 2007, 19(6): 667.
[21] Yim J H, Kim S J, Ahn S H, et al. Characterization of a novel bioflocculant, p-KG03, from a marine dinoflagellate,KG03.[J]. Bioresource Technology, 2007, 98(2): 361-367.
[22] Li W, Zhou W, Zhang Y, et al. Flocculation behavior and mechanism of an exopolysaccharide from the deep-sea psychrophilic bacterium. SM9913.[J]. Bioresource Technology, 2008, 99(15): 6893-6899.
[23] Zhang J L Z, Wang S, Jiang P. Characterization of a bioflocculant produced by the marine myxobacteriumNU-2[J]. Applied Microbiology & Biotechnology, 2002, 59(4/5): 517-522.
[24] Shih I L, Van Y T, Yeh L C, et al. Production of a biopolymer flocculant from Bacillus licheniformis and its flocculation properties[J]. Bioresource Technology, 2001, 78(3): 267-272.
[25] Li Z, Zhong S, Lei HY, et al. Production of a novel bioflocculant byX14 and its application to low temperature drinking water treatment[J]. Bioresource Technology, 2009, 100(14): 3650-3656.
[26] Liu W J, Wang K, Li B Z, et al. Production and characterization of an intracellular bioflocculant byW6 cultured in low nutrition medium[J]. Bioresource Technology, 2010, 101(3): 1044-1048
[27] Zhang B, Fan R, Bai Z, et al. Biosorption characteristics of Bacillus gibsonii S-2 waste biomass for removal of lead (II) from aqueous solution[J]. Environmental Science and Pollution Research, 2013, 20(3): 1367-1373.
[28] Liu J, Ma J, Liu Y, et al. Optimized production of a novel bioflocculant M-C11 by. and its application in sludge dewatering[J]. Journal of Environmental Sciences (China), 2014, 26(10): 2076-2083.
[29] Xia S Q, Zhang Z Q, Wang X J, et al. Production and characterization of a bioflocculant by Proteus mirabilis TJ-1[J]. Bioresource Technology, 2008, 99(14): 6520-6527
[30] 刘欢,李亚林,时亚飞,等. 无机复合调理剂对污泥脱水性能的影响[J]. 环境化学,2011,30(11):1877-1882.
Liu Huan, Li Yalin, Shi Yafei. Influence of inorganin comopsite conditioner on dewatering performance of sewage sludge[J]. Environmental Chemistry, 2011, 30(11): 1877-1882. (in Chinese with English abstract)
[31] 于荣丽,孙丽娜,孙铁珩. 微生物絮凝剂絮凝机理的研究概况及例证[J]. 安全与环境学报,2012(1):24-26.
Yu Rongli, Sun Lina, Sun Tieheng. Research on the flocculation mechanism of microbial flocculants[J]. Journal of Safety & Environment, 2012, 12(1): 1-4. (in Chinese with English abstract)
[32] 崔亚楠. 生物絮凝剂处理养殖废水研究[D]. 郑州:郑州大学,2011.
Cui Yanan. Study on treatment of swine wastewater with bioflocculant[D]. Zhengzhou: Zhengzhou University, 2011.
[33] 朱富坤,刘彬彬,闫永胜,等. 微生物絮凝剂PF-2的成分分析及絮凝机制研究[J]. 环境污染与防治,2008,30(2):37-40.
Isolation and identification of flocclant producing strain and its application for swine wastewater clarification
Zhang Luxin1, LuChen2, Li Lvmu1,2※, Xu Yayuan1, Liang Jun1, Diao Huan1, Ding Weimin3
(1.230036; 2.230036; 3.242200)
An efficient flocculant producing strain was isolated, which could effectively flocculate suspended matter in piggery wastewater.The sludge from piggery sewage sedimentation tank was selected as the screening material.Screening was carried out by dilution plate method and screening medium.Colonies with smooth, large and sticky surfaces were selected.Then the plate was used to isolate and purify the strain, and then inoculated into the liquid medium.The flocculation rate of swine wastewater treated by bacterial fermentation liquid as index was rescreened.Finally, a flocculant producing bacterial strain FD-14 was obtained and identified by 16S rDNA.First, single factor experiments were conducted on the culture conditions, in order to determine the influence of 4 factors on the flocculation activity, such as culture temperature, pH value, rotational speed and time,L9 (34) orthogonal design was used to optimize the culture conditions of the strain.The culture conditions were optimized: Temperature: 30, 33 and 36 ℃; pH vale: 6.6, 7, 7.4; speed: 120, 150, 180 r/min, and incubation time: 42, 48, 54 h.Then the single factor experiment was used to optimize the carbon and nitrogen source of the medium.By using ultraviolet spectroscopy, infrared spectroscopy, phenol sulfuric acid method and Coomassie brilliant blue method was used to analyze the components of flocculant. Under the optimal conditions, strain FD-14 was cultured and fermentation broth was used as a crude flocculant, which had been applied to practical swine farm wastewater treatment. The results showed that FD-14 was identified asbased on 16S rDNA gene sequencing. The optimum culture conditions of strain FD-14 were 33 ℃, initial pH value 6.5, rotational speed of 150 r/min, and 42 h incubation. The results showed that strain FD-14 could use starch as an alternative inexpensive carbon source for the fermentation medium, the flocculation rate of 80.80% was not significantly different (>0.05) from the original standard medium. The effect of substituting inexpensive nitrogen sources was poor; the flocculation rate of the best, ammonium chloride, was 67.38%, which was significantly less than the original standard medium (<0.05). According to the practical application results on a swine farm, the flocculation rates of the microbial and chemical flocculants of the swine farm wastewater were 79.0% and 62.7%, respectively. The flocculation rate of the microbial flocculant was 16.3% higher than that of the chemical flocculant. Analysis using UV and IR spectroscopy, the phenol sulfuric acid method, and the Coomassie brilliant blue method of flocculant composition revealed that the polysaccharide flocculant was rich in hydroxyl and carboxyl groups. Strain FD-14 mainly secreted 65.96% polysaccharide substances, but the protein content was minimal, so it had strong heat stability.In this study, it could be concluded that bioflocculant-producing bacteria with high flocculating activity and flocculation might be used for flocculation of swine farm wastewater.
screening; wastewater; purification; Bacillus amyloliquefaciens; flocculant; flocculation characteristics
10.11975/j.issn.1002-6819.2017.20.031
S18
A
1002-6819(2017)-20-0250-07
2017-03-29
2017-10-10
国家星火计划重点项目(2014GA710002)
张鲁新,主要从事微生物学研究。Email:791535996@qq.com
※通信作者:李吕木,男,安徽和县人,研究员,博士,博士生导师,主要从事畜牧微生物与动物营养研究。Email:llm56@ahau.edu.cn
张鲁新,鲁 陈,李吕木,徐雅芫,梁 君,刁 欢,丁维民. 产絮凝剂菌种的筛选及其在猪场污水净化中的应用[J]. 农业工程学报,2017,33(20):250-256. doi:10.11975/j.issn.1002-6819.2017.20.031 http://www.tcsae.org
Zhang Luxin, Lu Chen, Li Lvmu, Xu Yayuan, Liang Jun, Diao Huan, Ding Weimin. Isolation and identification of flocclant producing strain and its application for swine wastewater clarification[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(20): 250-256. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.20.031 http://www.tcsae.org
