适宜的毛管埋深提高温室番茄品质及产量
2017-11-13王京伟牛文全郭丽丽梁博惠
王京伟,牛文全,郭丽丽,梁博惠,李 元
适宜的毛管埋深提高温室番茄品质及产量
王京伟1,2,牛文全1,3※,郭丽丽4,梁博惠4,李 元1
(1. 西北农林科技大学水土保持研究所,杨凌 712100;2. 山西省水土保持生态环境建设中心,太原 030002; 3. 中国科学院、水利部水土保持研究所,杨凌 712100;4. 西北农林科技大学水利与建筑工程学院,杨凌 712100)
为探索地下滴灌条件下,毛管埋深对作物“地上部分-地下部分-产量和品质”相互作用的影响,合理配置滴灌措施,提高水分管理能力,该文研究了4种不同毛管埋深0、10、20和30 cm(CK、S10、S20和S30)对番茄植株生长、根系生长、光合产物分配、果实产量、品质和水分利用效率的影响,结果表明:与地面滴灌(CK)相比,毛管埋深为10 cm的番茄根系分叉数显著增加85.16%,但根长、根面积、番茄产量未显著提高,且番茄红素显著降低18.85%(<0.05);毛管埋深为20 cm,盛果期I番茄叶面积指数显著增加23.37%,根长、根面积、根系分叉数分别显著提高43.22%、20.82%、176.61%,番茄产量提高22.35%,番茄果实品质显著改善,如可溶性固形物、可溶性蛋白、维生素C、番茄红素含量和糖酸比分别提高10.86%、32.34%、35.66%、33.97%和53.01%,水分利用效率显著提高35.91%(<0.05);毛管埋深为30 cm,番茄根长、根系分叉数显著提高46.10%、122.37%,番茄产量显著提高19.53%,水分利用效率显著36.93%,但番茄红素显著降低34.02%。综合考虑番茄品质和产量,地下滴灌毛管埋深20 cm是较为适宜的布设方式。
灌溉;水分;土壤;地下滴灌;埋深;番茄;品质;产量
0 引 言
番茄果实富含维生素、类胡萝卜素及各种糖类物质,营养价值丰富[1],是人们喜欢食用的重要蔬菜,在中国西北地区广泛种植[2]。番茄生长需水量大[3],而中国西北地区属干旱、半干旱气候区[4],水资源缺乏是限制番茄生产的主要因素[5]。
地下滴灌通过地埋毛管将水分直接、缓慢渗流到作物根区土壤[6-7],能减少土壤水分蒸发[8-9]、疏松土壤[10-12]、高效节水[13],广泛用于果蔬种植中[14]。Rui等[15]研究表明,地下滴灌能促进根系生长,提高滴灌湿润区的根长密度,有利于水肥管理,增加番茄产量。有研究表明适度的毛管埋深能显著优化根系分布、提高根系活力[16-17],这将促进土壤养分吸收[18],提高产量和水分利用效率[19]。地下滴灌特殊的水分运移方式,提高了根区土壤湿润区持水性[20-21],促进土壤养分和微生物活化[22],增强根系对养分的吸收,促进番茄单果生长[23],进而提高了产量和水分利用效率,但这些机制内在机理还不清楚。另外,作物生长过程中,植株各部分物质交换、分配和能量流动相互影响、相互制约。有关地下滴灌对番茄生长影响的研究,更多关注水、肥对番茄根系生长、产量和水分利用效率的影响,而对毛管埋深,毛管布置方式对产量、品质影响的研究还较少。
因此,本文重点研究了不同毛管埋深地下滴灌对番茄根系生长、植株生长、产量和品质等的影响,分析地下滴灌条件下“土壤-作物-产量及品质”相互作用对光合产物累积和分配的影响,探讨地下滴灌节水增产优势的内在机制,以期为合理配置滴灌措施,完善灌溉制度,提高水土资源利用效率等提供参考。
1 材料和方法
1.1 试验区概况及试验设计
试验地位于108°08′E,34°16′N,海拔521 m,属于暖温带半湿润季风区,年均气温约16.3 ℃,多年平均降水量约535.6 mm,年均日照时数约2163 h,年均无霜期约210 d。试验于2014年10月-2015年5月在陕西杨凌区大寨乡大寨村菜农的生产用日光温室内进行。温室内无加温设施,在越冬季(2014年12月-2015年3月),白天通过透光塑料膜增温,夜间在温室表面加盖草被和棉被进行保温;试验载植耐冷型番茄品种“海地”。越冬季温室内平均气温维持在20 ℃,能基本满足番茄生长对温度的要求。试验温室东西长108 m,南北宽8 m。供试土壤容重为1.35 g/cm3,田间持水量为28.17%(质量含水率),土壤孔隙度为49.38%。土壤组成为砂砾(>0.02~2 mm)占25.4%,粉粒(>0.002~0.02 mm)占44.1%,黏粒(<0.002 mm)占30.5%。在温室内从西向东划分种植小区,种植小区起双垄,小区面积为3.4 m2(长6.0 m,垄面宽0.6 m,高0.2 m,沟宽0.3 m)。每个小区定植34株,采用双行种植,植株间距0.35 m。试验地两端均设保护行。
试验以地面滴灌为对照(CK),其毛管位于番茄行距中间,灌水上、下限分别为75% FC(FC为田间持水量)、70% FC。设3个地下滴灌处理,毛管位于番茄行距中间,埋深分别为10 cm (S10)、20 cm (S20)和30 cm (S30),考虑到地下滴灌比地上滴灌更节水,地下滴灌的灌水上、下限分别为65% FC、60% FC。
每个处理设3个重复,共12个试验小区。试验铺设地膜(江苏靖江市新丰塑料厂)为白色透光高压低密度聚乙烯地膜,膜厚度0.014 mm,滴灌管(甘肃大禹节水集团股份有限公司)为内镶式扁平滴灌管,直径16 mm,壁厚0.3 mm,滴头间距30 cm,工作压力为0.1 MPa,滴头流量为1.2 L/h。
在每个试验小区中间安装1 根深度为100 cm探管,采用Field TDR 200测试土壤含水率(美国Spectrum公司),进行水分控制,按10 cm的等间隔测试土壤含水率,深度测至60 cm,并用打钻取土烘干法校正。当土壤含水量达到土壤水分下限时,按照湿润层40 cm进行计算补充水分。灌水量计算式为
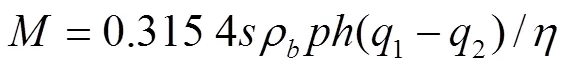
式中为灌水量,m3;为计划湿润面积,根据种植小区面积及生产实践取值4.6 m2;b为土壤容重,试验地土壤容重为1.35 g/cm3;为湿润比,为水分利用系数,根据当地番茄种植水分消耗,取值0.8,取值0.95;为湿润层深度,当地灌溉取值0.4 m;1、2分别为灌水上限、土壤实测含水率,%。
次灌水量的理论值为5% FC,由于无法实现对土壤水分的连续监控,实测土壤水分含量略低或略高于控制灌水下限,因此,实际灌水量约为10 mm。根据番茄生长情况,在开花坐果期(番茄定植后0~50 d)每隔4 d灌水1次,盛果期(番茄定植后50~140 d)每隔3 d灌水1次,成熟期(番茄定植后140~180 d)每隔4 d灌水1次。试验没有测得ET,根据水量平衡公式进行估算:

式中ET为实际作物需水量,mm;Pr为有效降雨量,mm;为灌水量,mm;为地下水补给量,mm;为径流量,mm;为深层渗漏量,mm;Δ为试验初期和末期土壤储水量差值,mm。由于试验地的地下水位较深(一般在5.0 m以下),作物无法吸收利用,故地下水补给量忽略不计,即=0;由于温室内没有降雨,Pr=0,试验采用滴灌,每次灌水量较少,故和可以忽略不计。估算得到4个处理CK、S10、S20和S30的EI值分别为283.17、264.05、256.48和247.92 mm,低于实际灌水量,实际灌水满足了番茄的水分需求。
1.2 测定指标
1.2.1 株高与茎粗
番茄定植后,于每个试验小区标记3株植株,排除边际效应的植株。开始试验处理后,观测株高和茎粗,使用精度1 mm的直尺测量植株株高,打顶后停止测量。采用十字交叉法,使用游标卡尺,选取植株基部的第3处节间测量植株直径,每10 d观测一次。
1.2.2 净光合速率、叶面积指数、光合色素
番茄植株叶片的光合速率分别于开花坐期(FP,番茄定植后0~50 d)、盛果期Ⅰ(FF1,番茄定植后50~100 d)、盛果期 II(FF2,番茄定植后100~140 d)、果实成熟期(MP,番茄定植后140~180 d),即2015年1月2日、2月4日、3月18日、4月15日的上午09:00-11:00分别进行了测定。用LI-6400便携式光合仪(美国LI-COR公司)测定番茄植株主茎叶净光合速率,仪器使用开放式气路,内置光源,光照度为800mol/(m2·s)。测定时每个处理每个试验小区随机选择3株植株,每株选择3张叶位一致、充分受光的叶片,每张叶片测定3次,取平均值。同时,采用手持式LI-3100C叶面积仪(美国LI-COR)测定各处理叶面积指数。每次光合速率测定完成后,在当天下午采集叶片,带回实验室采用丙酮浸提液提取色素,用分光光度计比色法分别于665、649、470 nm处测定叶片叶绿素a、叶绿素b、类胡萝卜素的吸光值,每个处理重复3次,取平均值,单位为mg/g。总叶绿素=叶绿素a+叶绿素b,叶绿素a/b=叶绿素a/叶绿素b。
1.2.3 植株干物质及根系分析
番茄果实开始成熟时,在每个处理对应的每个试验小区(4个处理,共12个试验小区),随机选取3株番茄植株,并编号标记。自2015年3月18日至5月3日进行果实采摘,果实采摘结束后,将提前标记好的番茄植株割掉地上植株部分,收集编号。植株样本带回实验室,称量鲜质量后,在鼓风干燥箱中烘干(105 ℃杀青30 min后在75 ℃条件下烘干36 h至恒质量)后称量干质量。
在对标记好的番茄植株进行地面样品采集后,采用整根挖掘法采集根样。以相邻植株间中线为界,以40 cm×30 cm矩形区域挖掘,深度与实际根深(约50 cm)一致。整体取出根样,将根系样品带回,在实验室用水浸泡,然后用水冲洗使土壤与根分离,冲洗时在冲洗池中铺三层细纱布收集微细根,用镊子将洗净的根样装入自封袋,称质量。用双面扫描仪(Epson Expression 1600 pro, Model EU-35,Japan)扫描根系,用WinRHIZO图像分析系统(WinRHIZO Pro2004b,5.0,Canada)分析总根长(cm),根表面积(cm2)等。根样随后烘干、称质量。
1.2.4 根系活力
分别于2014年12月21日(开花坐果期),2015年1月23日(盛果期)、4月23日(成熟期)采用1.2.3节中的整根挖掘法采集根样,取部分根样,用TTC法进行根系活力的测定。
1.2.5 产量和品质
果实成熟后分区采摘,对各种植小区进行测产,各小区单株产量总和计为该小区产量(t/hm2)。番茄果实可溶性糖含量、可溶性蛋白用、有机酸、维生素C、分别采用蒽酮比色法、考马斯-G250染色法、酸碱滴定法、钼蓝比色法测定,可溶性固形物含量用手持折光测糖仪测定,番茄红素采用EV300PC型紫外-可见分光光度计(Thermo Fisher,美国)测定。果实全氮采用半微量凯氏定氮法测定,全磷采用硫酸-高氯酸钼锑抗比色法测定,有机质采用重铬酸钾滴定法测定。
1.2.6 土壤孔隙度
试验对番茄种植土壤的孔隙度进行了测定,果实收获完毕后,在每个处理种植小区种植沟内按S型设置3个采样点,在土壤剖面0~40 cm深度,每隔10 cm,用容积为100 cm3的环刀取土样,带回实验室内烘干测定土壤容重。容重计算公式为

式中为土壤容重,g/cm3;1为环刀与自然结构土壤总质量,g;0为环刀质量,g;W为水分与新鲜土壤的质量分数;为环刀容积,cm3。
根据土壤容重,进行土壤孔隙度计算,孔隙度计算公式为
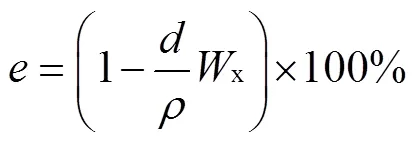
式中为土壤孔隙度,%;为土壤密度即单位体积土壤(不含孔隙)的烘干质量,试验地土壤密度为2.65 g/cm3。
1.3 数据处理
用SPSS22软件进行Duncan多重比较、方差、相关性分析,采用Excel软件作表图和表格。
2 结果与分析
2.1 番茄生长
2.1.1 株高、茎粗和叶面积指数
番茄植株打顶(定植后第80天)前,S20番茄株高最高,但各处理的平均株高经分析并无显著差异(>0.05);CK、S10、S20、S30的株高生长速率(是指把前一次测量值看作100%,相邻2次测量之间的净生长量与前一次测量值的比值)随番茄生长整体上呈降低趋势。CK、S10、S20、S30的株高生长速率定植20~40 d时,分别为72.67%、71.00%、84.33%、70.67%,定植60~80 d时分别下降到23.67%、36.67%、20.33%、23.00%(图1a)。CK、S10、S20、S30的茎粗生长率定植20~40 d时分别为38%、23%、32.33%、43.67%,定植60~80 d时分别为2.67%、5.33%、6%、12.67%,也随番茄生长整体呈降低趋势(图1b)。说明毛管埋深对番茄株高和茎粗生长速率无明显影响。
各处理番茄植株的叶面积指数由开花坐果期至成熟期呈先增后减趋势,盛果期I(FF1)时最大;开花坐果期(FP)、盛果期II(FF2)、成熟期(MP)时,各处理叶面积指数无显著性差异;盛果期I时,S20叶面积指数分别比CK、S10显著提高23.37%、28.25%,S30叶面积指数分别比CK、S10显著提高30.98%、36.16%(图2)。

注:CK、S10、S20和S30分别表示毛管埋深为0、10、20、30 cm,下同。

注:不同字母表示不同处理在同一生育阶段的差异显著(P<0.05),FP、FF1、FF2和MP分别是开花坐果期、盛果期I、盛果期II和成熟期,下同。
2.1.2 叶绿素和光合作用相关指标
各处理番茄叶片的叶绿素a、叶绿素b、总叶绿素及类胡萝卜素含量随生育阶段的发展,总体上呈先增后减趋势,盛果期II时最大(图3)。

图3 地下滴灌番茄不同生育阶段光合色素
CK番茄叶片的叶绿素a、叶绿素b、总叶绿素含量在盛果期I显著高于其他处理,但叶绿素a/b值却分别比S10、S20、S30低16.96%、17.70%和21.19%(<0.05),盛果期II的叶绿素a/b值比S20显著低17.73%(<0.05)(图3)。
叶片叶绿素组分的变化可能会影响叶片的光合特性。从不同处理的光合特性(表1)可以看出,S10番茄叶片净光合速率在盛果期Ⅰ和成熟期比CK显著低16.87%和24.43%;气孔导度在盛果期Ⅰ比CK显著低24.24%,盛果期II时则显著高122.22%;胞间CO2浓度在盛果期II比CK显著低6.89%;蒸腾速率在盛果期Ⅰ比CK显著低21.62%,盛果期II比CK显著高112.87%。
S20番茄叶片净光合速率在盛果期Ⅰ和成熟期比CK显著低24.51%和13.36%;气孔导度在开花坐果期和盛果期II比CK显著高35%和122.22%;胞间CO2浓度在开花坐果期和盛果期Ⅰ比CK显著高14.10%和4.46%,盛果期II和成熟期则显著低9.55%和5.57%;蒸腾速率在盛果期Ⅰ比CK显著低10.81%,盛果期II比则显著高121.45%。
S30番茄叶片净光合速率在开花坐果期比CK显著高19.82%,盛果期Ⅰ、盛果期II、成熟期则显著低22.76%、6.46%、13.36%;气孔导度在开花坐果期比CK显著高40%,盛果期Ⅰ和成熟期时显著低18.18%、29.41%;胞间CO2浓度在开花坐果期和盛果期Ⅰ比CK显著高25.65%和6.51%,成熟期时显著低28.88%;蒸腾速率在盛果期Ⅰ和成熟期比CK显著低17.03%和30.36%。
总体而言,不同毛管埋深的番茄叶面积指数和叶片叶绿素组份不同,进而使不同生育阶段番茄的光合特性有一定的差异,CK、S10在番茄FF2阶段的净光合速率最大。

表1 番茄不同生育阶段光合特性
2.1.3 根系生长
番茄根系生长的测定结果(表2)发现,S10根系分叉数比CK提高85.16%(<0.05);S20根长、根面积、根系分叉数分别比CK提高43.22%、20.82%、176.61%(<0.05);S30根长、根分叉数分别比CK提高46.10%、 122.37%(<0.05)。
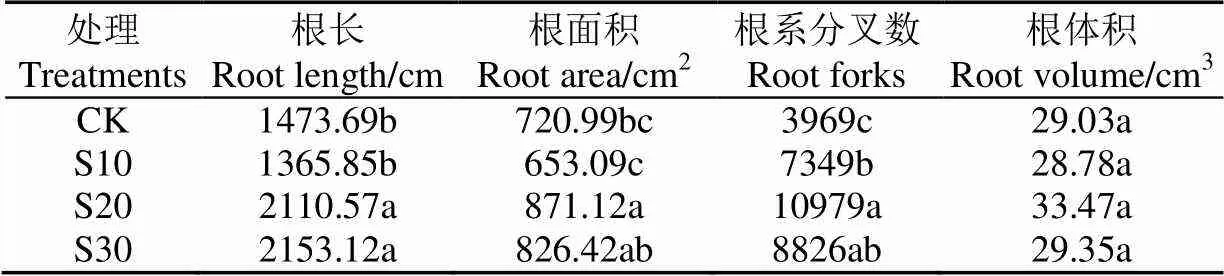
表2 番茄根系生长特征
根系活力是衡量植物根系吸收水分、养分能力的重要指标。S10开花坐果期的根系活力比CK提高17.13%(<0.05),盛果期和成熟期显著降低32.03%和44.86%(<0.05);S20根系活力在开花坐果期和成熟期比CK提高116.92%和12.43%(<0.05);S30根系活力开花坐果期和成熟期比CK分别提高46.04%和49.37%(<0.05),成熟期降低22.87%(<0.05)(图4)。说明S20处理根系生长能力最强。
2.1.4 干物质累积
S10、S20番茄植株干物质量与CK无显著差异,S30番茄植株干物质量分别比CK、S10、S20显著提高50.73%、36.97%、42.60%(图5)。分别对各处理番茄植株的根、茎、叶干物质量进行分析,结果发现各处理的根干质量无显著差异,S30茎干质量和叶干质量比CK分别提高92.67%和57.54%(<0.05),而CK、S10、S20等处理之间差异不显著。
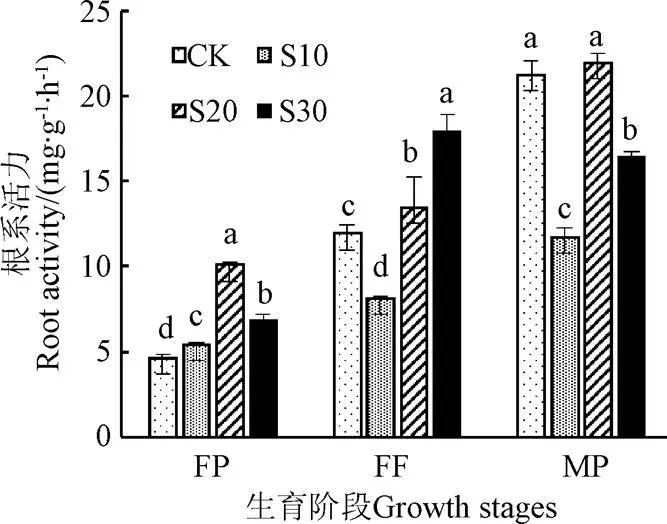
图4 地下滴灌番茄不同生育阶段根系活力

注:a(b,c),表示不同处理根干质量差异达显著水平(P<0.05);a′(b′,c′),表示不同处理茎干质量差异达显著水平(P<0.05);A′(B′,C′),表示不同处理叶干质量差异达显著水平(P<0.05);A(B,C),表示植株干物质量差异达显著水平(P<0.05)。
根、茎、叶干物质量占植株干物质量的比例可以表征光合产物的分配,因此进一步分析各处理番茄植株的根、茎、叶干物质量占植株干物质量的比例,结果表明各处理根干质量占植株干质量的比例无显著差异,S10、S20茎干质量占植株干质量比例分别比CK提高11.9% 和11.13%(<0.05)、分别比S30提高13.17%和12.39%(<0.05)。CK、S30叶干质量占植株干质量比例分别比S10提高18.32%和24.3%(<0.05)、分别比S20提高20.34% 和26.42%(<0.05)。说明毛管埋深主要影响地上部分干物质质量,改变了地上部分与地下部分干物质质量比。
2.2 番茄品质与产量
由表3可知,S10番茄果实可溶性糖、可溶性固形物、维生素C、有机酸含量及糖酸比与CK无显著差异,可溶性蛋白比CK显著高14.5%,番茄红素比CK显著低18.85%;S20番茄果实可溶性糖、有机酸含量与CK无显著差异,可溶性固形物、可溶性蛋白、维生素C、番茄红素含量及糖酸比分别比CK显著高10.86%、32.34%、35.66%、33.97%、53.01%;S30番茄果实可溶性固形物、可溶性蛋白、维生素C、有机酸含量与CK无显著差异,可溶性糖、糖酸比比CK显著高26.54%、44.4%,番茄红素比CK显著低34.02%。说明毛管埋深显著影响番茄的品质,S20处理的番茄品质最好。
由表4可知,S10番茄产量与CK和S30差异不显著,灌水量比CK显著低6.84%,水分利用效率比CK显著高14.83%;S20番茄产量比CK显著高22.35%但与S30差异不显著,灌水量比CK显著低10%但与S30差异不显著,水分利用效率比CK显著高35.91%但与S30差异不显著;S30番茄产量比CK显著高19.53%,灌水量比CK显著低12.72%,水分利用效率比CK显著高36.93%。说明毛管埋深可以显著影响番茄产量,其中S20、S30处理的产量较高。
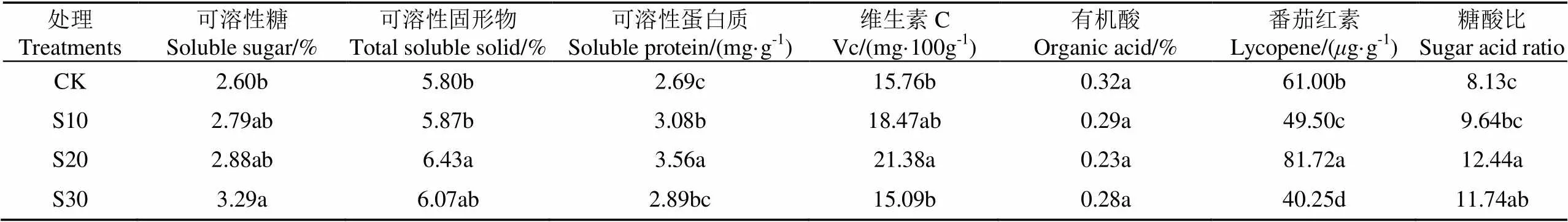
表3 地下滴灌番茄果实品质

表4 地下滴灌番茄产量、灌水量及水分利用效率
3 讨 论
3.1 适宜毛管埋深提高番茄盛果期I光合作用
有研究表明地下滴灌可显著提高番茄叶片叶绿素含量[24],但本试验地下滴灌并未显著提高番茄叶片光合色素含量,主要原因是前述研究水中Ca2+、K+、Mg2+等离子含量较高,促进了叶绿素的合成[25]。植物光合作用及生物量累积与植物叶片叶绿素、光合效率、叶面积指数显著相关[26],叶面积指数显著增加有利于提高作物冠层光线有效辐射的截获,促进番茄植株整体的光合作用[27],叶绿素a/b值的显著增加有利于增强植株对光能的转化利用[28],增加生物累积量[29]。本试验毛管埋深为10、20和30 cm地下滴灌番茄植株盛果期I的叶绿素a/b值显著高于地面滴灌(CK),其中毛管埋深20和30 cm处理番茄植株盛果期I的叶面积指数分别比CK显著提高23.37%、30.98%。因此,本试验中地下滴灌促进了盛果期番茄的光合作用,有利于光合产物累积和产量提高。
另外,光合作用是植物叶片利用二氧化碳和水,在可见光照射下,生成有机物并释放出氧气的过程,而根系是植物吸收利用水分的主要器官,因此植物光合作用还受制于根系生长状况的影响。有研究发现毛管埋深20和40 cm时,能促进根系生长[30]。本试验中毛管埋深10 cm的番茄根系分叉数比地面滴灌显著增加85.16%,毛管埋深20和30 cm的根长比地面滴灌显著增加43.22%,46.10%,根系分叉数则显著增加176.61%、122.37%,盛果期叶面积指数与根长、根面积显著相关,盛果期叶绿素a/b值与根长和根系活力显著相关(<0.01)。较长的根和较大的根面积能促进作物吸收更大、更深土壤范围的水分和养分,更多的根分叉数有利于作物吸收更多的水分和养分[31-33],进而提高叶面积指数和叶片叶绿素a/b值,提高植株光合作用[26-28],因此,地下滴灌可以显著提高番茄的光合作用,促进干物质快速积累。
3.2 毛管埋深影响番茄生物量累积
地下滴灌对番茄植株和根系生长的影响,将集中体现在生物量累积和产量上[34],试验发现,毛管埋深30 cm番茄干物质量、茎干质量、叶干质量分别比地面滴灌提高50.73%、92.67%、57.54%,番茄产量提高了19.53%。毛管埋深20 cm番茄干物质量(不包括果实)虽然与地面滴灌无显著差异,但产量却显著提高了22.35%。试验发现番茄产量与根干质量显著相关(<0.05),与根面积、根系分叉数、根体积极显著相关(<0.01),毛管埋深20 cm的根面积、根系分叉数显著大于地面滴灌,这有利于促进番茄对土壤水分和养分的吸收。因此,毛管埋深20 cm优化了植株光合产物分配,显著提高了番茄产量。
毛管埋深20 cm地下滴灌番茄根面积、根系分叉数的增加可能与土壤孔隙度有关,本试验发现土壤孔隙度与根系分叉数、根系活力显著相关(<0.05)。毛管埋深不同,土壤水分分布不同,进而影响土壤孔隙度,本试验发现地下滴灌根区土壤孔隙度整体优于地面滴灌(表5)。毛管埋深较浅时(埋深10 cm),土壤水分向上迁移距离短,土壤孔隙度与地面滴灌接近;适当增大毛管埋深(埋深20和30 cm),毛管上方土层扩大,土壤水分向四周上下迁移基本均衡,毛管四周土壤的孔隙在土壤水分支撑下不易破坏,有利于增加毛管周围土壤的孔隙度,因此,毛管埋深增大,0~10 cm土壤孔隙度显著增加。

表5 地下滴灌土壤孔隙度
注:SP0-10表示0-10cm土壤孔隙度,依此类推。
Note: SP0-10means soil porosity of 0-10cm below ground, and so on.
3.3 毛管埋深对番茄果实品质的影响
毛管埋深不但影响番茄植株生长和产量,还对番茄果实品质产生了不同程度的影响。试验发现毛管埋深10 cm的番茄果实可溶性蛋白比地面滴灌显著提高14.5%,但番茄红素显著降低18.85%;埋深20 cm番茄果实可溶性固形物、可溶性蛋白、维生素C、番茄红素含量及糖酸比分别比地面滴灌显著提高10.86%、32.34%、35.66%、33.97%、53.01%;埋深30 cm番茄果实可溶性糖、糖酸比比地面滴灌显著提高26.54%、44.4%,但番茄红素显著降低34.02%。有研究发现,地下滴灌能显著提高苹果中可溶性固形物和维生素C[35],这与本文结果相似。
本试验发现土壤孔隙度与番茄果实品质显著相关,原因可能是毛管埋深影响根系生长,增强番茄对土壤养分吸收,改善了番茄品质[36-37]。毛管埋深20 cm地下滴灌能显著改善根区土壤孔隙度(表5),其番茄果实中有机碳、全氮的含量显著高于地面滴灌(表6),果实氮含量的提高有利于品质的改善[38],因此其果实品质显著高于地面滴灌。毛管埋深30 cm处理根系吸收的养分和光合产物更多向植株体分配,这可能造成了果实中氮营养物质比例的相对降低(表6),影响果肉中氨基酸等物质的合成[38],因此,番茄果实品质差于滴灌带埋深20 cm处理。

表6 番茄果实养分含量
地下滴灌在促进番茄生长、提高产量的同时,也提高了水分利用效率。本试验中,地下滴灌3个处理的灌水下限比对照地面滴灌低10%,但地下滴灌3个处理的产量都不低于或显著高于地面滴灌。滴灌管埋深10 cm处理的灌水量比地面滴灌显著低6.84%(表4),水分利用效率比地面滴灌显著高14.83%;滴灌毛埋深20和30 cm处理灌水量比地面覆膜滴灌显著低10%、12.72%,水分利用效率显著高35.91%、36.93%。因此,即使是在灌水下限显著降低的情况下,地下滴灌依然显著促进了番茄的生长发育且提高了水分利用效率。综合考虑,在日光温室番茄的栽植中,地下滴灌带埋深20 cm是较为适宜的灌水布设方式。
4 结 论
毛管埋深20 cm地下滴灌显著促进番茄植株整体光合作用,显著促进根系生长,番茄根长、根面积、根系分叉分别比地面滴灌显著提高43.22%、20.82%、176.61%,番茄产量比地面滴灌显著高22.35%,并显著提高了番茄果实可溶性固形物、可溶性蛋白、维生素C、番茄红素含量及糖酸比,水分利用效率比地面滴灌显著高35.91%,是日光温室番茄的栽植中较为适宜的灌水布设方式。毛管埋深30 cm地下滴灌番茄产量和水分利用效率与毛管埋深20 cm处理无显著差异,但其番茄果实品质不如毛管埋深20 cm处理,是灌水布设方式的次优选择。
[1] Hallmann E. The influence of organic and conventional cultivation systems on the nutritional value and content of bioactive compounds in selected tomato types[J]. Journal of the Science of Food and Agriculture, 2012, 92(14): 2840-2848.
[2] 李红峥,曹红霞,郭莉杰,等. 沟灌方式和灌水量对温室番茄综合品质与产量的影响[J]. 中国农业科学,2016,49(21):4179-4191.
Li Hongzheng, Cao Hongxia, Guo Lijie, et al.Effect of furrow irrigation pattern and irrigation amount on comprehensive quality and yield of greenhouse tomato[J]. Scientia Agricultura Sinica, 2016, 49(21): 4179-4191.(in Chinese with English abstract)
[3] Ngouajio M, Wang G, Goldy R. Withholding of drip irrigation between transplanting and flowering increases the yield of field-grown tomato under plastic mulch[J]. Agricultural Water Management, 2007, 87(3): 285-291.
[4] Zheng J, Huang G, Wang J, et al. Effects of water deficits on growth, yield and water productivity of drip-irrigated onion (L.) in an arid region of Northwest China[J]. Irrigation Science, 2013, 31(5): 995-1008.
[5] Wang J, Huang G, Li J, et al. Effect of soil moisture-based furrow irrigation scheduling on melon (L.) yield and quality in an arid region of Northwest China[J]. Agricultural Water Management, 2017, 179: 167-176.
[6] Wang Dan, Kang Yaohu, Wan Shuqin. Effect of soil matric potential on tomato yield and water use under drip irrigation condition[J]. Agricultural Water Mangement, 2007, 87: 180-186.
[7] Lubana P P S, Narda N K. Modelling soil water dynamics under trickle emitters-a review[J]. Journal of Agricultural Engineering Research, 2001, 78(3): 217-232.
[8] Lamm F R, Trooien T P. Subsurface drip irrigation for corn production: areview of 10 years of research in Kansas[J]. Irrig Sci, 2003, 22: 195-200.
[9] Lamm F R, Kheira A A A, Trooien T P. Sunflower soybean, and grainsorghum crop production as affected by dripline depth[J]. Applied Engineering in Agriculture, 2010, 26: 873-882.
[10] Bordovsky J P, Colaizzi P D, Evett S R, et al. Investigating strategies to improve crop germination when using SDI[J]. Geoflow Com, 2012: 117-132.
[11] Mo Y, Li G, Wang D. A sowing method for subsurface drip irrigation that increases the emergence rate, yield, and water use efficiency in spring corn[J]. Agricultural Water Management, 2017, 179:288-295.
[12] Nasr S, Najafi P. Effects of raw wastewater injection by sdi system on soil physical properties[J]. Research on Crops, 2010, 11(3): 712-715.
[13] Payero J O, Tarkalson D D, Irmak S, et al. Effect of irrigation amounts applied with subsurface drip irrigation on corn evapotranspiration, yield, water use efficiency, and dry matter production in a semiarid climate[J]. Agricultural Water Management, 2008, 95(8): 895-908.
[14] Singh D K, Singh R M, Rao K V R. Subsurface drip irrigation system for enhanced productivity of vegetables[J]. Environment Ecology, 2010, 28(3): 1639-1642.
[15] Rui M A M, Rosário M D, Oliveira G, et al. Tomato root distribution, yield and fruit quality under subsurface drip irrigation[J]. Plant and Soil, 2003, 255(1): 333-341.
[16] Kong Q, Li G, Wang Y, et al. Bell pepper response to surface and subsurface drip irrigation under different fertigation levels[J]. Irrigation Science, 2012, 30(3): 233-245.
[17] Zhuge Y, Zhang X, Zhang Y, et al. Tomato root response to subsurface drip irrigation[J]. Pedosphere, 2003, 14(2): 205-121.
[18] Rogers E D, Benfey P N. Regulation of plant root system architecture: Implications for crop advancement[J]. Current Opinion in Biotechnology, 2015, 32: 93-98.
[19] Bidondo D, Andreau R, Martinez S, et al. Comparison of the effect of surface and subsurface drip irrigation on water use, growth and production of a greenhouse tomato crop[J]. Acta Horticulturae, 2012, 927(927): 309-314.
[20] Shen Z, Ren J, Wang Z, et al. Effects of initial water content and irrigation frequency on soil-water dynamics under subsurface drip irrigation[J]. Journal of Food, Agriculture and Environment, 2011, 9(2): 666-671.
[21] Schiavon M, Serena M, Leinauer B, et al. Seeding Date and Irrigation System Effects on Establishment of Warm-Season Turfgrasses[J]. Agronomy Journal, 2015, 107(3): 880-886.
[22] Dodd I C, Puértolas J, Huber K, et al. The importance of soil drying and re-wetting in crop phytohormonal and nutritional responses to deficit irrigation[J]. Journal of Experimental Botany, 2015, 66(8): 2239-2252.
[23] Al-Ghobari H M, Mohammad F S, El Marazky M S A. Assessment of smart irrigation controllers under subsurface and drip-irrigation systems for tomato yield in arid regions[J]. Crop and Pasture Science, 2015, 66(10): 1086-1095.
[24] Kahlaoui B, Hachicha M, Rejeb S, et al. Effects of saline water on tomato under subsurface drip irrigation: Nutritional and foliar aspects[J]. Journal of Soil Science and Plant Nutrition, 2011, 11(1): 643-656.
[25] Kumar V, Chopra A K, Srivastava S. Distribution, enrichment
and accumulation of heavy metals in soil and Vigna mungo L. Heaper (Black gram) after irrigation with distillery wastewater[J]. Journal of Environment and Health Sciences, 2014, 1: 1-8.
[26] 李磊,李向义,林丽莎,等. 两种生境条件下6种牧草叶绿素含量及荧光参数的比较[J]. 植物生态学报,2011,35(6):672-680.
Li Lei, Li Xiangyi, Lin Lisha, et al. Comparison of chlorophyll content and fluorescence parameters of six pasture species in two habitats in China[J]. Chinese Journal of Plant Ecology, 2011, 35(6): 672-680. (in Chinese with English abstract)
[27] 赵娟,黄文江,张耀鸿,等. 冬小麦不同生育时期叶面积指数反演方法[J]. 光谱学与光谱分析,2013,33(9):2546-2552.
Zhao Juan, Huang Wenjiang, Zhang Yaohong, et al. Inversion of leaf area index during different growth stages in winter wheat[J]. Spectroscopy and Spectral Analysis, 2013, 33(9): 2546-2552. (in Chinese with English abstract)
[28] Marschall M, Proctor M C. Are bryophytes shade plants? Photosynthetic light responses and proportions of chlorophyll a, chlorophyll b and total carotenoids[J]. Annals of Botany, 2004, 94(4): 593-603.
[29] Kitajima K, Hogan K P. Increases of chlorophyll a/b ratios during acclimation of tropical woody seedlings to nitrogen limitation and high light[J]. Plant Cell and Environment, 2003, 26(6): 857-865.
[30] Santos L N S D, Matsura E E, Gonçalves I Z, et al. Water storage in the soil profile under subsurface drip irrigation: Evaluating two installation depths of emitters and two water qualities[J]. Agricultural Water Management, 2016, 170: 91-98.
[31] 徐国伟,王贺正,翟志华,等. 不同水氮耦合对水稻根系形态生理、产量与氮素利用的影响[J]. 农业工程学报,2015, 31(10):132-141.
Xu Guowei, Wang Hezheng, Zhai Zhihua,et al. Effect of water and nitrogen coupling on root morphology and physiology, yield and nutrition utilization for rice[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(10): 132-141. (in Chinese with English abstract)
[32] Waddell H A, Simpson R J, Ryan M H, et al. Root morphology and its contribution to a large root system for phosphorus uptake by Rytidosperma species (wallaby grass)[J]. Plant and Soil, 2016: 1-13.
[33] Hochholdinger F. Untapping root system architecture for crop improvement[J]. Journal of Experimental Botany, 2016, 67(15): 4431-4433.
[34] Fernández M J, Barro R, Pérez J, et al. Influence of the agricultural management practices on the yield and quality of poplar biomass (a 9-year study)[J]. Biomass and Bioenergy, 2016, 93: 87-96.
[35] Chenafi A, Monney P, Arrigoni E, et al. Influence of irrigation strategies on productivity, fruit quality and soil-plant water status of subsurface drip-irrigated apple trees[J]. Fruits, 2016, 71(2): 69-78.
[36] Watanabe M, Ohta Y, Licang S, et al. Profiling contents of water-soluble metabolites and mineral nutrients to evaluate the effects of pesticides and organic and chemical fertilizers on tomato fruit quality[J]. Food Chemistry, 2015, 169: 387-395.
[37] Usman A R A, Al-Wabel M I, Abdulaziz A L H, et al. Conocarpus biochar induces changes in soil nutrient availability and tomato growth under saline irrigation[J]. Pedosphere, 2016, 26(1): 27-38.
[38] 袁丽萍,米国全,赵灵芝,等.水氮耦合供应对日光温室番茄产量和品质的影响[J]. 中国土壤与肥料,2008,26(2):69-73.
Yuan Liping, Mi Guoquan, ZhaoLingzhi, et al. Concurrent influences of different water and nitrogen supplement on yields and quality of tomato in solar-greenhouse[J]. Soil and Fertilizer Sciences in China, 2008, 26(2): 69-73.(in Chinese with English abstract)
Suitable buried depth of drip irrigation improving yield and quality of tomato in greenhouse
Wang Jingwei1,2, Niu Wenquan1,3※, Guo Lili4, Liang Bohui4, Li Yuan1
(1.712100,; 2.030002,; 3.712100,; 4.712100,)
Studies of the impact of subsurface drip irrigation on tomato growth paid more attention to the effects of subsurface drip irrigation and integration of water and fertilizer on root growth, yield and water use efficiency, but the responses of yield and fruit quality to root growth, plant growth and photosynthate allocation were rare. To understand the interaction between “ground part - underground part - yield and quality” in the process of crop growth, explore the inner mechanism of the subsurface drip irrigation, reasonably allocate drip irrigation measures, and further refine water management measures, this paper performed field experiments to investigate tomato plant growth, root growth, photosynthate allocation, fruit yield and quality, and water use efficiency response to different buried pipe depth in subsurface drip irrigation with conventional ground drip irrigation as reference (CK), and analyzed the effects of plant growth, root growth, and photosynthate allocation on fruit yield and quality. The field experiment was conducted in the sunlight greenhouse of Dazhai Village, Dazhai Township, Yangling District, Shaanxi Province from October, 2014 to May, 2015. The greenhouse was 108 m in length (in the east-west direction) and 8 m in width (in the south-north direction). The soil compositions in experiment were as follows: 25.4% gravel (>0.02-2 mm), 44.1% silt (0.02-0.002 mm), and 30.5% clay (<0.002 mm). The physical properties of the soil were as follows: bulk density, 1.35 g/cm3; field moisture capacity, 28.17% (mass fraction of water in soil); and soil porosity, 49.38%. The test crop was tomato, and the cultivar was “Haiti”, which was cold resistant variety. Test plots were built from west to east in the greenhouse, 2 ridges per plot; and the ridge was 6.0 m in length, 0.6 m in width and 0.2 m in height, divided by a ditch with the width of 0.3 m. The area of each plot was 3.4 m2. Thirty-four plants were planted in 2 rows, with a plant-spacing of 0.35 m in each plot and protection rows at each end of the plot. The experiment had 4 treatments: 1) Surface drip irrigation with plastic film mulching (control, CK) - the drip irrigation pipe was installed in the middle of the tomato rows, with an irrigation lower limit of 70% of field capacity and an irrigation upper limit of 75% of field capacity; 2) and 3 subsurface drip irrigation treatments with plastic film mulching - the drip irrigation pipe was installed in the middle of the tomato rows at a depth of 10 cm (S10), 20 cm (S20) or 30 cm (S30); given that subsurface drip irrigation is more water-saving than surface drip irrigation, the irrigation lower limit was set at 60% of field capacity, and the irrigation upper limit was set at 65% of field capacity. Each treatment had 3 replicates, with a total of 12 experimental plots. In the experiment, the tomato growth rate of plant height and stem diameter, root growth characteristics, and leaf area index (LAI) were measured. And, the evaluation indices of photosynthesis, such as the chlorophyll and photosynthetic rate, were also determined. Additionally, the plant biomass, the tomato yield, irrigation amount and IWUE (irrigation water use efficiency) were also measured. The correlation of these indicators was used to explore internal interaction and to determine the best agronomic measures in greenhouse. The results showed that subsurface drip irrigation with drip pipes in 20 cm burial depth significantly increased the overall photosynthesis of tomato plant, promoted tomato root length, root area, and number of root branching, enhanced tomato yields by 22.35% compared with the CK, and had no significant difference on fruit soluble sugar and organic acid content with the CK, but significantly increased total soluble solids, soluble protein, VC (vitamin C), lycopene content, and sugar acid ratio by 10.86%, 32.34%, 35.66%, 33.97%, and 53.01% respectively compared with the CK, and improved water use efficiency that was 35.91% higher than CK (<0.05). Subsurface drip irrigation with drip pipes in 30 cm burial depth significantly increased tomato dry matter, stem dry weight, leaf dry weight and tomato yields by 50.73%, 92.67%, 57.54% and 19.53% compared with the CK respectively, and had no significant difference on water use efficiency with subsurface drip irrigation with drip lines in 20 cm burial depth, however lowered tomato fruit quality. Therefore, subsurface drip irrigation with 20 cm burial depth is recommended to increase production, enhance fruits quality and improve water use efficiency to tomato production in a greenhouse.
irrigation; moisture; soils; subsurface drip irrigation; buried depth; tomato; quality; yield
10.11975/j.issn.1002-6819.2017.20.012
S607; S641.2; S627
A
1002-6819(2017)-20-0090-08
2017-05-08
2017-09-21
“十三五”国家重点研发计划资助项目(2016YFC0400202),国家自然科学基金项目(No.51679205)
王京伟,博士,主要从事节水灌溉与农业生物环境研究。 Email:lssks@qq.com
※通信作者:牛文全,研究员,博导,主要从事灌溉理论与节水技术研究。Email:nwq@nwsuaf.edu.cn,中国农业工程学会会员:牛文全(E041200504S)
王京伟,牛文全,郭丽丽,梁博惠,李 元. 适宜的毛管埋深提高温室番茄品质及产量[J]. 农业工程学报,2017,33(20):90-97. doi:10.11975/j.issn.1002-6819.2017.20.012 http://www.tcsae.org
Wang Jingwei, Niu Wenquan, Guo Lili, Liang Bohui, Li Yuan. Suitable buried depth of drip irrigation improving yield and quality of tomato in greenhouse[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(20): 90-97. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.20.012 http://www.tcsae.org
