宽叶金粟兰中具抗乳腺癌转移活性的倍半萜类化学成分研究
2017-11-11张珊珊付剑江陈怀远涂林锋春荣张睿增刘定平罗永明
张珊珊 付剑江 陈怀远 涂林锋 春荣 张睿增 刘定平 罗永明
[摘要]利用多种色谱分离方法和波谱学鉴定方法对宽叶金粟兰乙酸乙酯部位的化学成分进行了分离鉴定,并借助药理学方法对其中得到的部分化合物进行了抗乳腺癌转移活性的初步筛选。总共从宽叶金粟兰乙酸乙酯部位中分离得到15个倍半萜及其二聚体类化合物,分别鉴定为zedoarofuran(1), chlorajapolide D(2), 4β,8βdihydroxy5α(H)eudesm7(11)en8, 12olide(3), curcolonol(4), lasianthuslactone A(5), chlomultin C(6),(1E,4Z)8hydroxy6oxogermacra1(10), 4, 7(11)trieno12, 8lactone(7), shizukanolide E(8), shizukanolide F(9), 9αhydroxycurcolonol(10), shizukaol B(11), shizukaol C(12), cycloshizukaol A(13), sarcandrolide B(14), henriol A(15)。其中化合物2, 8~10为首次从该属植物中分离得到,化合物2, 5, 8~10,12,14为首次从该植物中分得。并对所分得量较大的5个化合物进行了抗乳腺癌转移活性筛选,其中化合物4, 11, 12表现出较强的活性。
[关键词]宽叶金粟兰; 倍半萜类; 抗乳腺癌转移活性
[Abstract]To study sesquiterpenes with antimetastasis breast cancer activity from Chloranthus henryi, ten sesquiterpenes ,zedoarofuran (1), chlorajapolide D (2), 4β, 8βdihydroxy5α(H)eudesm7(11)en8, 12olide (3), curcolonol (4), lasianthuslactone A (5), chlomultin C (6), (1E,4Z)8hydroxy6oxogermacra1(10), 4, 7(11) trieno12, 8lactone (7), shizukanolide E (8) , shizukanolide F (9) , 9αhydroxycurcolonol (10), and five bissesquiterpenes, shizukaol B (11), shizukaol C (12) , cycloshizukaol A (13) , sarcandrolide B (14) , henriol A(15), were isolated by using different kinds of column chromatography methods from the ethyl acetate part of Chhenryi and their structures were identified based on spectroscopic methods Compounds 2, 8, 9, and 10 were obtained from the genus Chloranthus for the first time Compounds 2, 5, 810, 12,and 14 were obtained from this plant for the first time Some isolated compounds were subjected to evaluate the antimetastasis breast cancer activity by using pharmacological methods, and only compounds 4, 11, and 12 were potent active.
[Key words]Chloranthus henryi; sesquiterpenes; antimetastasis breast cancer activity
宽叶金粟兰Chloranthus henryi Hemsl属金粟兰科植物,又名大叶及己、四块瓦、四叶细辛,多分布于我国西南地区,植物资源十分丰富。传统中医常用其全草入药,味辛,性温,有毒。具祛风除湿,活血散瘀,解毒的功效,民间广泛用于治疗风湿痹痛,跌打骨折,疮肿及毒蛇咬伤等病症[1]。课题组曾对多种金粟兰科植物进行了系统的化学成分研究,分离得到了萜类、黄酮、香豆素、生物碱等多种类型的化合物[26],并对这些化合物进行了抗乳腺癌转移活性筛选,发现其中倍半萜类化合物显示较好的抗乳腺癌转移活性[7]。前期从宽叶金粟兰的氯仿部位中分离得到一系列倍半萜及其二聚体类化合物,经初步研究也显示部分化合物具有較好的抗乳腺癌转移活性。因此,为了对宽叶金粟兰抗乳腺癌转移活性成分进行更加深入的研究,课题组对宽叶金粟兰乙酸乙酯部位的倍半萜类化学成分进行了系统的分离,并对从中获得的部分化合物进行了抗乳腺癌转移活性的筛选。
本文报道从宽叶金粟兰的乙酸乙酯部位中分离得到15个倍半萜类化合物,经波谱学方法分别鉴定为zedoarofuran(1),chlorajapolide D(2),4β,8βdihydroxy 5α(H)eudesm7(11)en8,12olide(3),curcolonol(4),lasianthuslactone A(5),chlomultin C(6),(1E,4Z)8hydroxy6 oxogermacra 1(10),4,7(11)trieno12,8lactone(7),shizukanolide E(8),shizukanolide F(9),9αhydroxycurcolonol(10),shizukaol B(11),shizukaol C(12),cycloshizukaol A(13),sarcandrolide B(14),henriol A(15)。其中化合物2,8~10为首次从该属植物中分离得到,化合物2,5,8~10,12,14为首次从该植物中分得。并对所分得量较大的5个化合物进行了抗乳腺癌转移活性筛选,其中化合物4,11,12表现出较强的活性。endprint
1材料
核磁共振仪Bruker AVANCEIII HD(瑞士Bruker公司,600 MHz);高分辨飞行时间质谱联用仪AB SCIEX Triple TOF(美国AB SCIEX公司,5600+);薄层/柱色谱硅胶G254(青岛海洋化工厂);葡聚糖凝胶Sephadex LH20(Amersham Pharmacia Biotech );旋转蒸发仪(瑞士Buchi公司);高效液相色谱仪(美国Agilent公司);半制备型液相色谱仪(美国Waters公司);制备型反相色谱柱(日本YMCPack ODSA C18,20 mm×250 mm,5 μm),分析型反相色谱柱(日本Inertsil ODS3,46 mm×250 mm,5 μm);所用试剂均为分析纯或色谱纯。Recombinant Human TGFβ1(美國PeproTech公司,10021);Batimastat(BB94,美国Selleck公司,S7155);Matrigel Basement Membrane Matrix(美国BD公司,356234);磷酸盐缓冲液(PBS,美国Biohao Biotechnologo,C0260);纤维连接蛋白(fibronectin,FN);(美国Sigma公司,F2006);结晶紫(Crystal violet,天津市光复精细化工研究所);24孔细胞培养板(美国Costar 公司);Cell Culture Insert(美国Coring公司,353097);025% TrypsinEDTA(1X),Phenol Red(美国Gbico公司,25200056);Oris Universal Cell Migration Assembly Kit细胞迁移试剂盒(美国Platypus Technologies,CMA1101)。
药材采自江西井冈山,由江西中医药大学刘勇教授鉴定为金粟兰属植物宽叶金粟兰Ch henryi,凭证标本保存在江西中医药大学标本馆(20141011)。
2提取与分离
干燥的宽叶金粟兰根茎药材13 kg,用95%乙醇冷浸提取3次,每次浸泡7 d,提取液减压回收得到总浸膏404 g。用乙酸乙酯溶解,硅胶900 g拌样,硅胶400 g做固定相,干法上样、装柱,依次用石油醚、氯仿、乙酸乙酯、丙酮、甲醇洗脱。 分别得到石油醚部位(2 g),氯仿部位(80 g),乙酸乙酯部位(88 g),丙酮部位(62 g),甲醇部位(161 g)。
乙酸乙酯部位(88 g)经硅胶柱色谱分离,以氯仿甲醇(50∶1~0∶1)为洗脱剂得到6个组分G~K。组分G(24 g)以二氯甲烷甲醇(50∶1~0∶1)作为流动相进行硅胶柱色谱梯度洗脱得到FrGA~GE共5个组分。FrGA(125 g)经反复柱色谱(二氯甲烷甲醇50∶1~0∶1为洗脱剂)和制备液相色谱分离,得到化合物化合物1(13 mg),2(6 mg),3(15 mg),4(11 mg),11(23 mg),12(
22 mg);FrGB(10 g)经反复硅胶柱色谱(二氯甲烷甲醇40∶1~0∶1为洗脱剂)和制备液相色谱分离,得到化合物5(4 mg),6(9 mg),7(5 mg),8(5 mg),13(10 mg);FrH(13 g)以二氯甲烷甲醇(25∶1~0∶1)作为流动相进行硅胶柱色谱梯度洗脱,洗脱液用薄层色谱法分析合样,得到FrH1~10共10个组分。FrH3采用反复硅胶柱色谱(二氯甲烷甲醇15∶1~0∶1为洗脱剂)和制备液相色谱分离,从中得到了化合物9(7 mg),10(3 mg),14(8 mg),15(5 mg)。
3结构鉴定
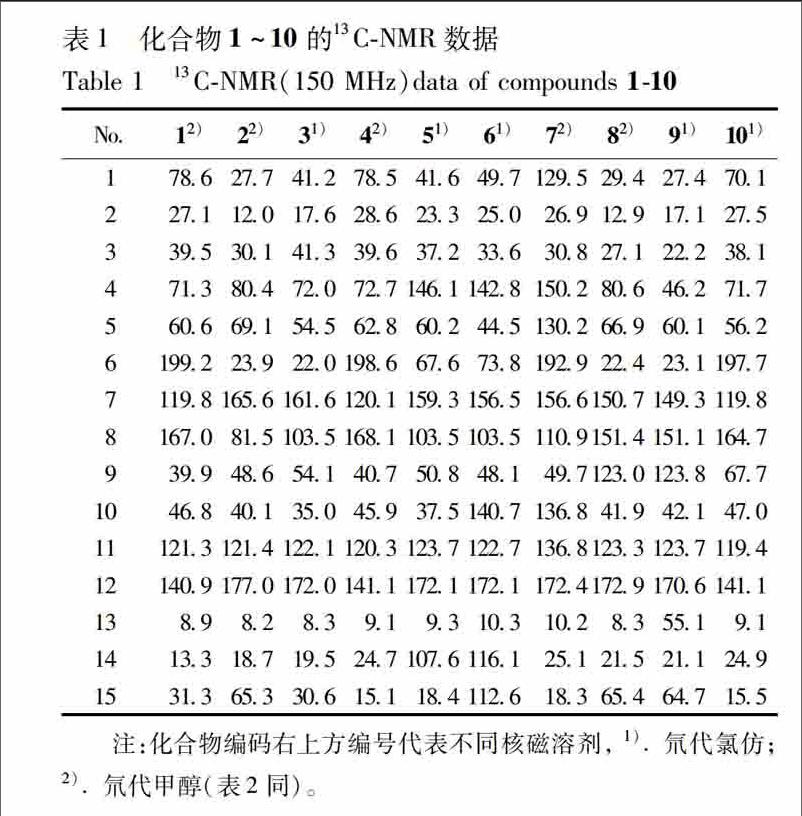
化合物1黄色油状物,ESIMS m/z 265[M+H]+,287[M+Na]+。分子式为C15H20O4。1HNMR(CD3OD,600 MHz)δ:360(1H,dd,J=119,37 Hz,H1),193(1H,m,H2α),160(1H,m,H2β),179(2H,m,H3),263(1H,s,H5),290(1H,d,J=172 Hz,H9α),279(1H,d,J=172 Hz,H9β),722(1H,s,H12),215(3H,d,J=13 Hz,H13),108(3H,s,H14),144(3H,s,H15)。13CNMR数据参见表1。以上数据对比文献[8]报道,故鉴定其为zedoarofuran。
化合物2黄色油状物,ESIMS m/z 265[M+H]+,287[M+Na]+。分子式为C15H20O4。1HNMR(CD3OD,600 MHz) δ:141(1H,m,H1),087(1H,m,H2α),072(1H,m,H2β),147(1H,m,H3α),209(1H,J=147,27 Hz,H5),282(1H,dd,J=134,26 Hz,H6α),212(1H,m H6β),507(1H,m,H8),143(1H,m,H9α),251(1H,dd,J=114,68 Hz,H9β),180(3H,t,J=16 Hz,H13),100(3H,s,H14),354(1H,m,H15α),348(1H,d,J=117 Hz,H15β)。13CNMR数据参见表1。以上数据对比文献[9]报道,故鉴定其为chlorajapolide D。
化合物3白色粉末。ESIMS m/z 289[M+Na]+,267[M+H]+,分子式为C15H22O4。1HNMR(CDCl3,600 MHz) δ:170(1H,m,H2α),201(1H,m,H2β),151(2H,m,H3),111(1H,m,H5),250(1H,m,H6α),278(1H,dd,J=134,28 Hz,H6β),211(2H,d,J=136 Hz,H9),195(3H,m,H13),133(3H,s,H14),127(3H,s,H15)。13CNMR数据见表1。以上数据对比文献[10]报道,故鉴定其为4β,8βdihydroxy5α(H)eudesm 7(11)en8,12olide。endprint
化合物4淡黄色粉末。ESIMS m/z 287[M+Na]+,265[M+H]+,分子式为C15H20O4。1HNMR(CD3OD,600MHz) δ: 369(1H,m,H1),175(1H,m,H2α),163(1H,m,H2β),155(2H,m,H3),264(1H,s,H5),300(1H,d,J=169 Hz,H9α),282(1H,d,J=169 Hz,H9β),723(1H,s,H12),217(3H,d,J=13Hz,H13),146(3H,s,H14),097(3H,s,H15)。13CNMR数据见表1。以上数据对比文献[11]报道,故鉴定其为curcolonol。
化合物5淡黄色油状化合物。ESIMS m/z 287[M+Na]+,265[M+H]+,分子式为C15H20O4。1HNMR(CDCl3,600 MHz) δ:127(1H,m,H1α),158(1H,m,H1β),168(2H,m,H2),196(1H,m,H3α),240(1H,m,H3β),209(1H,d,J=109 Hz,H5α),493(1H,dd,J=109 Hz,19 Hz,H6β),156(1H,m,H9α),229(1H,d,J=138 Hz,H9β),206(3H,s,H13),510(1H,s,H14α),476(1H,s,H14β),105(3H,s,H15)。13CNMR数据见表1。以上数据对比文献[12]报道,故鉴定其为lasianthuslactone A。
化合物6白色粉末,ESIMS m/z 285[M+Na]+。分子式为C15H18O4。1HNMR(CDCl3,600MHz) δ:224(1H,t,J=19 Hz,H1β),174(1H,m,H2α),201(1H,m,H2β),248(2H,m,H3),288(1H,dd,J=130,19 Hz,H5α),269(1H,dq,J=130 Hz,H5β),309(1H,m,H9α),238(1H,m,H9β),205(3H,s,H13),521(1H,s,H14α),500(1H,s,H14β),493(1H,q,J=19 Hz,H15α),485(1H,q,J=19 Hz,H15β)。13CNMR数据见表1。以上数据对比文献[13]报道,故鉴定其为chlomultin C。
化合物7无色透明方晶,ESIMS m/z 285[M+Na]+。分子式为C15H18O4。1HNMR(CD3OD,600 MHz) δ: 494(1H,m,H1),210(1H,m,H2),231(1H,m,H3),635(1H,s,H5),281(1H,d,J=128 Hz,H9α),242(1H,d,J=128 Hz,H9β),199(3H,s,H13),192(3H,s,H14),168(3H,s,H15)。13CNMR数据见表3。以上数据对比文献[14]报道,故鉴定其为(1E,4Z)8hydroxy6oxogermacra1(10),4,7(11) trieno12,8lactone。
化合物8淡黄色油状物,ESIMS m/z 303[M+Na]+。分子式为C15H20O5。1HNMR(CD3OD,600 MHz) δ:151(1H,ddd,J=94,75,43 Hz,H1),087(2H,m,H2),175(1H,m,H3),266(1H,dd,J=145,34 Hz,H5),283(1H,dd,J=169,35 Hz,H6α),241(1H,ddt,J=169,145,34 Hz,H6β),627(1H,s,H9),188(3H,m,H13),099(3H,m,H14),372(2H,m,H15)。13CNMR数据见表1。以上数据对比文献[15]报道,故鉴定其为shizukanolide E。
化合物9淡黄色油状物,ESIMS m/z 262[M]+。分子式为C15H18O4。1HNMR(CDCl3,600 MHz) δ:153(1H,Btd,J=81,38 Hz,H1),084(2H,td,J=84,59 Hz,H2),128(1H,dd,J=80,41 Hz,H3),167(1H,m,H4),233(1H,m,H5),290(1H,dd,J=160,25 Hz,H6α),236(1H,dd,J=160,25 Hz,H6β),639(1H,s,H9),442(2H,s,H13),091(3H,s,H14),379(2H,dd,J=58,22 Hz,H15)。13CNMR数据见表1。13CNMR数据见表1。以上数据对比文献[15]报道,故鉴定其为shizukanolide F。
化合物10淡黄色油状物,ESIMS m/z 303 [M+Na]+。分子式为C15H20O5。1HNMR(CDCl3,600 MHz) δ 425(1H,dd,J=112,45 Hz,H1),190(1H,m,H2α),178(1H,m,H2β),170(2H,m,H3),296(1H,s,H5),465(1H,s,H9),719(1H,q,J=13 Hz,H12),221(1H,d,J=13 Hz,H13),148(3H,s,H14),094(3H,s,H15)。13CNMR数据见表1。以上数据对比文献[16]报道,故鉴定其为9αhydroxycurcolonol。
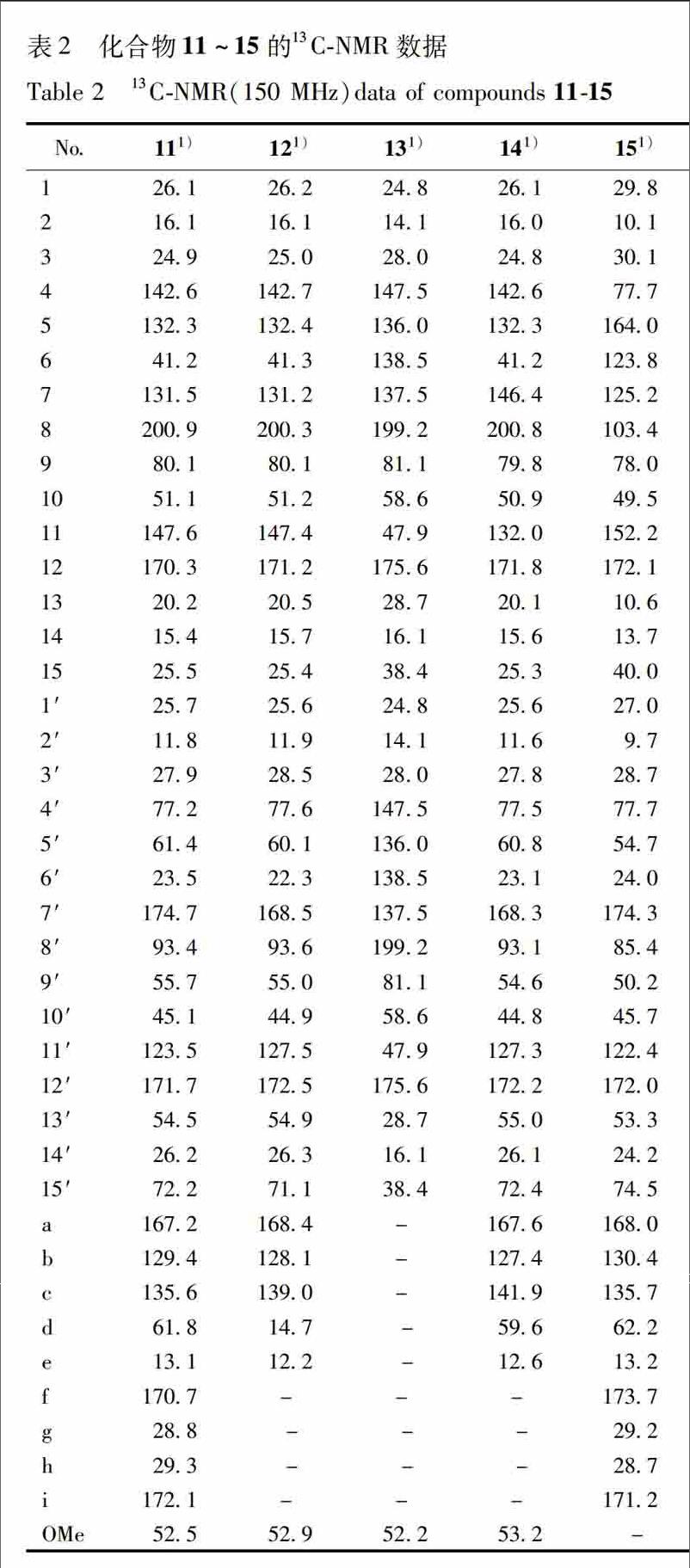
化合物11白色粉末,ESIMS m/z 755[M+Na]+。分子式为C40H44O13。1HNMR(CDCl3,600 MHz) δ: 209(1H,m,H1),105(1H,m,H2α),032(1H,td,J=43,29 Hz,H2β),395(1H,d,J=38 Hz,H6),387(1H,s,H9),192(3H,s,H13),102(3H,s,H14),283(2H,m,H15),160(1H,td,J=89,42 Hz,H1′),073(1H,td,J=89,58 Hz,H2α),133(1H,dt,J=58,39 Hz,H2′β),139(1H,ddd,J=89,73,39 Hz,H3′),454(1H,dd,J=203,119 Hz,H13′),510(1H,m,H13′),082(3H,s,H14′),368(1H,m,H15′),661(1H,ddt,J=67,53,13 Hz,Hc),463(1H,ddd,J=148,68,12 Hz,Hd),501(1H,m,Hd),191(3H,s,He),289(1H,ddd,J=172,102,27 Hz,Hg),253(1H,m,Hg),275(2H,m,Hh),370(3H,s,HOMe)。13CNMR數据见表2。以上数据对比文献[17]报道,故鉴定其为shizukaol B。endprint
化合物12黄色油状物,ESIMS m/z 657[M+Na]+。分子式为C36H42O10。1HNMR(CDCl3,600 MHz) δ:211(1H,m,H1),105(1H,m,H2α),033(1H,td,J=43,30 Hz,H2β),189(1H,m,H3),395(1H,m,H6),377(3H,s,H9),198(3H,s,H13),100(3H,s,H14),281(1H,dd,J=163,18 Hz,H15α),256(1H,ddd,J=163,62,39 Hz,H15β),160(1H,ddd,J=86,74,41 Hz,H1′),070(1H,td,J=89,57 Hz,H2′α),126(1H,dt,J=57,39 Hz,H2′β),151(1H,ddd,J=89,74,36 Hz,H3′),190(1H,m,H5′),226(1H,ddt,J=183,62,14 Hz,H6′α),271(1H,dd,J=183,137 Hz,H6′β),431(1H,dd,J=137,14 Hz,H13′),439(1H,dd,J=137,14 Hz,H13′),086(3H,s,H14′),386(1H,d,J=116 Hz,H15′),420(1H,d,J=116 Hz,H15′),687(1H,tdt,J=68,56,12 Hz,Hc),363(3H,s,HOMe)。13CNMR数据见表2。以上数据对比文献[17]报道,故鉴定其为shizukaol C。
化合物13无色透明块状结晶,ESIMS m/z 571[M+Na]+,分子式为C32H36O8。1HNMR(CDCl3,600 MHz) δ:183(2H,ddd,J=84,58,41 Hz,H1,1′),087(2H,td,J=81,44 Hz,H2,2′),022(2H,td,J=44,31 Hz,H2,2′),716(2H,s,H6,6′),380(2H,s,H9,9′),151(6H,s,H13,13′),100(6H,s,H14,14′),296(2H,d,J=135 Hz,H15,15′),260(2H,d,J=135 Hz,H15,15′),364(3H,s,HOMe)。13CNMR数据见表2。以上数据对比文献[17]报道,故鉴定其为cycloshizukaol A。
化合物14黄色油状物,ESIMS m/z 650[M]+,673[M+Na]+,分子式为C36H42O11。1HNMR(CDCl3,600MHz) δ:204(1H,m,H1),104(1H,
m,H2α),036(1H,m,H2β),189(1H,m,H3),390(1H,s,H6),391(1H,s,H9),191(3H,s,H13),101(3H,s,H14),258(1H,m,H15α),286(1H,m,H15β),163(2H,qd,J=80,45 Hz,H1′),072(2H,ddd,J=143,99,56 Hz,H2′α),132(1H,dt,J=56,38 Hz,H2′β),148(1H,m,H3′),189(1H,m,H5′),246(1H,m,H6′α),286(1H,m,H6′β),194(1H,m,H9′),433(3H,m,H13′),087(3H,s,H14′),383(1H,m,H15′α),418(1H,d,J=124 Hz,H15′β),677(1H,ddd,J=70,53,16 Hz,H3′),448(3H,m,H4′),374(3H,s,HOMe)。13CNMR数据见表2。以上数据对比文献[18]报道,故鉴定其为sarcandrolide B。
化合物15淡黄色油状物,ESIMS m/z 735[M+H]+,分子式为C39H42O14。1HNMR(CDCl3,600 MHz) δ:147(1H,ddd,J=89,71,34 Hz,H2α),060(1H,td,J=89,53Hz,H2β),173(1H,m,H3) 376(1H,s,H9),163(3H,s,H13),084(3H,s,H14),276(1H,m,H15α),187(1H,m,H15β),170(1H,m,H1′),105(1H,dt,J=53,42 Hz,H2′α),081(1H,d,J=58 Hz,H2′β),237(1H,dd,J=123,72 Hz,H5′),298(1H,dd,J=183,124 Hz,H6′α),273(1H,m,H6′β),272(1H,m,H9′),452(1H,d,J=120 Hz,H13′α),518(1H,dd,J=120,09 Hz,H13′β),094(3H,s,H14′),455(1H,m,H15′α),388(1H,d,J=115 Hz,H15′β),673(1H,ddq,J=68,55,14 Hz,Hc),469(1H,m,Hd),186(3H,s,He),271(1H,m,Hg),259(1H,m,Hg),270(1H,m,Hh)。13CNMR数据见表2。以上数据对比文献[6]报道,故鉴定其为henriol A。
4抗乳腺癌转移活性研究
因化合物分离量的限制,仅对从宽叶金粟兰中提分离量较大的5个单体化合物(化合物1,3,4,11,12)进行抗乳腺癌转移活性的初步研究,实验采用transwell侵袭和oris迁移实验方法初步探究化合物对乳腺癌细胞(MDAMB231)侵袭和迁移的影响。
41体外侵袭试验倒扣transwell小室,将稀释好的趋化剂(FN,05 mg·L-1)滴在小室外部并涂匀,于每个小室中各加50 μL稀释均匀的matrigel胶(DMEM培养基 1∶9)后置于培养箱中1 h,吸出水化液体后备用。收集对数生长期的的MDAMB231细胞处理清洗,在培养基(01%DMEM)重悬,制成细胞悬液(终浓度为2×106 个/mL)。取24孔板,将小室置于已经加入了500 μL含药培养基的小孔中,每小室中加入200 μL细胞悬液,将24孔板置于细胞培养箱(5% CO2,37 ℃)中培养16 h。取出小室,用37%多聚甲醛固定10 min,用05%结晶紫染色20 min,将小室内部的细胞用棉签轻轻擦去,用荧光倒置显微镜,拍照并计数5个不同视野内的侵袭细胞数,计算平均值,得到细胞侵袭抑制率,上述实驗均重复3 次。实验分为空白组、高浓度组(100 mg·L-1)、低浓度组(10 mg·L-1)以及阳性组(batimastat,BB94 10 μg·L-1)。endprint
42体外迁移试验将100 μL细胞悬液(方法同31项)接种于插入了Stopper 的OrisTM细胞培养板。5% CO2,37 ℃孵育12 h。小心拔出Stopper,每个处理重复3个复孔。上述细胞继续培养48 h。处理结束后,弃去培养液,加入浓度为05%结晶紫染色20 min,PBS洗涤3遍,用荧光倒置显微镜,拍照并计数5个不同视野内的侵袭细胞数,计算平均值,得到细胞迁移抑制率,上述实验均重复3 次。实验分为空白组、高浓度组(100 mg·L-1)、低浓度组(10 mg·L-1)以及阳性组(BB94 10 μg·L-1。
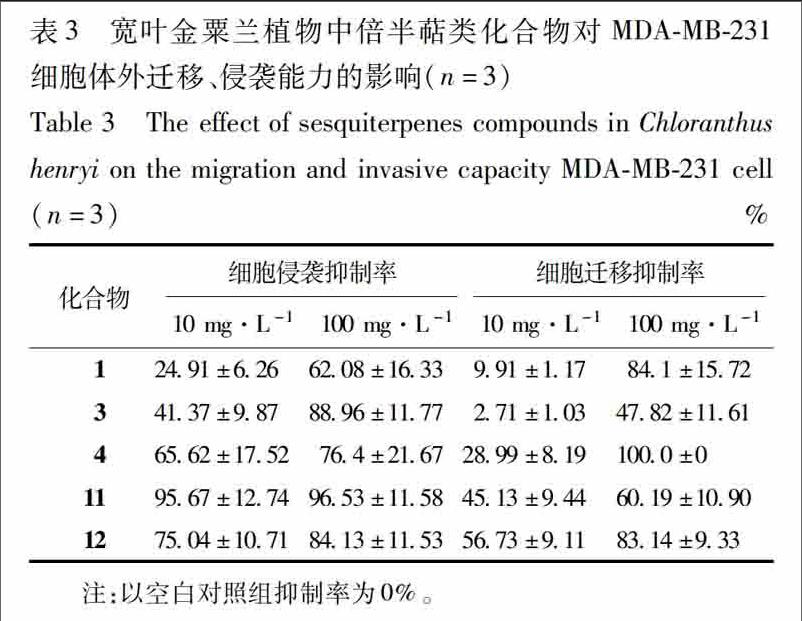
43结果低浓度下化合物4,11,12对MDAMB231细胞侵袭的抑制率分别为(6562±1752)%,(7504±1071)%,(9567±1274)%,高浓度下为(764±2167)%,(8413±1153)%,(9653±1158)%,高浓度下对MDAMB231细胞迁移抑制率分别为(1000±0)%,(8314±933)%,(6019±1090)%,结果显示高低浓度下化合物4,11,12对MDAMB231细胞侵袭和迁移的抑制率均较高,说明这3个化合物具有一定的抗乳腺癌转移活性。实验结果见表3。
5 讨论
本实验对宽叶金粟兰乙酸乙酯部位化学成分进行了研究,从中共分得了15个倍半萜类化合物,其中大多为首次中该植物中分离得到。目前乳腺癌作为全球女性最常见的恶性肿瘤在我国女性中的发病率一直不断攀升,而造成患者死亡的原因多是由于乳腺癌的转移[19],公认的治疗方式是采用手术+局部放射治疗+化疗+内分泌综合治疗,但传统治疗方法对于患者有较多的副作用,因此寻找更加安全的具有良好抗乳腺癌转移活性的药物,是提高乳腺癌患者生存率和改善乳腺癌患者生存质量的重要目标,中药相较于传统化疗药物具有不良反应较少的优点,因此,对于具有抗乳腺癌转移活性的中药有效成分的研究仍具有十分重要的研究意义。故对所分得的化合物进行了抗乳腺癌转移活性的筛选,
并结合结构类型发现乌药烷型的化合物11,12对MDAMB231细胞侵袭抑制作用表现的更为突出,桉叶烷型的化合物4对MDAMB231细胞迁移的抑制作用更明显,说明这3个化合物具有一定的抗乳腺转移活性。结合其他关于倍半萜类化合物抗肿瘤活性的研究可以推测倍半萜化合物很有可能是宽叶金粟兰抗乳腺癌转移的主要活性部位,具有一定的研究前景,其具体的作用机制还有待进一步研究。
[参考文献]
[1]中国科学院中国植物志编辑委员会 中国植物志20卷1分册[M]. 北京: 科学出版社, 1982.
[2]李创军,张东明,罗永明 宽葉金粟兰化学成分的研究[J]. 药学学报, 2005, 40(6): 525.
[3]陈芳有,张东明,罗永明,等. 及己根倍半萜类化学成分研究[J]. 中药材, 2015, 38(10):2087.
[4]林凤祥, 李宏焘, 罗永明, 等. 多穗金粟兰的化学成分研究[J]. 中国中药杂志, 2016, 41(12): 2273.
[5]林凤祥,李宏焘,罗永明, 等. 多穗金粟兰乌药烷型倍半萜二聚体类化学成分研究[J]. 中草药, 2016, 47(18): 3169.
[6]Li C J, Zhang D M, Luo Y M, et al Bissesquiterpenes and diterpenes from Chloranthus henryi[J]. Phytochemistry, 2008, 69(16): 2867.
[7]Fu J J, Wang S, Luo L M, et al In vitro inhibitory effects of terpenoids from Chloranthus multistachys on epithelialmesenchymal transition via downregulation of Runx2 activation in human breast cancer[J]. Phytomedicine, 2015,22(1): 165.
[8]Matsuda H, Morikawa T, Toguchida I, et al Medicinal foodstuffs ⅩⅩⅦ Inhibitors of nitricoxide production and new sesquiterpenes, zedoarofuran, 4epicurcumenol, neocurcumenol, gajutsulactones A and B, and zedoarolides A and B, from Zedoariae Rhizoma [J]. Chem Pharm Bull, 2002, 49(12): 1558.
[9]Wang Q H, Kuang H X, Yang B Y, et al Sesquiterpenes from Chloranthus japonicas[J]. J Nat Prod, 2011, 74(1):16.
[10]陈芳有, 陈俊杰, 罗永明, 等. 及己根的化学成分研究[J]. 中草药, 2015(20):3004.
[11]Syu W J, Shen C C,Don M J, et al Cytotoxicity of curcuminoids and some novel compounds from Curcuma zedoaria [J]. J Nat Prod, 1998, 61(12):1531.
[12]李斌, 张东明, 罗永明 长尾粗叶木根一个新倍半萜内酯的分离(英文)[J]. 药学学报, 2006(5): 426.
[13]Zhang S, Su Z S, Yang S P, et al Four sesquiterpenoids from Chloranthus multistachys[J]. J Asian Nat Prod Res, 2010, 12(6):522.
[14]Wu B, He S, Wu X D, et al New tyrosinase inhibitory sesquiterpenes from Chloranthus henryi [J]. Chem Biodivers, 2008, 5(7):1298.
[15]Jun Kawabata, Junya Mizutani, Shizukanolides D, et al Novel lindenanolides from Chloranthus spp (Chloranthaceae)[J]. Agric Biol Chem, 1989, 53(1):203.
[16]Yang X Z, Chao Wang C, Yang J, et al Antimicrobial sesquiterpenes from the Chinese medicinal plant, Chloranthus angustifolius [J]. Tetrahedron Lett, 2014, 55(41): 5632.
[17]Jun Kawabata, Junya Mizutani Dimeric sesquiterpenoid esters from Chloranthus serratus[J]. Phytochemistry, 1992, 31(4):1293.
[18]He X F, Yin S, Ji Y C, et al Sesquiterpenes and dimeric sesquiterpenoids from Sarcandra glabra[J]. J Nat Prod, 2010, 73(1):45.
[19]陈万青, 郑荣寿 中国女性乳腺癌发病死亡和生存状况[J]. 中国肿瘤临床, 2015(13): 668
[责任编辑丁广治]endprint
