丹参CYP76AH1转基因毛状根的建立及其蛋白的分离
2017-11-11齐梦蝶王健马晓晶张权王方方康莹刘勇林慧馨
齐梦蝶 王健 马晓晶 张权 王方方 康莹 刘勇 林慧馨


[摘要]蛋白质复合物参与植物多种次生代谢物的合成,其分离对阐明植物次生代谢及提高体外催化效率至关重要。该研究构建了过表达丹参酮合成途径关键酶CYP76AH1的转基因毛状根株系,通过Western杂交筛选得到高表达CYP76AH1蛋白的丹参转基因毛状根,并以此作为后续提取丹参酮合成途径中蛋白质复合物的组培材料。通过优化蛋白提取缓冲液中的去污剂种类和浓度,筛选出含05% Triton X100的缓冲液为最佳提取缓冲液,并分离得到相对大量的可溶性CYP76AH1蛋白质。该研究为后续进一步分离纯化与CYP76AH1相互作用的蛋白质复合物奠定了基础,也为深度解析丹参酮合成代谢通路提供思路。
[关键词]蛋白质复合物; 次生代谢物; 丹参酮; CYP76AH1; 转基因毛状根; 去污剂
[Abstract]Protein complexes are involved in the synthesis of multiple secondary metabolites in plants, and their separation is essential to elucidate plant secondary metabolism and improve in vitro catalytic efficiency In this study, the transgenic hairy roots of CYP76AH1, a key enzyme of tanshinone synthesis pathway, was constructed and the transgenic hairy roots of Danshen overexpressing CYP76AH1 protein were screened by Western blotting and used as a tissue culture material for the subsequent extraction of protein complex in tanshinone synthesis pathway By optimizing the type and concentration of the detergent in the protein extraction buffer, the buffer containing 05% Triton X100 was selected as the best extraction buffer, and a relatively large amount of soluble CYP76AH1 protein was isolated This study lays the foundation for the further separation and purification of protein complexes interacting with CYP76AH1, and provides the idea for deep analysis of tanshinone metabolic pathway.
[Key words]protein complexes; secondary metabolism; tanshinone; CYP76AH1; transgenic hairy root; detergent
丹参为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge的干燥根和根茎,具有活血祛瘀、通经止痛、清心除烦、凉血消痈之功效,是最常用的活血化瘀类中药之一[1]。丹参的主要成分丹参酮[2]是松香烷型二萜化合物,不仅具有抗肿瘤活性[34],同时具有治疗心脑血管疾病的作用[5],在临床上应用广泛。丹参在我国分布广泛,但是随着丹参需求量剧增,野生丹参资源已不能满足市场需求,而各地栽培的丹参质量参差不齐,有效成分含量低,这已成为丹参作为高品质植物药大规模进军国际市场的一个最大障碍。利用现代分子生物学技术,研究丹参酮等次生代谢物的生物合成途径,分离参与该途径的蛋白質复合物,阐明相关蛋白之间相互作用,利用合成生物学手段,实现丹参酮异源高效生产将是大量获取丹参酮,缓解供给压力最有潜力的方法之一。
研究表明在包括多胺类[6]、黄酮类[7]、苯丙素类[8]等多种次生代谢物生物合成途径中,催化酶类可以相互作用形成蛋白质复合物,共同催化产物合成。在丹参酮合成途径中已经发现SmCPS和SmKSL相互作用催化次丹参酮二烯的合成[9]。丹参CYP450蛋白CYP76AH1为丹参酮合成的关键酶[10](图 1)。利用CYP76AH1作为诱饵,将可能分离到与该关键酶相互作用的其他催化酶类。为了探索丹参酮合成途径下游的蛋白质复合物,本研究拟利用标签抗体,通过亲和纯化方法分离与丹参酮合成关键酶CYP76AH1的相互作用蛋白,进而分离参与丹参酮合成的蛋白质复合物。而上述研究的基础是获得高表达CYP76AH1融合蛋白的转基因植株及可溶性CYP76AH1融合蛋白。
本研究将CYP76AH1克隆进包含Flag表达标签的双元载体,转入发根农杆菌C58C1,侵染紫花丹参叶片外植体,获得多个转基因毛状根株系。通过Western杂交筛选出高表达CYP76AH1的转基因毛状根。在进行亲和纯化的过程中,所有的蛋白必须以可溶的形式存在于缓冲液里,否则难以进行分离纯化。为了得到可溶性的CYP76AH1融合蛋白,作者对蛋白提取缓冲液的去污剂种类及去污剂浓度进行了优化,最终获得了适合CYP76AH1蛋白分离的提取缓冲液。本研究为后续分离与CYP76AH1相互作用蛋白奠定了基础。
1材料
丹参来自中国中医科学院中药资源中心实验室保存株系,中国中医科学院中药资源中心郝近大研究员鉴定为丹参S miltiorrhiza。所有的大肠杆菌菌株均购自全式金生物科技公司。KOD聚合酶购自日本TOYOBO公司,琼脂糖胶回收试剂盒,Page Ruler Prestained Protein Ladder购自Thermo Fisher公司,质粒提取试剂盒购自Omega公司,pEASYBlunt Zero Cloning Kit,pEASYUni Seamless Cloning and Assembly Kit,DNA marker,AntiDYKDDDDK Mouse mAb,Goat AntiMouse lgG购自全式金生物科技公司,Protease Inhibitor Cocktail购自Roche公司,ECL Plus Detection Reagent购自兰博利德公司,其他试剂为国产分析纯。引物合成和测序由上海生工生物工程技术服务有限公司完成。endprint
2方法
21CYP76AH1Flag双元载体的构建根据CYP76AH1基因和载体pCAMBIA1300cFlag序列设计引物,1300cFlagAH1F:cggggtcgacatttaaataATGGATTCTTTTCCTCTC,1300cFlagAH1R: gtccatggtaccggatccactagAGACTTAACTATTGGGAT,以实验室保存的pESCHisCYP76AH1质粒为模板进行扩增,用pEASYUni Seamless Cloning and Assembly Kit进行连接,构建重组载体,具体实验步骤根据试剂盒说明书操作进行。将连接产物转化到Trans1T1感受态细胞上,在含有卡纳霉素的LB培养板(终浓度为50 mg·L-1)上,37 ℃培养过夜。挑取单克隆进行菌落PCR检测,经测序验证,命名为CYP76AH1cFlag。
22农杆菌转化重组质粒CYP76AH1cFlag转化发根农杆菌C58C1感受态细胞。取100 μL冻融的感受态细胞,加入cFlagCYP76AH1重组质粒1 μg,轻轻混匀,冰浴30 min。液氮速冻1 min,37 ℃水浴5 min,冰浴2 min。加入600 μL LB液体培养基,28 ℃,200 r·min-1培养4 h,使细胞复苏,培养结束后将菌液涂布于含有利福平和卡纳霉素的固体LB培养基,28 ℃温箱培养2 d,挑取农杆菌单克隆进行PCR验证。
23丹参转基因毛状根的诱导选取幼嫩的丹参无菌苗叶片,将叶片剪成1 cm2的小块,置于包含CYP76AH1cFlag质粒的农杆菌菌液中,浸染8 min。将侵染后的叶片用无菌滤纸吸去农杆菌菌液,置于MS固体培养基上,于暗处共培养。48 h后将共培养后的外植体用无菌水清洗5次,吸干水后移至含5 mg·L-1潮霉素和400 mg·L-1头孢菌素的MS固体培养基上,于黑暗条件筛选培养。每2星期更换1次培养基,将长至3 cm以上抗性毛状根切下单独标号继代培养,多次继代后转移至6,7V培养液中摇瓶培养。
24高表达转基因毛状根株系的筛选选取生长健壮的丹参毛状根株系,称取01 g材料,彻底粉碎后加入200 μL 1×SDS蛋白上样缓冲液,混匀后,沸水浴10 min,离心后取上清进行SDS聚丙烯凝胶电泳。蛋白经电泳分离后,电转印至 PVDF 膜上。转膜结束后,用常规免疫杂交程序进行Western blotting检测,一抗为AntiDYKDDDDKMouse mAb,二抗为HRP标记的山羊抗小鼠。杂交结束后,用ECL Plus 发光液孵育1 min,置于Biorad检测仪中检测。
25非变性CYP76AH1cFlag融合蛋白提取缓冲液的优化根据发表文献[10],配制蛋白提取缓冲液(10 mmol·L-1TrisHCl pH 74,150 mmol·L-1 NaCl,2 mmol·L-1 EDTA,05% NP40,1×protease inhibitor)。在此基础上首先优化不同种类的去污剂,即将提取缓冲液中的05% NP40换成2% NP40,2% Triton x100,2% SDS,2% Tween20;最后进行05%,1%,2% 3个梯度的优化。
3结果与分析
31CYP76AH1cFlag双元载体的构建以本实验室保存的pESCHisCYP76AH1为模板,特异扩增出1条1 500 bp左右的DNA片段,与CYP76AH1基因的大小一致(图2 A)。将此DNA片段以重组的方法构建至双元载体pCAMBIA1300Flag的Super 启动子下游。测序结果显示与目的基因的序列一致,并且和下游的Flag标签序列正确融合,说明CYP76AH1基因已经构建到pCAMBIA1300cFlag载体上(图2 B),命名为CYP76AH1cFlag。
ACYP76AH1cFlag的菌落PCR鉴定;MDNA Marker;1CYP76AH1基因片段;B质粒CYP76AH1cFlag的图谱。
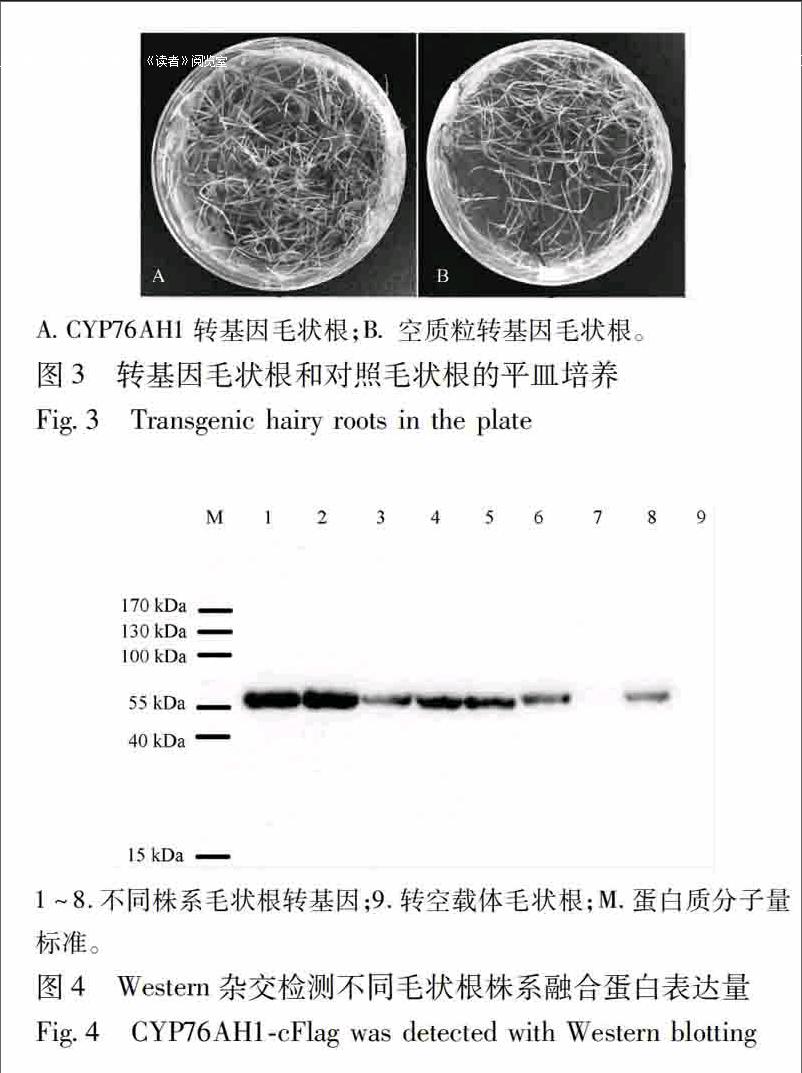
32CYP76AH1转基因毛状根的获得用分别转入空载体pCAMBIA1300Flag和CYP76AH1cFlag的发根农杆菌C58C1,侵染健壮的丹参叶片外植体,大约1个月后,在抗性培养基上成功诱导出大量的丹参毛状根(图 3)。选择粗壮且生长迅速的毛状根转入摇瓶培养,并对其进行Western杂交检测融合蛋白的表达量。在转空载体的对照样品中检测不到蛋白表达,而在转CYP76AH1cFlag的多株毛状根中都检测了1个比55 kDa分子量略大的条带(图4)。CYP76AH1cFlag蛋白的预期相对分子质量约为59 kDa。因此,本研究认为此条带就是CYP76AH1cFlag的杂交信号,CYP76AH1在毛状根中成功表达。其中选择杂交条带较强、表达量较高、生长迅速的毛状根及对照株系扩大培养,进行后续研究。
ACYP76AH1转基因毛状根;B空质粒转基因毛状根。
1~8.不同株系毛状根转基因;9.转空载体毛状根;M.蛋白质分子量标准。
33CYP76AH1蛋白提取缓冲液的优化在上述研究中,CYP76AH1cFlag是以变性蛋白的形式被提取出来。这种提取方法只适合进行Western blotting检测,并不适合后续拟进行的亲和纯化研究。为了在温和条件下分离CYP76AH1Flag蛋白,根据文献[10]中的实验方法配制缓冲液,提取CYP76AH1cFlag蛋白,但通过Western并未检测到目的蛋白。蛋白提取缓冲液中对蛋白溶解性影响最大的是去污剂的种类和浓度,因此本文在该方法基础上,对缓冲液中的去污剂进行了一系列优化。
首先选择常用的4种去污剂SDS,Tween20,Triton X100,NP40,并都以2%的浓度替换原始缓冲液中的05% NP40。取等量的转基因毛状根,液氮速冻后打成细粉,分别加入等量的提取缓冲液,混合均匀后,于冰上放置15 min后,离心取上清,进行western blotting检测,比较4种去污剂的效果。其中SDS,NP40和Triton X100在2%的浓度下都有较好的提取效果,Tween20只能提出少量目的蛋白。但是SDS具有較强的蛋白质变性作用,不利于保持蛋白的空间结构,不适合用于分离互作蛋白。于是选取NP40和Triton X100进行后续研究(图5)。endprint
1~4.含2%SDS,2% Tween20,2% Triton X100,2% NP40缓冲液提取融合蛋白结果;M.蛋白质分子量标准;CK.转空质粒毛状根对照。
选择3个浓度梯度,即05%,1%,2%的NP40和Triton X100替换原始提取缓冲液中的去污剂,尝试提取效果。NP40的提取效果受浓度的影响很大。用包含05% NP40缓冲液提取的样品中检测不到目的蛋白;NP40浓度增加到1%时,目的蛋白能被检测到,但是条带很弱;而用包含2% NP40的缓冲液能够得到最大量的目的蛋白(图6)。和NP40不同的是,不同浓度的Triton X100提取效果变化不明显,3个浓度都有较好的提取效果,即使05%的浓度也能分离出较多的目的蛋白。分离的目的蛋白主要准备用于下游的免疫亲和纯化以分离相互作用蛋白,而较低的去污剂浓度有利于维持蛋白的空间结构及其与其他蛋白的相互作用。综合上述实验结果,筛选出05% Triton X100作为提取缓冲液的去污剂成分以分离CYP76AH1cFlag蛋白。
1~6.含05%Triton X100,1%Triton X100,2%Triton X100,05%NP40,1%NP40,2%NP40缓冲液提取融合蛋白结果;M.蛋白质分子量标准;CK.转空质粒毛状根对照。
4讨论
基于比较转录组学寻找差异表达基因,从中挖掘参与植物次生代谢的关键基因,已经成为阐明植物次生代谢途径的主要手段。但是上述方法也存在测序质量不高、基因同源性低、基因注释不准确、只能分离差异表达基因等局限性。近年来,利用免疫亲和纯化的方法,分离相互作用蛋白,寻找参与植物次生代谢关键酶得到了很大的发展[1113]。CYP76AH1是丹参酮合成途径中的一个关键酶,用这个蛋白作为诱饵(Bait),分离相互作用蛋白,有可能分离到参与丹参酮合成的重要合成酶和调控因子[14]。因此构建了高表达CYP76AH1的转基因丹参毛状根。
CYP76AH1蛋白的N末端有一个内质网结合的结构域,因此CYP76AH1与细胞的膜系统结合较为紧密,不易得到可溶性蛋白,而可溶性蛋白是进行后续免疫亲和纯化的前提和必要条件。去污剂是蛋白提取缓冲液中的重要成分。常见的去污剂有离子型去污剂和非离子型去污剂。SDS是阴离子去污剂,几乎可以溶解所有的蛋白。但是SDS会使蛋白质变性、破坏蛋白间的相互作用。而非离子型去污剂可以破坏蛋白质与脂质间的连接,促进蛋白质的溶解和分离,较好地维持蛋白质间的相互作用。为此,本研究以SDS作为阳性对照,选择了NP40,Triton X100,Tween20这3种非离子去污剂,优化提取缓冲液。结果表明,含有较高浓度(2%)的NP40和Triton X100的缓冲液都有较好的提取效果。而较低的去污剂浓度更有利于保持蛋白的空间结构及其与其他蛋白的相互作用,于是进一步筛选了去污剂的浓度。最终认为含有05% Triton X100的提取缓冲液最适于后续研究。本研究为利用免疫亲和纯化技术,分离CYP76AH1的相互作用蛋白,进而深入阐明丹参酮生物合成途径奠定了基础。
[参考文献]
[1]马丙祥,董宠凯丹参的药理作用研究新进展[J]. 中国药房,2014,25(7):663.
[2]袁媛, 吴芹,石京山,等. 丹参及其主要成分保肝作用的研究进展[J]. 中国中药杂志,2015,40(4):588.
[3]Chen X,Guo J,Bao J, et al The anticancer properties of Salvia miltiorrhiza Bunge (Danshen): a systematic review[J]. Med Res Rev, 2014,34:768.
[4]Zhang Y, Jiang P, Ye M, et al Tanshinones: sources, pharmacokinetics and anticancer activities[J]. Int J Mol Sci, 2012,13:13621.
[5]刘莉嘉,杨鑫,彭玉帅,等. 丹参酮生物合成的关键酶研究进展[J]. 中草药,2015,46(1):140.
[6]Winkel B S Metabolic channeling in plants[J]. Annu Rev Plant Biol,2004,55:85.
[7]Jorgensen K, Rasmussen A V,Morant M, et al Metabolon formation and metabolic channeling in the biosynthesis of plant natural products[J]. Curr Opin Plant Biol, 2005, 8:280.
[8]Sweetlove L J,Fernie A R The spatial organization of metabolism within the plant cell[J]. Annu Rev Plant Biol,2013,64:723.
[9]Zhou Y J, Gao W, Rong Q X,et al Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production[J]. J Am Chem Soc, 2012,134(6): 3234.
[10]Guo J, Zhou Y J,Hillwig M L, et al CYP76AH1 catalyzes turnover of miltiradiene in tanshinones biosynthesis and enables heterologous production of ferruginol in yeasts[J]. Proc Natl Acad Sci USA, 2013, 110:12108.
[11]Lin H, Yang Y,Quan R, et al Phosphorylation of SOS3like calcium binding protein8 by SOS2 protein kinase stabilizes their protein complex and regulates salt tolerance in Arabidopsis[J]. TP Cell, 2009, 21:1607.
[12]Panicot M,Minguet E G,Ferrando A, et al A polyamine metabolon involving aminopropyl transferase complexes in Arabidopsis[J]. TP Cell, 2002, 14:2539.
[13]Lallemand B,Erhardt M,Heitz T, et al Sporopollenin biosynthetic enzymes interact and constitute a metabolon localized to the endoplasmic reticulum of tapetumcells[J]. Plant Physiol, 2013, 162:616.
[14]K wiatkowska M,Polit J T,Stepinski D, et al Lipotubuloids in ovary epidermis of Ornithogalum umbellatum act as metabolons: suggestion of the name ′lipotubuloid metabolon′[J]. J Exp Bot, 2015, 66:1157.
[15]樊同濤,樊小农,麻聪聪,等. 免疫共沉淀技术的应用研究[J]. 中华针灸电子杂志, 2014,3(4):13
[责任编辑吕冬梅]endprint
