SAFE 通路介导的炎症因子在大鼠心肌缺血再灌注致脑损伤中的作用
2017-11-11赵博马莉詹丽英冷燕袁泉刘恋
赵博,马莉,詹丽英,冷燕,袁泉,刘恋
(武汉大学人民医院麻醉科,湖北 武汉 430060)
·论 著·
SAFE 通路介导的炎症因子在大鼠心肌缺血再灌注致脑损伤中的作用
赵博,马莉,詹丽英,冷燕,袁泉,刘恋
(武汉大学人民医院麻醉科,湖北 武汉 430060)
目的探讨生存活化因子增强通路(SAFE)介导的炎症因子在大鼠心肌缺血再灌注致脑损伤中的作用。方法24只雄性SD大鼠按随机数表法分为三组(n=8):假手术组(Sham)、心肌缺血/再灌注组(IR)、心肌缺血/再灌注+AG490组(IR+AG490)。IR组及IR+AG490组通过结扎大鼠冠状动脉左前降支30 min,再灌注120 min建立大鼠心肌缺血/再灌注模型。取大鼠脑组织,Western blot检测Janus激酶2(Jak2)、信号转导子和转录激活子3(STAT3)蛋白表达及炎症因子白介素1(IL-1),白介素6(IL-6),白介素8(IL-8),TUNEL法检测细胞凋亡,比色法检测含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase3)活性。结果与Sham组比较,IR组p-Jak2[(1.8±0.13)vs(1.0±0)]、p-STAT3[(1.6±0.08)vs(1.0±0)]表达增高,炎症因子IL-1[(3.3±0.16)vs(1.0±0)]、IL-6[(3.3±0.16)vs(1.0±0)]、IL-8[(2.8±0.28)vs(1.0±0)]表达增多,TUNEL[(18.8±1.29)%vs(4.2±0.44)%]表达增多,Caspase3活性[(2.6±0.24)vs(1.0±0)]升高,差异均有统计学意义(P<0.05);与IR组比较,IR+AG490组p-Jak2[(1.3±0.09)vs(1.8±0.13)],p-STAT3[(1.1±0.11)vs(1.6±0.08)]表达减少,炎症因子IL-1[(2.1±0.17)vs(3.3±0.16)]、IL-6[(1.9±0.22)vs(3.3±0.16)]、IL-8[(2.2±0.19)vs(2.8±0.28)表达降低,TUNEL[(13.2±1.03)%vs(18.8±1.29)%]表达降低,Caspase3活性 [(2.1±0.21)vs(2.6±0.24)]降低,差异均有统计学意义(P<0.05)。结论抑制SAFE通路的激活可以降低其下游炎症因子的级联表达,从而减少细胞凋亡,减轻大鼠心肌缺血再灌注引起的脑损伤。
生存活化因子增强通路;炎症因子;心肌缺血再灌注;脑损伤
生存活化因子增强通路(survivor activating factor enhancement,SAFE)作为新近发现的保护性通路,是参与炎症反应的重要信号通路之一,其可被多种炎症因子激活,并参与炎症反应的级联放大[1-2],其中最重要的信号通路为Jak2/STAT3通路[3]。目前Jak2/STAT信号通路在心肌缺血再灌注后致脑损伤的作用报道尚少,本研究拟通过建立大鼠心肌缺血再灌注模型,探讨Jak2/STAT3通路介导的炎症因子在心肌缺血再灌注后脑损伤中的作用。
1 材料与方法
1.1 材料 Jak2特异性抑制剂AG490(Selleck公司,美国);单克隆抗体Jak2、STAT3、白细胞介素1,6,8(CST公司,美国);原位末端转移酶标记(TUNEL)试剂盒(Roche公司,美国);Caspase-3活性检测试剂盒(碧云天科技有限公司,中国)。
1.2 实验分组 雄性SD大鼠24只(北京华阜康生物科技股份有限公司,中国),体质量200~220 g。采用随机数字表法分为假手术组(Sham)、心肌缺血/再灌注组(IR)、心肌缺血/再灌注+AG490组(IR+AG490),每组8只。IR+AG490组在再灌注前20 min静脉给予Jak2特异性抑制剂AG490。
1.3 大鼠心肌缺血再灌注模型 大鼠腹腔注射3%戊巴比妥钠50 mg/kg进行麻醉,固定后连接心电导联,行气管插管,呼吸机机械通气,分离股静脉并置管。开胸结扎冠状动脉左前降支(LDA),心电图见到明显的ST段抬高(>0.12 mV),心前区变白,则认为造模成功。结扎时间为30 min,松开线结再灌注120 min后取脑组织。再灌注成功标准:ST段回落,心尖恢复红润。
1.4 观察指标及检测方法 (1)Western blot法检测Jak2、STAT3、IL-1、IL-6、I-L8的表达:脑组织用裂解液提取蛋白,并测定蛋白浓度,采用聚丙烯酞胺凝胶电泳分离目的蛋白,冰浴转膜后,脱脂奶粉室温封闭1~2 h,加入单克隆抗体Jak2、STAT3、IL-1、IL-6、IL-8在4℃下摇床孵育过夜,次日采用荧光二抗孵育1 h后用TBST清洗,应用红外成像系统扫膜,并读取灰度值,用Odessay软件进行数据分析;(2)TUNEL法检测细胞凋亡水平:制备石蜡切片,H2O2孵育10 min,滴加新鲜稀释蛋白酶K,消化10 min,加入反应混合液,孵育60 min后,加入转化剂,孵育30 min,DAB显色;(3)比色法检测Caspase3活性:提取新鲜脑组织蛋白匀浆制成蛋白悬浊液后,设立标准曲线和空白孔,采用Caspase3活性检测试剂盒检测Caspase3活性。
1.5 统计学方法 应用SPSS17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用S-N-K检验,以P<0.05为差异有统计学意义。
2 结果
2.1 心肌缺血再灌注后脑组织Jak2,STAT3变化 与Sham组比较,IR组脑组织中p-Jak2,p-STAT3的表达增多,差异有统计学意义(P<0.05);与IR组比较,IR+AG490组Jak2,STAT3磷酸化水平降低,差异有统计学意义(P<0.05),见表1。
表1 心肌缺血再灌注后脑组织Jak2,STAT3的变化(±s)

表1 心肌缺血再灌注后脑组织Jak2,STAT3的变化(±s)
注:与Sham组比较,aP<0.05,与IR组比较,bP<0.05。
?
2.2 心肌缺血再灌注后脑组织炎症因子变化 IR损伤能引起脑组织炎症因子释放水平增加,差异有统计学意义(P<0.05);而心肌缺血再灌注前通过静脉给予Jak2抑制剂AG490可减少脑组织IL-1,IL-6,IL-8的表达和释放,差异有统计学意义(P<0.05),见表2。
表2 心肌缺血再灌注后脑组织炎症因子的变化(±s)
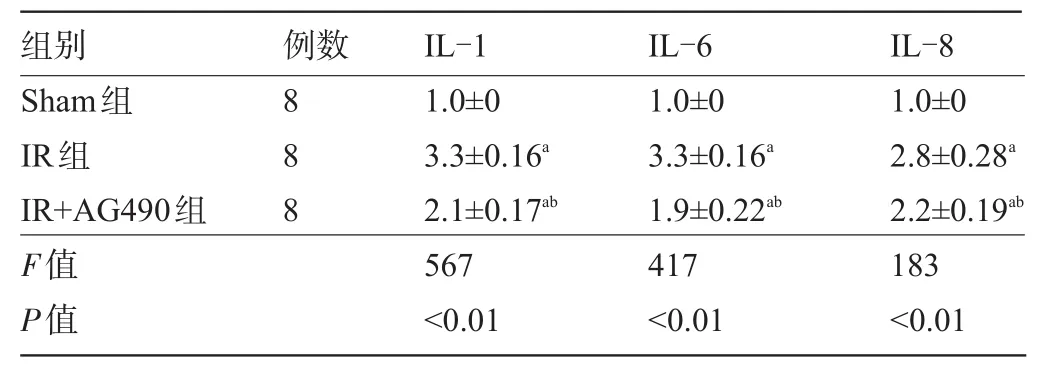
表2 心肌缺血再灌注后脑组织炎症因子的变化(±s)
注:与Sham组比较,aP<0.05,与IR组比较,bP<0.05。
?
2.3 心肌缺血再灌注后脑组织凋亡水平 与Sham组比较,IR组TUNEL表达增多,Caspase3活性升高,差异有统计学意义(P<0.05);与IR组比较,IR+AG490组TUNEL表达减少低,Caspase3活性降低,差异有统计学意义(P<0.05),见表3。
表3 心肌缺血再灌注后脑组织TUNEL及Caspase3的变化(±s)

表3 心肌缺血再灌注后脑组织TUNEL及Caspase3的变化(±s)
注:与Sham组比较,aP<0.05,与IR组比较,bP<0.05。
?
3 讨 论
再灌注损伤补救激酶通路(reperfusion injury salvage kinases,RISK)与SAFE通路是缺血/再灌注损伤中的重要信号通路[4-5],2009年Lecour[6]首次描述了SAFE促生存信号通路,在该通路中保护性信号分子在缺血/再灌注过程中被激活从而抑制细胞凋亡减轻组织损伤。Jak2/STAT3通路作为SAFE通路中重要的信号通路之一,由于介导信号由细胞膜向细胞核内转导,从而调节蛋白表达[7],引起研究者的广泛关注。
IL-6作为炎症反应的始动因素及诱导者,具有催化和放大炎症反应的作用,能直接反映损伤的严重程度。而IL-1可以刺激其它炎症因子的合成,在病理生理进展中起着重要的协同作用[8-9]。本研究结果显示大鼠心肌缺血再灌注后脑组织中的Jak2和STAT3磷酸化程度增高,进一步研究显示大鼠脑组织中炎症因子IL-1,IL-6,IL-8和凋亡相关蛋白TUNEL,Caspase3的表达量亦增高。因此推测大鼠Jak2/STAT3信号通路激活加重脑损伤可能与脑组织局部炎症因子的激活和释放增加有关[10]。当心肌IR损伤发生后脑组织的损伤亦明显增加,其主要表现在组织中凋亡水平和炎性因子的显著增加[11]。因此推测炎性因子的激活和释放可能是心脑同病变的病理生理基础。
本研究结果显示:在术前静脉给予JAK2特异性抑制剂AG490后,抑制剂组脑组织中Jak2/STAT3通路磷酸化降低,炎症因子释放减少,细胞凋亡程度较再灌注组降低。推测Jak2/STAT3表达降低可能对炎症因子的释放起到了调控作用,并通过调节目的基因的表达减少TUNEL和Caspase3的表达,从而在多种病理生理过程中发挥重要作用[9]。
有研究发现Jak2/STAT3作为SAFE通路中的主要信号通路,其与RISK通路之间可能存在“串话”现象[12]。这种现象可能是导致研究者对信号通路传导研究结果不一致的可能原因之一。有研究报道称STAT3可能是连接PI3K和JAK2的适配器蛋白[13-14]。
综上所述,在大鼠心肌缺血再灌注引起的脑损伤模型中Jak2/STAT3通路通过调节炎症因子的变化,进而对心肌缺血再灌注后脑损伤发挥作用。Jak2特异性抑制剂AG490通过抑制炎症因子的释放,减轻心肌缺血再灌注所致的脑损伤。
[1]Yu L,Li B,Zhang M,et al.Melatonin reduces PERK-eIF2α-ATF4-mediated endoplasmic reticulum stress during myocardial ischemia-reperfusion injury:role of RISK and SAFE pathways interaction[J].Apoptosis,2016,21(7):809-824.
[2]Penna C,Settanni F,Tullio F,et al.GH-releasing hormone induces cardioprotection in isolated male rat heart via activation of RISK and SAFE pathways[J].Endocrinology,2013;154(4):b1624-1635.
[3]Hu GQ,Du X,Li YJ,et al.Inhibition of cerebral ischemia/reperfusion injury-induced apoptosis:nicotiflorin and JAK2/STAT3 pathway[J].Neural Regen Res,2017,12(1):96-102.
[4]Frias MA,Lecour S,James RW,et al.High density lipoprotein/sphingosine-1-phosphate-induced cardioprotection:Role of STAT3 as part of the SAFE pathway[J].JAKSTAT,2012,ik1(2):92-100.
[5]Hausenloy DJ,Lecour S,Yellon DM.Reperfusion injury salvage kinase and survivor activating factor enhancement prosurvival signaling pathways in ischemic postconditioning:two sides of the same coin[J].Antioxid Redox Signal.2011,14(5):893-907.
[6]Lecour S.Activation of the protective Survivor Activating Factor Enhancement(SAFE)pathway against reperfusion injury:Does it go beyond the RISK pathway?[J]J Mol Cell Cardiol,2009,47(1):32-40.
[7]Luan HF,Zhao ZB,Zhao QH,et al.Hydrogen sulfide postconditioning protects isolated rat hearts against ischemia and reperfusion injury mediated by the JAK2/STAT3 survival pathway[J].Braz J Med Biol Res.2012,45(10):898-905.
[8]Liu T,Fei Z,Gangavarapu KJ,et al.Interleukin-6 and JAK2/STAT3 signaling mediate the reversion of dexamethasone resistance after dexamethasone withdrawal in 7TD1 multiple myeloma cells[J].Leuk Res,2013,37(10):1322-1328.
[9]Jo HA,Kim JY,Yang SH,et al.The role of local IL6/JAK2/STAT3 signaling in high glucose-induced podocyte hypertrophy.Kidney Res Clin Pract,2016,35(4):212-218.
[10]Zhao L,Wu D,Sang M,et al.Stachydrine ameliorates isoproterenol-induced cardiac hypertrophy and fibrosis by suppressing inflammation and oxidative stress through inhibiting NF-κ B and JAK/STAT signaling pathways in rats[J].Int Immunopharmacol,2017,48:102-109.
[11]Harima M,Arumugam S,Wen J,et al.Effect of carvedilol against myocardial injury due to ischemia-reperfusion of the brain in rats[J].Exp Mol Pathol,2015,98(3):558-562.
[12]Marchant DJ,Boyd JH,Lin DC,et al.Inflammation in myocardial diseases[J].Circ Res,2012,110(1):126-144.
[13]Li Y,Shan Z,Liu C,et al.MicroRNA-294 Promotes Cellular Proliferation and Motility through the PI3K/AKT and JAK/STAT Pathways by Upregulation of NRAS in Bladder Cancer[J].Biochemistry(Mosc),2017,82(4):474-482.
[14]Kim MS,Lee WS,Jeong J,et al.Induction of metastatic potential by TrkB via activation of IL6/JAK2/STAT3 and PI3K/AKT signaling in breast cancer[J].Oncotarget,2015,6(37):40158-40171.
Role of inflammatory factor in SAFE pathway on brain injury in rats induced by myocardial ischemia reperfusion.
Z HAO Bo,MA Li,ZHAN Li-ying,LENG Yan,YUAN Quan,LIU Lian.Department of Anesthesiology,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo evaluate the role of inflammatory factor in survivor activating factor enhancement(SAFE)pathway on brain injury rats induced by myocardial ischemia reperfusion(IR).MethodsTwenty-four male Sprague-Dawley rats were divided into 3 groups by random number table(8 cases in each group):Sham group,IR group,IR+AG490 group.Myocardial IR was induced by occlusion of the anterior descending branch of the left coronary artery for 30 min in IR group and IR+AG490 group.The rats were sacrificed after 120 min of reperfusion and the brain were removed for the check of Janus Kinase 2/Signal Transducer and Activator of Transcription 3(JAK2/STAT3),interleukin-1(IL-1),interleukin-6(IL-6),interleukin-8(IL-8).Apoptosis was detected by TUNEL assay and cysteine-containing aspartic proteolytic enzyme 3(Caspase3)activity was detected by colorimetric assay.ResultsCompared with sham group,p-Jak2[(1.8±0.13)vs(1.0±0)],p-STAT3[(1.6±0.08)vs(1.0±0)],IL-1[(3.3±0.16)vs(1.0±0)],IL-6[(3.3±0.16)vs(1.0±0)],IL-8[(2.8±0.28)vs(1.0±0)],TUNEL[(18.8±1.29)%vs(4.2±0.44)%],Caspase3[(2.6±0.24)vs(1.0±0)]were significantly increased in IR group(P<0.05);compared with IR group,p-Jak2[(1.3±0.09)vs(1.8±0.13)],p-STAT3[(1.1±0.11)vs(1.6±0.08)],IL-1[(2.1±0.17)vs(3.3±0.16)],IL-6[(1.9±0.22)vs(3.3±0.16)],IL-8[(2.2±0.19)vs(2.8±0.28)],TUNEL[(13.2±1.03)%vs(18.8±1.29)%],Caspase3[(2.1±0.21)vs(2.6±0.24)]were significantly decreased in IR+AG490 group(P<0.05).ConclusionInhibiting the activation of SAFE pathway can reduce brain injury induced by myocardial IR in rats though decreasing the inflammatory factor of downstream.
Survivor activating factor enhancement(SAFE)pathway;Inflammatory factor;Myocardial ischemia reperfusion;Brain injury
R-332
A
1003—6350(2017)20—3269—03
10.3969/j.issn.1003-6350.2017.20.001
湖北省自然科学基金(编号:2016CFB167,2017CFB267);中央高校基本科研业务费专项基金(编号:2042017kf0147)
赵博。E-mail:zb14526@163.com
2017-04-03)
