湿法炼锌过程中赤铁矿生成及硫的吸附转化
2017-11-11王益昭李存兄邓志敢李兴彬易烁文
王益昭,李存兄, 2,魏 昶,邓志敢,李兴彬,樊 刚,易烁文
湿法炼锌过程中赤铁矿生成及硫的吸附转化
王益昭1,李存兄1, 2,魏 昶1,邓志敢1,李兴彬1,樊 刚1,易烁文1
(1. 昆明理工大学冶金与能源工程学院,昆明 650093;2. 昆明高聚科技有限公司,昆明 650106)
赤铁矿法除铁工艺因渣含铁高,渣量小,无二次污染等特点备受国内外关注。硫含量是影响赤铁矿品质并实现其资源化利用的重要因素之一。本工作研究温度、时间、Na2SO4浓度、晶种用量、始酸浓度等因素对赤铁矿沉铁过程除铁率、亚稳态铁物相转变及硫吸附转化行为的影响规律。结果表明:升高温度、延长反应时间、添加晶种、降低始酸浓度、控制Na2SO4浓度可有效提高除铁率且有利于铁矾向赤铁矿转化,从而显著降低渣中硫含量,提升赤铁矿渣品质。在反应温度为180 ℃、反应时间3 h、氧分压0.4 MPa、晶种15 g/L、硫酸钠浓度为0.15 mol/L的条件下,除铁率达到96%左右,渣含铁为65.8%,硫、钠的含量为1.42%、0.067%,获得了高品质的赤铁矿渣。
赤铁矿;铁矾转化;沉铁率;吸附
随着我国国民经济的快速发展,国内对金属锌的需求急剧上升,然而伴随矿产资源的不断开发利用,高品质锌资源逐渐枯竭,为满足市场的需求,低品位、多金属、杂质含量高的复杂锌矿物资源的开发利用越来越受到锌冶炼企业的重视,尤其是高铁闪锌矿的开发利用引起人们的广泛关注。高铁闪锌矿具有含铁高(>10%,质量分数),锌含量较低(<45%)的特点[1−2],使得湿法炼锌过程中除铁工艺的选择显得尤为重要。如何在含锌高铁溶液中实现锌铁的高效分离以及铁的资源化利用已成为当今湿法炼锌行业研究的热点问题。传统湿法炼锌过程主要包括焙烧、浸出、净化和电积4个工序[3],锌焙砂中的铁在浸出过程中会不可避免的进入到溶液中,为获得高质量阴极锌及高电流效率,必须将电积前液的铁浓度除至合理的范围。
传统锌冶炼工艺中的除铁方法有两种:常规法(中浸渣还原挥发)和热酸浸出法。热酸浸出法根据铁入渣的形态不同,又分为黄钾铁矾法、针铁矿法和赤铁矿法。黃钾铁矾法除铁工艺因为操作简单、投资少、除铁率高等优点而广泛被湿法炼锌企业所采用,然而该工艺产出的铁矾渣存在着含铁低(25%~35%)、渣量大、易造成有价金属损失及无法实现资源循环利用等问题;针铁矿工艺产出的铁渣虽铁含量较高(32%~45%),但同样有渣量大、渣中杂质元素含量高等问题存在[4−5]。随着国内环保要求越来越严格,两种除铁工艺带来的问题也越来越突出—沉铁渣无法循环利用且需要进行无害化处理。相比于传统的除铁方法,赤铁矿工艺虽然存在设备成本昂贵,维修费用高等问题,但在环境保护和废弃资源循环利用方面具有显著的优势:赤铁矿渣稳定性强、渣中铁含量高(55%~65%)、渣量小且在回收锌精矿伴生有价金属(如铟、铜)等方面存在着巨大的优势及可行性[6−7]。然而由于赤铁矿法除铁工艺的特殊性及技术保密等原因,全球目前只有日本的秋田锌冶炼厂采用赤铁矿除铁工艺,该厂将大部分的赤铁矿渣作为副产品销售给水泥厂,实现了废弃资源循环利用的目标[8]。
秋田锌厂产出的赤铁矿渣中硫含量在2%~4%之间,硫含量过高会直接影响赤铁矿的销售。赤铁矿渣中S的主要来源有3种:碱式硫酸铁、铁矾以及硫酸根离子的不可逆吸附,其中铁矾含硫量占赤铁矿渣中总含硫量50%以上[8]。Na2SO4是高铁溶液中不可避免的硫酸盐,会导致除铁过程中黄钠铁矾的产生;大量硫酸根离子的存在会改变高温酸性溶液的性质,进而对除铁过程产生影响。研究高铁溶液中硫酸盐对赤铁矿法除铁的影响及除铁过程中亚稳态铁物相(铁矾)向赤铁矿转化的规律,对降低赤铁矿渣中硫含量,提高赤铁矿渣的品质具有重要的现实意义。
1 实验
1.1 实验试剂
本实验所用的高铁溶液是用分析纯七水硫酸亚铁(FeSO4·7H2O)和硫酸钠(Na2SO4)(天津市风船化学试剂科技有限公司)按一定浓度要求配置。晶种为分析纯的三氧化二铁(Fe2O3)(天津市瑞金特化学品有限公司)。
1.2 实验方法
将1.5 L配置好的高铁溶液加入高压釜(型号:GSH2/TA2−00)内,密封高压釜后通氮气2~3 min,排出釜内氧气后开始加热,待温度升至设定温度后开始计时,开启搅拌(500 r/min),通入氧气并调节氧分压为0.4 MPa。反应过程中每隔0.5 h取一次样(30、60、90、120、150、180 min),并快速进行固液分离,到达反应时间后快速降温冷却。所有矿浆经过液固分离后获得滤液和滤渣,量取滤液体积后保存,取等滤液体积的去离子水(80 ℃)洗渣(重复4次),滤渣在101−I型电热鼓风干燥箱烘干(48 h)后制样。
1.3 分析检测
采用X射线衍射仪(型号:D/max−2200)分析赤铁矿渣的物相组成;红外光谱仪(型号:Bruker TENSOR27)对沉铁渣中硫含量变化趋势进行表征;马尔文激光粒度仪(型号 ZEN3690)分析赤铁矿渣的粒度。利用扫描电镜和扫描电镜能谱仪(SEM/EDS)(型号 VEGA 3 SBH)对沉铁渣的形貌进行表征。采用X射线光电子能谱仪(XPS)(型号 PHI5500)分析硫在赤铁矿渣表面的存在形态。取沉铁渣和滤液送云南省分析测试中心测定相关元素含量。
1.4 实验原理
硫酸亚铁氧化水解为赤铁矿的反应:
2FeSO4+0.5O2+2H2O=Fe2O3+2H2SO4(1)
反应(1)主要由亚铁氧化和三价铁的水解两部分组成:
2FeSO4+0.5O2+H2SO4=Fe2(SO4)3+H2O (2)
Fe2(SO4)3+3H2O=Fe2O3+3H2SO4(3)
当溶液处于高酸浓度下时,存在如下反应:
Fe2(SO4)3+2H2O=2FeOHSO4+H2SO4(4)
当溶液中有Na+存在时,会存在如下反应:

式(4)、(5)以及SO42−的不可逆吸附是赤铁矿渣中硫的主要来源。高温条件下,式(5)可按照收缩核模 型[9]逆向进行,铁矾溶解最终形成赤铁矿。
2 结果与讨论
2.1 反应温度和时间的影响
在初始Fe2+浓度为30 g/L、Na2SO4浓度0.15 mol/L、初始pH=3.5、反应时间3 h、氧分压0.4 MPa、搅拌速度500 r/min的条件下,改变反应温度和时间,考察温度、时间对除铁率及铁物相转化的影响规律。结果如图1所示。

图1 温度和时间对除铁率的影响
由图1可见,溶液中的除铁率随着反应时间延长和温度升高而逐渐升高,当反应时间为180 min时,4个温度(170、180、190、200 ℃)下的除铁率分别为91%、92%、92.6%、94.5%。说明升高温度和延长反应时间均有利于赤铁矿(见式(1))和铁矾(见式(5))的形成。不同温度下获得的沉铁渣的X射线衍射分析结果如图2所示。
由图2可知,当反应温度为170 ℃和180 ℃时,渣中物相主要为赤铁矿和铁矾。随着反应温度的升高,铁矾的衍射峰强度逐渐减弱,赤铁矿的衍射峰变窄其特征峰明显增强,当反应温度升至200 ℃时,沉铁渣中只存在赤铁矿物相。说明温度对沉铁渣的物相组成有显著影响,升高温度有利于赤铁矿生成并得到更稳定的赤铁矿晶型。
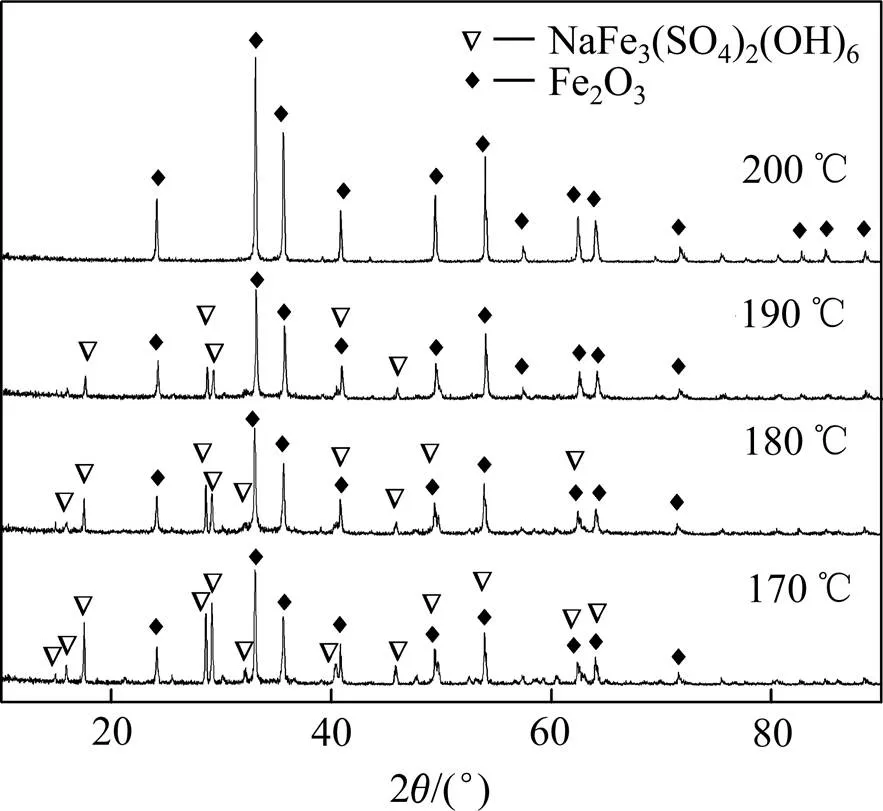
图2 不同反应温度下赤铁矿渣的XRD谱
为明确温度和时间对渣中物相组成的影响,分别对沉铁渣中铁矾及铁的含量进行了检测。结果如图3所示。
由图3(a)可知,反应30 min后,不同温度(170、190和200 ℃)下渣中的铁矾含量分别为35.8%、15.1%和1.02%;200 ℃时,渣中铁矾含量先增加后减少,120 min时铁矾含量为0.068%。说明高温对铁矾的生成具有抑制作用,温度越高(≥200 ℃)铁矾越容易发生溶解,最终转化成赤铁矿。
由图3(b)可知,在较低温度(170和190 ℃)下,随着反应时间的延长,渣中铁含量逐渐降低;200 ℃时,随着反应时间延长,渣中铁含量先降低后升高,说明升高温度并延长反应时间有利于赤铁矿的生成并能有效提高渣中铁含量。
2.2 硫酸钠浓度的影响
在初始Fe2+浓度为30 g/L、反应温度200 ℃、初始pH=3.5、反应时间3 h、氧分压0.4 MPa、搅拌速度500 r/min的条件下,考察了Na2SO4浓度对除铁率及渣中铁、钠、硫含量的影响规律。结果分别如图4和表1所列。
由图4可见,随着Na2SO4浓度升高,除铁率逐渐增加,当Na2SO4浓度由0 mol/L升高到0.25 mol/L时,除铁率由91%提高至96.3%。除铁率升高与Fe2+的氧化能力密切相关,Na2SO4的加入会使体系中SO42−增多,溶液中会形成大量的FeSO4离子对,它的氧化能力远强于Fe2+,使更多的Fe2+氧化水解形成赤铁矿[10]。又因同离子效应的存在,使得该硫酸盐体系存在以下平衡关系:

图3 温度和时间对渣中铁矾及铁含量的影响

图4 初始硫酸钠浓度对除铁率的影响
H2SO4=H++HSO4−(完全电离) (6)
HSO4−=H++SO42−(部分电离) (7)
Na2SO4的加入使溶液中H+活度的降低,扩大了赤铁矿的稳定区,更多的赤铁矿颗粒从溶液中析 出[11−12]。

表1 不同初始Na2SO4浓度下沉铁渣主要化学元素组成
表1可见,随着Na2SO4浓度升高(≤0.15 mol/L),渣中铁含量逐渐升高,硫含量逐渐降低,钠含量几乎可以忽略。
当Na2SO4浓度升高至0.25 mol/L时,除铁率虽增加,但渣中的铁含量降低,硫、钠含量同时升高,说明渣中可能存在着少量铁矾,可能因为其含量较少或以非晶形式存在于渣中,固无法从该渣样的XRD检测中并未发现铁矾的存在。为了确定铁矾是否存在于这部分渣中,对渣样中的硫进行了XPS检测分析,结果如图5所示。
由图5可知,硫的2p3/2和2p1/2峰结合能分别为168.8和167.45。由相关物质结和能的数据[13]可知,硫是以某种硫酸盐的形式存在于赤铁矿表面。已有研究表明[14],沉铁渣中铁矾和赤铁矿是共生关系,结合本实验实际反应条件,可确定该物质为铁矾。

图5 赤铁矿渣中S的XPS谱
2.3 晶种浓度的影响
高温(200 ℃)虽更有利于赤铁矿的形成,促使铁矾溶解并最终转化成赤铁矿。但温度过高会使企业的经济成本增加,不利于赤铁矿技术推广及应用。为在较低温度(180 ℃)下获得纯净赤铁矿,研究了晶种用量对赤铁矿法除铁过程的影响。实验条件如下:初始Fe2+浓度为30 g/L,Na2SO4浓度0.15 mol/L,初始pH=3.5,反应温度180 ℃,反应时间3 h,氧分压0.4 MPa,搅拌速度500 r/min,考察晶种用量对除铁率和渣型的影响。实验结果分别如图6、7和8所示。
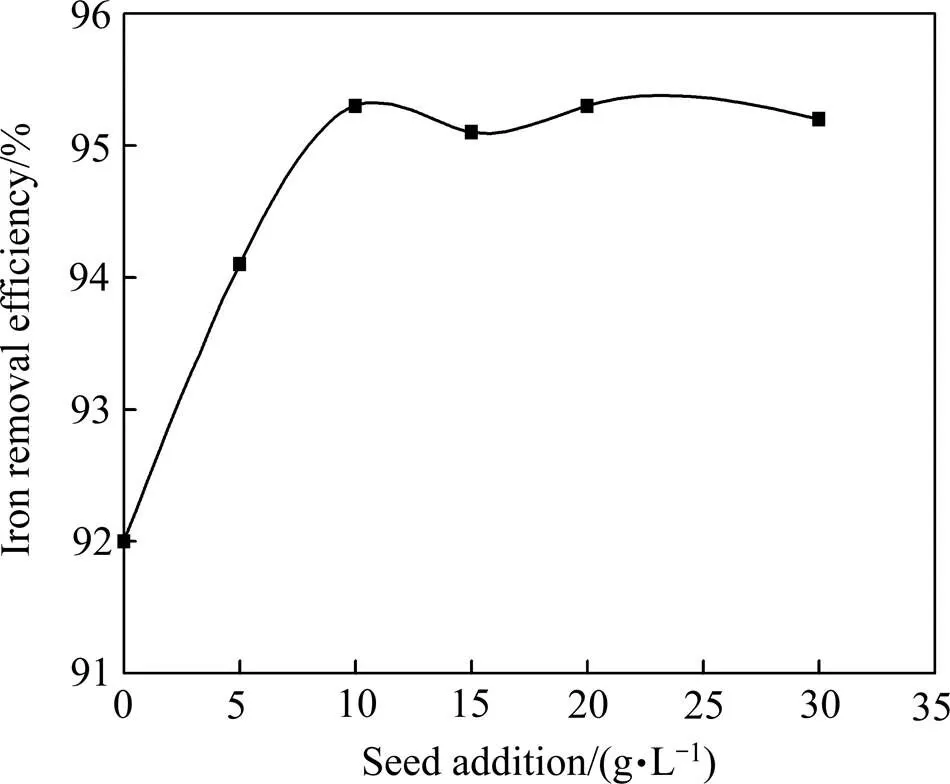
图6 Fe2O3晶种用量对除铁率的影响
由图6可见,当溶液中晶种用量由0 g/L增大至10 g/L时,除铁率由92%升高至95.3%。说明赤铁矿晶体的形核长大过程与晶种有关。无晶种存在时,溶液中Fe3+的浓度需要达到或超过其均相成核的临界饱和度才会形成晶核并逐渐长大析出;晶种的存在为溶液中的Fe3+提供了大量的核心,Fe3+在低于均相成核的临界饱和度时,就已扩散至晶种表面,并在其表面长大析出[15−16]。继续增加晶种用量(>10 g/L)对除铁率影响不大,主要是赤铁矿的形成过程是一个产酸的过程(见式(1)),酸的存在会抑制Fe3+的水解,导致溶液中会始终残留少量的Fe3+。
由图7可知,随着晶种用量的增加,渣中的铁逐渐升高,硫、钠逐渐减少。当晶种用量为15 g/L时,渣中铁含量最高(65.8%),硫、钠含量最低(1.4%、0.073%),继续增加晶种用量对3种元素含量影响不大。图8所示部分解释了渣中铁、硫、钠含量变化的原因,晶种浓度0 g/L时,赤铁矿和铁矾同时存在于渣中;当晶种浓度升高至15 g/L时,沉铁渣中只有赤铁矿存在。晶种的存在既加快赤铁矿晶体形核析出,又避免了铁矾的生成。实验过程中为获得较高除铁率和高品质的赤铁矿,晶种用量选择15 g/L。
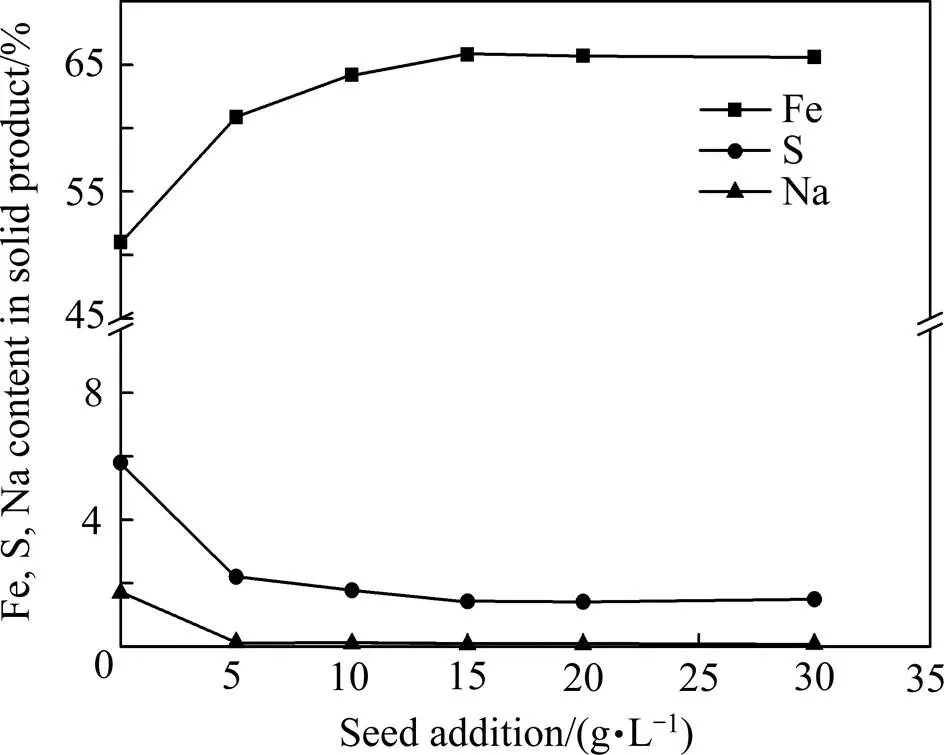
图7 Fe2O3晶种用量对渣中主要化学成分的影响

图8 沉铁渣的XRD谱
2.4 初始酸度的影响
在初始Fe2+浓度为30 g/L、Na2SO4浓度0.15 mol/L、晶种(Fe2O3)浓度15 g/L、反应温度180 ℃、反应时间3 h、氧分压0.4 MPa、搅拌速度500 r/min的条件下,考察硫酸浓度对除铁率和渣型的影响。实验结果分别如图9、10和11所示。
由图9和10可知,随着始酸浓度的升高,溶液中除铁率明显下降,始酸浓度由0升高至0.2 mol/L时,除铁率从95.1%降至78.6%;酸度升高的同时渣中铁含量急剧降低,硫、钠含量则是明显上升;当硫酸浓度为0.2 mol/L时,渣中铁、钠和硫含量分别为41.2%、3.3%和9.1%。说明酸的存在会同时抑制铁矾和赤铁矿的生成,但与铁矾的形成相比(见式(1)和(5)),赤铁矿对酸的变化更为敏感,因而酸的存在对赤铁矿的抑制作用也更为明显;另外由于赤铁矿的溶解度随着酸度的升高而逐渐增大[17],部分赤铁矿颗粒无法从溶液中析出,导致渣中铁矾的占比逐渐增大,进而铁含量降低,硫含量升高。

图9 始酸浓度对除铁率的影响

图10 始酸浓度对渣中化学成分的影响
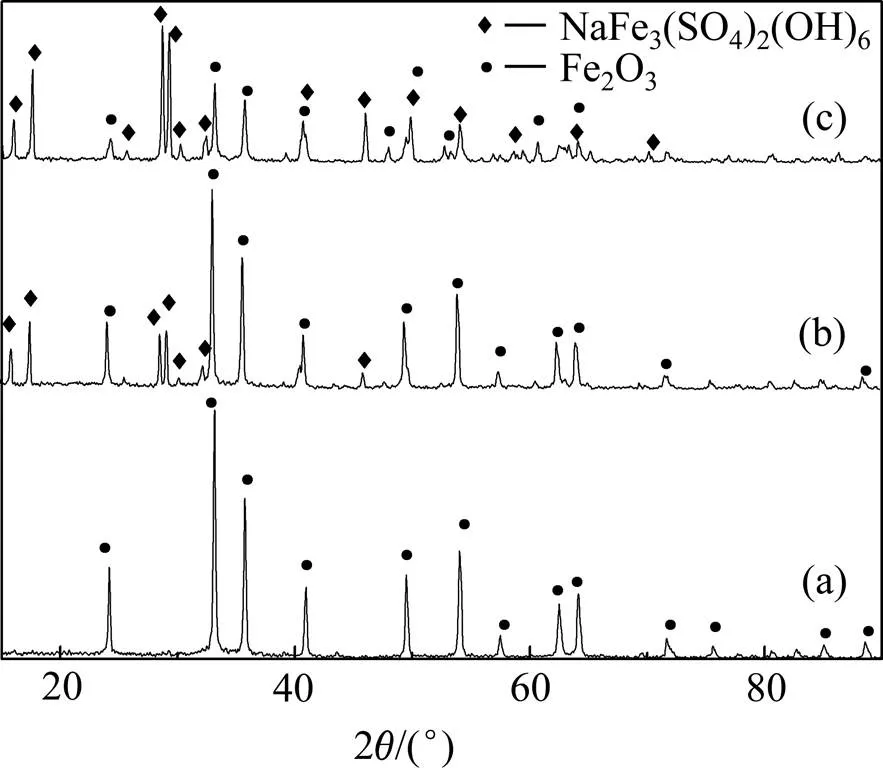
图11 不同硫酸浓度下沉铁渣的XRD谱
由图11可知,随着始酸浓度升高,赤铁矿的衍射峰逐渐减弱,而铁矾的衍射峰逐渐增强,当始酸浓度达到0.1 mol/L时,渣中主要成分为铁矾,并含有少量赤铁矿。进一步说明了酸的存在对赤铁矿的生成更为不利。因此,生产实践中为了获得更为纯净的赤铁矿,需要对除铁前液进行预中和处理。
2.5 渣样分析
2.5.1 赤铁矿渣中硫的分析
为更直观地反映赤铁矿渣中吸附硫的含量变化,对Fe2+浓度为30 g/L、Na2SO4浓度0.15 mol/L、反应温度200 ℃、初始pH=3.5条件下得到的赤铁矿渣进行红外光谱分析,结果如图12所示。

图12 200 ℃时赤铁矿渣的红外光谱图
在900~1300 cm−1范围内的3个红外波段是SO42−的震动吸收峰,其对应着S—O键的拉伸震动。随着反应时间的延长,3个波段的透过率明显减弱,说明SO42−在渣中的吸附作用随着反应时间延长而减弱。SO42−是以双配位络合反应的形式吸附于赤铁矿渣表面的,H+浓度的升高会阻碍硫的双配位络合反应[18],因此延长反应时间,有利于降低SO42−在赤铁矿颗粒表面的吸附作用,进而减少渣中的硫含量。SO42−的吸附还与赤铁矿晶体表面的形貌有关[5],由赤铁矿的SEM图(见图15)可知,赤铁矿是由细小的晶体颗粒附聚长大形成的,其表面由很多细小的孔隙,这种物理表面有利于硫酸根的吸附。
2.5.2 粒度分析
图13(a)所示为不同温度下(170、190和200 ℃),初始FeSO4浓度30 g/L,Na2SO4浓度0.15 mol/L,pH=3.5,反应3 h后获得的赤铁矿渣粒度累积分布图,用50(颗粒的平均粒度)表示。温度为170、190和200℃时,50数值分别为13.13、8.95和7.60 μm。说明温度越高,赤铁矿的粒度越小。

图13 不同温度和Na2SO4浓度下赤铁矿渣的粒度分布
图13(b)所示为200℃时,不同Na2SO4浓度下赤铁矿渣的粒度累积分布图,随着硫酸钠浓度的升高D0值分别为12.54、7.60和5.82 μm。Na2SO4的存在,加快了Fe2+氧化速率,溶液中部分赤铁矿形核析出的速度超过了附聚长大速度,导致赤铁矿粒度降低。同时硫酸盐的存在使溶液的黏度增加[19],溶质离子的传质速度减缓,影响Fe3+在赤铁矿晶体表面继续析出。
2.5.3 沉铁渣形貌分析
对初始亚铁离子浓度30 g/L、Na2SO4浓度0.15 mol/L、pH=3.5、不同反应温度(180和200 ℃)下得到的沉铁渣进行扫描电镜(SEM)和扫描电镜能谱(EDS)分析。结果如图14所示。
图14(a)和(b)所示为200 ℃时得到的纯赤铁矿晶体,其以大、小两种无定形的球状颗粒聚合物为主,颗粒间分散性较好。这种颗粒聚合物主要是由于溶液中均相成核占主导,赤铁矿颗粒聚集长大的速度大于其定向长大速度所致。

图14 沉铁渣的SEM像及SEM-EDS谱
图14(c)和(d)所示为180 ℃时获得的沉铁渣,主要由两种形状和大小不同的晶体颗粒组成,结合XRD谱(见图2)和SEM-EDS谱(见图14(e)和(e′))分析,可确定渣中方块状颗粒物为铁矾晶体,其粒度远大于赤铁矿;由图14(d)可见,方块状铁矾表面有细小的颗粒附着物,可能是少数赤铁矿晶体以铁矾表面为异相成核的核心进行结晶析出。
3 结论
1) 升高温度不仅可提高溶液除铁率,更有利于铁矾溶解向赤铁矿转化,获得高品质的赤铁矿渣;硫酸盐的存在有利于加快Fe2+的氧化速率,提高除铁率和渣中铁含量,降低硫含量。为防止铁矾的生成,应该尽可能的降低溶液的始酸和Na+的浓度。
2) Fe2O3晶种的存在可抑制铁矾的生成,加快赤铁矿的形核过程,降低溶液的过饱和度,使更多的Fe3+沉淀析出。减少硫酸根在赤铁矿表面的吸附,降低渣中硫含量的同时得到性质更为稳定的赤铁矿渣。
3) 本实验中铁矾和硫酸根的吸附是赤铁矿渣中硫的两种主要存在形式,硫酸根的吸附与反应时间、赤铁矿渣的形貌有关。
4) Na2SO4存在的条件下,为获得较高的除铁率和高品质的赤铁矿渣,在反应温度为180 ℃,时间3 h,氧分压0.4 MPa,晶种用量15 g/L时,溶液中的除铁率可达95%以上,渣中的铁、硫、钠含量分别为65.8%、1.42%、0.067%,实现了亚稳态铁物相向其稳定态的转化。
[1] 王吉坤, 李存兄, 李 勇, 张红耀, 黄 卉, 阎江峰, 刘 露, 魏 昶. 高铁闪锌矿高压酸浸过程中ZnSFeSH2O系的电位−pH图[J].有色金属(冶炼部分), 2006(2): 2−5.WANG Ji-kun, LI Cun-xiong, LI Yong, ZHANG Hong-yao, HUANG Hui, YAN Jiang-feng, LIU Lu, WEI Chang. The−pH figure of ZnS-FeS-H2O system during acid leaching under pressure of high iron sphalerite[J]. Nonferrous Metal (Extractive Metallurgy), 2006(2): 2−5.
[2] ZHANG Fan, WEI Chang, DENG Zhi-gan, LI Xing-bin, LI Cun-xiong. Reductive leaching of indium-bearing zinc residue in sulfuric acid using sphalerite concentrate as reductant[J]. Hydrometallurgy, 2016, 161: 102−106.
[3] 魏 昶, 李存兄. 锌提取冶金学[M]. 北京: 冶金工业出版社, 2013: 114−124. WEI Chang, LI Cun-xiong. Zinc extraction metallurgy[M]. Beijing: Metallurgical Industry Press, 2013: 114−124.
[4] 杨 凡, 邓志敢, 魏 昶, 李存兄, 李兴彬. 采用赤铁矿去除高铁闪锌矿浸出液中的铁[J]. 中国有色金属报, 2014,24(9): 2387−2392.YANG Fan, DENG Zhi-gan,WEI Chang, LI Cun-xiong, LI Xing-bin. Iron-removal by hematite from leaching liquor of high iron sphalerite[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(9): 2387−2392.
[5] 陈永明, 唐谟堂, 杨声海, 何 静, 唐朝波, 杨建广, 鲁君乐. NaOH分解含铟铁矾渣新[J]. 中国有色金属报, 2009, 19(7): 1322−1331. CHEN Yong-ming, TANG Mo-tang, YANG Sheng-hai, HE Jing, TANG Chao-bo, YANG Jian-guang, LU Jun-yue. Novel technique of decomposition of ammonium jarosite bearing indium in NaOH medium[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(7): 1322−1331.
[6] RUIZ M C, ZAPATA J, PAILL R. Effect of variables on the quality of hematite precipitated from sulfate solutions[J]. Hydrometallurgy,2007, 89(2): 32−39.
[7] TINDALL G P, MUIR D M. Effect of Eh on the rate and mechanism of the transformation of goethite into hematite in a high temperature acid leach process[J]. Hydrometallurgy, 1998, 47(2): 377−381.
[8] CHENG T C M. Production of hematite in acidic zinc sulfate media[D]. Montreal: Materials Engineering McGill University, 2002: 1−3.
[9] 陈家镛,余淑秋,伍志春. 湿法冶金中铁的分离与利用[M]. 北京: 冶金工业出版社, 1991: 112−135. CHEN Jia-yong, YU Shu-qiu, WU Zhi-chun. Separation and utilization of iron in hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1991: 112−135.
[10] DREISINGER D B, PETERS E. The oxidation of ferrous sulfate by molecular oxygen under zinc pressure-leach conditions[J]. Hydrometallurgy, 1989, 22(1): 101−119.
[11] VOIGT B, GOBLER A. Formation of pure hematite by hydrolysis of iron(Ⅲ) salt solutions under hydrothermal conditions[J]. Crystal Research and Technology,1986, 21(9): 1177−1183.
[12] CHENG T C M, DEMOPOULOS G P. Hydrolysis of ferric sulfate in the presence of zinc sulfate at 200°C: Precipitation kinetics and product characterization[J]. Industrial & Engineering Chemistry Research, 2004, 43(20): 6299−6308.
[13] BRIGGS D. X射线与紫外光电子能谱[M]. 桂琳琳, 黄惠忠, 郭国霖. 北京: 北京大学出版社, 1984: 23..
BRIGGS D. Handbook of X-ray and ultraviolet photoelectron spectroscopy [M]. GUI Lin-lin, HUANG Hui-zhong, GUO Guo-lin, transl. Beijing: Peking University Press, 1984: 23.
[14] 杨 凡, 邓志敢, 魏 昶, 李兴彬, 李存兄, 邱伟佳, 朱如龙. 高铁闪锌矿赤铁矿法除铁中锌离子和镁离子的影响及存在机理[J]. 中国有色金属学报, 2014, 24(11): 2906−2913.YANG Fan, DENG Zhigan, WEI Chang, LI Xingbin, LI Cunxiong, QIU Weijia, ZHU Rulong. Effect and existence mechanism of zinc ion and magnesium ion in iron removal from high iron sphalerite by hematite process[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(11): 2906−2913.
[15] UMETSU Y, SASAKI K. Hydrometallurgical studies on hydrolysis of ferric sulphate solutions at elevated temperatures[J]. Canadian Metallurgical Quarterly, 1977, 16(1): 111−117.
[16] LU J M, DREISINGER D. Pressure oxidation of ferrous ions by oxygen and hematite precipitation from concentrated solution of calcium [J]. Copper and Iron Chlorides, 2013, 140(9): 59−65.
[17] LIU H, PAPANGELAKIS V G, ALAM M S, SINGH G. Solubility of hematite in H2SO4solutions at 230−270 ℃[J]. Canadian Metallurgical Quarterly, 2003, 2(42): 111−118.
[18] TUMER L J, KRAMER J R. Sulfate ion binding on goethite and hematite[J]. Soil Science, 1991, 3(152): 226−132.
[19] LIU H X, VLADIMIROS G, PAPANGELAKIS V G. Themodynamic equilibrium of the O2-ZnSO4-H2SO4-H2O system from 25 to 250 ℃[J]. Fluid Phase Equilibria, 2005, 234: 122−130.
Production of hematite and conversion of adsorption S in zinc hydrometallurgy process
WANG Yi-zhao1, LI Cun-xiong1, 2, WEI Chang1, DENG Zhi-gan1, LI Xing-bin1, FAN Gang1, YI Shuo-wen1
(1. Kunming University of Science and Technology, Faculty of Metallurgical and Energy Engineering, Kunming 650093, China; 2. Kunming Gaoju Science and Technology Co., Ltd., Kunming 650106, China)
Hematite process with the properties of high iron content, small residue volume and no secondary pollution has been paid great attention in the whole world. Sulfur content is one of the most important factors which affect the hematite quality and its utilization as a resource. The effects of temperature, time, Na2SO4concentration, seed addition, initial concentration of sulfuric acid on iron removal efficiency, conversion behavior of semi-stable iron phases and adsorption of sulfur were investigated in present work. The results show that the jarosite is more likely to convert into hematite and sulfur content reduces in precipitate with increasing temperature, time and seed addition, and reducing the initial acid concentration and controlling the sodium ion concentration. The high quality hematite precipitates, which are obtained at reaction temperature of 180 ℃, retention time of 3h, oxygen partial pressure of 0.4 MPa, seed addition of 15 g/L and Na2SO4concentration of 0.15 mol/L, contain 65.8% Fe, 1.42% S and 0.067% Na, and with iron removal efficiency of 96%
hematite; jarosite transformation; removal efficiency of iron; adsorption
(编辑 何学锋)
Projects(51474117, 51664038, 51364022, 51564030) supported by the National Natural Science Foundation of China; Project(2014CB643404) supported by the National Basic Research Development Program of China; Project(ZD2014003) supported by the Education Department of Yunnan Province, China
2016-09-12;
2017-04-26
LI Cun-xiong; Tel: +86-871-65188819; E-mail: licunxiong@126.com
10.19476/j.ysxb.1004.0609.2017.10.23
1004-0609(2017)-10-2145-09
TF813
A
国家自然科学基金资助项目(51474117,51664038,51364022,51564030);国家重点基础研究发展计划资助项目(2014CB643404);云南省教育厅科学研究基金重大专项项目(ZD2014003)
2016-09-12;
2017-04-12
李存兄,教授,博士;电话:0871-65188819;E-mail: licunxiong@126.com
