miRNA-106b失活可通过上调MMP2表达参与乳腺癌骨转移
2017-11-10倪小健张宏伟
倪小健,张宏伟,朱 玮
复旦大学附属中山医院普通外科,上海 200032
·论著·
miRNA-106b失活可通过上调MMP2表达参与乳腺癌骨转移
倪小健,张宏伟,朱 玮*
复旦大学附属中山医院普通外科,上海 200032
目的探讨基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)及其调控子has-miR-106b (miRNA-106b/miR-106b)在乳腺癌骨转移中的作用及机制。方法采用定量PCR、免疫组织化学染色、Western 印迹法测定乳腺癌骨转移患者MMP2、 miR-106b的表达,并分析MMP2与乳腺癌骨转移患者临床特征的关系。细胞迁移和侵袭实验观察MMP2、miR-106b表达变化体外对乳腺癌细胞迁移和侵袭的影响。荧光素酶报告基因检测MMP2和miR-106b的靶向关系。Western 印迹验证受调控的下游信号通路。结果MMP2在侵袭能力较强的细胞如SUM1315-bo中表达较高,在侵袭能力较弱的乳腺癌细胞如MCF-7中表达较低;而miR-106b的表达与之相反。与未发生骨转移的乳腺癌患者相比,MMP2蛋白在乳腺癌骨转移患者原位肿瘤标本中表达较高;miR-106b的表达与之相反。MMP2促进乳腺癌细胞的迁移和侵袭,miR-106b反之(P<0.05)。miR-106b可下调 MMP2 的表达,进而影响下游调控因子p-ERK/ERK的表达(P<0.05)。 在SUM1315-bo中下调 MMP2 基因后,其培养基培养的骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cell,HMSC)定向分化为成骨细胞过程中,细胞核因子 κB 受体活化因子配体(RANKL)/骨保护素(osteoprotegerin,OPG)轴失衡,即 OPG含量增加、 RANKL含量减少,导致破骨细胞分化减少(P<0.05)。结论MMP2过表达是乳腺癌骨转移的危险因素,这可能与miR-106b失活有关;MMP2 可能通过调节ERK信号通路而促进乳腺癌溶骨性骨转移;miR-106b-MMP2-ERK信号通路是乳腺癌骨转移潜在的预测因子及治疗靶标。
基质金属蛋白酶2; miR-106b; 骨转移; 乳腺癌
乳腺癌在女性中发病率较高,达女性肿瘤总发病率的30%[1]。乳腺癌常转移至骨[2],导致病理性骨折、神经压迫(包括脊髓压迫)、高钙血症等[3],严重影响患者生活质量。本研究前期在新型人源性乳腺癌骨转移小鼠模型中发现,人乳腺癌细胞株SUM1315可在新模型的移植骨中形成自发的骨转移[4-5]。从SUM1315在模型移植物中形成的原位肿瘤和骨转移瘤中分别分离、提取、纯化了得到了相应的原代细胞亚株(移植人乳腺来源SUM1315-br,移植人骨来源SUM1315-bo),并对这些亚株进行基因表达谱、miRNA表达谱分析[6]。
基质金属蛋白酶(matrix metalloproteinases,MMPs)与肿瘤的侵袭和转移相关[7]。其中,MMP2可以分解基膜的主要构成成分Ⅳ型胶原酶和明胶[8]。MMP2在多种肿瘤中高表达,且其表达与肿瘤的局部浸润、淋巴结转移及患者生存率相关[9-12]。MMP2是乳腺微环境和肿瘤微环境的重要成分,其在人源性乳腺癌骨转移小鼠模型中显著上调[6]。乳腺癌患者血清中MMP2水平增加与其不良预后相关[13],但是目前缺乏其与乳腺癌骨转移关系的相关研究。
微小RNA(microRNA,miRNA)与乳腺癌的发生、发展、侵袭及转移密切相关[14-16]。本课题组通过TargetScan软件发现,miR-106b能调控MMP2的表达。miR-106b定位于染色体7q22的13号内含子区域的miRs 93-25[17]。但miR-106b在乳腺癌中的作用目前鲜有报道。因此,本研究探讨了MMP2、miR-106b在乳腺癌骨转移过程中的表达及相关机制,以期为乳腺癌骨转移潜在机制探讨及治疗靶点的筛选提供新思路。
1 材料与方法
1.1 乳腺癌细胞及来源 实验所用乳腺癌细胞MDA-MB-231、BT474、MCF-7、MDA-MB-468、HCC1937、T47D、和ZR-75-30均购自ATCC公司。乳腺癌细胞SUM1315由美国密歇根大学Stephen Ethier教授馈赠。乳腺癌细胞SUM1315-br来源于移植人乳腺;SUM1315-bo来源于移植人骨。细胞均用含10%FBS的DMEM在37℃、5%CO2培养箱中培养。
1.2 乳腺肿瘤组织来源 选取在江苏省人民医院乳腺外科及复旦大学附属中山医院普通外科确诊为乳腺肿瘤Ⅰ期、Ⅱ期、Ⅲ期患者的乳腺肿瘤组织。本研究通过医院伦理委员会审核批准,患者或家属知情同意并签署知情同意书。
1.3 荧光定量PCR (qPCR)测定MMP2表达 106细胞或100 mg组织抽提RNA,反转录成cDNA,-20℃保存。β-actin引物为: 5′-CTC CAT CCT GGC CTC GCT TGT-3′(F);5′-GCT GTC ACC TTC ACC GTT CC-3′(R)。MMP2 引物为: 5′-GTG GAT GAT GCC TTT GCT C-3′(F); 5′-CAG GAG TCC GTCC TTA CC-3′(R)。引物序列均由Invitrogen公司合成,采用2-ΔΔCt法计算。
1.4 免疫组化染色测定乳腺癌患者原位肿瘤标本中MMP2蛋白的表达 选取临床分期Ⅰ、Ⅱ或Ⅲ期的50例乳腺癌患者的原位肿瘤组织进行免疫组织化学(IHC)染色。染色程度定义为:阳性染色的肿瘤细胞占被检组织区域的百分比。MMP2染色共分为 0~7级:0~5级定义为低表达;6~7级定义为高表达[14]。免疫组织化学染色切片由2位资深的病理学专家读片。采用96%相同的读片结果。意见不一致时请另一位病理学专家读片,采用其中2位相同的读片结果。用ImagePro Plus 6.0 (ImagePro, Bethesda, MD, U.S.)软件分析。
1.5 细胞迁移和侵袭实验
1.5.1 细胞迁移 在Transwell培养板上层加入500 μL不含血清的DMEM培养液,下层加入1.5 mL含10%血清的DMEM培养液,于37℃、5%CO2细胞培养箱中孵育1 h。胰酶消化制成单细胞悬液,计数细胞,按105个/孔将细胞加入 Transwell板,分为实验组、无关干涉对照组和未处理组(每组设3个复孔)。将细胞于37℃、5%CO2培养箱中孵育12 h。取出滤膜,将附于滤膜上层的细胞用棉签擦去,4%多聚甲醛固定15 min,PBS冲洗3次,苏木精染色15 s,PBS冲洗4次;显微镜下计数迁移至滤膜外表面的细胞数,每张滤膜随机取5个视野(×200)。
1.5.2 细胞侵袭 用10 mg/L Matrigel 100 μL/孔包被 Transwell小室底部膜的上室面,在37℃、5%CO2细胞培养箱中干燥2~3 h; 制备细胞悬液,余步骤同细胞迁移。
1.6 荧光素酶报告基因实验 采用Dual-Luciferase®Reporter Assay System (Promega公司)检测。培养SUM1315-bo细胞和MCF-7细胞,并分别接种于 24 孔板中(5.0×104/24孔培养板)。待细胞生长至80%融合度时,将microRNA及荧光素酶报告质粒共转染细胞。42 h后, 每孔加入500 μL PLB裂解细胞,将10 μL细胞裂解液和50 μL LAR Ⅱ混合,检测萤火虫荧光素酶(firefly luciferase, FL)的活力;将100 μL Stop &GloTM试剂加入荧光照度仪管中,湮灭萤火虫荧光素酶反应,同时激活海肾荧光素酶反应,并立即检测海肾荧光素酶(renilla luciferase, RL)的活力。12 s内完成2次测试。结果判断:FL/RL。
1.7 乳腺癌细胞SUM1315-bo对骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cell,HMSC)分化的影响 SUM1315-bo细胞生长融合至70%~80%,在无血清的培养基DMEM中培养24 h,收集培养液,离心、浓缩、分装,存储在-20℃备用。
HMSC(ScienCell公司)以(1.5~2)×105细胞/孔接种于T-75培养瓶中,用3 mL间充质干细胞培养基(MSCM, Scien Cell公司)于37℃、5%CO2培养箱中常规培养。24~48 h首次换液,以后每隔3 d换液1次,共培养7~10 d。细胞融合近80%时,胰酶消化,以5 000/孔接种于24孔板,用MSCM 培养24 h后, 弃MSCM培养液,加入成骨细胞培养基(OBM),诱导细胞向成骨细胞诱导分化。培养第7天,以1×106/孔接种于24孔板,加入按1∶1比例混合的基本培养基/条件培养基(肿瘤细胞在无血清培养基中培养24 h后收集培养液,过滤)。每2 d更换培养基。

2 结 果
2.1 乳腺癌细胞MMP2、miR-106b的表达 结果(图1)表明:MMP2基因在侵袭能力较强的乳腺癌细胞SUM1315、MDA-MB-231中表达较高,在侵袭能力低的乳腺癌细胞MCF-7中表达较低。miR-106b的表达与MMP2的表达趋势相反,即其在MCF-7中的表达最高,在MDA-MB-231、SUM1315中的表达较低。
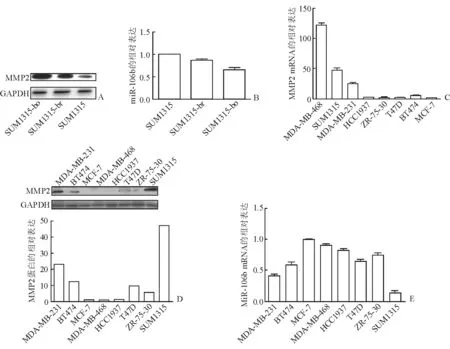
图1 乳腺癌细胞MMP2、miR-106b的表达
A:Western 印迹显示,MMP2蛋白在SUM1315-bo中表达最高;B:荧光定量PCR显示,miR-106b在乳腺癌原代细胞SUM1315-bo中表达最低;C:荧光定量PCR显示,MMP2 mRNA在各种乳腺癌细胞中的表达;D:Western印迹显示,MMP2蛋白在各种乳腺癌细胞中的表达;E:荧光定量PCR显示,miR-106b在各种乳腺癌细胞中的表达
2.2 乳腺癌骨转移患者原位肿瘤组织中MMP2蛋白的表达及其与骨转移的关系 免疫组织化学分析(图2)显示:与未发生骨转移的乳腺癌患者原位肿瘤组织中MMP2的表达相比,发生骨转移的乳腺癌患者原位肿瘤组织中MMP2蛋白表达较高。结果(表1)显示:原位肿瘤组织MMP2蛋白表达高的患者骨转移发生率较高(P=0.001)。
2.3 MMP2基因促进乳腺癌细胞迁移和侵袭 结果(图3)显示:SUM1315-bo中转染MMP2干涉片段1或2后,与无关干涉对照组相比,SUM1315-bo的迁移和侵袭能力下降;MCF-7中过表达MMP2基因后,迁移、侵袭能力升高(P<0.01)。

图2 免疫组化染色测定乳腺癌骨转移患者原位肿瘤组织中MMP2蛋白表达
A:正常乳腺组织;B:未发生骨转移的乳腺癌原位肿瘤标本;C:发生骨转移的乳腺癌原位肿瘤标本. 箭头所指为MMP2蛋白染色结果. Original magnification:×100
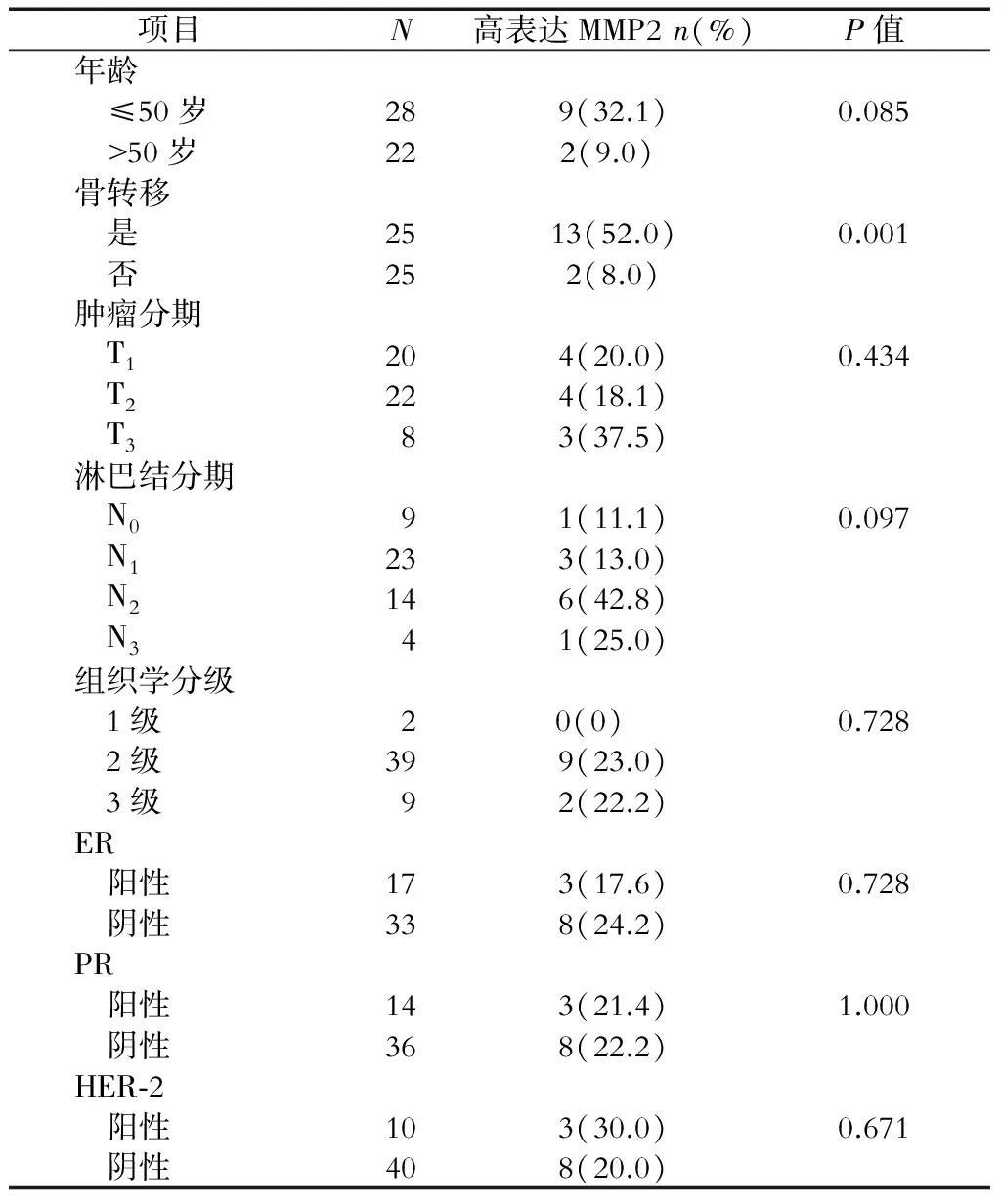
表1 不同临床特征乳腺癌患者MMP2蛋白的表达
ER:雌激素受体;PR:孕激素受体;HER-2:人类表皮生长因子受体2
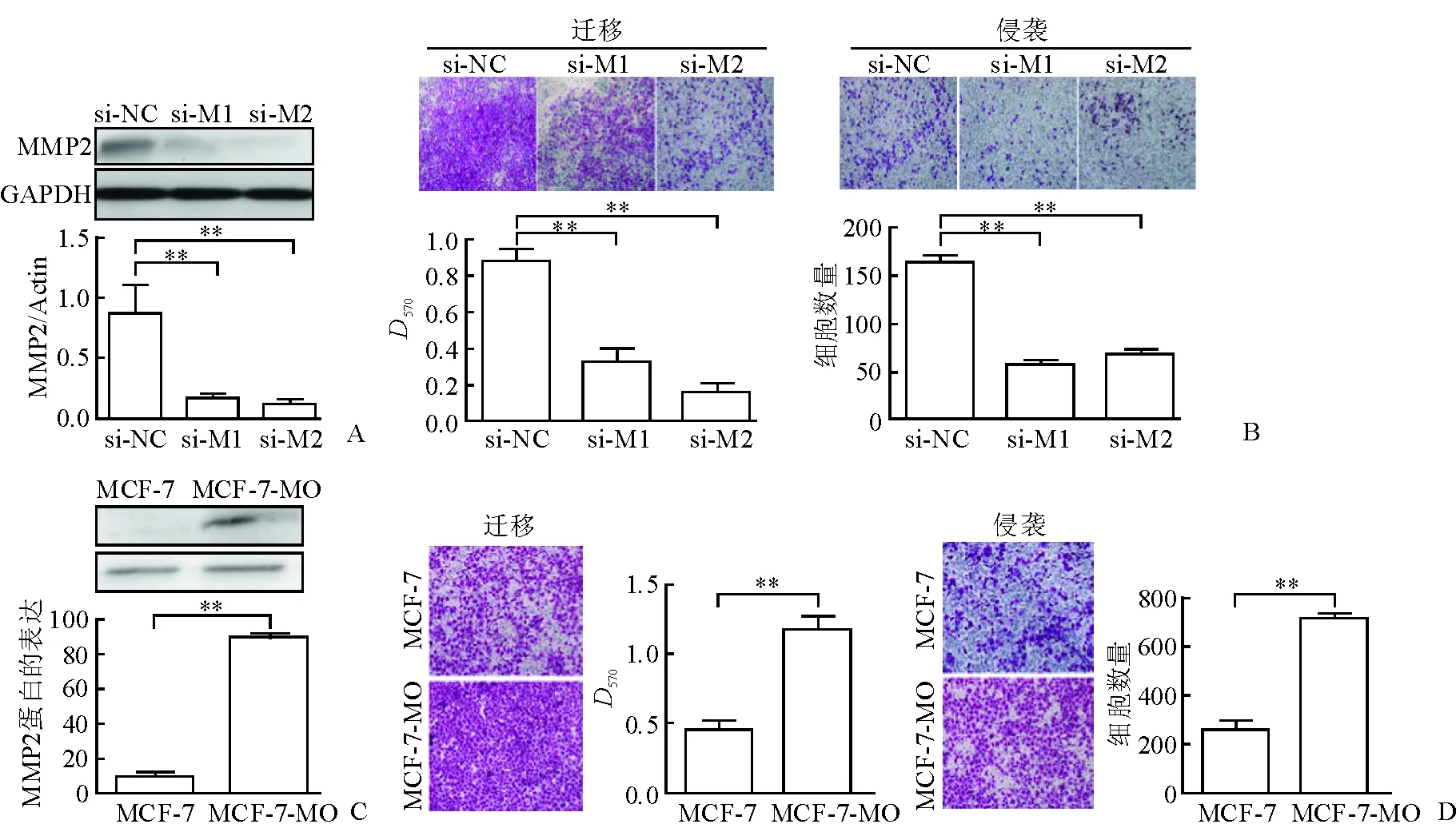
图3 MMP2基因体外促进乳腺癌细胞迁移和侵袭
2.4 miR-106b转染乳腺癌细胞后细胞迁移和侵袭能力下降 定量PCR结果(图4)显示:与对照组相比,SUM1315-bo转染miR-106b后,miR-106b含量增加约90%(图4A),细胞迁移、侵袭能力下降(图4B,P<0.05);与对照组相比,MCF-7中转染miR-106b抑制剂后,miR-106b含量减少约80%(图4C,P<0.05),细胞迁移、侵袭能力增强(图4D,P<0.05)。
2.5 miR-106b调控MMP2基因的表达
2.5.1 荧光定量PCR和Western印迹结果 乳腺癌患者原位肿瘤组织中miR-106b含量低于肿瘤周围正常组织(图5A)。SUM1315-bo中转染miR-106b模拟剂后,miR-106b表达上调、MMP2基因表达下调;MCF-7中转染miR-106b抑制剂后,miR-106b表达下调、MMP2基因表达上调(图5B、5C,P<0.05、0.01)。
2.5.2 荧光素酶报告基因实验结果 突变型荧光报告质粒与miR-106b模拟物共转染SUM1315-bo细胞(miR-106b+pGL3-M-MUT)后,其荧光比值(萤火虫荧光素酶/海肾荧光素酶)与对照组(miR-NC+pGL3-M-MUT)差异无统计学意义,表明miR-106b不能靶向结合MMP2基因3′-UTR区。与突变组(miR-106b+pGL3-M-MUT)相比,野生型荧光报告质粒组(miR-106b+pGL3-M-WT) 中MMP2表达减少(P<0.01),表明miR-106b能特异性结合MMP2的3′-UTR(图5D)。
突变型荧光报告质粒与miR-106b抑制剂共转染MCF-7(miR-106bI+pGL3-M-MUT)后,其荧光比值与对照组(miR-NCI+pGL3-M-MUT)差异无统计学意义,表明miR-106b不能靶向结合MMP2基因的3′-UTR区。野生型荧光报告质粒组(miR-106bI+pGL3-M-WT)荧光比值显著高于对照组(P<0.01),表明miR-106b受抑制后,MMP2 mRNA的表达增加(图5E)。
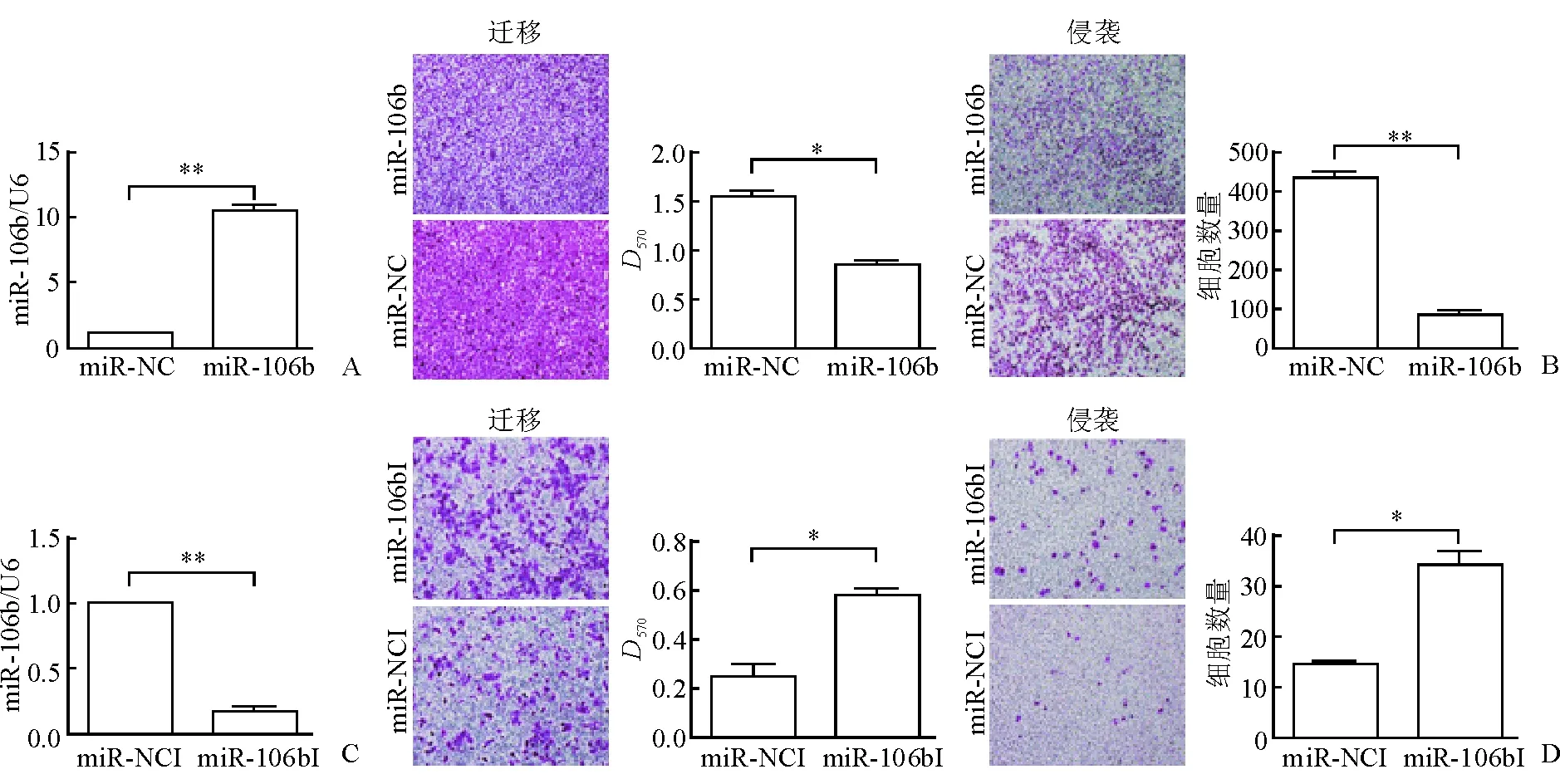
图4 miR-106b抑制乳腺癌细胞迁移和侵袭能力
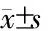
2.6 MMP2和miR-106b对乳腺癌细胞迁移和侵袭能力的影响 免疫组织化学结果(图6)显示: MCF-7共转染miR-106b抑制剂和MMP2无关干涉片段(106bI+si-NC)后,细胞迁移和侵袭能力较对照组(NCI+si-NC)增强。MCF-7共转染miR-106b抑制剂和MMP2干涉片段(106bI+si-MMP2)后,细胞迁移和侵袭能力较对照组(106bI + si-NC)下降(P<0.01)。
2.7 miR-106b下调对乳腺癌细胞ERK表达的影响 Western 印迹结果显示:SUM1315-bo中转染miR-106b模拟剂或转染MMP2干涉片段后,p-ERK/ERK表达较未转染组减小(P<0.05,图7A);MCF-7细胞中转染miR-106b抑制剂,p-ERK/ ERK较未转染组增大(P<0.05,图7B)。
无条件培养基的HMSC定向分化为成骨细胞后,细胞中RANKL/OPG比值<1;SUM1315-bo的培养上清作为条件培养基培养的HMSC定向分化为成骨细胞后,细胞中RANKL/OPG比值>1;转染MMP2干涉片段的SUM1315-bo的培养上清作为条件培养基培养HMSC,其定向分化的成骨细胞中RANKL/OPG比值<1(图7C)。

图5 miR-106b调控MMP2基因的表达
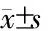

图6 MMP2干涉片段能逆转miR-106b抑制剂的功能
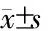

图7 miR-106b下调对乳腺癌细胞ERK表达的影响
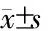
3 讨 论
乳腺癌是女性患病和死亡人数最多的恶性肿瘤,约70%的乳腺癌会发生骨转移[2],且骨转移不能治愈。乳腺癌骨转移后的5年生存率约20%[1]。本研究首次应用免疫组织化学的方法在50例乳腺癌患者中证实:乳腺原位肿瘤组织中MMP2表达高的患者乳腺癌骨转移率高。本研究还通过正向和负向调节证实:MMP2可促进乳腺癌细胞迁移和侵袭,与研究[18]结论相似。
研究表明,肿瘤细胞miRNA表达水平的异常是肿瘤发生、发展的重要影响因素[19]。本研究前期的miRNA芯片结果[6]表明:乳腺癌细胞从乳腺组织到人骨组织的转移过程中,miR-106b表达下调。本研究首次证实:miR-106b在侵袭能力较强的乳腺癌细胞SUM1315-bo中表达较低;miR-106b可以抑制乳腺癌细胞的迁移和侵袭;miR-106b可能参与靶向下调MMP2基因的表达及下游ERK信号通路,从而抑制肿瘤细胞的迁移和侵袭。
RANK和其配体(RANKL)对骨骼改建、免疫系统成熟有重要作用[20];OPG作为游离的诱饵受体,能够和RANK竞争性结合RANKL。成骨细胞表达RANKL和OPG。OPG是RANKL假受体(decay receptor),它可以抑制体内及体外破骨细胞的分化和骨质重吸收。RANKL和OPG相对含量的多少决定了破骨细胞的活性。MMP2表达增高导致RANKL/OPG比值增加,使破骨细胞分化增多[21]。这是乳腺癌导致溶骨性骨转移的经典模式。本研究证实,miR-106b/MMP2/ERK信号通路通过影响RANKL/OPG轴的平衡,从而诱导破骨细胞的分化最终促进乳腺癌骨转移。这说明MMP2不仅能增强肿瘤的侵袭,而且可通过影响肿瘤细胞、成骨细胞、破骨细胞之间的溶骨性信号通路促进肿瘤细胞定居于骨髓微环境。
综上所述,本研究在乳腺癌组织及多种乳腺癌细胞中证实,miR-106b和MMP2的表达与癌细胞的迁移和侵袭相关,其可能通过ERK信号通路发挥作用;靶向miR106b/MMP2/ERK信号通路可能成为乳腺癌骨转移治疗的潜在靶点。
[ 1 ] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[ 2 ] ROODMAN G D. Mechanisms of bone metastasis[J].N Engl J Med, 2004,350(16):1655-1664.
[ 3 ] COSTA L, MAJOR P P. Effect of bisphosphonates on pain and quality of life in patients with bone metastases[J]. Nat Clin Pract Oncol, 2009,6(3):163-174.
[ 4 ] XIA T S, WANG J, YIN H, et al. Human tissue-specific microenvironment: an essential requirement for mouse models of breast cancer[J].Oncol Rep, 2010,24(1):203-211.
[ 5 ] PARUTHIYIL S, CVORO A, TAGLIAFERRI M, et al. Estrogen receptor β causes a G2 cell cycle arrest by inhibiting CDK1 activity through the regulation of cyclin B1, GADD45A, and BTG2[J]. Breast Cancer Res Treat, 2011,129(3):777-784.
[ 6 ] XIA T S, WANG G Z, DING Q, et al. Bone metastasis in a novel breast cancer mouse model containing human breast and human bone[J]. Breast Cancer Res Treat, 2012,132(2):471-486.
[ 7 ] ALLOTT E H, LYSAGHT J, CATHCART M C, et al. MMP9 expression in oesophageal adenocarcinoma is upregulated with visceral obesity and is associated with poor tumour differentiation[J].Mol Carcinog, 2013,52(2):144-154.
[ 8 ] REN F, TANG R, ZHANG X, et al. Overexpression of MMP family members functions as prognostic biomarker for breast cancer patients: a systematic review and Meta-analysis[J]. PLoS One, 2015,10(8):e0135544.
[ 9 ] SRIVASTAVA P, LONE T A, KAPOOR R, et al. Association of promoter polymorphisms in MMP2 and TIMP2 with prostate cancer susceptibility in North India[J]. Arch Med Res, 2012,43(2):117-124.
[10] GAO P, XING A Y, ZHOU G Y, et al. The molecular mechanism of microRNA-145 to suppress invasion-metastasis cascade in gastric cancer[J]. Oncogene, 2013,32(4):491-501.
[11] LOU L, YE W, CHEN Y, et al. Ardipusilloside inhibits survival, invasion and metastasis of human hepatocellular carcinoma cells[J]. Phytomedicine, 2012,19(7):603-608.
[12] CHEN J, LIU X, ZHANG J, et al. Targeting HMGB1 inhibits ovarian cancer growth and metastasis by lentivirus-mediated RNA interference[J]. J Cell Physiol, 2012,227(11):3629-3638.
[13] LAWICKI S, ZAJKOWSKA M, GLAZEWSKA E K, et al. Plasma levels and diagnostic utility of VEGF, MMP-2 and TIMP-2 in the diagnostics of breast cancer patients[J]. Biomarkers, 2017,22(2):157-164.
[14] LE QUESNE J, CALDAS C. Micro-RNAs and breast cancer[J]. Mol Oncol, 2010,4(3):230-241.
[15] YU Z, BASERGA R, CHEN L, et al. microRNA, cell cycle, and human breast cancer[J]. Am J Pathol, 2010,176(3):1058-1064.
[16] CAMPOS-PARRA A D, MITZNAHUATL G C, PEDROZA-TORRES A, et al. Micro-RNAs as potential predictors of response to breast cancer systemic therapy: future clinical implications[J]. Int J Mol Sci, 2017,18(6). pii: E1182.
[17] KIM Y K, KIM V N. Processing of intronic microRNAs[J]. EMBO J, 2007,26(3):775-783.
[18] SHIMODA M, KHOKHA R.Metalloproteinases in extracellular vesicles[J].Biochim Biophys Acta, 2017, 1864(11 Pt A):1989-2000.
[19] ZARE M, BASTAMI M, SOLALI S, et al. Aberrant miRNA promoter methylation and EMT-involving miRNAs in breast cancer metastasis: Diagnosis and therapeutic implications[J]. J Cell Physiol, 2017.[Epub ahead of print]
[20] SISAY M, MENGISTU G, EDESSA D. The RANK/RANKL/OPG system in tumorigenesis and metastasis of cancer stem cell: potential targets for anticancer therapy[J]. Onco Targets Ther, 2017,10:3801-3810.
[21] MARTIN T J, SIMS N A. RANKL/OPG; Critical role in bone physiology[J]. Rev Endocr Metab Disord, 2015,16(2):131-139.
InactivationofmiR-106binducesbreastcancermetastasistoboneassociatedwithoverexpressionofmatrixmetalloproteinase2
NI Xiao-jian, ZHANG Hong-wei, ZHU Wei*
Department of General Surgery, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective: To investigate the function and mechanism of matrix metalloproteinase 2 (MMP2) and micro-RNA-106b (miR-106b) in the breast cancer bone metastasis.MethodsThe expressions of MMP2 and miR-106b were measured by immunohistochemistry, RT-PCR, and Western blotting in breast cancer bone metastasis tissue samples, and the relationship between MMP2 and clinical features of breast cancer bone metastasis patients was analyzed. The influence of MMP2 and miR-106b on migration and invasion of breast cancer cellsinvitrowas analyzed. The targeting relationship between miR-106b and MMP2 was confirmed by luciferase target assay. Western blotting was used to verify the regulated downstream signaling pathways.ResultsThe expression of MMP2 was higher in invasive cells, such as SUM1315-bo, but lower in less invasive breast cancer cells, such as MCF-7. However, the expression of miR-106b was opposite. Compared with breast cancer patients without bone metastasis, the expression of MMP2 protein in breast cancer patients with bone metastasis was higher, while the expression of miR-106b was the opposite. MMP2 promoted the migration and invasion of breast cancer cells, while miR-106b did the opposite (P<0.05). MiR-106b downregulated the expression of MMP2, and then affected the expression of downstream regulatory factor p-ERK/ERK. After downregulation of MMP2 gene in SUM1315-bo, the cultured human bone marrow-derived mesenchymal stem cell (HMSC) differentiated into osteoblasts, in which process receptor activator for nuclear factor-κ B ligand (RANKL) / osteoprotegerin (OPG) axis lost balance-the content of OPG increased and the content of RANKL decreased, resulting in reduced osteoclast differentiation (P<0.05).ConclusionsOverexpression of MMP2 may be one of the risk factors for bone metastasis in breast cancer, which may be related to the inactivation of miR-106b. MMP2 may promote the osteolytic bone metastasis of breast cancer by regulating the ERK signaling pathway. MiR-106b-MMP2-ERK signaling pathway has the potential to be a predictive factor and a therapeutic target for bone metastasis in breast cancer.
matrix metalloproteinase 2; miR-106b; bone metastasis; breast cancer
2017-06-21接受日期2017-08-07
国家自然科学基金(81702586, 81502267),复旦大学附属中山医院青年基金(2016ZSQN59). Supported by National Natural Science Foundation of China (81702586, 81502267) and Youth Foundation of Zhongshan Hospital, Fudan University (2016ZSQN59).
倪小健, 博士,住院医师. E-mail:ni.xiaojian@zs-hospital.sh.cn
*通信作者(Corresponding author). Tel: 021-64041990-3207, E-mail:drzhu@163.com
10.12025/j.issn.1008-6358.2017.20170529
R 737.9
A
[本文编辑] 姬静芳
