活性炭负载磷钨酸催化剂的制备及其催化氧化脱硫性能
2017-11-09侯影飞李力军蒋驰郭宁牛青山
侯影飞,李力军,蒋驰,郭宁,2,牛青山
(1中国石油大学(华东)化学工程学院,重质油国家重点实验室,山东 青岛 266580;2中国海洋大学化学化工学院,山东,青岛 266100)
活性炭负载磷钨酸催化剂的制备及其催化氧化脱硫性能
侯影飞1,李力军1,蒋驰1,郭宁1,2,牛青山1
(1中国石油大学(华东)化学工程学院,重质油国家重点实验室,山东 青岛 266580;2中国海洋大学化学化工学院,山东,青岛 266100)
以活性炭(AC)为载体,磷钨酸(HPW)为活性组分,通过等体积浸渍法制备HPW/AC催化剂,并以二苯并噻吩(DBT)的正十二烷溶液为模拟油(硫含量为800μg/g),H2O2为氧化剂,探究催化剂的催化氧化脱硫性能。采用BET、SEM和XRD表征手段对催化剂的结构进行分析。考察了反应温度、反应时间、H2O2用量、催化剂用量、乳化剂用量以及模拟油的组成对催化剂催化氧化脱硫效果的影响,最后考察了催化剂的循环使用性能。结果表明,AC经质量分数45%硝酸溶液80℃下活化2h,活性组分HPW的负载质量分数为30%时,所制备的HPW/AC催化剂的氧化脱硫性能最好;最佳反应条件为反应温度80℃,反应时间80min,氧化剂/硫摩尔比n(H2O2)/n(S)=12,催化剂用量0.05g/mL,乳化剂用量0.004g/mL。该反应条件下DBT被氧化为二苯并噻吩砜(DBTO2),用N-甲基吡咯烷酮(NMP)进行萃取,萃取比为1,模拟油的氧化脱硫率达到90.4%。芳香族化合物和烯烃对氧化脱硫效果起到抑制作用,烯烃的影响最为显著,并且催化剂具有良好的稳定性。
模拟油;HPW/AC催化剂;氧化脱硫;过氧化氢
油品中有机硫化物在燃烧过程中会产生SOx,对环境造成严重污染,加之世界各国对环境的保护日益重视和环保法规日益严格,生产超低硫油品势在必行[1-3]。目前,油品精制过程中成熟的脱硫技术是加氢脱硫(HDS),该技术通常在高温(300~400℃)、高压(3~6MPa)条件下进行,将有机硫化物转化为H2S[4]。但是,对稠环噻吩类含硫化合物脱除效率不高,环境污染严重,设备投资和操作费用居高不下,因此,亟需开发可替代的节能环保型深度脱硫技术[5]。
氧化脱硫技术(ODS)在温和的非临氢条件下(<100℃,常压)进行,将有机硫化物氧化为极性较强的物质,通过萃取或吸附方法进行分离,工艺流程简单,运行成本低,脱硫率较高,可以脱除油品中80%以上的噻吩类含硫化合物,表现出良好的工业应用前景[6]。杂多酸(HPA)是一种经济的环境友好型催化剂,具有良好的催化酸性和氧化还原性质,被提倡作为氧化脱硫催化剂[7-9]。其中,磷钨酸(HPW)是一种良好的杂多酸催化剂,模拟油中二苯噻吩(DBT)的转化率可以达到98%~99%[10]。但是杂多酸比表面积较低(<10m2/g),表面活性位较少,催化效率低,使其应用受到限制,将杂多酸负载于多孔固体材料制备新型催化剂是一种潜在的解决方案。活性炭(AC)是一种廉价的多孔材料,表面含有大量的含氧官能团[11-12],将其作为杂多酸的载体表现出良好的稳定性和再生性[13-14]。H2O2具有很强的氧化性,分解产物为H2O,是一种绿色友好型氧化剂。为解决磷钨酸比表面积小而造成的催化效率低下的问题,作者将磷钨酸负载于活性炭,利用等体积浸渍法制备HPW/AC催化剂,以H2O2为氧化剂研究模拟油的氧化脱硫过程。此外,还探讨了油品典型组分对HPW/AC催化氧化脱硫效果的影响。
1 实验部分
1.1 试剂
二苯并噻吩、活性炭,分析纯,阿拉丁试剂有限公司;磷钨酸(HPW)、质量分数为30%的双氧水、二甲苯、萘、1,6-二甲基环己烯、正十二烷、N-甲基吡咯烷酮(NMP)、硝酸,分析纯,国药集团化学试剂有限公司;十六烷基三甲基溴化铵(CTAB),分析纯,北京百灵威科技有限公司。
1.2 模拟油的配制
将一定量的DBT与正十二烷中混合均匀后制得模拟油,硫含量为800μg/g。此外,二甲苯、萘和1,6-二甲基环己烯分别与正十二烷混合,然后将一定量的DBT与上述各组分含量不同的正十二烷充分混合,硫含量保持800μg/g。
1.3 催化剂的制备
采用等体积浸渍法制备磷钨酸/活性炭催化剂(HPW/AC)。将活性炭研磨选取20~40目(442~920μm)的颗粒,用质量分数为45%的硝酸溶液在85℃下处理2h,冲洗至中性,120℃下干燥5h,备用。称取一定量的HPW溶于超纯水,50℃下超声分散2h直至完全溶解。称取10g上述活性炭,倒入HPW溶液中,磁力搅拌下常温浸渍24h。浸渍后的活性炭在110℃下干燥12h,制得HPW/AC催化剂,装入自封袋备用。
1.4 催化剂的表征
采用美国Micromeritics公司ASAP2020M型比表面积及微孔物理吸附分析仪测定催化剂样品的N2吸附-脱附等温线,根据BET方程和BJH方程计算催化剂比表面积、平均孔径及孔径分布。采用液氮吸附,吸附温度-196℃/77K,样品测试前200℃预脱气6h。
采用荷兰帕纳科公司X’Pert PRO MPD型X射线衍射仪对催化剂进行XRD分析,Cu靶,Kα射线,X’Celerator超能探测器,管电压40kV,管电流40mA,广角和小角分析扫描步长均为0.02°,扫描速率分别为0.3s/step和2s/step,2θ范围为5°~75°。
采用日本日立公司S-4800型冷场发射扫描电子显微镜观察催化剂的表面形态和载体上活性组分分布情况。
1.5 催化剂氧化脱硫性能评价
氧化脱硫实验采用间歇式反应装置进行评价。量取20mL模拟油加入到50mL的三颈反应烧瓶中,在恒温水浴中预热到实验温度后,立即加入一定量的催化剂、H2O2和CTAB,同时连接冷凝回流装置,在磁力搅拌下反应一定时间。反应结束后,立即冷却至室温,离心分离,回收催化剂。氧化脱硫后的反应液转移至60mL分液漏斗中,以NMP为萃取剂进行萃取分离,萃取比为1,震荡均匀,静置15min后,分液。氧化脱硫后的萃余液用荧光硫测定仪测定硫含量。氧化-萃取脱硫率按式(1)计算。

式中,w0、wx分别为氧化-萃取脱硫前后模拟油中硫化物的浓度,μg/g。
2 结果与讨论
2.1 HPW/AC催化剂的表征结果
2.1.1 BET表征结果
本研究用45%硝酸溶液对活性炭载体进行改性处理,对处理前后的活性炭及不同HPW负载量的3种HPW/AC催化剂进行BET结构表征,结果列于表1。从表1可见,经硝酸溶液在85℃下处理2h后,活性炭及HPW/AC催化剂的比表面积均有所减小,而总孔容和孔径呈现增大的趋势。硝酸具有强烈的腐蚀作用,使活性炭内部一些封闭的孔道被打开,部分微孔变成中孔,部分中孔进一步增大变成介孔,最终造成总孔容和孔径的增大。活性炭比表面积的减小,可能是因为硝酸的腐蚀作用主要发生在微孔向中孔演变的过程,而中孔演变为介孔的过程稍弱,总孔容增大的过程中比表面积反而下降。随着HPW负载量的逐渐增加,其比表面积下降,总孔容和孔径大小都有所减小。当HPW负载量为10%时,比表面积仅下降3%左右,HPW主要在活性炭孔道内进行吸附;当负载量达到30%时,比表面积下降约20%,此时HPW同时在活性炭的孔道内和表面同时进行吸附,也造成总孔容和孔径的小幅下降。

表1 不同制备条件下HPW/AC催化剂的比表面积和孔结构

图1 不同制备条件下HPW/AC催化剂的XRD谱
2.1.2 XRD表征结果
图1为HPW/AC催化剂的XRD谱图。
不同制备条件下HPW/AC催化剂的XRD谱示于图1。从图1可以看出,HPW的负载量从0增加到10%的HPW/AC催化剂,没有出现明显的磷钨酸衍射峰,当HPW负载量增加到30%后,开始出现磷钨酸特征峰,出峰强度适中。活性炭具有非常大的比表面积(表1),经过硝酸活化后产生大量中孔结构,可以容纳直径约为1.2nm的磷钨酸,当磷钨酸负载量较小时,磷钨酸分子与活性炭表面含氧官能团结合,均匀分散于活性炭的孔结构和表面,失去部分晶相结构,因此出峰不明显;随着负载量的增加,磷钨酸分子在催化剂表面由单层分散转向聚集态,2θ角在7°~10°、16°~22°和25°~30°开始出现三簇特征峰,说明催化剂表面开始出现keggin结构,呈现较为均匀的单分散状态,具有良好的催化氧化性能。
2.1.3 SEM表征结果
不同制备条件下HPW/AC催化剂的SEM照片示于图2。从图2可以看出,经过硝酸活化后制备的催化剂,因硝酸的刻蚀作用出现一系列的孔洞,其总孔容和平均孔径均提高,与表1结果吻合,有利于磷钨酸的负载。当磷钨酸负载量不同时,催化剂表面表现出不同的形貌。负载量为30%时,小于其单层负载量37.5%,磷钨酸在活性炭表面分散均匀,无堆积效应产生,说明该负载量的HPW/AC催化剂的表面形态趋于完善。
2.2 催化剂制备条件对HPW/AC催化剂脱硫效果的影响

图2 不同制备条件下HPW/AC催化剂的SEM照片
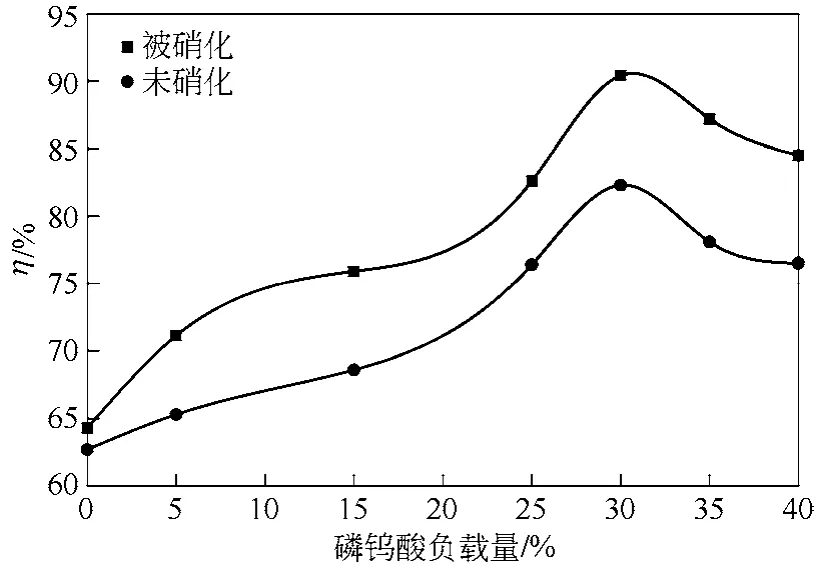
图3 催化剂制备条件对30% HPW/AC催化剂催化模拟油氧化脱硫率(η)的影响
当反应温度为80℃,反应时间为80min,n(H2O2)/n(S)=12,催化剂用量为0.05g/mL,乳化剂CTAB用量为0.004g/mL时,考察HPW/AC催化剂的制备条件对其催化脱硫效果的影响,结果示于图3。
从图3可以看出,随着HPW负载量的增加,模拟油的氧化脱硫率先增加后减小,负载量为30%时达到最高,为90.4%。这是由于氧化反应为酸催化过程[15],在酸性条件下H2O2可以产生羟基自由基(·OH),具有较强的氧化能力,将DBT氧化成相应的砜类。和纯HPW相比,活性炭载体将HPW高度分散于其表面上,为反应物提供更多HPW酸性中心,随着HPW负载量的提高其酸量增加,催化剂的活性随之提高,因此氧化脱硫率也增加。但是当负载量超过30%后,HPW在活性炭的孔道和表面由单层分散转向多层分散,发生团聚,比表面积也随之减小,酸量虽继续增加,但起到催化作用的酸性中心降低,氧化脱硫率下降,当负载量达到40%时,氧化脱硫率为84.5%,仍显著大于纯HPW的氧化脱硫率64.3%。
经硝酸改性处理后的活性炭所制备的催化剂,氧化脱硫率大于原活性炭所制备的催化剂。经硝酸改性后,活性炭表面引入的官能团大部分为羧基,相同负载量催化剂的酸性中心有所提高,产生协同催化效应,同时活性炭的中孔数增加,使HPW负载更加均匀,提供更多的有效酸性中心,因此氧化脱硫率大大增加。
2.3 反应条件对HPW/AC催化剂脱硫效果的影响
氧化-萃取脱硫过程共分为两步完成。第一步,模拟油中的苯并噻吩被氧化为强极性的砜和亚砜类;第二步,生成的砜和亚砜类用NMP从模拟油中萃取而脱除。本实验在不同反应条件下,探究反应温度、反应时间、H2O2用量、催化剂用量和乳化剂用量对30% HPW/AC催化剂脱硫效果的影响。
2.3.1 反应温度和反应时间
当n(H2O2)/n(S)=12,催化剂用量为0.05g/mL,乳化剂CTAB用量为0.004g/mL时,考察30℃、40℃、60℃和80℃及反应时间对HPW/AC催化脱硫效果的影响,结果示于图4。

图4 不同温度下反应时间对30% HPW/AC催化模拟油氧化脱硫率(η)的影响
从图4可以看出,随着反应时间的增加,氧化脱硫率先急剧升高,然后趋于平缓。反应温度为80℃时,反应进行前10min内,氧化脱硫率超过60%,增加较快;随后,氧化脱硫速率随反应时间的增加逐步减缓,反应进行100min时,达到91.7%。纯HPW的比表面积较小(<10m2/g),而HPW/AC催化剂拥有大比表面积(表1),HPW通过活性炭表面含氧官能团之间的作用力,将HPW吸附在其表面,高度分散[16],提供大量的磷钨酸酸性中心,生成的H+促进H2O2分解产生羟基自由基(·OH),使HPW/AC表现出较高的催化活性和反应速率。HPW的Keggin结构分解产生的杂多阴离子([P(W3O10)4]3–)[17-18]促进硫化物的吸附作用,最终将其氧化为砜类,也起到显著的作用。综合考虑,80min为最佳反应时间。
从图4可以看出,反应温度为30℃,反应进行10min时,氧化脱硫率达到28.7%,反应100min,氧化脱硫率增加到48.1%,仅提高19.4%;随着温度的升高,氧化脱硫率急剧增加,到达80℃时达到最大值,反应温度为40℃、60℃和80℃时,反应100min,氧化脱硫率分别为82.1%、88.5%和91.7%,之后开始降低,90℃时脱硫率降低到87.5%。随着反应温度的升高,反应速率常数变大,同时H2O2分解加快,产生大量的羟基自由基(·OH),相界面间的传质阻力变小,DBT更容易扩散到催化剂表面与·OH进行接触,提高了氧化脱硫率;随着温度的继续升高,H2O2分解加快,HPW/AC表面的羟基自由基(·OH)数下降,抑制氧化脱硫反应进行,同时氧化脱硫反应为放热反应,高温不利于反应进行,80℃为最佳反应温度。
2.3.2 H2O2用量
当反应温度为80℃、反应时间为80min、催化剂用量为0.05g/mL、乳化剂CTAB用量为0.004g/mL时,考察氧化剂(H2O2)用量对HPW/AC催化脱硫效果的影响,结果示于图5。
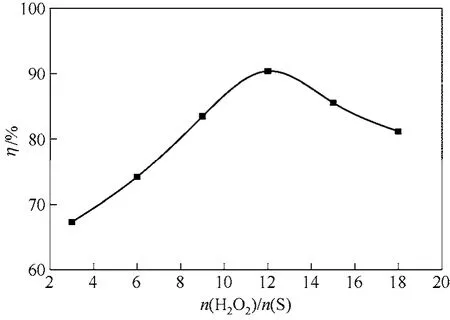
图5 氧化剂用量n(H2O2)/n(S)对30% HPW/AC催化模拟油氧化脱硫率(η)的影响
从图5可以看出,氧化剂H2O2的用量对模拟油氧化脱硫率的影响十分显著。随着H2O2用量的增加,氧化脱硫率也随之增加,当n(H2O2)/n(S)=12时,达到最大值90.4%,之后再增加H2O2的用量,氧化脱硫率开始下降。DBT被氧化为二苯并噻吩砜(DBTO2)所需的H2O2理论值为n(H2O2)/n(S)=2,但H2O2极易发生副反应而分解。体系中可能存在两个相互竞争反应:DBT的氧化反应和H2O2的自动分解反应[19],增加H2O2用量有利于氧化反应的顺利进行;当H2O2过量时,H2O2会占据大量的酸性活性位,不利于DBT的吸附作用,抑制氧化反应的进行,导致催化剂活性下降,同时,H2O2分解生成的H2O也抑制氧化反应的进行,最终导致氧化脱硫效果下降。
2.3.3 催化剂用量
当反应温度为80℃、反应时间为80min、n(H2O2)/n(S)=12、乳化剂CTAB用量为0.004g/mL时,考察催化剂用量对HPW/AC催化脱硫效果的影响,结果示于图6。

图6 催化剂用量对30% HPW/AC催化模拟油氧化脱硫率(η)的影响
从图6可以看出,催化剂的用量小于0.05g/mL时,随着催化剂用量的增加,氧化脱硫率显著增加,催化剂用量为0.05g/mL时,氧化脱硫率达到90.4%,继续增加催化剂的用量,氧化脱硫率增加值很小且趋于稳定,催化剂的用量为0.07g/mL,氧化脱硫率为91.1%。HPW/AC含有大量的酸性中心,H2O2与酸性中心作用分解产生强氧化性的羟基自由基(·OH),将DBT氧化成DBTO2,随着催化剂用量的增加,为H2O2提供的活性中心增多,显著地提高催化氧化脱硫效果;当催化剂的用量与H2O2的量达到平衡后,继续增加催化剂的用量不能继续产生更多的羟基自由基(·OH),氧化脱硫效率只维持在一个较高的水平,但变化不大。因此,考虑到成本和脱硫率的影响,选择0.05g/mL为最佳的催化剂用量。
2.3.4 乳化剂用量
当反应温度为80℃、反应时间为80min、n(H2O2)/n(S)=12、催化剂用量为0.05g/mL时,考察乳化剂(CTAB)用量对HPW/AC催化脱硫效果的影响,结果示于表2。

表2 乳化剂用量对30% HPW/AC催化模拟油氧化脱硫率(η)的影响
从表2可以看出,使用乳化剂可显著提高模拟油的氧化脱硫率。乳化剂可以使模拟油和双氧水形成“油包水”型乳状液,增加油相和水相的接触面积,减小传质阻力,使氧化脱硫反应顺利进行。未加乳化剂时,氧化脱硫率仅为70.1%,随着CTAB用量的增加,氧化脱硫率不断增加,当CTAB用量达到0.004g/mL时,氧化脱硫率最高达到90.4%,此时已经形成稳定的“油包水”型乳状液,继续增加CTAB的用量,“油包水”型乳状液的稳定性遭到破坏,油相和水相不能顺利接触进行传质,造成脱硫率呈现下降趋势,因此适宜的乳化剂用量为0.004g/mL。
2.4 模拟油组分对HPW/AC催化剂脱硫效果的影响
油品中除了烷烃类化合物,还含有芳香族和烯烃类化合物,这些不饱和烃类(包括芳香烃、萘、烯烃等)对氧化脱硫反应产生不利影响[20-21],本文作者进一步探究了不饱和烃类对氧化脱硫反应的影响。一种典型柴油的组成列于表3,根据柴油中不同组分的相对含量,在模拟油中分别引入不同含量的二甲苯、萘和1,6-二甲基环己烯,模拟不饱和烃的组成,考察其对30% HPW/AC氧化脱硫率的影响。反应条件为:反应温度80℃,反应时间80min,n(H2O2)/n(S)=12,催化剂用量0.05g/mL,乳化剂CTAB用量为0.004g/mL。

表3 一种商用柴油的组成
模拟油中二甲苯的含量对30% HPW/AC氧化脱硫率的影响结果示于图7。模拟油中二甲苯的质量分数分别为2%、5%和10%,反应进行80min时,氧化脱硫率有不同程度的下降,从90.4%分别下降到81.6%、72.3%和55.2%,下降幅度分别为9.7%、20%和38.9%。模拟油中萘的含量对30% HPW/AC氧化脱硫率的影响结果示于图8。模拟油中萘的质量分数分别为2%、5%和8%,反应进行80min时,氧化脱硫率有不同程度的下降,从90.4%分别下降到84.6%、75.4%和60.2%,下降幅度分别为6.4%、16.6%和33.4%。模拟油中1,6-二甲基环己烯的含量对30% HPW/AC氧化脱硫率的影响结果示于图9。模拟油中萘的含量分别为2%、5%和15%,反应进行80min时,氧化脱硫率有不同程度的下降,从90.4%分别下降到57.3%、40.9%和7.1%,下降幅度分别为36.6%、54.8%和92.1%。结果表明模拟油中二甲苯、萘和1,6-二甲基环己烯均对DBT的氧化产生不利的影响,抑制氧化脱硫反应的进行。模拟油中的芳烃类和烯烃类化合物相比于DBT的质量分数(一般为20%~30%)较高,与痕量的DBT相比,更容易在HPW/AC催化剂表面吸附而占据活性中心发生氧化反应,导致DBT不能顺利在HPW/AC表面进行氧化脱硫反应。烯烃有两对共用电子,分别形成σ键和π键,π键形成的富电子区极容易受到亲电试剂(H2O2)的进攻,形成共价键;烷基芳香族化合物含有大π键,形成稳定的体系,不易受亲电试剂的攻击,但体系内存在α-H,使侧链甲基官能团(—CH3)易被氧化成苯甲酸和酚类。

图7 模拟油中二甲苯的含量对30% HPW/AC氧化脱硫率

图8 模拟油中萘的含量对30% HPW/AC氧化脱硫率(η)的影响

图9 模拟油中1,6-二甲基环己烯的含量对30% HPW/AC氧化脱硫率(η)的影响
从图7~图9可以看出,反应进行80min时,不同组分含量为2%的模拟油氧化脱硫率,二甲苯、萘和1,6-二甲基环己烯对应的氧化脱硫下降幅度分别为9.7%、6.4%和36.6%,当组分含量增加到5%时,3类化合物对应的氧化脱硫下降幅度分别增加20%、16.6%和54.8%,1,6-二甲基环己烯对氧化脱硫过程产生的不利影响明显大于二甲苯和萘,3类化合物的存在对模拟油氧化脱硫效果的影响顺序为:萘<二甲苯<1,6-二甲基环己烯。在氧化脱硫过程烯烃类化合物对HPW/AC表面的活性中心的竞争吸附作用要大于芳香族化合物。
2.5 HPW/AC催化剂的循环使用性能
在最佳工艺条件下进行氧化脱硫实验,将催化剂回收后经水洗、110℃下干燥2h后继续进行氧化脱硫实验,结果示于图10。从图10可以看出,催化剂循环使用过程中,氧化脱硫率有所降低,重复使用5次之后,逐渐趋于稳定;催化剂重复使用8次,脱硫率仍达到80.2%,具有较强的催化活性,因此,HPW/AC催化剂的循环使用性能较高。肖静等[22]探究了活性炭负载杂多酸催化氧化噻吩的实验,90℃反应2h脱硫率达到90%;CHOI等[23-24]研究了磷钨酸、磷钼酸和硅钨酸催化氧化苯并噻吩(BT)氧化脱硫过程,超声条件下于70℃反应30min,BT的脱硫率分别达到89%、51%和12%,DBT的脱硫率达到91%、83%和24%。对比发现,本研究中的HPW/AC催化剂催化氧化DBT的脱硫率达到较高水平,同时表现良好的循环使用性能。
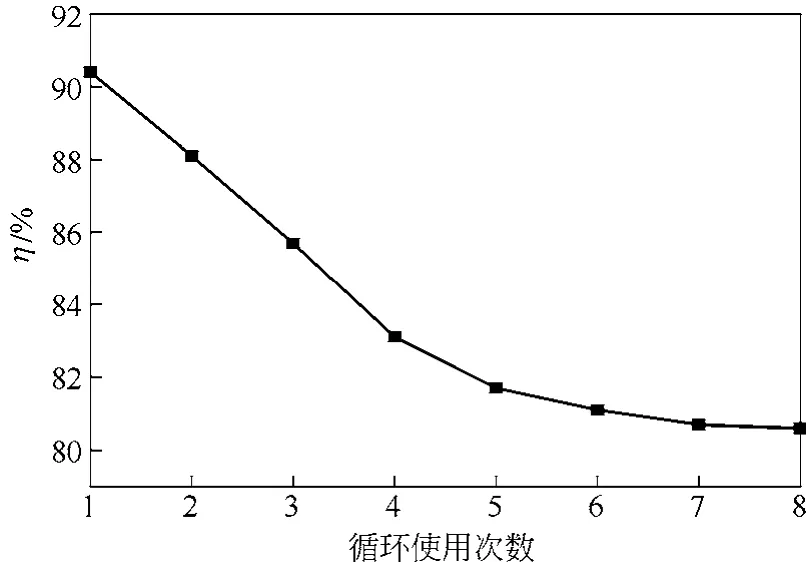
图10 HPW/AC催化剂在氧化脱硫实验中的循环使用性能
3 结论
(1)用等体积浸渍法制备HPW/AC催化剂,用正十二烷的DBT溶液(800μg/g)作为模拟油,以H2O2为氧化剂进行氧化脱硫实验,催化剂脱硫率最高可达90.4%。
(2)活性炭载体经质量分数为45%的硝酸溶液85℃下活化2h,HPW负载质量分数为30%制备的催化剂,活性组分在催化剂表面分散较好,氧化脱硫效果最好。
(3)HPW/AC催化剂对模拟油氧化-萃取脱硫的最佳操作条件为:反应温度80℃,反应时间80min,氧化剂H2O2用量n(H2O2)/n(S)=12,催化剂用量0.05g/mL,乳化剂CTAB用量0.004g/mL,NMP的萃取比为1∶1。
(4)模拟油中芳香烃和烯烃组分与BDT在HPW/AC表面存在竞争作用,对模拟油中DBT的氧化过程起到强烈的抑制作用,烯烃类的抑制作用更为明显。
(5)HPW/AC催化剂的循环使用性能良好,重复使用8次,脱硫率仍达到80.2%。
[1] LV Y X,YU X H,TU S T,et al. Experimental studies on simultaneous removal of CO2and SO2in a polypropylene hollow fiber membrane contactor[J]. Applied Energy,2012,97:283-288.
[2] SUNDARARAMAN R,SONG C S. Catalytic oxidative desulfurization of diesel fuels using air in a two-step approach[J].Industrial & Engineering Chemistry Research,2014,53(5):1890-1899.
[3] MA X L,ZHOU A N,SONG C S. A novel method for oxidative desulfurization of liquid hydrocarbon fuels based on catalytic oxidation using molecular oxygen coupled with selective adsorption[J]. Catalysis Today,2007,123(1-4):276-284.
[4] SONG C S. An overview of new approaches to deep desulfurization for ultra-clean gasoline,diesel fuel and jet fuel[J]. Catalysis Today,2003,86(1-4):211-263.
[5] XIAO J,SONG C S,MA X L,et al. Effects of aromatics,diesel additives,nitrogen compounds,and moisture on adsorptive desulfurization of diesel fuel over activated carbon[J]. Industrial &Engineering Chemistry Research,2012,51(8):3436-3443.
[6] 郭宁,杨冲,刘振学,等. 活性炭负载S2O82–/ZrO2催化剂的制备及其催化氧化脱硫性能[J]. 石油学报(石油加工),2015(6):1416-1424.GUO N,YANG C,LIU X Z,et al. Preparation and performance of activated carbon loaded S2O82-/ZrO2catalyst for catalytic oxidative desulfurization[J]. Acta Petrolei Sinica(Petroleum Processing Section),2015(6):1416-1424.
[7] YANG Y,ABU-OMAR M M,HU C W. Heteropolyacid catalyzed conversion of fructose,sucrose,and inulin to 5-ethoxymethylfurfural,a liquid biofuel candidate[J]. Applied Energy,2012,99:80-84.
[8] YAMAGUCHI S,SUMIMOTO S,ICHIHASHI Y,et al.Liquid-phase oxidation of benzene to phenol over V-substituted heteropolyacid catalysts[J]. Industrial & Engineering Chemistry Research,2005,44(1):1-7.
[9] TALEBIAN-KIAKALAIEH A,AMIN N A S,ZAREI A,et al.Transesterification of waste cooking oil by heteropoly acid (HPA)catalyst:optimization and kinetic model[J]. Applied Energy,2013,102:283-292.
[10] LI B,MA W,LIU J,et al. Synthesis of the well-ordered hexagonal mesoporous silicate incorporated with phosphotungstic acid through a novel method and its catalytic performance on the oxidative desulfurization reaction[J]. Catalysis Communications,2011,13(1):101-105.
[11] ZHOU A N,MA X L,SONG C S. Effects of oxidative modification of carbon surface on the adsorption of sulfur compounds in diesel fuel[J]. Applied Catalysis B:Environmental,2009,87(3/4):190-199.
[12] ZHOU A N,MA X L,SONG C. Liquid-phase adsorption of multi-ring thiophenic sulfur compounds on carbon materials with different surface properties[J]. The Journal of Physical Chemistry B,2006,110(1):4699-4707.
[13] KOZHEVNIKOV I V. Catalysis by heteropoly acids and multicomponent polyoxometalates in liquid-phase reactions[J].Chemical Reviews,1998,98(1):171-198.
[14] ABDALLA Z E A,LI B. Preparation of MCM-41 supported(Bu4N)4H3(PW11O39) catalyst and its performance in oxidative desulfurization[J]. Chemical Engineering Journal,2012,200-202:113-121.
[15] 黎先财,杨春燕,黄绍祥,等. 负载型磷钨酸对柴油催化氧化脱硫[J]. 南昌大学学报(理科版),2009(6):557-560.LI X C,YANG C Y,HUANG S X,et al. The oxidative desulfurization of diesel oil catalyzed by supported phosphotungstic acid[J]. Jounal of Nanchang University(Natural Science),2009(6):557-560.
[16] ABDALLA Z E A,LI B,TUFAIL A. Direct synthesis of mesoporous(C19H42N)4H3(PW11O39)/SiO2and its catalytic performance in oxidative desulfurization[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2009,341(1-3):86-92.
[17] TE M,FAAIRBRIDGE C,RING Z. Oxidation reactivities of dibenzothiophenes in polyoxometalate/H2O2and formic acid/H2O2systems[J]. Applied Catalysis A:General,2001,219:267-280.
[18] TORRES-GARCIA E,GALANO A,RODRIGUEZ-GATTNONO G.Oxidative desulfurization(ODS)of organosulfur compounds catalyzed by peroxo-metallate complexes of WOx-ZrO2:Thermochemical,structural,and reactivity indexes analyses[J].Journal of Catalysis,2011,282(1):201-208.
[19] HAI M,MEI B W,TEH F Y. A new method for obtaining ultra-low sulfur diesel fuelviaultrasound assisted oxidative desulfurizationq[J].Fuel,2003,82(3):405-414.
[20] TANG S W,LIANG B. Kinetics of the liquid-phase oxidation of toluene by air[J]. Industrial & Engineering Chemistry Research,2007,46(5):6442-6448.
[21] BARTEAU M A. Surface science and the advancement of direct olefin epoxidation[J]. Surface Science,2006,600(23):5021-5023.
[22] XIAO J,WU L M,WU Y,et al. Effect of gasoline composition on oxidative desulfurization using a phosphotungstic acid/activated carbon catalyst with hydrogen peroxide[J]. Applied Energy,2014,113(6):78-85.
[23] CHOI A E S,ROCES S,DUGOS N,et al. Oxidation by H2O2of bezothiophene and dibenzothiophene over different polyoxometalate catalysts in the frame of ultrasound and mixing assisted oxidative desulfurization[J]. Fuel,2016,180:127-136.
[24] CHOI A E S,ROCES S,DUGOS N,et al. Mixing-assisted oxidative desulfurization of model sulfur compounds using polyoxometalate/H2O2catalytic system[J]. Sustainable Environment Research,2016,26(4):184-190.
Preparation and performance of phosphotungstic acid/activated carbon catalyst for catalytic oxidative desulfurization
HOU Yingfei1,LI Lijun1,JIANG Chi1,GUO Ning1,2,NIU Qingshan1
(1State Key Laboratory of Heavy Oil Processing,College of Chemical Engineering,China University of Petroleum(East China),Qingdao 266580,Shandong,China;2College of Chemistry and Chemical Engineering,Ocean University of China,Qingdao 266100,Shandong,China)
The HPW/AC catalyst was prepared by the incipient wetness impregnation method with activated carbon and phosphotungstic acid(HPW)as the support and active component respectively.The model fuel was prepared by dissolving dibenzothiophene(DBT) inton-dodecane yielding a sulfur concentration of 800μg/g,for which HPW/AC was investigated with hydrogen peroxide(H2O2)as oxidant. HPW/AC was characterized by the means of BET,SEM and XRD. The effects of oxidative temperature,reaction time,the mount of H2O2,the dosage of catalyst and CTAB on the performance of HPW/AC for the oxidative desulfurization(ODS)were also investigated. The reusability of HPW/AC was explored as well. The results showed that HPW/AC with activation of 45% HNO3at HPW loading amount of 30% had the best performance in the ODS. The optimum reaction conditions were determined as oxidative temperature at 80℃,the molar ratio of oxidant to sulfur of 12,and the dosage of catalyst and CTAB of 0.05g/mL and 0.004g/mL in the model fuel,under which DBT was substantially converted to dibenzothiophene sulfone(DBTO2). After extracted byN- methyl pyrrolidone(NMP)with a volumetric ratio of 1,the model fuel could achieve a sulfur removal rate as high as 90.4%. The presence of aromatic compounds and alkenes inhibited the ODS of DBT,and the inhibiting effect caused by alkenes was more significant. The catalyst could be regenerated as well.
model fuel;phosphotungstic acid/activated carbon catalyst;oxidative desulfurization;hydrogen peroxide
TE624
A
1000–6613(2017)11–4072–08
10.16085/j.issn.1000-6613.2017-0356
2017-03-07;修改稿日期2017-06-17。
国家自然科学基金(51173203)、中央高校基本科研业务费专项资金(15CX05014A)及山东省自然科学基金(ZR2012BL15)项目。
及联系人:侯影飞(1977—),男,博士,副教授,从事石油与天然气加工、膜分离、油田化学品等研究。E-mail:houyf@upc.edu.cn。
