高中化学中“化学平衡常数”的应用分析
2017-11-09吴季洹湖南省长沙市明德中学
吴季洹 湖南省长沙市明德中学
高中化学中“化学平衡常数”的应用分析
吴季洹 湖南省长沙市明德中学
学生在学习“化学平衡常数”相关知识点的时候,只有准确把握每一个知识点的概念以及各个知识点之间的关系,才能够使学习活动更加具有针对性以及有效性。基于这样的背景之下,本文对高中化学当中的“化学平衡常数”相关的知识点进行了分析,以此提高学生学习化学的效率。
化学平衡常数 反应方向 计算
在化学学习的过程中,学生应该加强学习的积极性以及主动性,同时对“化学平衡常数”相关的知识点进行深入了解和分析。只有掌握“化学平衡常数”相关的知识点,才能为水的离子积、弱电解质的电离常数等相关知识点的学习打下坚实的基础。
1 “化学平衡常数”可以对化学反应的方向进行判断
通常情况下,“化学平衡常数”可以对化学反应的程度以及反应的方向进行判断。在对化学反应的程度进行判断的时候,可以根据以下标准来进行判断:第一就是如果K越大,那就说明反应的程度越大,反应物之间转化的效率也就越大。第二就是如果当的时候,该反应能够完全进行。
对于“化学平衡常数”可以对化学反应的方向进行判断,可以通过相关例题的解答以及分析来得出相应的结论。
例题1:在一个特定温度以及特定容器的环境当中,当反应方程式达到了平衡的时候,经过测算,A、B、C三种物质的质量为别为4mol,2mol以及4mol,如果对温度以及压强不变,对三种物质做出哪种变化能够使化学方程式的平衡右移?
A、三种物质的质量全部减半;
B、三种物质的质量全部加倍;
C、三种物质的质量全部增加1mol;
D、三种物质的质量全部减少1mol。
在对这道题进行解答的时候,大部分学生都能够运用多种比较的方法得出正确的答案。运用“化学平衡常数”相关知识点进行解答就会更加方便,比如可以设容器的容积为V,K=V,如果三种物质的质量全部减半或者是全部加倍,各种物质的浓度是不变的,所以K也就不会变,化学方程式的平衡也就不会移动。如果三种物质的质量全部增加1mol或者是全部减少1mol,当全部增加1mol的时候,那么就可以设容积为,那么>V),则K>Q那么就可以得出在这个时段反应物的浓度是大于平衡常数的,所以应该向反方向移动。当全部减少1mol的时候,得出的结果与当全部增加1mol的时候相反,所以D选项正确。
2 对平衡常数相关计算进行具体的分析
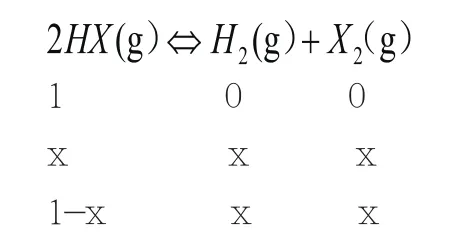
根据上面例题的分析可以得出。在反应环境以及其它条件相同的情况之下,化学反应式的平衡状态是可以达到最大限度的,在这样的情况之下,各种物质之间的浓度关系是能够与平衡常数K相一致的。根据这样的关系建立出化学反应的方程式,就能够对这些问题进行有效解决。如果当的时候,该反应能够完全进行。
3 对热效应判断进行具体的分析
如果化学反应方程式 Fe(s)+CO2(g)FeO(s)+CO(g)的平衡常数是,化学反应方程式 Fe(s)+H2O(g)FeO(s)+H2(g)的平衡常数是,当温度为973℃的时候,为 1.47,为2.28;当温度为1173℃的时候,为 2.15,为 1.67。
(1)根据上面的分析,可以得出化学反应方程式F(es)+CO(2g)FeO(s)+CO(g)是吸热反应。
(2)现在有一个化学反应方程式CO(2g)+H(2g)CO(g)+H2O(g),根据已知的条件,该反应式的平衡常数(H2O)/C(CO2)·C(H2)。
(3)根据 Fe(s)+CO2(g)FeO(s)+CO(g)以及Fe(s)+H2O(g)FeO(s)+H2(g),就可以得出之间的关系,
“化学平衡常数”知识点十分广阔,但是只要将“化学平衡常数”知识点进行有效的概括,就能够在具体的运用过程中通过判断平衡常数的方法对化学反应式反应的程度以及方向进行判断。学生在学习的过程中,应该把握“化学平衡常数”的重点以及核心,提高自己解题的技巧,以此提高化学成绩。
[1]朱艳雨.高中生“化学平衡常数”概念的心智模型研究[D].安徽师范大学,2016
