破骨细胞在骨关节炎中的增殖变化及意义*
2017-11-08朱成华孙先润李亚国李晓云李莲娥
肖 壮,唐 涛,朱成华, 孙先润,李亚国,李晓云,李莲娥
(1.云南省第一人民医院药学部,昆明 650034;2.云南省第一人民医院康复科,昆明 650034;3.云南新昆华医院药学部,昆明 650300;4.云南省第一人民医院骨科,昆明 650034;5.昆明理工大学医学院康复医学教研室,昆明 650500)
论著·基础研究doi:10.3969/j.issn.1671-8348.2017.30.002
破骨细胞在骨关节炎中的增殖变化及意义*
肖 壮1,唐 涛2,5△,朱成华3, 孙先润4,李亚国5,李晓云2,李莲娥5
(1.云南省第一人民医院药学部,昆明 650034;2.云南省第一人民医院康复科,昆明 650034;3.云南新昆华医院药学部,昆明 650300;4.云南省第一人民医院骨科,昆明 650034;5.昆明理工大学医学院康复医学教研室,昆明 650500)
目的探讨破骨细胞(OC)在骨关节炎(OA)各个时期中的增殖变化及临床意义。方法20只健康成年SD雄性大鼠用改良Hulht手术方法造模,左膝为对照组,右膝为OA模型组。分别于术后1、2、4、8 周时采集全膝关节(n=5),并置于4 ℃多聚甲醛(PFA)液固定,石蜡包埋切片,抗酒石酸酸性磷酸酶(TRAP)、甲苯胺蓝(TB)及番红-O快绿染色,观察软骨形态学改变并半定量TRAP染色阳性的OC数量,通过Mankin′s评价OA软骨破坏的进展,采用SPSS17.0统计软件进行统计分析。结果两组间OC均呈快速增高,然后下降的一过性增殖变化。对照组(左膝)在1周时OC数量为(65.20±4.12)个/mm2,2、4周时逐渐减少,分别为(47.20±4.31)个/mm2、(26.20±3.87)个/mm2,8周时几乎看不到,细胞数为(7.00±2.28)个/mm2;OA模型组(右膝)在1周时OC数量为(70.40±5.46)个/mm2,2周时增加至(86.20±5.42)个/mm2,4周时减少至(38.00±3.16)个/mm2,8周时几乎看不到,细胞数为(6.21±2.93)个/mm2。模型组OC数量在2、4周时明显高于对照组,差异有统计学意义(P<0.05)。结论大鼠膝关节OA实验的早中期OC大量增殖,OC可能参与了骨关节炎的形成。
破骨细胞;骨关节炎;关节软骨;软骨下骨;关节损伤
骨关节炎(osteoarthritis,OA)是临床常见多发疾病之一,以老年患者多见,具有较高的发病率和致残率[1];主要病理改变是软骨的进行性蜕变及破坏,风险因素包括年龄、负重改变及外伤等,但发病机制仍不清楚。基础和临床研究多集中于软骨细胞凋亡[2]与细胞因子[如白细胞介素(IL)-1、IL-18、肿瘤坏死因子(TNF)-α、基质金属蛋白酶(MMPs)家族]等方面[3],对破骨细胞(osteoclast,OC)在OA整个发病过程中的增殖变化与临床防治意义方面的关注甚少。本研究拟通过观察OC在大鼠OA模型中各时期的增殖变化,探讨OA的相关发病机制,为临床更合理地预防和治疗OA提供一定的实验理论依据。
1 材料与方法
1.1实验动物 无特殊病原体(SPF)级8周龄雄性SD大鼠20只(体质量240~260 g)用于本次实验,均由昆明理工大学动物实验室提供。
1.2主要试剂及仪器 抗酒石酸酸性磷酸酶(TRAP)试剂盒;番红-O快绿染色剂;生物组织包埋机;光学显微镜(日本O-LYMPUS公司);滑行式组织切片机(日本Funakoshi公司)。
1.3方法
1.3.1大鼠OA模型的制备 采用改良Hulht[4]手术方法制造OA动物模型:大鼠左右膝关节经剃毛、消毒后,右膝关节切断内侧副韧带(MCL)、前交叉韧带(ACL)并切除内侧半月板(MM),行抽屉实验确认,用无菌生理盐水冲洗关节腔,消毒并缝合术口;左膝关节仅切开关节腔,不伤及MCL、ACL、MM,然后用无菌生理盐水冲洗关节腔,消毒、缝合术口。自然喂养,手术当天和术后第1天给予抗菌药物预防感染。
1.3.2标本收集及检测方法 (1)分别于术后1、2、4、8周时,选5只大鼠,乙醚麻醉后置于组织摄片机下,X射线对膝关节进行组织摄片。(2)组织摄片完成后处死大鼠,取全膝关节(n=5)。去皮后快速置入4 ℃,4%多聚甲醛(PFA)中固定。左侧膝关节为对照组;右侧膝关节为模型组。经20%乙二胺四乙酸(EDTA)脱钙后,将全膝关节沿髌尖韧带正中线矢状面一分为二切开,常规系列脱脂、脱水、石蜡包埋,切片厚5 μm于4 ℃冷藏备用[5]。(3)TRAP、甲苯胺蓝(TB)及番红-O快绿染色:切片脱蜡至水,蒸馏水浸洗,TRAP染色,浸入TRAP液避光孵育1 h(按试剂盒说明书操作);TB染色,浸入TB 5 min;番红-O快绿染色,浸入番红-O液5 min后迅速浸入快绿液。蒸馏水3次浸洗多余染液; 逐级乙醇(70%、75%、80%、90%、100%)脱水,二甲苯透明,中性树脂封片备查。
1.3.3OC半定量 对软骨下骨组织中TRAP染色阳性的OC进行分析测定:200倍镜下选取不相重叠的5个代表性视野,测量单位面积阳性细胞个数(红色区域内核数量大于或等于2个且紧密堆积细胞核团计为1个OC),见图1。
1.3.4关节软骨形态学变化-Mankin′s评分标准 关节软骨Mankin′s评分标准:(1)软骨结构,光滑整齐如常为0分;表面出现不规则裂痕为1分;裂痕深达辐射层为2分;裂痕深达移行层为3分;裂痕深达钙化层为4分;软骨脱落为5分。(2)软骨细胞,数量正常为0分;数量弥漫性增多为1分;出现大量簇集样细胞团为2分;数量减少3分。(3)番红-O快绿染色,正常染色为0分;染色轻度减少为1分;染色中度减少为2分;染色重度减少为3分;染色完全消失为4分。(4)TB染色,正常染色为0分;染色轻度减少为1分;染色中度减少为2分;染色重度减少为3分;染色完全消失为4分。(5)潮线完整性,完整为0分;多重潮线为1分;软骨下骨血管入侵潮线为2分。
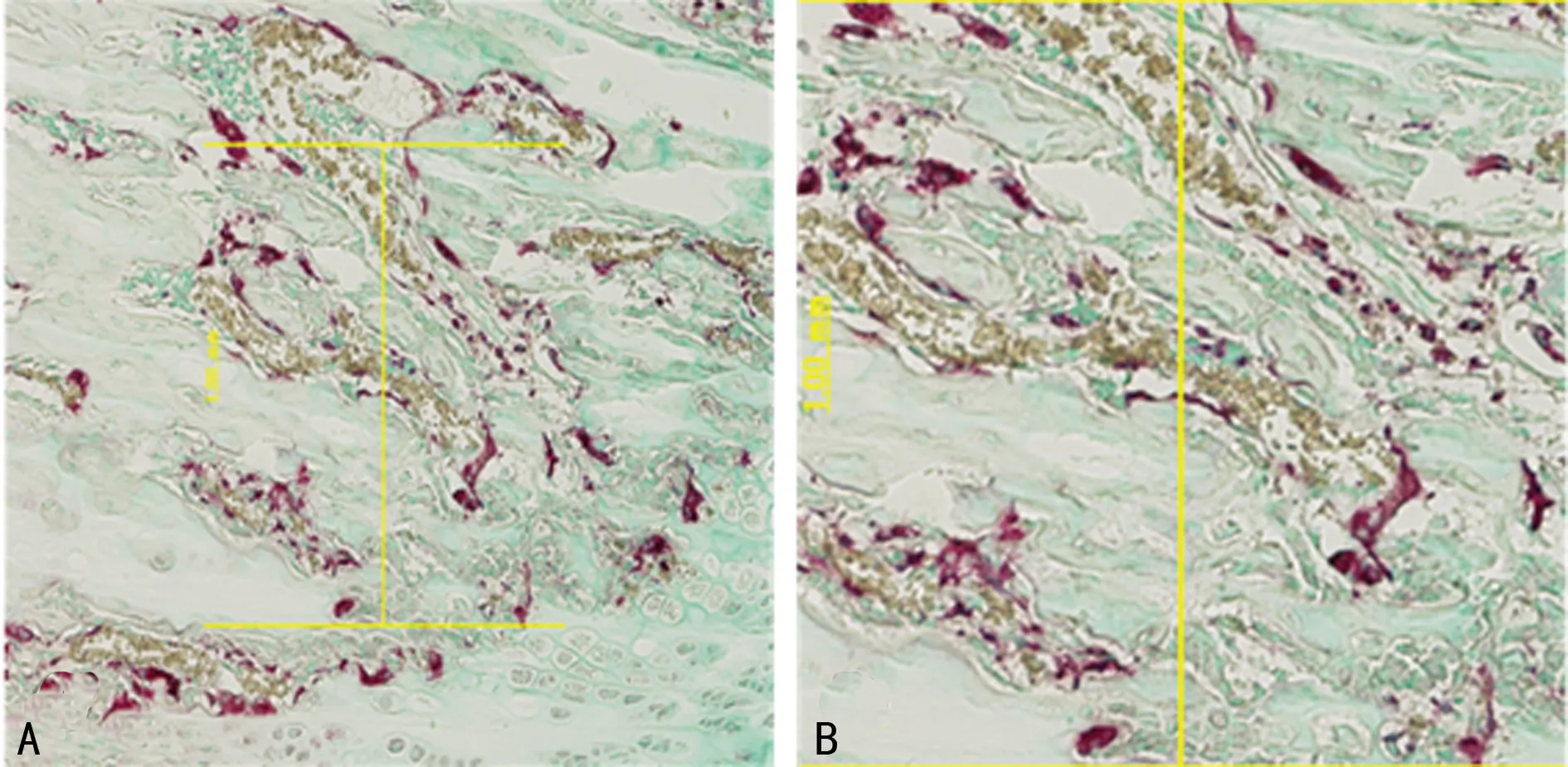
图1 OC TRAP染色(A)及阳性细胞半定量(B)示意图

2 结 果
2.1膝关节X射线摄片 通过X射线摄片观察(1、2周X射线摄片观察没发现关节有明显变化,故省略),模型组8周时呈现OA的典型表现:关节表面不平整、关节间隙狭窄、骨质质密化和囊性变,骨质增生并伴骨赘形成(图2)。
2.2TRAP染色及OC数量变化 胫骨软骨下骨TRAP染色结果显示:对照组在1周时可见大量TRAP染色阳性的OC,2周时开始逐渐减少,8周时几乎看不到;模型组在1周时可见大量OC,2周时明显增加,4周时开始减少,8周时几乎看不到。1、2、4、8周时OC数量分别为:对照组(65.20±4.12)个/mm2、(47.20±4.31)个/mm2、(26.20±3.87)个/mm2、(7.00±2.28)个/mm2;模型组(70.40±5.46)个/mm2、(86.20±5.42)个/mm2、(38.00±3.16)个/mm2、(6.21±2.93)个/mm2,模型组OC数量在2、4周时高于对照组,两组之间差异有统计学意义(P<0.05)。见图3。
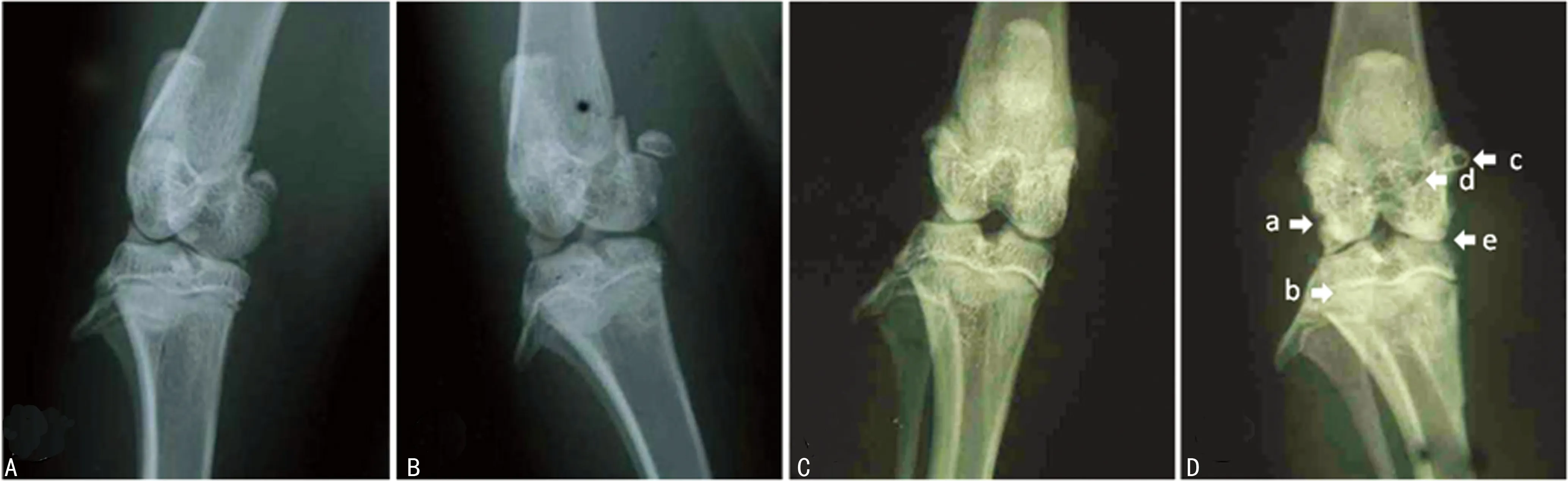
A:对照组4周;B:模型组4周;C:对照组8周;D:模型组8周;模型组8周时呈现典型的OA表现:骨面粗糙(a),骨质密度增加、硬化(b),骨质增生(c),囊腔形成(d),关节间隙变窄(e)
图2膝关节X射线摄片

A、B、C、D:对照组;E、F、G、H:模型组
图3胫骨下骨TRAP染色(×40)
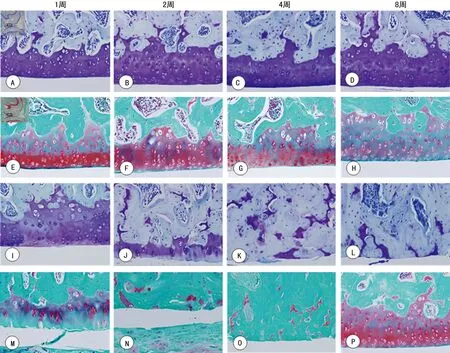
A、B、C、D:对照组TB染色;E、F、G、H:对照组番红-O快绿染色;I、J、K、L:模型组TB染色;M、N、O、P:模型组番红-O快绿染色
图4膝关节胫骨软骨面TB及番红-O快绿染色(×100)
2.3关节软骨的破坏及Mankin′s评分 胫骨关节软骨面经TB及番红-O快绿染色后,光镜观察:对照组软骨表面光整,软骨4层结构清晰可见,在1~8周的观察中变化很小,TB和番红-O快绿染色正常;模型组在第1周时与对照组相当,但在第2周时软骨细胞即大量减少,表面出现不规则裂痕,染色中重度减少。至4周时软骨几乎全部脱落,染色消失,软骨下骨血管入侵至潮线。各期Mankin′s评分为:对照组1分(1周)、2分(2周)、5分(4周)、6分(8周);模型组3分(1周)、10分(2周)、17分(4周)、17分(8周),2、4、8周时两组间差异有统计学意义(P<0.05)。见图4。
3 讨 论
笔者通过手术切断大鼠右膝关节MCL、ACL、MM建立OA疾病模型[4],与同体异肢未伤及韧带的左膝关节(对照组)进行对照,模型组关节软骨的破坏程度明显高于对照组,8周时X射线摄片呈典型的OA病理改变。实验结果表明,切断关节韧带会导致OA的形成。软骨下骨TRAP染色结果显示,对照组与模型组在术后1周时OC数量分别为(65.20±4.12)个/mm2和(70.40±5.46)个/mm2,两组间差异无统计学意义(P>0.05);第2周时对照组OC数量减少至(47.20±4.31)个/mm2,模型组则增加至(86.20±5.42)个/mm2,差异有统计学意义(P<0.05);第4周时,对照组为(26.20±3.87)个/mm2,模型组也减少至(38.00±3.16)个/mm2(P<0.05);至第8周时,对照组为(7.00±2.28)个/mm2,模型组为(6.21±2.93)个/mm2(P>0.05),两组OC数量均明显减少,镜下几乎看不到。OC在关节损伤后大量增殖,与Bertuglia等[6]的研究结果一致。不过,本实验还观察到关节损伤-康复的整个周期中OC的增殖呈早期快速增高,然后下降的一过性变化,模型组OC的增殖比对照组多,持续时间更长。
OC是一种巨大的多核细胞,起源于单核巨噬细胞/单核系造血前体细胞,具有重要的骨吸收功能,其骨吸收作用与成骨细胞的骨形成作用维持着骨代谢的动态平衡,是人体维系正常骨组织更新,维持骨骼的正常硬度与弹性的关键。OC的形成、活化及凋亡受机体众多因素的调节,为尽量规避大鼠个体间差异的影响,本实验采用同体异肢进行对照。关节经手术造成损伤后,局部炎症形成,大量的炎性因子和细胞因子聚集、形成,促进OC大量增殖、分化、成熟和活性增加[7-9]。随着损伤的逐步修复,炎症减轻,OC的增殖也逐渐降低。模型组OC的增殖更多,持续时间更长的原因,可能是切断MCL、ACL、MM后创伤更大、炎症更重,导致OC增殖、分化更多;同时,韧带切断后关节不稳定,恢复较对照组慢,大鼠活动时即以对照侧为主要支撑,模型侧处于失重状态,力学刺激减少,OC形成和活化,OC增殖进一步增加[10-11]。
OC大量形成与活化,骨吸收作用极大增强,软骨下骨基质及钙化层中有机质和无机矿物质被大量降解,骨质破坏,吸收陷窝形成,骨面坑洼不平,不能将软骨所承受的压力均匀分散与传递,软骨在外压力下直接受损、破裂,局部炎症形成,炎性因子和细胞因子等形成并聚集,软骨代谢改变,软骨内形成骨化点,次级骨化中心形成[12]。另一方面,软骨下骨连接着骨与软骨,具有传导垂直应力、抵抗剪切应力等作用[13],其结构改变将直接影响所支撑的软骨的结构和功能,导致软骨钙化增加及软骨损伤。大量OC增殖和活化,打破了软骨下骨的代谢平衡,促使软骨下骨重塑增加。软骨下骨的代谢改变及重塑与OA的发生、发展密切相关,软骨和软骨下骨相互作用,形成恶性循环,贯穿 OA病程始终[14-15]。
结合实验结果,笔者认为,OC大量增殖和活化后,骨吸收大幅增加,骨质被破坏,骨基质表面不平导致关节软骨受压而直接损伤,以及由骨吸收病理性增加导致的软骨下骨骨代谢动态平衡改变,骨重塑增加,是形成OA的又一原因。在严重关节损伤的临床治疗中,应注意对OA早期的预防处理。OC在早中期OA中的一过性高增殖,为OA防治提供了新的靶点,也为选择防治的最佳时间提供了科学、合理的实验理论依据。早期预防性使用OC抑制剂或许是防治OA的又一有效方法。
综上所述,大鼠膝关节骨关节炎实验的早中期OC大量增殖,表明OC可能参与了骨关节炎的形成。
[1]李宁华.中老年人群骨关节炎的流行病学特征[J].中国临床康复,2005,38(9):133-135.
[2]Palmieri B,Lodi D,Capone S.Osteoarthritis and degenerative joint disease:local treatment options update[J].Acta Biomed,2010,81(2):94-100.
[3]谢辉晋,杜远立.骨关节炎相关细胞因子作用机制研究进展[J].重庆医学,2011,40(4):395-398.
[4]Stoop R,Bnma P,Van der Kraan PM,et al.Type II collagen degradation in articular cartilage fibrillation after anterior cruciate ligament transection in rats[J].Osteoarthritis Carilage,2001,9(4):308-315.
[5]Tang T,Muneta T,Ju YJ,et al.Serum keratin sulfate transiently increases in the early stage of osteoarthritis during strenuous running ofrats:protective effect of intraarticular hyaluronan injection[J].Arthritis Res Ther,2008,10(1):R13.
[6]Bertuglia A,Lacourt M,Girard C,et al.Osteoclasts are recruited to the subchondral bone in naturally occurring post-traumatic equine carpalosteoarthritis and may contribute to cartilage degradation[J].Osteoarthritis Cartilage,2016,24(3):555-566.
[7]Zhao Q,Shao J,Chen W,et al.Osteoclast differentiation and gene regulation[J].Front Biosci,2007,1(12):2519-2529.
[8]谭春秋,王迪,张玉英,等.破骨细胞功能及影响因素的研究进展[J].中国优生与遗传杂志,2013,21(3):135-136.
[9]Kim JH,Jin HM,Kim K,et al.The mechanism of osteoclast differentiation induced by IL-1[J].J Immunol,2009,183(3):1862-1870.
[10]Trüssel A,Müller R,Webster D.Toward mechanical systems biology in bone[J].Ann Biomed Eng,2012,40(11):2475-2487.
[11]王晓楠,孙联文,樊瑜波.微重力对骨组织细胞功能的影响[J].中华航空航天医学杂志,2012,23(2):151-156.
[12]Burr DB,Radin EL.Microfractures and microcracks in subchondral bone:are they relevant to osteoarthrosis?[J].Rheum Dis Clin North Am,2003,29 (4):675-685.
[13]Iijima H,Aoyama T,Ito A,et al.Immature articular cartilage and subchondral bone covered by menisci are potentially susceptive to mechanical load[J].BMC Musculoskelet Disord,2014,26(15):101.
[14]Wang T,Wen CY,Yan CH,et al.Spatial and temporal changes of subchondral bone proceed to microscopic articular cartilage degeneration in guinea pigs with spontaneous osteoarthrit[J].Osteoarthritis Cartilage,2013,21(4):574-581.
[15]Lories RJ,Luyten FP.The bone-cartilage unit in osteoarthritis[J].Nat Rev Rheumatol,2011,7(1):43-49.
Proliferationchangeandsignificanceofosteoclastsinosteoarthritis*
XiaoZhuang1,TangTao2,5△,ZhuChenghua3,SunXianrun4,LiYaguo5,LiXiaoyun2,LiLiane5
(1.DepartmentofPharmacy,YunnanProvincialFirstPeople′sHospital,Kunming,Yunnan650034,China; 2.DepartmentofRehabilitation,YunnanProvincialFirstPeople′sHospital,Kunming,Yunnan650034,China; 3.DepartmentofPharmacy,NewKunhuaHospital,Kunming,Yunnan650300,China; 4.DepartmentofOrthopedics,YunnanProvincialFirstPeople′sHospital,Kunming,Yunnan650034,China; 5.TeachingandResearchingSectionofRehabilitation,MedicalCollegeofKunmingUniversityofScienceandTechnology,Kunming,Yunnan650500,China)
ObjectiveTo explore the proliferative changes and clinical significance of osteoclasts (OC) in various stages of osteoarthritis (OA).MethodsTwenty healthy adult male SD rats were made the model by modified Hulht procedure,the left knee served as the control group and the right knee as the OA model group.The total knee joint (n=5) was collected at postoperative 1,2,4,8 weeks,fixed at 4 ℃ 4% poly formaldehyde(PFA) liquid,embedded by paraffin for conducting sections,and stained by TRAP,toluidine blue(TB) and safranine O (Saf O)fast staining.Then the cartilage morphology change was observed and OC positive cells number with TRAP staining were semi-quantitatively detected,the OA cartilage destruction progression was evaluated by Mankin ′s method and SPSS17.0 statistics software was used to conduct statistical analysis.ResultsOC in the two groups showed the transient change of rapidly increasing and then decreasing.The OC number at 1 week in the control group (left knee) was (65.20±4.12) cells/mm2,and was gradually reduced at 2,4 weeks,which were (47.20±4.31) cells/mm and (26.20±3.87) cells/mm2,which at 8 weeks was almost invisible,the number of cells was (7.00±2.28) cells/mm2;the OC number at 1 week in the OA model group (right knee) was (70.40 ± 5.46) cells/mm2,increased to (86.20±5.42)cells /mm2at 2 weeks,reduced to (38.0±3.16) cells/mm2at 4 weeks,was almost invisible at 8 weeks,the number of cells was (6.21±2.93) cells /mm2.The OC number at 2,4 weeks in the model group was significantly higher than that in the control group,the difference had statistical significance (P<0.05).ConclusionLarge numbers of osteoclasts are proliferated in the early and middle stages of rat knee osteoarthritis,which indicating that OC might be involved in the formation of osteoarthritis.
osteoclast;osteoarthritis;articular cartilage;subchondral bone;joint injury
云南省应用基础研究计划项目(2013FZ182);昆明理工大学引进人才基金资助项目(KKZ3201460023)。
肖壮(1982-),主管药师,在读硕士,主要从事骨关节炎基础及药物治疗的研究。△
,E-mail:taoer2324@sina.com。
R684.3
A
1671-8348(2017)30-4181-04
2017-01-18
2017-04-06)
