通过检测血清中的病毒载量评估不同圆环病毒疫苗对母猪的免疫效果
2017-11-08王小龙熊培鑫戚兆富王福军张丽宏范根成杜元钊
王小龙,张 青,熊培鑫,戚兆富,王福军,张丽宏,范根成,杜元钊
(1. 青岛易邦生物工程有限公司,山东青岛 266114;2. 雨润集团养殖事业部,江苏南京 210000)
通过检测血清中的病毒载量评估不同圆环病毒疫苗对母猪的免疫效果
王小龙1,张 青1,熊培鑫2,戚兆富2,王福军1,张丽宏1,范根成1,杜元钊1
(1. 青岛易邦生物工程有限公司,山东青岛 266114;2. 雨润集团养殖事业部,江苏南京 210000)
为了给规模化猪场圆环病毒2型(PCV2)的感染和疫苗评价提供科学合理的评判标准,本研究建立了一套成熟敏感的real-time PCR检测方法,通过检测母猪免疫前后血液中病毒载量变化,来评价不同类型圆环病毒疫苗的免疫效果。结果显示:4个厂家疫苗对降低病毒载量的效果差异很大,其中原核表达的PCV2疫苗效果最佳,降幅比例为97.78 %,离散度为49.8。此外,PCV2疫苗免疫能够降低猪繁殖与呼吸综合征(PRRS)的抗体水平,有助于猪场PRRS疫情的控制。以上试验证明:PCV2病毒载量的降低是控制PCV2感染的关键;抗体水平不能作为疫苗的评价标准;不同厂家的PCV2疫苗效果存在很大差异。
猪圆环病毒2型疫苗;病毒载量;抗体水平;猪繁殖与呼吸综合征;免疫效果评价
猪圆环病毒病严重危害我国养猪业的发展,给我国造成了严重的经济损失[1-2]。圆环病毒造成的疾病包括:PMWS(断奶后多系统衰竭综合征)、PDNS(猪皮炎肾病综合征)、PRDC(猪呼吸道疾病综合征)和Reproductive Disorders(繁殖障碍)[3-4]。目前我国猪场的圆环病毒2型感染(PCV2)十分普遍,无阴性场。但是猪感染PCV2不一定出现临床症状,而是隐性带毒。因此在目前PCV2感染普遍的情况下,其病原学监测的意义不大。PCV2的抗体检测不能区分疫苗免疫与野毒感染,并且不同抗体检测试剂盒厂家ELISA包被的成份有所不同,所以不能简单地用ELISA检测的抗体滴度和整齐度,去评价不同类型圆环病毒苗的免疫效果[5-6]。
美国自暴发PCV2感染以来,对PCV2进行了大量的研究试验。其对疫苗的评价包括降低血清中的病毒载量、降低临床病例和降低组织病理学损伤,而降低血清中的病毒载量是一个非常好的检测指标[7-8]。之前的研究表明,粪便、鼻腔和口腔拭子中的PCV2 DNA含量能够反映血清中的病毒含量,并且PCV2的病毒载量和病毒诱导产生的抗体并没有严格的相关性,所以血清中的病毒载量能够反应猪群的带毒和排毒情况。通过一些数据发现,美国经过长达6年的PCV2疫苗免疫,使母猪群中的病毒载量得到了有效降低,从2006年的猪群平均病毒载量104~106copies/mL降到2012年的103~104copies/mL,大大降低了感染猪群的临床症状和PCV2的感染压力[9-10]。
为科学合理地评价PCV2疫苗的效果,借鉴美国的成功经验,通过建立一套成熟敏感的realtime PCR检测方法,检测免疫不同类型PCV2疫苗的母猪血清中病毒载量变化,来评价不同类型疫苗的使用效果。
1 材料与方法
1.1 实验动物
在某集团公司的规模化种猪场,挑选同批次分娩前2个月的妊娠母猪150头,将其分成5组(胎龄、防疫和饲养条件基本一致):全病毒灭活疫苗(A和D场)、基因工程疫苗(B和C场)和对照组,每组30头。试验之前对不同试验组的猪群进行采血,采血1周后进行猪群免疫;再间隔3周加强免疫1次;1个月后再次采血(表1)。

表1 试验方案
1.2 引物设计与扩增
根据发表的序列,选用病毒特异性序列设计引物。上游引物为GGCTCCAGTGCTGTTATT,下游引物为AGGGCTGGGTTATGGTAT,扩增片段为110 bp。按DNA提取试剂盒说明,制备病毒DNA模板,用TaKaRa Ex Taq试剂盒进行PCR扩增。常规PCR反应条件:预变性 94 ℃ 2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,共35个循环,延伸反应72 ℃ 10 min,用1%琼脂糖凝胶电泳鉴定PCR 产物。
1.3 标准DNA模板的制备
含PCV2全长基因组重组质粒(pMD-PCV2),由本实验室构建。以此重组质粒作为实时定量PCR标准品,用紫外法测定质粒DNA浓度,小量分装,置-20 ℃备用。
1.4 实时定量PCR操作程序
采用SYBR Premix Ex Taq试剂盒进行实时定量PCR试验。以重组质粒标准品为模板,在ABI Prism 7500仪(Bio-Rad)上,应用矩阵法,对实时定量PCR的循环参数、引物浓度等条件进行优化。取200 µL血清,按照病毒DNA核酸提取试剂盒(碧云天)的操作流程进行核酸提取,最后将病毒的DNA溶解到50 µL溶解液中,将其作为荧光定量的上样模板。荧光定量试剂为SYBR® Green I检测(Takara),样品上样量为2 µL。反应体系为20 µL,其中 2×SYBR Premix Ex Taq 预混液 10 µL、DNA 模板 2 µL、上下游引物(20 pmol)各 0.25 µL,加灭菌双蒸水至终体积20 µL。反应条件为94 ℃ 预变性 5 min,94 ℃ 15 s,55 ℃ 30 s,72 ℃ 45 s,共 40个循环。在每个循环的延伸时,测定荧光信号,进行实时定量PCR检测。
1.5 标准曲线确定
将质粒标准品经10倍系列稀释,设定质粒浓度范围为107~102拷贝/µL,对每个稀释度设3个重复。按照实时定量PCR操作程序进行试验,确定标准曲线。
1.6 ELISA检测抗体
将实验前后收集的血液进行抗体检测。内容包括PCV2(金诺试剂盒)和PRRSV(爱德仕试剂盒)。通过抗体的离散度进行评价。
1.7 数据分析
将试验数据用“平均值±标准差”(Means±SD)表示。利用GraphPad Prism(version 5.0)软件中的Two-way ANOVA test进行显著性分析。P>0.05(ns),表示差异不显著;P<0.05(*),表示差异显著;P<0.01(**)和P<0.001(***),表示差异极显著。
2 结果
2.1 实时荧光定量
以重组质粒作为标准DNA模板,纯化质粒,测定其浓度,并换算得到病毒拷贝数为1×109拷贝/µL。以质粒DNA模板作为标准,对实时定量反应条件进行优化,建立了检测 PCV2核酸的PCR扩增曲线和标准曲线(图1、图2)。从107~102拷贝/µL之间的标准模板浓度具有良好的线性关系,相关系数R2=0.998,扩增效率E=0.92。
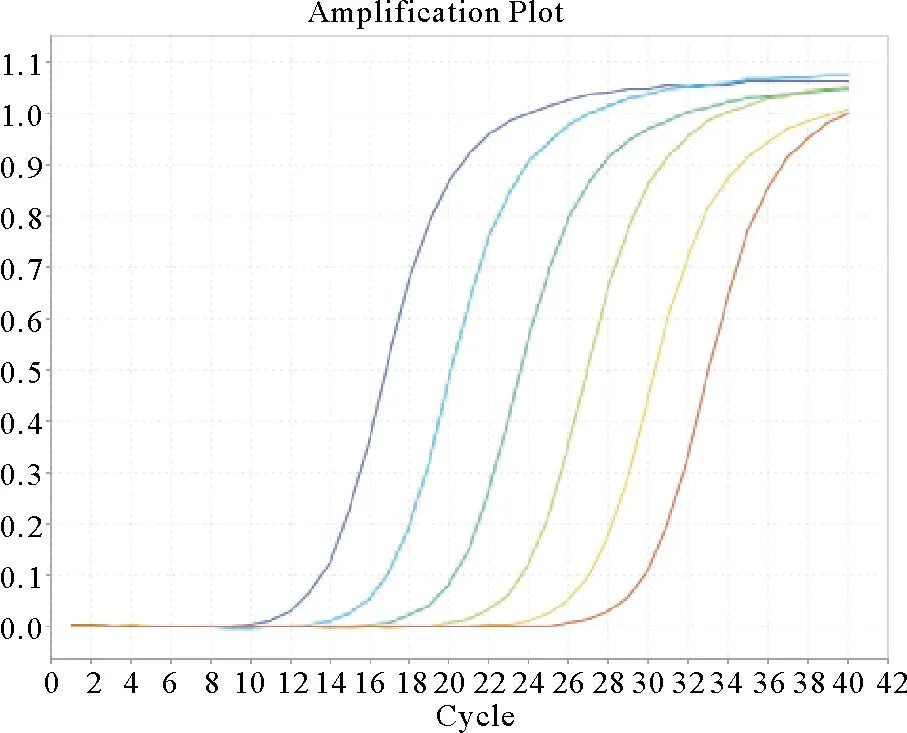
图1 实时定量PCR法检测PCV2质粒DNA扩增曲线
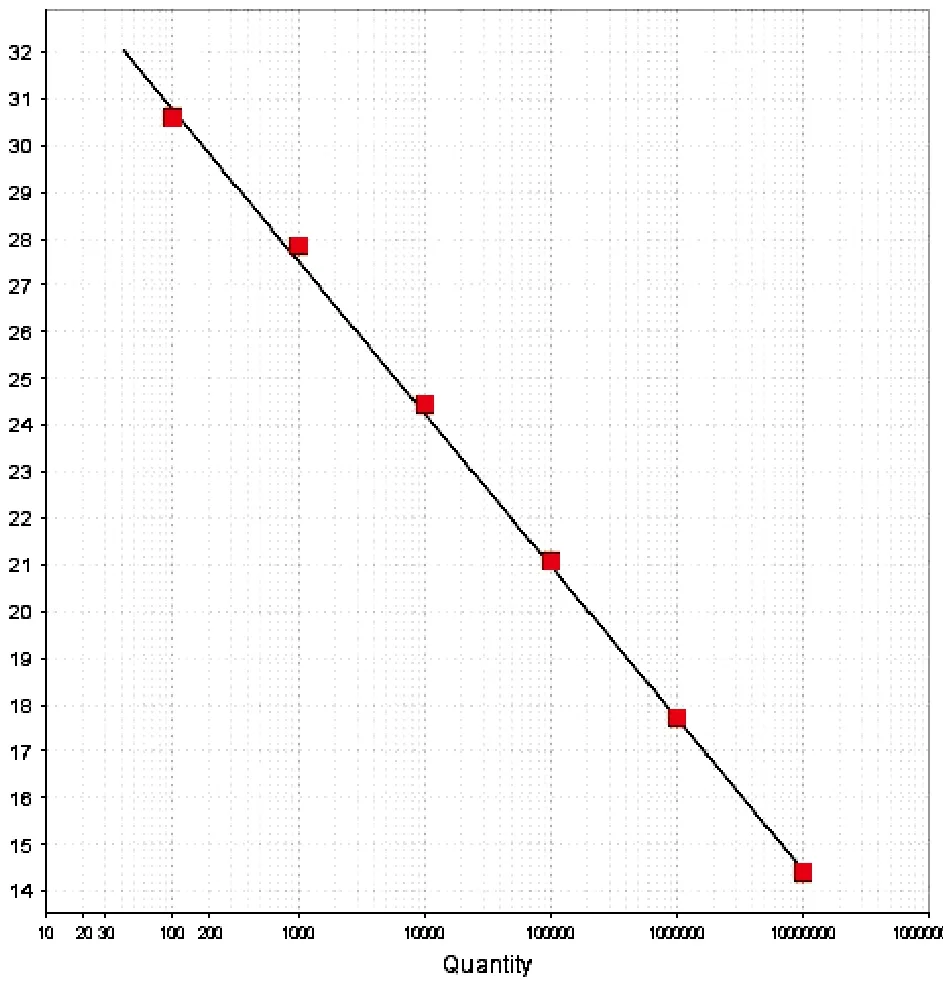
图2 实时定量PCR法检测PCV2质粒DNA标准曲线
2.2 病毒载量分析
分别对不同免疫组免疫前后血清中的PCV2病毒含量进行测定。结果显示:B组免疫后的病毒载量为2.7×104±2.6×103,明显低于其他组,而且整齐度最好,是所有组别中效果最好的;对照组病毒载量有轻微下降;A组效果较好,C组和D组没有将病毒载量降到理想程度,效果基本一致;所有处理组免疫前后病毒载量差异都极显著(图3、表2)。

图3 PCV2病毒载量在免疫前后的变化
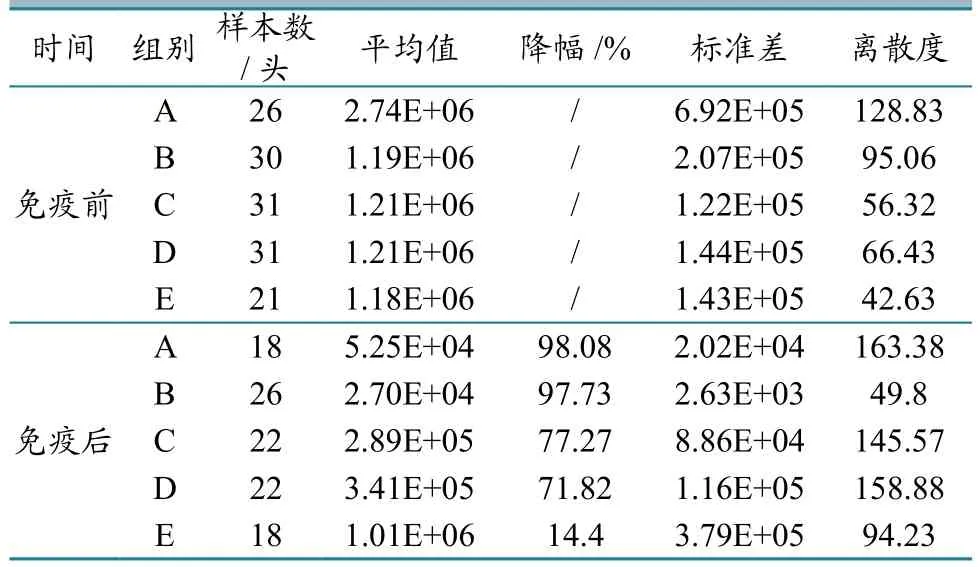
表2 PCV2病毒载量免疫前后的变化
2.3 PCV2和PRRSV的抗体分析
对不同处理组免疫前后的血清进行抗体检测,结果显示:PCV2抗体免疫后都有明显上升,其中C组免疫后最高,其次为B组,A组、D组和E组基本一致,相对较低;免疫后的PRRSV抗体都普遍下降,各组间差异不显著。这说明PCV2免疫能够降低猪群中的PRRSV活跃度,从而降低PRRSV的抗体水平(图4)。
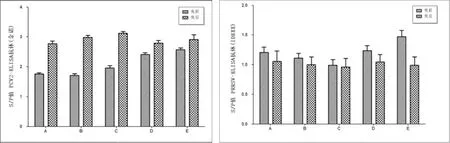
图4 PCV2和PRRSV抗体在免疫前后的变化
3 讨论
目前,国内猪场的PCV2感染现象十分普遍,并且一旦感染终生带毒。PCV2只有在体内产生很高的病毒血症时,才会导致猪出现临床症状,从而影响生产成绩。病毒血症的高低是国际上认可的评价PCV2感染程度和疫苗效果的指标,因此如何在临床上降低病毒血症是控制PCV2感染的关键[11-12]。
PCV2传入我国后,在短短几年内迅速传遍各大猪场。这与最初几年大面积使用全病毒灭活苗有很大关系。由于PCV2培养滴度低,难灭活,造成一些技术不过关企业生产出的疫苗存在应激过大、抗原含量不够、灭活不彻底、易散毒等问题[13]。PCV2自然感染猪群后,能够刺激机体产生Cap(核衣壳蛋白)和Rep(复制酶蛋白)两种抗体。然而无论是全病毒灭活苗,还是基因工程疫苗,免疫后都只能产生针对Cap的抗体,不会产生非结构蛋白Rep抗体。目前ELISA检测试剂盒大多针对Cap抗体,因此无法区分猪群产生的抗体是疫苗产生的,还是野毒感染所致[9]。通过上述试验发现,试验组(C和D组)免疫后的抗体水平虽然很高,但是病毒载量并没有得到有效降低。这与疫苗质量有很大关系。因此,不能用PCV2-Cap抗体水平的高低,去评价PCV2疫苗的效果。而基因工程疫苗(B组),由于只产生Cap抗体,因此抗体检测的滴度虽然不是最高,但是能够明显降低病毒载量,并且组内整齐度最好。这就是基因工程疫苗的优势。随着技术研究的不断深入,部分动物疫苗会从简单传统的全病毒时代迈向具有高技术含量的基因工程时代。这是技术发展的必然。PCV2基因工程疫苗能够克服全病毒灭活苗抗原含量低、应激大和易散毒等问题,可为PCV2的有效防控做出巨大贡献。
目前我国猪场普遍存在PCV2和PRRSV的共感染问题。由于PRRSV和PCV2都是免疫抑制病毒,并且可在猪体内相互促进复制,因此PCV2极易造成猪群中PRRSV的不稳定。在上述试验中,猪群免疫PCV2疫苗后,PRRSV的抗体水平相应下降,使猪群中的PRRSV趋于稳定。猪场防疫是一个系统工程,因此必须重视PCV2有效免疫对PRRSV控制的影响[14]。
PCV2疫苗只能降低血液中的病毒载量,不能消除感染。因此,疫苗免疫不能在短时间内降低猪群的阳性率。只有坚持长期免疫,才能达到对PCV2的有效防治[7-9]。仔猪可以通过接触母猪和环境而感染。虽然母猪的高水平PCV2-Cap抗体不能影响仔猪群感染,但可减少母猪排毒现象,降低猪场的PCV2感染压力。高病毒血症母猪产出的仔猪基本为阳性,无病毒血症母猪产出的仔猪一般为低水平或检测不出病毒血症[15]。PCV2感染容易发生在母猪妊娠70 d之前,而仔猪则最易发生在出生后8~10周。这是因为此时母源抗体最低。母猪的疫苗免疫不能阻止PCV2传播和清除初乳中的PCV2,但可以诱发血清和初乳中的PCV2抗体[16]。此外,PCV2在仔猪中导致的发病和损失更为严重。血清PCV2病毒载量对仔猪平均日增重(ADWG)的影响存在量的效应,即血清中的PCV2病毒载量越高,ADWG越低。PCV2疫苗可以降低感染猪场的发病率、减少病毒载量以及改善ADWG,同时可提高同批猪只的均匀度。仔猪在断奶前后接种疫苗可减少该病导致的危害,降低血清中PCV2的感染水平,提高生产性能[17]。
[1] 杨汉春. 猪免疫抑制性疾病的流行特点与控制对策[J].中国畜牧兽医,2004. 31(5):41-43.
[2] 王忠田,杨汉春,郭鑫.规模化猪场猪圆环病毒2型感染的流行病学调查[J]. 中国兽医杂志,2002,38(10):3-6.
[3] 刘正飞,陈焕春,吴斌,等. 猪圆环病毒研究进展[J].养殖与饲料,2004(10):4-7.
[4] 王忠田,杨汉春,郭鑫. 猪圆环病毒研究进展[J]. 中国兽医杂志,2004,40(3):33-35.
[5] 李鹏飞. 猪圆环病毒II型抗体检测ELISA试剂盒的研制[D]. 郑州:郑州大学,2015.
[6] 刘肖. 猪圆环病毒2型病毒样颗粒性疫苗的制备与免疫评价[D]. 郑州:河南农业大学,2015.
[7] DVORAK C M,YANG Y,HALEY C. National reduction in porcine circovirus type 2 prevalence following introduction of vaccination[J]. Veterinary Microbiology,2016,189:86-90.
[8] PATTERSON A R,OPRIESSNIG T. Epidemiology and horizontal transmission of porcine circovirus type 2(PCV2)[J].Animal Health Research Reviews,2010,11(2):217-234.
[9] DVORAK C M T,LILLA M P,BAKER S R,et al.Multiple routes of porcine circovirus type 2 transmission to piglets in the presence of maternal immunity[J]. Veterinary Microbiology,2013,166(3/4):365-374.
[10] KEKARAINEN T,MCCULLOUGH K,FORT M,et al.Immune responses and vaccine-induced immunity against Porcine circovirus type 2[J]. Veterinary Immunology and Immunopathology,2010,136(3/4):185-193.
[11] OLVERA A,SIBILA M,CALSAMIGLIA M,et al.Comparison of porcine circovirus type 2 load in serum quantified by a real time PCR in postweaning multisystemic wasting syndrome and porcine dermatitis and nephropathy syndrome naturally affected pigs[J]. Journal of Virological Methods,2004,117(1):75-80.
[12] SEGALES J. Porcine circovirus type 2(PCV2)infections:clinical signs,pathology and laboratory diagnosis[J]. Virus research,2012,164(1/2):10-19.
[13] 苏金存. 猪圆环病毒2型油乳剂灭活疫苗及其免疫效力研究[D]. 合肥:安徽农业大学,2010.
[14] CHAE C. Porcine respiratory disease complex:Interaction of vaccination and porcine circovirus type 2,porcine reproductive and respiratory syndrome virus,and Mycoplasma hyopneumoniae[J]. Vet Journal,2016,212:1-6.
[15] PARIS S,SILLION F,OIS X,et al. Absence of porcine circovirus type 1(PCV1)and high prevalence of PCV 2 exposure and infection in swine finisher herds[J]. Virus research,2011,157(1):92-98.
[16] FENG H,SEGALÉS J,FRAILE L. Effect of high and low levels of maternally derived antibodies on porcine circovirus type 2(PCV2)infection dynamics and production parameters in PCV2 vaccinated pigs under field conditions[J].Vaccine,2016,34(27):3044-3050.
[17] LÓPEZSORIA S,SIBILA M,NOFRARÍAS M. Effect of porcine circovirus type 2 PCV2)load in serum on average daily weight gain during the postweaning period[J]. Veterinary microbiology,2014,174(3/4):296-301.
(责任编辑:朱迪国)
Immune Effect Assessment of Different PCV2 Vaccines on Sow by Detecting PCV2 Viral Load in Serum
Wang Xiaolong1,Zhang Qing1,Xiong Peixin2,Qi Zhaofu2,Wang Fujun1,Zhang Lihong1,Fan Gencheng1,Du Yuanzhao1
(1. Qingdao YEBIO Bioengineering Co.,Ltd.,Qingdao,Shandong 266114;2. Pig Industry Department of YURUN Group,Nanjing,Jiangsu 210000)
In order to provide scientific rational evaluation for PCV2 infection and vaccine evaluation in largescaled swine farms,a mature real-time PCR assay was designed and was used to quantify viral load in before and after immunized serum samples,so as to evaluate the immunity status on different domestic PCV2 vaccine. The results showed that the effect on reducing viral load of vaccines from 4 manufacturers varied significantly. The effect of prokaryotic expression vaccine of PCV2 was the best,of which the percentage decline was 97.78%,and the discretization was 49.8. In addition,PCV2 vaccine could both decrease PRRSV antibody levels and control PRRSV infection in pig farms. The results showed that the reduction of PCV2 viral load was the key to control PCV2 infection.The antibody level couldn't be the standard to estimate vaccine efficacy and there was a big difference of vaccine effectiveness from different manufactures.
PCV2 vaccine;viral load;antibody level;PRRSV;immune effect evaluation
S855.3
A
1005-944X(2017)11-0074-05
10.3969/j.issn.1005-944X.2017.11.020
杜元钊
