ClO2气相氧化联合CaCO3浆液吸收同时脱硫脱硝试验研究*
2017-11-07徐凯杰刘志华潘理黎
徐凯杰 文 静 刘志华 潘理黎
(浙江工业大学环境学院,浙江 杭州 310014)
ClO2气相氧化联合CaCO3浆液吸收同时脱硫脱硝试验研究*
徐凯杰 文 静 刘志华 潘理黎#
(浙江工业大学环境学院,浙江 杭州 310014)
采用ClO2气相氧化联合CaCO3浆液吸收工艺对模拟烟气进行同时脱硫脱硝,研究了ClO2/NO摩尔比、SO2初始浓度对气相氧化段NO氧化率的影响及液相吸收段中CaCO3浆液pH、温度和液气比对同时脱硫脱硝效果的影响。结果表明,在气相氧化段,NO的氧化率随着ClO2/NO摩尔比的增加呈先快速增加后逐渐平稳的变化趋势;在给定的ClO2/NO摩尔比(0.8)下,随着SO2初始浓度的增加,NO氧化率稍有下降,高浓度SO2的存在对ClO2氧化NO的抑制作用有限,说明ClO2对NO的氧化反应具有良好的选择性。ClO2气相氧化联合CaCO3浆液吸收工艺最优反应条件:ClO2/NO摩尔比为0.8,CaCO3浆液初始pH为7.0、温度为55 ℃,液气比为18L/m3。当SO2初始质量浓度为1 000mg/m3、NOx初始质量浓度为509mg/m3时,最佳反应条件下SO2去除率达100.00%,NOx去除率达81%左右。
ClO2CaCO3浆液 中小型工业锅炉 脱硫脱硝
我国中小型工业锅炉每年消耗原煤约4亿t,排放SO2约600万t,NOx约360万t,其烟气污染物排放量大面广,是仅次于火电厂的第二大煤烟型污染源。旧版《锅炉大气污染物排放标准》(GB 13271—2001)对燃煤工业锅炉的NOx排放不做要求,当前中小型工业锅炉多采用双减法、氨法与石灰石-石膏法等进行烟气脱硫处理,这些方法在应用中存在很多问题,许多中小型工业锅炉烟气排放处于失控状态。新版《锅炉大气污染物排放标准》(GB 13271—2014)于2014年7月1日开始实施,对工业锅炉新增了脱硝要求,然而目前无适合中小型工业锅炉的烟气脱硝方法,很多企业采用选择性催化还原法(SCR)进行烟气脱硝,但中小型工业锅炉负荷波动大[1],烟气温度低,SCR法脱硝效果较差。
当前,燃煤工业锅炉脱硫脱硝的常用技术有氧化吸收法[2-10]、氨法[11-14]、尿素法[15-20]以及钙基吸收法联合氧化法等[21-26]。针对中小型工业锅炉脱硫脱硝存在的问题,本研究尝试在喷淋塔中采用ClO2气相氧化联合CaCO3浆液吸收工艺来提高脱硫脱硝效率,降低处理成本,并对该联合工艺的最佳试验条件、系统稳定性进行了试验研究。
1 试验装置与方法
1.1 试验装置
试验装置包括ClO2发生器(见图1)和模拟烟气脱硫脱硝试验装置(见图2)。模拟烟气脱硫脱硝试验装置主要由模拟烟气产生系统、反应系统和烟气分析系统组成。
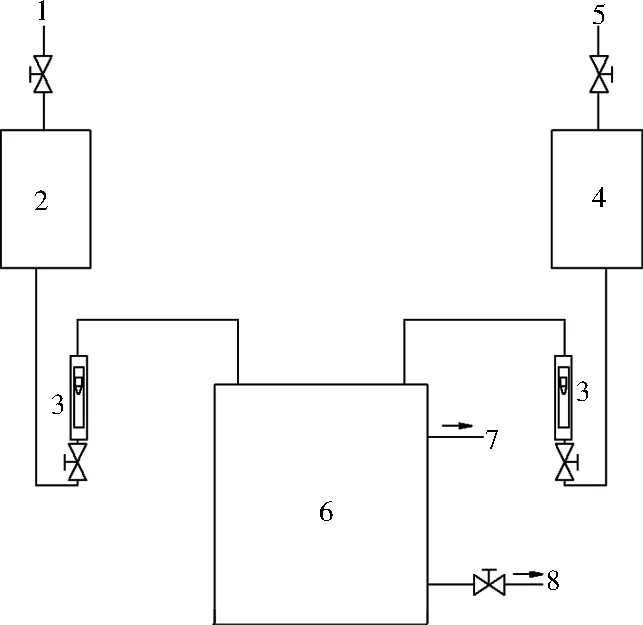
1—盐酸进料口;2—盐酸储槽;3—流量计;4—亚氯酸钠溶液储槽; 5—亚氯酸钠溶液进料口;6—ClO2发生器;7—ClO2出口;8—排污口图1 ClO2发生器Fig.1 ClO2 generator
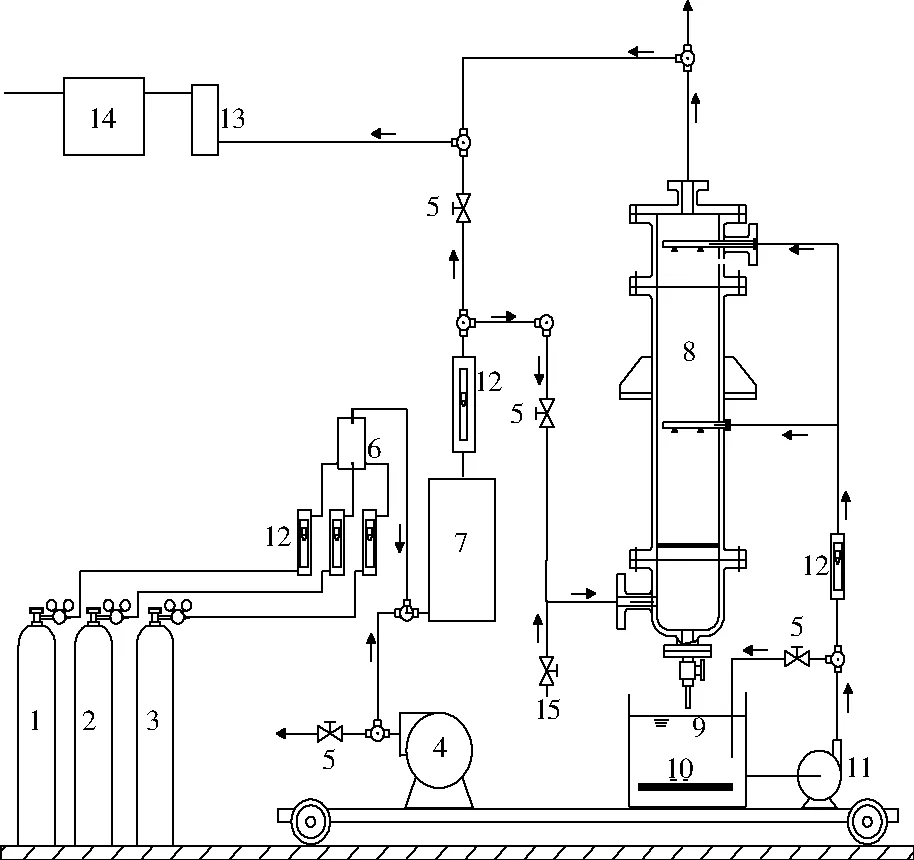
1—N2钢瓶;2—SO2钢瓶;3—NO钢瓶;4—空气泵;5—截止阀; 6—一级稀释罐;7—二级缓冲罐;8—喷淋塔;9—储液槽; 10—温控加热器;11—循环水泵;12—转子流量计;13—干燥器; 14—烟气分析仪;15—ClO2气体注射口图2 模拟烟气脱硫脱硝试验装置Fig.2 Schematic diagram of the experimental apparatus for simultaneous desulfurization and denitrification
1.2 试验方法
Ca/S摩尔比是脱硫系统中的重要控制指标,工业上Ca/S摩尔比一般要控制在1.02~1.05[27],本试验取Ca/S摩尔比为1.05。根据模拟烟气SO2浓度,用纯度为99%的CaCO3粉末配制成一定浓度的CaCO3浆液10 L,调节pH,置入模拟烟气脱硫脱硝试验装置的储液槽中。向ClO2发生器的进料口中分别加入盐酸与亚氯酸钠,利用小流量空气泵将产生的ClO2气体稳定输出,去除盐酸并测试ClO2浓度,随后从ClO2气体注射口注入模拟烟气脱硫脱硝试验装置中。用转子流量计控制SO2、NO、N2的进气浓度,气体进入一级稀释罐稀释后进入二级缓冲罐与空气混合,从底部进入喷淋塔。浆液加热后,经泵提升进入喷淋塔,与烟气逆流反应,反应后流入储液槽继续循环,经处理的气体从喷淋塔顶部排空。SO2、NO和NOx的进口和出口浓度由ecom-PLC烟气分析仪分别测定。
1.3 ClO2测定方法
ClO2气体易溶于水,一定温度下ClO2在溶液中达到溶解平衡时,液相中ClO2的浓度与气相中ClO2的浓度呈正比[28]。将制得的ClO2气体以一定速率在一定的时间内通入定量的超纯水中,制得ClO2标准液,用碘量法标定标准液中ClO2浓度,将ClO2标准溶液稀释一定倍数,在357 nm处测量吸光度,制作标准曲线,如图3所示。
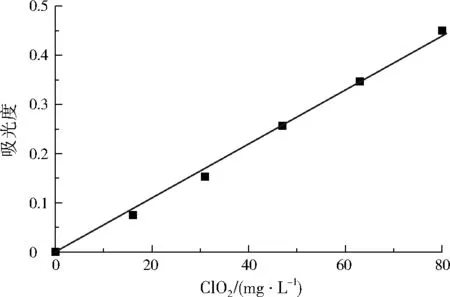
图3 ClO2标准曲线Fig.3 The standard curve of ClO2
每次气相氧化前后,用100.0 mL超纯水吸收通入的ClO2气体一定时间(一般控制在5 s左右)后,在波长357 nm处测量吸光度,代入标准曲线推算溶液中ClO2质量浓度,根据式(1)计算气相ClO2投加量:
nClO2=3.6×c×0.1/67.5t
(1)
式中:nClO2为ClO2的投加量,mol/h;c为液相中ClO2质量浓度,mg/L;t为通气时间,s。
2 结果与讨论
2.1 气相氧化段各因素对NO氧化率的影响
由于NO难溶于水,需由气相氧化段将NO氧化为较易溶于水的高价态NOx,进而对其进行液相吸收。因此,NOx的去除主要由气相段的NO氧化率决定,故先进行单独NO氧化试验。
2.1.1 ClO2/NO摩尔比对NO氧化率的影响
ClO2氧化燃煤烟气时对NO有较好选择性。为考察ClO2对NO氧化率的影响,改变ClO2进口浓度,使ClO2/NO摩尔比分别为0、0.1、0.2、0.4、0.5、0.6、0.8、1.1,控制模拟烟气中NO初始质量浓度为535 mg/m3、SO2为0 mg/m3、烟气量为20 m3/h,常温下进行反应,则NO氧化率随ClO2/NO摩尔比的变化如图4所示。
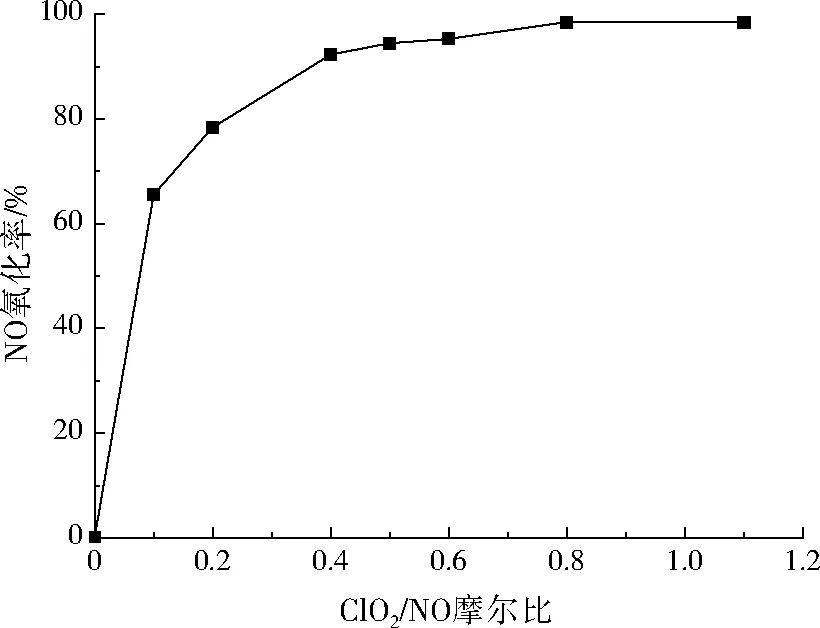
图4 ClO2/NO摩尔比对NO氧化率的影响Fig.4 The effect of ClO2/NO molar ratio on the oxidation rate of NO
由图4可见,当模拟烟气中不含SO2时,ClO2/NO摩尔比为0~0.4,NO氧化率随ClO2/NO摩尔比的增加迅速增加,最高达92.25%;当ClO2/NO摩尔比为0.4~0.8,NO氧化率增幅放缓;当ClO2/NO摩尔比为0.8~1.1时,NO氧化率基本稳定。说明ClO2/NO摩尔比为0.8时氧化反应已基本完成,因此ClO2/NO摩尔比宜选为0.8。
2.1.2 SO2初始浓度对NO氧化率的影响
SO2的存在会消耗ClO2,影响NO氧化效率。调节SO2初始质量浓度分别为280、640、1 500、2 200、2 750、4 250 mg/m3左右,控制ClO2/NO摩尔比为0.8、NO初始质量浓度为1 200mg/m3、烟气流量为20 m3/h,常温下进行反应,NO和SO2氧化率随SO2初始质量浓度的变化如图5所示。
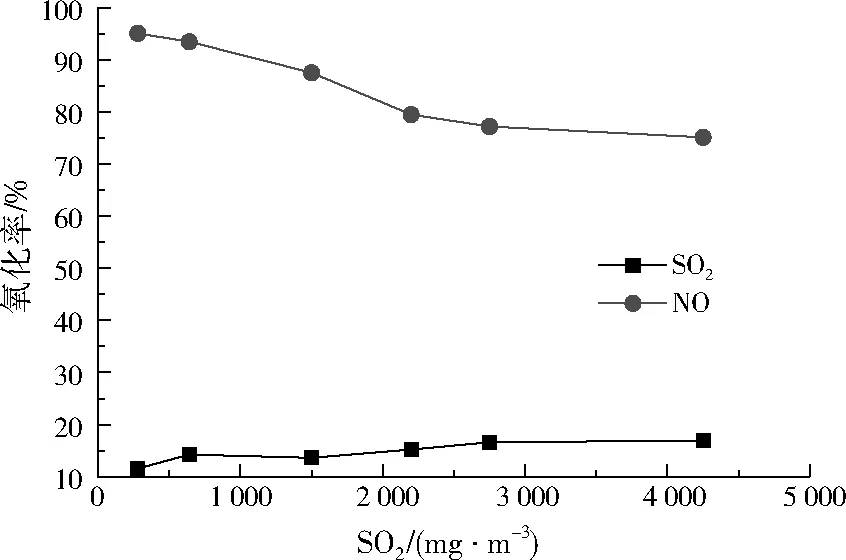
图5 SO2初始质量浓度对NO和SO2氧化率的影响Fig.5 The effect of SO2 initial concentration on the oxidation rate of NO and SO2
由图5可见,随着SO2初始浓度的增加,NO氧化率有所下降,但总体下降不明显,可能是SO2与ClO2的脱硝氧化中间产物ClO·发生反应,使ClO·浓度下降,影响了NO的氧化率。随着SO2初始质量浓度从280 mg/m3增加到4 250 mg/m3,SO2氧化率缓慢增加,增幅不到20%,且SO2的氧化率远小于NO的氧化率,主要原因是ClO2氧化SO2的反应速率常数远小于NO[29],可见高浓度SO2的存在对ClO2氧化NO的抑制作用有限,ClO2对NO的氧化反应具有很好的选择性。
2.2 液相吸收段各因素对脱硫脱硝的影响
2.2.1 CaCO3浆液初始pH对脱硫脱硝的影响
控制模拟烟气中SO2初始质量浓度为1 000 mg/m3、NOx初始质量浓度为509 mg/m3、ClO2/NO摩尔比为0.8、CaCO3浆液温度为55 ℃、CaCO3浆液与烟气的液气比为18 L/m3,改变CaCO3浆液的初始pH分别为4.5、5.5、6.5、7.0、8.0,CaCO3浆液初始pH对SO2、NOx去除率的影响如图6所示。
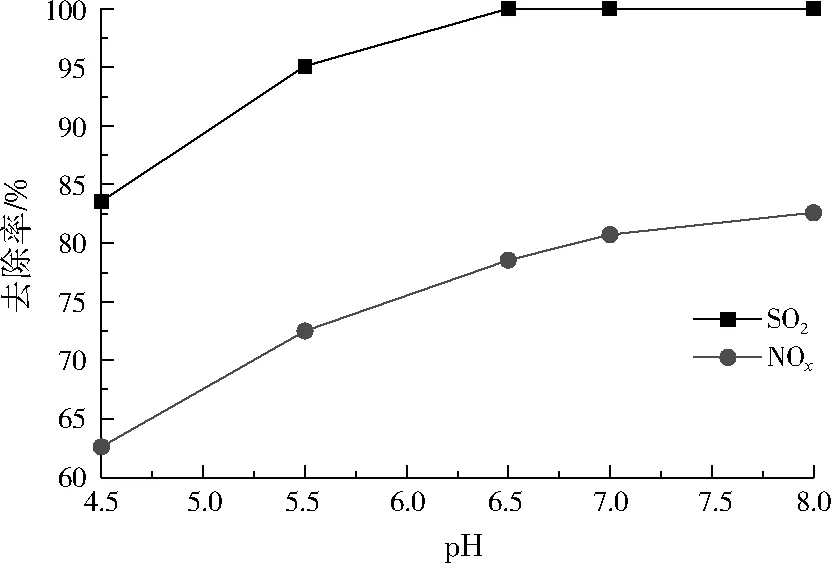
图6 CaCO3浆液初始pH对SO2、NOx去除率的影响Fig.6 The effect of intial pH of CaCO3 slurry on the removal rate of SO2 and NOx
由图6可见,NOx的去除率随着CaCO3浆液初始pH的增加而增加,当初始pH>7.0后,NOx去除率增加速率逐渐变缓。SO2去除率也随初始pH的增加迅速增加,在初始pH为6.5时,SO2去除率接近100%,继续增加初始pH,SO2去除率一直保持在100%左右。可见,在试验范围内,CaCO3浆液初始pH越高,对烟气脱硫脱硝效果越好,可能因为碱性条件下有利于SO2、NOx进一步氧化,从而被CaCO3浆液吸收。考虑到实际工程运用的处理成本,将CaCO3浆液初始pH定为7.0。
2.2.2 CaCO3浆液温度对脱硫脱硝的影响
本研究使用的模拟烟气脱硫脱硝试验装置储液槽中设有温控加热器,可以调节CaCO3浆液的温度。控制模拟烟气中SO2初始质量浓度为1 000 mg/m3、NOx初始质量浓度为509 mg/m3、ClO2/NO摩尔比为0.8、CaCO3浆液初始pH为7.0、CaCO3浆液与烟气的液气比为18 L/m3,改变CaCO3浆液的温度分别为20、30、45、55、60、70 ℃,CaCO3浆液温度对SO2、NOx去除率的影响如图7所示。
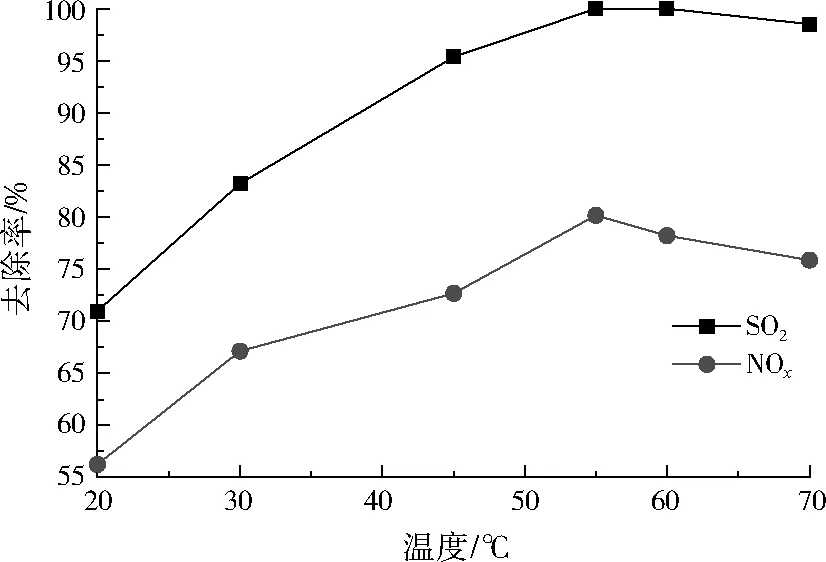
图7 CaCO3浆液温度对SO2、NOx去除率的影响Fig.7 Effect of CaCO3 slurry temperature on the removal rate of SO2 and NOx
由图7可见,随着CaCO3浆液温度的升高,NOx去除率先增加而后降低,在55 ℃处达到最高值。SO2去除率在55 ℃后基本趋于稳定,接近100%,综合SO2、NOx的去除率,CaCO3浆液的最佳温度选为55 ℃。
2.2.3 液气比对脱硫脱硝的影响
液气比是实际湿法脱硫工程中的重要运行参数。控制模拟烟气中SO2初始质量浓度为1 000 mg/m3、NOx初始质量浓度为509 mg/m3、ClO2/NO摩尔比为0.8、CaCO3浆液初始pH为7.0、CaCO3浆液温度为55 ℃,调节CaCO3浆液与烟气的液气比分别为10、13、15、18、20、25 L/m3,则液气比对SO2、NOx去除率的影响如图8所示。
由图8可见,当液气比≤18 L/m3时,NOx去除率随液气比的增加迅速增加,当液气比为18 L/m3时,NOx去除率达82.13%;继续增加液气比,NOx去除率基本不变;而SO2去除率在为13 L/m3时就迅速达到最大值且保持稳定。综合考虑运行成本和脱硫脱硝效率,确定液气比为18 L/m3。

图8 液气比对SO2、NOx去除率的影响Fig.8 The effect of liquid/gas ratio on the removal of SO2 and NOx
2.3 平行试验
为验证工艺和装置的稳定性,在最佳工艺条件下(SO2初始质量浓度为1 000 mg/m3,NOx初始质量浓度为509 mg/m3,ClO2/NO摩尔比为0.8,CaCO3浆液初始pH为7.0、温度为55 ℃,液气比为18 L/m3)进行了模拟烟气脱硫脱硝的平行试验,试验结果如表1所示。平行试验结果表明,该系统的稳定性良好,脱硫脱硝性能稳定,最佳工艺条件下,SO2去除率维持在100.00%,NOx去除率在81%左右。

表1 平行试验结果
本研究中进口NOx的质量浓度为509 mg/m3时,按NOx去除率为81.00%进行计算,则出口NOx质量浓度为97 mg/m3。按照GB 13271—2014的要求,需将实测排放浓度折算为基准氧含量下的排放浓度,其中规定燃煤锅炉基准氧含量为9%(体积分数)。目前燃煤锅炉过量空气系数高达4.66[30],即基准氧含量为16.49%,根据基准氧含量折算后的出口NOx质量浓度为258 mg/m3。GB 13271—2014中规定在用锅炉NOx排放标准为400 mg/m3,新建锅炉排放标准为300 mg/ m3,可见经联合工艺处理后,锅炉烟气NOx可以达到排放标准。
3 脱硫脱硝机制

(1) 气相氧化段
气相氧化段主要发生SO2和NO的氧化过程,反应方程式如下:
NO +ClO2→NO2+ClO·
(2)
NO +ClO·→NO2+Cl·
(3)
SO2+ClO·→ SO3+Cl·
(4)
(2) 液相吸收段
在液相吸收段中,气相过量ClO2进入到CaCO3浆液中。液相中有少量ClO2存在时烟气中SO2将发生如下反应:
(5)
(6)
(7)
(8)
式(4)中氧化生成的SO3也被CaCO3吸收:
(9)
(10)
NOx的液相吸收过程相对复杂。其中,NO2在气液界面主要发生如下反应:
2NO2+H2O→HNO3+HNO2
(11)
5HNO2+2ClO2+H2O→5HNO3+2HCl
(12)
2HNO3+CaCO3→CO2+Ca(NO3)2+H2O
(13)
根据上述机制分析可知,NOx的液相吸收主要通过气体在溶液中的吸收平衡来实现,由于NO的溶解度很低,本研究先采用ClO2气体在烟道中将NO迅速氧化成NO2等易吸收的状态,再进入CaCO3浆液吸收,是一种相当有效的脱除NOx的方法。
4 经济成本分析
针对中小型工业锅炉脱硫脱硝改造,一些地方政府规定采用前端低氮燃烧(LNB)+SCR技术脱硝,脱硝成本约为12 500元/t[31]。本联合工艺使用的ClO2气体在工业上大规模采用亚氯酸钠法生产,估算药剂费用为7 340元/t,总脱硝费用约9 429元/t,具有一定经济优势;与湿法烟气脱硫(WFGD)+SCR工艺相比,本联合工艺为一塔式同时脱硫脱硝,初始投资比WFGD+SCR工艺约低30%[32],且占地面积较小、总运行费用略低。可见,本联合工艺针对中小型工业锅炉脱硫脱硝具有一定的经济优势。
5 结 论
(1) 在气相氧化段,NO的氧化率随着ClO2/NO摩尔比的增加呈先快速增加后逐渐平稳的变化趋势;当模拟烟气中有SO2存在时,NO的氧化率稍有降低,高浓度SO2的存在对ClO2氧化NO的抑制作用有限,ClO2对NO的氧化反应具有良好的选择性。
(2) ClO2气相氧化联合CaCO3浆液吸收工艺的最佳反应条件:ClO2/NO摩尔比为0.8,CaCO3浆液初始pH为7.0、温度为55 ℃,液气比18 L/m3。当SO2初始质量浓度为1 000 mg/m3、NOx初始质量浓度为509 mg/m3时,在最佳反应条件下,最终SO2去除率达100.00%,NOx去除率达81%左右。
(3) 经ClO2气相氧化联合CaCO3浆液吸收工艺处理后,烟气NOx排放可达到GB 13271—2014的要求,该工艺一次性投资小,脱硫脱硝总运行成本较低,占地面积小,具有较好的推广应用前景。
[1] 李金玉,闫静,宋光武,等.北京市工业锅炉脱硝系统运行状况分析[J].环境科学与管理,2012,37(8):120-124.
[2] 雷鸣,岑超平,胡将军.尿素添加剂湿法烟气脱氮的试验研究[J].环境污染与防治,2004,26(3):225-228.
[3] 岑超平.尿素添加剂湿法烟气同时脱硫脱氮研究[D].上海:华东理工大学,2002.
[4] DONALD L W,YIANNIS A L,GIRARD A S,et al.Control of air toxin particulate and vapor emissions after coal combustion utilizing calcium magnesium acetate[J].Conservation and Recycling,1996,16(1/2/3/4):15-69.
[5] KOBAGASHI M,SHIRAI H,NINOLAWA M.Investigation on desulfurization performance and pore structure of sorbents containing zinc ferrite[J].Energy & Fuels,1997,11(4):887-896.
[6] WANG Wuyin,ZHONG Qin,YE Zhicheng.Simultaneous reduction of SO2and NOxin an entrained-flow reactor[J].Fuel,1995,74(2):267-272.
[7] 叶小莉,吴晓琴,王淑娟.氨水/FeⅡEDTA溶液同时脱硫脱硝试验研究[J].环境科学学报,2014,34(6):1560-1566.
[8] 姜艳艳,张朋,李娟娟,等.改进氨吸收法同时脱硫脱硝试验研究[J].环境污染与防治,2014,36(6):25-29.
[9] 杨一理.尿素与氧化剂复合吸收液同时脱硫脱硝试验研究[D].杭州:浙江工业大学,2013.
[10] FANG Ping,CEN Chaoping,WANG Xinming,et al.Simultaneous removal of SO2,NO and Hg0by wet scrubbing using urea+KMnO4solution[J].Fuel Processing Technology,2013,106(2):645-653.
[11] ZHAO Yi,HAN Yinghui,CHEN Cheng.Simultaneous removal of SO2and NO from flue gas using multicomposite active absorbent[J].Industrial & Engineering Chemistry Research,2012,51(1):480-486.
[12] LEE H K,DESHWAL B R,YOO K S.Simultaneous removal of SO2and NO by sodium chlorite solution in wetted-wall column[J].Korean Journal of Chemical Engineering,2005,22(2):208-213.
[13] HUTSON N D,KRZYZYNSKA R,SRIVASTAVA R K.Simultaneous removal of SO2,NOx,and Hg from coal flue gas using a NaClO2-enhanced wet scrubber[J].Industrial & Engineering Chemistry Research,2008,47(16):5825-5831.
[14] JAMSHIDI E,ALE EBRAHIM H,DABRIL S,et al.Study on simultaneous removal of NOxand SO2with NaClO2in a novel swirl wet system[J]. Industrial & Engineering Chemistry Research,2011,50(13):8278-8284.
[15] PARK H W,CHOI S,PARK D W.Simultaneous treatment of NO and SO2with aqueous NaClO2solution in a wet scrubber combined with a plasma electrostatic precipitator[J].Journal of Hazard Material,2015,285:117-126.
[16] CHU H,CHIEN T W,LI S Y.Simultaneous absorption of SO2and NO from flue gas with KMnO4/NaOH solutions[J].Science of Total Environment,2001,275(1/2/3):127-135.
[17] ZHAO Yi,GUO Tianxiang,CHEN Zhouyan,et al.Simultaneous removal of SO2and NO using M/NaClO2complex absorbent[J].Chemical Engineering Journal,2010,160(1):42-47.
[18] GUO Ruitang,PAN Weiguo,REN Jianxing,et al.Absorption of NO from simulated flue gas by using NaClO2/(NH4)2CO3in a stirred tank reactor solutions[J]. Korean Journal of Chemical Engineering,2013,30(1):101-104 .
[19] WEI Jinchao,LUO Yunbai,YU Ping,et al.Removal of NO from flue gas by wet scrubbing with NaClO2/(NH2)2CO solutions[J].Journal of Industrial and Engineering Chemistry,2009,15(1):16-22.
[20] LI Ying,ZHONG Wenqi,JU Jing,et al.Experimental on simultaneous absorption of NO and SO2from aintering flue gas by oxidizing agents of KMnO4/NaClO[J].International Journal of Chemical Reactor Engineering,2014,12(1):539-547.
[21] ZHANG Hu,TONG Huiling,WANG Sujuan,et al.Simultaneous removal of SO2and NO from flue gas with calcium-based sorbent at low temperature[J].Industrial & Engineering Chemistry Research,2006,45(18):6099-6103.
[22] SAKAI M,SU C L,SAOKA E J.Simultaneous removal of SO2and NOxusing slaked lime at low temperature[J]. Industrial & Engineering Chemistry Research,2002,41(20):5029-5033.
[23] 白云峰,李永旺,吴树志,等.钙基吸收剂液相氧化法协同脱硫脱硝试验[J].环境科学学报,2009,29(3):505-510.
[24] 张相,朱燕群,王智化,等.臭氧氧化多种污染物协同脱及副产物提纯的试验研究[J].工程热物理学报,2012,33(7):1259-1262.
[25] 张相.臭氧结合钙基吸收多种污染物及副产物提纯的试验与机理研究[D].杭州:浙江大学,2012.
[26] 王彬.石灰石-石膏湿法烟气脱硫系统优化[D].济南:山东大学,2010.
[27] 周德平,张渝,成琼,等.高浓度二氧化氯气体的在线检测研究[J].分析试验室,2005,24(8):35-38.
[28] 秘密.ClO2对NO和SO2的氧化及NOx-SO2协同脱除的试验及机理研究[D].济南:山东大学,2014.
[29] 张明慧,马强,徐超群,等.臭氧氧化结合湿法喷淋对玻璃窑炉烟气同时脱硫脱硝试验研究[J].燃料化学学报,2015,43(1):88-93.
[30] 余洁.中国燃煤工业锅炉现状[J].洁净煤技术,2012,18(3):89-91,113.
[31] 郭斌,廖宏楷,徐程宏,等.我国SCR脱硝成本分析及脱硝电价政策探讨[J].热能动力工程,2010,25(4):437-440.
[32] 高宏亮,覃海华,郭静.燃煤工业锅炉烟气湿法脱硫脱硝技术探讨[J].工业安全与环保,2014,40(5):12-14.
ExperimentalresearchofsimultaneousdesulfurizationanddenitrificationbyClO2gasphaseoxidationcombiningwithCaCO3slurryabsorption
XUKaijie,WENJing,LIUZhihua,PANLili.
(CollegeofEnvironment,ZhejiangUniversityofTechnology,HangzhouZhejiang310014)
Simultaneous desulfurization and denitrification of simulated flue gas was carried out by combining ClO2gas phase oxidation and CaCO3slurry absorption process. The influence of the ClO2/NO molar ratio and the SO2initial concentration on the oxidation efficiency of NO in the gas phase oxidation section and the effect of the pH and temperature of CaCO3slurry absorbent,liquid to gas ratio on the desulfurization and denitrification efficiency were studied. The results show that in the gas phase oxidation section,the oxidation rate of NO was increased first and then steadily with the increase of ClO2/NO molar ratio. With the increasing of the initial SO2concentration,the oxidation rate of NO decreased slightly under the given ClO2/NO molar ratio (0.8),means the existence of high concentrate SO2had little effect on NO oxidation by ClO2,which indicated that ClO2had good selectivity for the oxidation of NO. When the initial concentration of SO2was 1 000 mg/m3,the initial concentration of NOxwas 509 mg/m3,the optimal reaction conditions of combining ClO2gas phase oxidation and CaCO3slurry absorption process were as follows: the ClO2/NO molar ratio was 0.8,the initial pH of CaCO3slurry was 7.0,the temperature was 55 ℃,the liquid gas ratio was 18 L/m3. Under these optimal conditions,the desulfurization rate reached 100.00% and the denitrification rate was about 81%.
ClO2; CaCO3slurry; medium and small industrial boiler; desulfurization and denitrification
2016-10-10)
徐凯杰,女,1992年生,硕士研究生,主要从事烟气脱硫脱硝研究。#
。
*浙江省公益技术应用研究项目(No.2010C33069)。
10.15985/j.cnki.1001-3865.2017.05.009
