健脾补土组方对体外神经元低氧/复氧后PI3K、Akt、Caspase-3表达的影响
2017-11-07陈昱文刘旺华周小青郑彩杏范元硕李诚均颜艳艳
陈昱文 ,李 花 ,3*,刘旺华 ,3,周小青 ,3,郑彩杏 ,金 梦 ,范元硕 ,李诚均 ,颜艳艳
(1.湖南中医药大学中医诊断研究所,湖南 长沙 410208;2.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410007;3.湖南中医药大学数字中医药协同创新中心,湖南 长沙 410208)
健脾补土组方对体外神经元低氧/复氧后PI3K、Akt、Caspase-3表达的影响
陈昱文1,2,李 花1,2,3*,刘旺华1,2,3,周小青1,2,3,郑彩杏1,2,金 梦1,2,范元硕1,2,李诚均1,2,颜艳艳1,2
(1.湖南中医药大学中医诊断研究所,湖南 长沙 410208;2.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410007;3.湖南中医药大学数字中医药协同创新中心,湖南 长沙 410208)
目的观察健脾补土组方对新生SD鼠神经元体外培养低氧/复氧后的凋亡情况以及PI3K、Akt、Caspase-3表达的影响,探讨其减少神经元凋亡的作用机制。方法原代分离培养新生SD鼠神经元,随机分为正常血清对照组、低氧模型组、神经生长因子组、健脾补土组。将标本低氧诱导24h,再复氧培养4h进行造模。用流式细胞术检测神经元凋亡情况,RT-qPCR法检测 PI3K、Akt、caspase-3mRNA的表达,免疫细胞化学法和Western blot法检测PI3K、Akt、caspase-3蛋白的表达。结果与正常对照组相比,低氧模型组神经元凋亡率显著增加,PI3K、Akt mRNA与蛋白表达显著减少,Caspase-3mRNA与蛋白表达显著增加;与低氧模型组比较,神经生长因子组、健脾补土组神经元凋亡率均显著减少,PI3K、Akt mRNA及蛋白表达显著增强,Caspase-3mRNA及蛋白表达显著较少(P<0.01);与神经生长因子组比较,健脾补土组神经元凋亡率显著减少,PI3K、Akt mRNA及蛋白表达显著增加,Caspase-3mRNA及蛋白表达显著降低。结论健脾补土组方能减少脑缺血后神经元的凋亡,其作用机制可能与其通过上调PI3K和Akt的表达水平,最终抑制在细胞凋亡中起关键作用的因子Caspase-3的表达有关。
健脾补土;神经元;凋亡;磷脂酰肌醇-3激酶;蛋白激酶-B;半胱天冬酶-3
缺血性脑卒中是严重危害当代人类健康的常见病与多发病之一,其发病后的高致残率与脑缺血后发生神经细胞凋亡有紧密联系[1]。对于脑缺血后半暗带区的血供的及时恢复,阻止神经元进一步凋亡,最大程度上促进脑功能的恢复,是当前治疗脑缺血疾病急需解决的问题。研究表明,在涉及细胞凋亡机制的众多信号转导通路中,磷脂酰肌醇3激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶(Akt)是其中最为重要的信号通路之一,可通过调控凋亡蛋白和凋亡基因来实现对细胞凋亡的抑制[2],在细胞生长、增殖、分化过程中起到极其关键的作用。本课题组通过研究发现中医“脾土”功能与细胞外基质的功能有诸多相似之处[3],提出了以健脾补土法治疗中风后遗症的观点,并通过前期研究发现健脾补土组方对脑缺血损伤患者的认知能力和智力状态有显著改善[4],能通过抑制NF-κB炎性信号通路的激活而抗脑缺血/再灌注损伤减少神经元凋亡[5],且能够抑制MMP-2表达,保护血脑屏障[6]。本实验在此基础之上进一步探讨健脾补土方抗脑缺血损伤、减少神经元凋亡的作用机制。本研究通过观察新生SD鼠体外神经元经低氧/复氧损伤后健脾补土组方对其凋亡情况以及PI3K、Akt、Caspase-3表达变化的影响,探讨健脾补土法抗脑缺血损伤作用及机制。
1 材料
1.1 实验动物
用于神经元细胞原代培养用鼠选用20只1~3d出生的SPF级SD鼠,雌雄各半。另选用200~250g SPF级大鼠20只,用于含药血清的制备,雌雄各半。老鼠均购于湖南斯莱克景达实验动物有限公司,实验单位使用许可证编号:SYXK(湘)2013-0005;许可证号:SCXK(湘)2011-0003。
1.2 实验药物
健脾补土组方以健脾益气经典名方四君子汤为基础加入黄芪、山药、薏苡仁组成。处方组成:人参 15g,白术 12g,茯苓 10g,黄芪 15g,山药 12g,薏苡仁12g,炙甘草6g。均购自湖南中医药大学第一附属医院。
1.3 主要试剂与仪器
Neuralbasal培养基(Gibico公司)、木瓜蛋白酶(Sigma公司)、B27生长因子(Gibico 公司)、神经生长因子(NGF)(Peprotech 公司)、逆转录试剂盒、TRIZOL总RNA提取试剂、SYBGREEN PCR Mix、通用基因组DNA提取试剂盒 (康为世纪)、EDTA(Sigma公司)、DEPC、Tris(Sigma 公司)、引物(上海生工)、Annexin V-FITC细胞凋亡检测试剂盒(南京凯基)、神经元特异性烯醇化酶抗体(NSE,型号:10149-1-AP)、DAB试剂盒 (中杉金桥)、TGL-16台式冷冻离心机 (湘仪)、DYCZ-40A转膜仪 (北京六一)、DH-160I直热式二氧化碳培养箱 (上海三藤仪器)、7220-01荧光定量RCP仪 (Thermo公司)、MB-530酶标仪(汇松)、流式细胞仪(BD公司)、BA210T显微镜(Motic公司)。
2 方法
2.1 受试药物制备
取健脾补土组方饮片加水适量,浸泡2h,用水煎煮。首煎用6倍水,水沸后文火煎煮1.5h;第二次用3倍水,水沸后文火煎煮1h。两次水煎液混合,浓缩至浓度为1g/mL的生药,放于4℃冰箱冷藏备用[7]。
2.2 含药血清制备
SD大鼠适应性喂养3d后予以健脾补土组方药液(1g/mL)灌胃,给药量 14.8g/kg,2 次/d,连续给药3d,并于末次灌胃后2h经腹主动脉采血,大鼠采血完后,将采血管置于离心机内以3 000r/min的速度离心15min。离心完毕后用移液枪将含药血清混合后一起移入50mL离心管内,放在预热好的水浴锅内56℃水浴灭活30min,然后血清过0.2 μm一次性滤器过滤,用2mL冻存管分装后用封口胶封口,标记好后冻存于-80℃冰箱备用[8]。
2.3 原代细胞培养
在超净工作台下分离新生SD鼠海马组织,剪碎后将组织碎片装入5mL小玻璃瓶中。向瓶中加入终浓度为5mL浓度为2mg/mL的木瓜蛋白酶,混匀,在37°C温度下消化10min,每5min颠倒离心管1次。加入含10%胎牛血清的DMEM/F12培养基终止消化,离心机1 000r/min离心10min,弃去上清液,重复离心1次。加入DMEM/F12培养液,用巴氏管轻轻吹打成细胞悬液,过200目滤网后种植于多聚赖氨酸(0.1mg/mL)包被的6孔培养板中,每孔2mL,接种密度为4×105cell/mL,于37°C培养箱中培养。第二天全部换成无血清培养液 (98%Neurobasal Media,2%B27 Supplement,0.5/上 Glutamine solution;1mMHepes),之后每 2~3 天半量换液 1 次[9]。
2.4 细胞化学染色鉴定
培养第10天后,取出细胞爬片用于免疫细胞化学鉴定:PBS液清洗爬片2×3次,将爬片用4%多聚甲醛固定30min,PBS液冲洗5min×3次,加入3%H2O2,室温10min以灭活内源性酶,PBS液冲洗3min×3次;孵育一抗:滴加适当稀释的一抗 (1∶100),4 ℃过夜,PBS 液冲洗 5min×3次;孵育二抗:滴加50~100 μL抗兔IgG抗体-HRP多聚体,37℃孵育 30min,PBS液冲洗 5min×3次;DAB显色:滴加预制好的显色剂DAB工作液50~100 μL,于室温下孵育1~5min,在镜下观察控制反应时间,后用蒸馏水洗涤;苏木素复染5~10min,蒸馏水冲洗,PBS液返蓝;各级酒精 (60%~100%)脱水,每级5min。取出后置于二甲苯10min,2次,中性树胶封片、显微镜观察。
2.5 含药血清的合理化浓度摸索
取新鲜的神经元细胞,将细胞浓度调为5×107/L接种于96孔板中,用含10%胎牛血清的DMEM培养24h后,再用DMEM无血清培养基培养24h。然后将细胞分成各实验组,各实验组加入不同浓度含药血清(1%、5%、10%、15%、20%),用含 10%胎牛血清的DMEM培养24h后,以MTT法测定A570 nm吸光度,测出不同含药血清浓度对细胞增殖的抑制率,摸索出含药血清的无毒性浓度。以对细胞生长抑制率<20%的浓度作为无细胞毒性的浓度,最后确定以最大无毒性浓度(15%)作为实验工作浓度[10]。
2.6 分组与造模
将培养好的神经元细胞分成四组:正常血清对照组(简称正常对照组)、正常血清+低氧(10%O2)(简称低氧模型组)、低氧+正常血清+神经生长因子(0.01mg/mL)(简称神经生长因子组)、低氧+健脾补土组方含药血清组(简称健脾补土组)。将标本放入37℃三气培养箱中,低氧诱导24h后,恢复正常条件培养4h。
2.7 指标检测
2.7.1 流式细胞术检测不同处理对细胞凋亡的影响按照AnnexinⅤ-FITC/PI双标法,先用PBS液洗涤细胞后,用双蒸水稀释好的结合缓冲液重悬细胞,并调整细胞浓度为(2-5)×105/mL。再取 200 μL 细胞悬液,加入 5 μL Annexin V-FITC(20 μg/mL)混匀后,加入 5 μL Propidium Iodide,混匀,室温、避光、反应 5~15min。最后再用 PBS液洗涤细胞,以190 μL稀释的结合缓冲液重悬, 加 10 μL 20 μg/mLPI。用流式细胞仪检测,激发波长Ex=488nm;发射波长 Em=530nm[11]。
2.7.2 RT-qPCR 法检测 PI3K、Akt、Caspase-3mRNA的表达 按照TRIZOL总RNA提取试剂操作,提取神经元的总RNA,并于紫外分光光度计检测其浓度,将总RNA经琼脂糖凝胶电泳鉴定,可见明显的28s、18s两条区带,表明其完整性。在已调制好的 20mL反应液中加入2 μL的总RNA,混合均匀后进行反转录。应用SYBR法进行RT-qPCR检测,利用Primer 5.0 设计引物,各自的引物依次为:PI3K-F:CACTGGTAGACGATGACGAGGAT,PI3K-R:TTGATGACGCAATGTTTGACTT,扩增长度 196bp;Akt-F:TACCTG AAGCTACTGGGCAAGGG,Akt-R:CGGTCGTGGG TCTGGAAT GAG,扩增长度212bp;Caspase3-F:GGAAC GAACGGACCTGTG,Caspase3-R:GGGTGCGGTAGAG TAAGCA,扩增长度 219bp。采用 2-ΔΔCt法,以 2-ΔΔCt值反映目的基因表达水平,其数值越大,表达越强[12]。
2.7.3 免疫细胞化学法和Western blot法检测PI3K、Akt、Caspase-3蛋白的表达 取出细胞爬片,PBS清洗2-3次,将爬片用4%多聚甲醛固定30min,PBS冲洗5min×3次,加入3%H2O2,室温10min以灭活内源性酶。PBS冲洗3min×3次;加入适量按1∶200稀释的一抗,放入4℃冰箱中过夜。取出标本,用PBS缓冲液冲洗3min×3次。加入山羊抗兔 IgG(二抗),室温下孵育15min。无菌PBS缓冲液冲洗后进行DAB显色约10min。苏木素复染5~10min,蒸馏水冲洗,无菌PBS缓冲液返蓝。各级酒精 (60%~100%)脱水,每级5min。取出后置于二甲苯10min,2次。加入适量树脂胶进行封片,镜检[13]。每组每个爬片选取5个400倍视野进行拍照。应用Image-Pro Plus 6.0软件选取相同的棕黄色细胞作为判断所有照片阳性细胞的共同参照标准,然后对每张照片进行分析,计算出每张照片阳性细胞的积分光密度值(integrated optical density,IOD)。
Western blot法经蛋白质抽提剂提取神经元蛋白,行SDS-PAGE电泳后进行转膜,将膜浸入用TBST配制好的5%脱脂奶粉后,放置于室温下1h。将一抗用封闭液稀释(1∶200),将膜与一抗一起孵育,在4℃下过夜。孵育结束后,用TBS-T清洗3次,每次15min。用封闭液稀释HRP标记的二抗(稀释比例1∶4 000),将稀释后的二抗与膜共同孵育 45~60min。孵育结束后,TBS-T清洗15min×3次。使用ECL化学发光液将膜孵育3min,用保鲜膜将膜包裹杂交膜,在暗盒内与X胶片曝光数秒至数分钟,显影冲洗。最后用 AlphaEase FC软件分析自身灰度值,以目的蛋白条带灰度与管家蛋白β-actin条带灰度的比值表示蛋白表达水平。
2.8 统计学处理
3 结果
3.1 免疫细胞化学法细胞鉴定结果
NES免疫细胞化学法染色(DAB染色),胞浆和突起被染成棕褐色而胞核为蓝色的为阳性细胞,整个细胞不被染色的为阴性细胞,在高倍镜下随机选取5个视野中阳性神经元的数目占总细胞的比例为神经元纯度,经鉴定神经元纯度达96%左右。见图1。
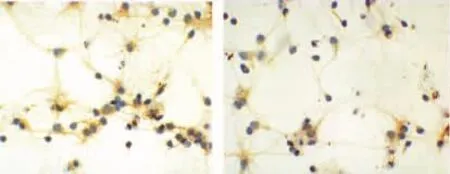
图1 神经细胞鉴定光镜图(免疫组化,×400)
3.2 健脾补土组方对神经元凋亡的影响
AnnexinⅤ/PI流式细胞分析检测,与正常对照组相比,低氧模型组神经元凋亡率显著增加,差异有统计学意义(P<0.01);与低氧模型组比较,神经生长因子组、健脾补土组神经元凋亡率均显著减少,差异有统计学意义(P<0.01);与神经生长因子组比较,健脾补土组神经元凋亡率显著减少,差异有统计学意义(P<0.01)。见表1。
表1 各组神经元细胞凋亡比较 (±s,%)

表1 各组神经元细胞凋亡比较 (±s,%)
注:与对照组比较,**P<0.01;与低氧模型组比较,△△P<0.01;与神经生长因子组比较,##P<0.01。
组别正常对照组低氧模型组神经生长因子组(0.01mg/mL)健脾补土组(1g/mL)凋亡率6.23±0.63 53.22±4.32**31.35±2.33**△△13.22±1.95**△△##F 值 29.87n 5 5 5 5
3.3 健脾补土组方对神经元细胞 PI3K、Akt、Caspase-3mRNA表达的影响
RT-qPCR检测结果显示,与正常对照组比较,低氧模型组PI3K、Akt mRNA表达显著减少,Caspase-3mRNA表达显著增加,差异均有统计学意义(P<0.01)。与低氧模型组比较,神经生长因子组与健脾补土组PI3K、Akt mRNA表达均显著增加,Caspase-3mRNA表达显著减少,差异均有统计学意义(P<0.01)。与神经生长因子组比较,健脾补土组PI3K、Akt mRNA表达均显著增高,Caspase-3mRNA表达显著降低,差异有统计学意义(P<0.01)。见表2。
表2 各组神经元PI3K、Akt、Caspase-3mRNA的表达比较(±s,2-△△ct值,n=5)
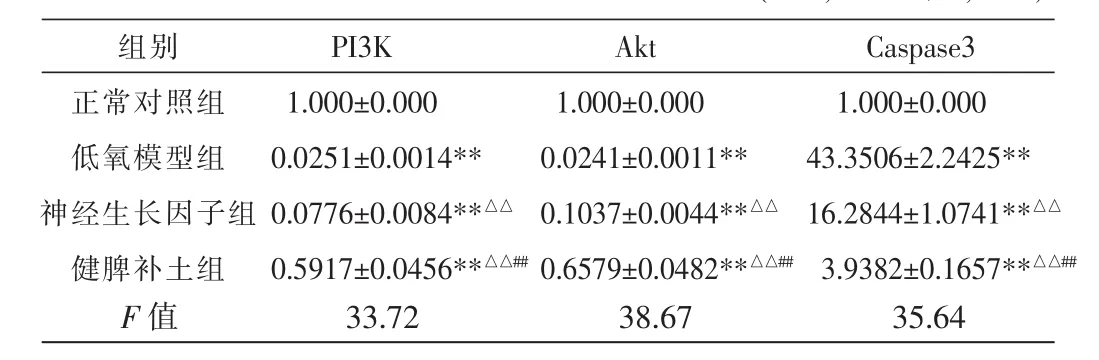
表2 各组神经元PI3K、Akt、Caspase-3mRNA的表达比较(±s,2-△△ct值,n=5)
注:与正常对照组比较,**P<0.01;与低氧模型组比较,△△P<0.01;与神经生长因子组比较,##P<0.01。
组别正常对照组低氧模型组神经生长因子组健脾补土组Caspase3 1.000±0.000 43.3506±2.2425**16.2844±1.0741**△△3.9382±0.1657**△△##F 值 33.72 38.67 35.64 PI3K 1.000±0.000 0.0251±0.0014**0.0776±0.0084**△△0.5917±0.0456**△△##Akt 1.000±0.000 0.0241±0.0011**0.1037±0.0044**△△0.6579±0.0482**△△##
3.4 健脾补土组方对神经元细胞 PI3K、Akt、Caspase-3蛋白表达的影响
免疫细胞化学法显示,正常血清对照组中神经元细胞核完整,细胞突起明显,未见明显细胞浆黄染。低氧模型组中神经元细胞核皱缩、突起回缩,细胞浆黄染较多。PI3K与Akt蛋白阳性表达在对照组中显示数目最多,在健脾补土组与神经生长因子组中表达逐渐较少,在低氧模型组中表达数目最少;Caspase-3、Caspase-8蛋白阳性表达在低氧模型组中显示数目最多,在神经生长因子组与健脾补土组中表达数目逐渐减少,在对照组中已基本未见阳性表达(见图2-4)。统计分析结果:与正常血清对照组比较,低氧模型组神经元PI3K、Akt蛋白表达显著减少,Caspase-3蛋白表达显著增加,差异均有统计学意义(P<0.01);与低氧模型组比较,神经生长因子组和健脾补土组神经元PI3K、Akt蛋白表达显著增加,Caspase-3蛋白表达显著较少,差异均有统计学意义(P<0.01);与健脾补土组比较,神经生长因子组神经元PI3K、Akt蛋白表达均显著减少,差异有统计学意义 (P<0.01),Caspase-3 蛋白表达明显增加,差异有统计学意义(P<0.05)。见表3。
表3 各组神经元PI3K、Akt、Caspase-3蛋白表达比较(±s,IOD 值,n=5)
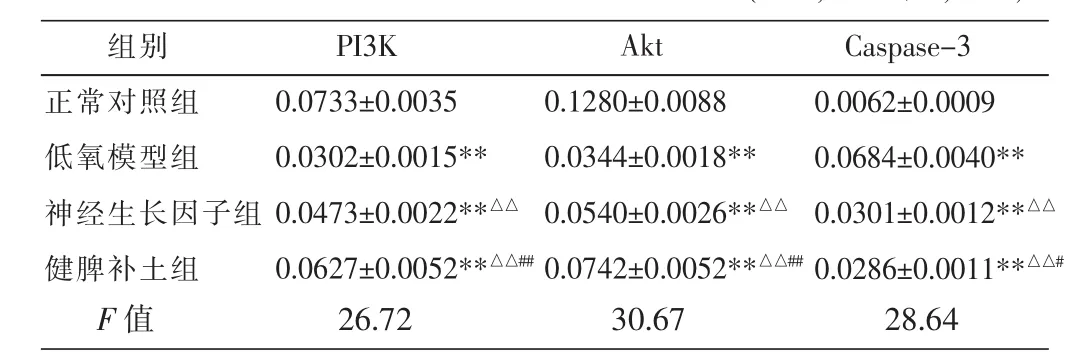
表3 各组神经元PI3K、Akt、Caspase-3蛋白表达比较(±s,IOD 值,n=5)
注:与正常对照组比较,**P<0.01;与低氧模型组比较,△△P<0.01;与神经生长因子组比较,#P<0.01,##P<0.05。
组别正常对照组低氧模型组神经生长因子组健脾补土组Caspase-3 0.0062±0.0009 0.0684±0.0040**0.0301±0.0012**△△0.0286±0.0011**△△#F 值 26.72 30.67 28.64 PI3K 0.0733±0.0035 0.0302±0.0015**0.0473±0.0022**△△0.0627±0.0052**△△##Akt 0.1280±0.0088 0.0344±0.0018**0.0540±0.0026**△△0.0742±0.0052**△△##
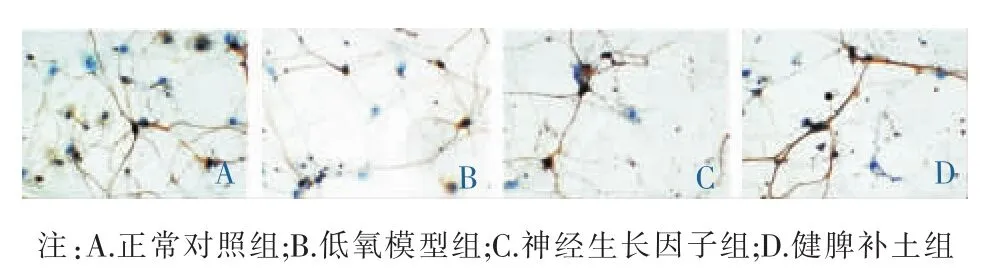
图2 各组中神经元PI3K蛋白表达(免疫细胞化学法,×400)
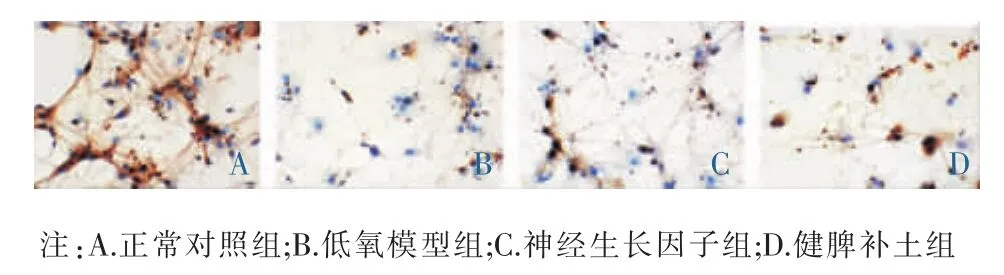
图3 各组中神经元Akt蛋白表达的比较(免疫细胞化学法,×400)

图4 各组中神经元Caspase-3蛋白表达的比较(免疫细胞化学法,×400)
Western Blot法检测结果显示:与正常对照组比较,低氧模型组神经元PI3K、Akt蛋白表达显著减少,Caspase-3蛋白表达显著增加,差异均有统计学意义(P<0.01);与低氧模型组比较,神经生长因子组和健脾补土组神经元PI3K、Akt蛋白表达显著增加,Caspase-3蛋白表达显著较少,差异均有统计学意义(P<0.01);与神经生长因子组比较,健脾补土组神经元PI3K、Akt蛋白表达均显著增加,Caspase-3蛋白表达显著减少,差异有统计学意义(P<0.01)。见表4、图5。
表4 各组神经元 PI3K、Akt、Caspase-3 蛋白表达比较 (±s,n=5)
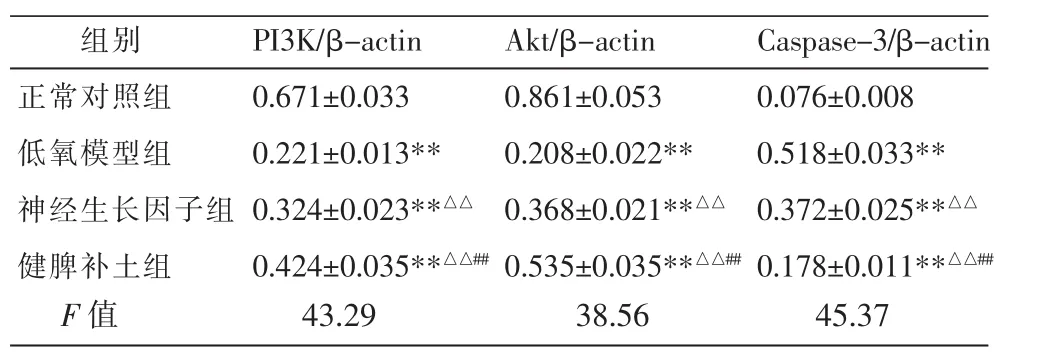
表4 各组神经元 PI3K、Akt、Caspase-3 蛋白表达比较 (±s,n=5)
注:与正常対照组比较,**P<0.01;与低氧模型组比较,△△P<0.01;与神经生长因子组比较,##P<0.01。
组别正常对照组低氧模型组神经生长因子组健脾补土组Caspase-3/β-actin 0.076±0.008 0.518±0.033**0.372±0.025**△△0.178±0.011**△△##F 值 43.29 38.56 45.37 PI3K/β-actin 0.671±0.033 0.221±0.013**0.324±0.023**△△0.424±0.035**△△##Akt/β-actin 0.861±0.053 0.208±0.022**0.368±0.021**△△0.535±0.035**△△##
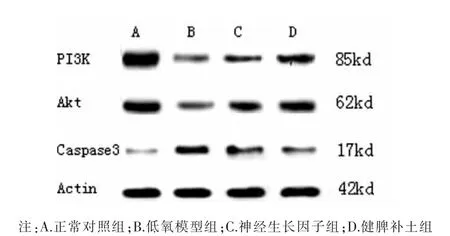
图5 各组神经元PI3K、Akt、Caspase-3蛋白表达电泳图
4 讨论
脑缺血再灌注导致脑损伤后,缺血中心区神经元以坏死为主,半暗带区神经元则以凋亡为主。所以抑制半暗带区神经元凋亡在改善缺血再灌注损伤中起到了重要作用[14]。脑缺血再灌注的损伤所涉及的作用机制较为复杂,而凋亡细胞内基因的表达对神经元凋亡具有更直接、更重要的作用[15]。脑缺血再灌注损伤后,可通过多条相应的信号转导通路而导致细胞凋亡。现代研究认为,PI3-K/Akt通路是重要的细胞存活信号通路之一,可通过对其信号通路的激活从而抑制神经细胞的凋亡,最终发挥对脑的保护作用[16-17]。
PI3K/Akt信号通路存在于大多数细胞之中,对于细胞的增殖、迁移、分化以及凋亡起到了重要的调节作用[18]。P13K是由调节亚基p85和催化亚基p110所组成的异二聚体,其主要功能是激活Akt。Akt是一种丝氨酸/苏氨酸蛋白激酶,在静息状态下,Akt位于细胞质内,由Aktl、Akt2和Akt3三个异构体组成。Akt是非常重要的抗凋亡调节因子,能介导多种生物学效应。Akt的活化需要Serl24、Thr450、Thr308和Ser473等4个位点的磷酸化。研究发现PI3-K有多种下游效应分子,而Akt为PI3-K直接的下游作用靶点,PI3-K被激活后进一步激活Akt及其下游的信号的级联反应,参与细胞的生长、分化和存活[19]。PI3K的激活方式有两种,一种是与具有磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用,使二聚体构象发生改变从而被激活;另一种是通过Ras和p110直接结合致使PI3K发生活化。活化的PI3K产生第二信使3,4,5-三磷酸磷脂肌醇PIP3,PIP3与信号蛋白Akt和磷酸肌醇依赖激酶(PDK1)结合,从而使Akt的蛋白结构发生改变,致使细胞膜上的PDK-1和PDK-2从而发生蛋白磷酸化,最终导致Akt的活化。活化的Akt可通过磷酸化从而激活或抑制其下游的作用底物如 Caspase-9、Bad、NF-κB、mTOR等改变,从而对细胞的增殖、分化、凋亡以及迁移进行调节。Caspase-3是参与细胞凋亡的核心环节,是Akt下游线粒体凋亡信号通路的重要组成部分,在细胞凋亡过程中,由于凋亡启动蛋白信号的作用,Caspase-8,Caspase-9等启动型基因被激活,然后通过级联作用最终激活执行型因子Caspase-3。Caspase-3被激活后可裂解其底物蛋白激酶C,使损伤的DNA无法进行修复。此外,活化的Caspase-3还可直接诱导线粒体凋亡途径,加速线粒体功能障碍和细胞色素C释放,最终引起细胞凋亡[20]。研究表明[21],在脑缺血再灌注期Caspase-3的表达早于细胞凋亡,且表达持续时间长,是检测缺血再灌注凋亡的敏感指标。Jover-Mengual等研究发现,全脑缺血后立即注射外源性雌激素,可以通过激活PI3K/Akt通路,从而抑制Caspase-3的活性,发挥抗细胞凋亡作用,改善缺血敏感区海马CA1区神经元损害情况[22]。
脑缺血卒中属中医学“中风”范畴,目前普遍认为中风的病位在心脑,病因病机多是在内伤积损的前提下,又因感受外邪、劳损过度、饮食失节或情志不遂等触发,而令脑脉痹阻或血溢脑脉之外所致。中风发生后患者多存在气血亏虚,然脾为人体后天之本,气血生化之源,因此脾胃与中风有着密切联系。而综观历代有关中风病的文献记载,多重视对肝肾的论述,而忽略了脾胃。健脾补土组方拟用四君子汤为基本方,方中人参、白术、茯苓、甘草四药配伍,共奏益气健脾之效。由于脾失健运,往往多生痰湿,且现代人多喜食肥甘厚味,临床上常见脾虚生湿的证候,故另加入黄芪、山药与薏苡仁三药共用以增强补气祛湿之功。现代药理学证明,方中人参[23]、白术[24]、黄芪[25]、薏苡仁[26]及其提取物等均能减少神经细胞的凋亡,改善脑缺血损伤。
本研究通过对体外神经元进行低氧/复氧损伤造模,模拟脑缺血再灌注损伤模型,借此观察健脾补土组方对其神经元凋亡情况以及PI3K、Akt、Caspase-3mRNA及蛋白表达的影响。结果显示,与正常血清对照组比较,低氧模型组神经元凋亡率显著增加,PI3K、Akt mRNA及蛋白表达显著减少,Caspase-3mRNA及蛋白表达显著增加,提示当神经元遭受缺氧损伤时,PI3K、Akt的表达被抑制,而Caspase-3的表达增强。与低氧模型组比较,健脾补土组神经元凋亡率显著降低,PI3K、Akt mRNA及蛋白表达显著增加,二者分子水平及其趋势基本一致,Caspase-3mRNA及蛋白表达显著较少,提示健脾补土组方能在一定程度上抑制神经元的凋亡从而改善脑缺血损伤,其作用可能与通过上调PI3K和Akt的表达,最终抑制其下游对细胞凋亡起关键作用的基因Caspase-3的表达有关;进一步验证了神经细胞的凋亡与PI3K、Akt的表达呈负相关,与Caspase-3的表达呈正相关,与前人研究结论一致。本实验中健脾补土组表达显著优于神经生长因子组,可能与中药复方中多种药物活性成分作用的叠加或协同,并且可通过多途径、多靶点干预脑缺血发生机制有关。因本实验为体外水平研究,干扰条件较少,而健脾补土组方能否通过血脑屏障等其它体内干扰因素,同样影响此信号通路及相关因子的表达,有待进一步进行体内水平的研究。此外,引起脑缺血后神经元细胞凋亡发生的是一个多条信号通路串联交叉形成的复杂信号网络,健脾补土组方对其他相关通路的影响也尚待深入研究。
综上所述,健脾补土组方能减少脑缺血后神经元的凋亡,其作用机制可能与其通过激活PI3K/Akt通路,从而上调PI3K和Akt的表达,最终抑制在细胞凋亡中起关键执行作用的因子Caspase-3的表达有关。
[1]何 敏,韩江全,倪白云,等.PI3K/Akt信号转导通路与脑缺血后细胞凋亡[J].国际脑血管病杂志,2010,18(7):553-557.
[2]谢 飞,魏 珂,闵 苏,等.神经生长因子对H9c2心肌细胞缺氧/复氧后凋亡的保护作用及其机制[J].中国药理学通报,2014,30(4):506-510.
[3]刘旺华,李 花,周小青.论神经细胞外基质与中医脾土相关及其对脑缺血保护的启示[J].中国中医药信息杂志,2010,17(3):5-6.
[4]李 花,刘旺华,廖亮英,等.健脾补土方药治疗缺血性脑卒中后遗症疗效观察[J].中国中医药信息杂志,2010,17(3):73-74.
[5]付小金,刘旺华,李 花,等.健脾补土方对脑缺血/再灌注损伤大鼠NF-κB和IκBα蛋白表达水平的影响 [J].湖南中医药大学学报,2015,35(3):5-8.
[6]李 花,刘旺华,周小青,等.健脾补土法对脑缺血再灌注大鼠脑组织MMP-2的表达及血脑屏障通透性的影响[J].湖南中医杂志,2013,29(2):115-116.
[7]辛曙丹,姜建民,杨明华,等.怡心健脑软胶囊的质量控制[J].中医药导报,2011,30(6):780-784.
[8]张 宏,王旭昀,刘美奇,等.中药含药血清实验动物灌胃给药剂量探讨[J].吉林中医药,2015,35(6):623-625.
[9]Beaudoin GM,Lee SH,singh D,et al.Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex[J].Nat Protoc,2012,7(9):1741-1754.
[10]高 丽,聂中标,柴 智,等.归脾汤含药血清对骨髓细胞增殖的影响[J].光明中医,2011,26(5):913-915.
[11]焦志军,王文红,杨 友.AnnexinⅤ-FITC/PI双标记流式细胞术检测结直肠癌细胞凋亡[J].江苏大学学报(医学版),2005,15(2):97-99.
[12]梁祥森.实时荧光定量PCR联合检测非小细胞肺癌中MTA1和E-cad基因的表达及意义[D].南宁:广西医科大学,2012.
[13]刘喜波,孙爱静,王 宁.免疫细胞化学检测50例乳腺癌ER、PR 表达的意义[J].Journal of Oncology,2010,16(7):584-585.
[14]Graham SH,Chen J.Programmed Cell Death in Cerebral Ischemia[J].Journal of Cerebral Blood Flow&Metabolism Official Journal of the International Society of Cerebral Blood Flow&Metabolism,2001,21(2):99.
[15]Ovize M,Baxter GF,Lisa FD,et al.PostconditIoning and protection from reperfusion injury:where do we stand?[J].Organization Studies,2010,36(12):1675-1692.
[16]Kim AH,Khursigara G,Sun X,el al.Akt phosphorylates and negatively regulates apoptosis signal-regulating kinase 1[J].Mol cell Biol,2001,21:893-901.
[17]高洋洋,赵志英.PI3K/Akt信号通路及神经损伤的研究进展[J].医学综述,2017,23(16):3121-3125.
[18]仇志富,颜 勇,吴晓光.PI3K/Akt信号转导通路与神经细胞凋亡研究进展[J].中风与神经疾病,2015,32(10):952-953.
[19]杨冀萍,刘怀军,王藏海,等.半胱氨酸蛋白酶 3在局灶性脑缺血再灌注损伤皮质中的动态时空表达 [J].中国临床康复,2006,10(34):64-66.
[20]闫凤霞,钱 涛,高维娟,等.黄芪注射液抑制缺氧缺糖/复氧复糖大鼠海马神经元 Caspase-3 表达[J].解剖学报,2011,42(1):14-21.
[21]刘旺华,李 花,周小青.论神经细胞外基质与中医脾土相关及其对脑缺血保护的启示[J].中国中医药信息杂志,2010,17(3):5-6.
[22]Jover-Mengual T.Acute estradiol protects CA1 neurons from ischemia-induced apoptotic cell death via the PI3K/Akt pathway[J].Brain Res,2010,19(5):1-12.
[23]刘馨雨.人参皂苷Rd通过激活PI3K/Akt通路促进脑缺血/再灌注大鼠神经发生的作用[D].北京:北京中医药大学,2005.
[24]王光伟,丰 昀,邱细敏.白术多糖对大鼠创伤性脑损伤后脑水肿的影响及其机制探讨[J].中草药,2009,40(6):948-950.
[25]赵燕玲,曲友直,王宗仁.黄芪对脑缺血-再灌注后神经细胞凋亡及凋亡相关基因表达的影响[J].中国中西医结合急救杂志,2005,12(6):341-343.
[26]高 靓,杜元灏,李中正,等.薏苡仁提取液静脉注射对脑缺血大鼠存活率、存活时间及脑水肿影响的实验研究[J].天津中医药,2011,28(6):500-502.
Effect of Jianpi Butu Formula on the Expression of PI3K,Akt,Caspase 3and Apoptosis in Neurons in Vitro Induced by Hypoxia/Reoxygenation
CHEN Yuwen1,2,LI Hua1,2,3*,LIU Wanghua1,2,3,ZHOU Xiaoqing1,2,3,ZHENG Caixing1,2,JIN Meng1,2,FAN Yuanshuo1,2,LI Chengjun1,2,YAN Yanyan1,2
(1.Institute of Diagnostics Traditional Chinese Medicine,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.The Key Laboratory of Diagnostics of Chinese Medicine in Hunan Province,Hunan University of Chinese Medicine,Changsha,Hunan 410007,China;3.Collaborative Center for Research and Innovation of Digital Chinese Medicine,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
ObjectiveTo observe the effect of Jianpi Butu (tonifying spleen)formula on apoptosis and expression of PI3K,Akt and Caspase3 in neonatal SD neurons cultured in vitro induced by hypoxia/reoxygenation,to explore the mechanism of reducing neuronal apoptosis.MethodsPrimary cultured neurons of newborn SD rats were randomly divided into normal serum control group,hypoxia model group,NGF group,Jianpi Butu formula group.Specimens to modeling were induced by hypoxia for Mei,reoxygenation for 4h.The neuronal apoptosis was induced by flow cytometry.The expression of PI3K,Akt and Caspase3 mRNA was determined by qPCR.The expression of PI3K,Akt and Caspase3 protein was detected by immunocytochemistry and Western blot.ResultsCompared with normalcontrolgroup,the rate ofneuronalapoptosis in hypoxia model group increased significantly,the expression of Akt mRNA and protein reduced obviously,and the expression of Caspase3 protein and mRNA increased significantly.Compared with the hypoxia model group,the rate of neuronal apoptosis in NGF group,Jianpi Butu formula group decreased significantly,and the expression of Akt mRNA and protein increased obviously,and the expression of Caspase3 mRNA and protein decreased significantly (P <0.01).Compared with the nerve growth factor group,the neuronal apoptosis rate in Jianpi Butu group decreased significantly,the expression of Akt mRNA and protein increased obviously,and the expression of Caspase3 mRNA and protein decreased significantly.ConclusionJianpi Butu formula could reduce the apoptosis of neuron after cerebral ischemia.Its mechanism may be related to the up-regulated expression of PI3K and Akt,the ultimate expression of inhibitory factor Caspase3 plays a key role in cell apoptosis.
tonifying spleen;neurons;apoptosis;PI3K;FAK;Caspase3
本文引用:陈昱文,李 花,刘旺华,周小青,郑彩杏,金 梦,范元硕,李诚均,颜艳艳.健脾补土组方对体外神经元低氧/复氧后PI3K、Akt、Caspase-3表达的影响[J].湖南中医药大学学报,2017,37(10):1063-1069.
R285.5;R743
A
10.3969/j.issn.1674-070X.2017.010.004
2016-12-25
国家自然科学基金(81202632、81373702、81473567),教育部博士点基金(20124323120003),湖南省自然科学基金(13JJ3097),湖南省教育厅科研项目(14B134),湖南省高校创新平台开放基金(15K092),湖南中医药大学中诊开放基金(2015ZYZD30),湖南省研究生科研创新项目(CX2016B368)。
陈昱文,在读硕士研究生,研究方向:中医心脑血管病证治研究。
*李 花,女,副教授,E-mail:1041584415@qq.com。
(本文编辑 杨 瑛)
