地黄饮子含药血清对大鼠BMSCs与NSCs共培养影响转归的研究
2017-11-07武博文武密山王慧娜郭金栋高维娟韩红伟师旭亮
武博文 ,武密山 ,2*,王慧娜 ,郭金栋 ,高维娟 ,2,王 茹 ,韩红伟 ,师旭亮
(1.河北中医学院,河北 石家庄 050200;2.河北省心脑血管病中医药防治重点实验室,河北 石家庄 050091;3.承德医学院,河北 承德 067000)
地黄饮子含药血清对大鼠BMSCs与NSCs共培养影响转归的研究
武博文1,武密山1,2*,王慧娜3,郭金栋1,高维娟1,2,王 茹1,韩红伟1,师旭亮1
(1.河北中医学院,河北 石家庄 050200;2.河北省心脑血管病中医药防治重点实验室,河北 石家庄 050091;3.承德医学院,河北 承德 067000)
目的探讨以升麻为药引子的地黄饮子(CRD)含药血清对经过骨髓间充质干细胞(BMSCs)共培养后的大鼠神经干细胞(NSCs)的存活和分化的影响。方法 建立BMSCs与NSCs共培养模型,在共培养体系中加入CRD含药血清,从培养第3天开始分别进行5-溴-2-脱氧尿嘧啶(BrdU)和神经元特异性烯醇化酶(NSE)、胶质细胞纤维酸性蛋白(GFAP)、神经元特异性标志物微管相关蛋白2(MAP-2)、少突胶质细胞特异性表达蛋白标志物(MBP)免疫细胞化学双染色。采用流式细胞仪检测NSCs的存活率,利用细胞免疫荧光和Western blot法鉴定NSCs的分化情况,比较NSCs的存活率和分化率,分析CRD含药血清对共培养后NSCs的存活及分化的影响。结果 与生理盐水对照组相比,中、高浓度CRD含药血清在BMSCs与NSCs共培养体系中第7天能显著提高NSCs存活率和NSE、GFAP、MAP-2、MBP活性(P<0.01)。结论 CRD 含药血清在BMSCs与NSCs共培养体系中能促进NSCs有效分化和提高NSCs存活率。
骨髓间充质干细胞;神经干细胞;药引子;地黄饮子;含药血清;神经样细胞
脊髓损伤(spinal cord injury,SCI)是损伤脊髓平面以下的感觉及运动功能丧失的中枢神经系统疾病[1],治疗方法主要通过细胞移植[2]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是理想的种子细胞[3],不仅可向成骨细胞等中胚层细胞定向分化,而且在特定条件下还可向外胚层神经元样细胞、星形胶质样细胞和少突胶质样细胞分化[4]。神经干细胞(neural stem cells,NSCs)有多向分化潜能,能分化为特定的神经细胞[5]。BMSCs与NSCs因其特有的生物学特征成为细胞移植的主要来源[6],其分化受微环境的影响,亦能各自分泌因子,有关将二者共培养的作用机制研究少见报道。前期研究表明,升麻苷能透过血脑屏障,可调节脑缺血兴奋性氨基酸神经递质,对神经元损伤有保护作用[7]。本研究将升麻(Cimicifuga heracleifolia Kom)加入地黄饮子(Rehmannia decoction,RD),制备以升麻为药引子的地黄饮子(简称CRD)含药血清,探索CRD对BMSCs与NSCs共培养中NSCs存活及分化的影响,以期为干细胞移植治疗脑和脊髓损伤提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验药物 地黄饮子来源于宋朝刘河间的《黄帝素问·宣明论方》,药物组成:熟干地黄24g,巴戟天12g,山萸肉12g,石斛12g,肉苁蓉12g,熟附子9g,五味子6g,肉桂6g,白茯苓9g,麦冬12g,石菖蒲 9g,远志 6g,薄荷 5g,生姜 3g,大枣6g。另备升麻12g作为药引子。地黄饮子加上具有“升清阳”作用的升麻,参照文献[8],水提醇沉,制备CRD,每毫升药液含生药5.5g,相当于临床用量的20倍。同法制备RD组,生药含量同CRD组。
1.1.2 主要试剂 DMEM低糖细胞培养液 (美国Hyclone公司);DMEM/F12细胞培养液(美国Gibco公司);小鼠抗兔BrdU单克隆抗体(Sigma公司);兔抗大鼠NSE多克隆抗体(Boster biotechnology公司);小鼠抗大鼠神经胶质细胞酸性纤维蛋白 (glial fibrillaryacidic protein,GFAP)单克隆抗体 (Sigma公司);兔抗小鼠抗微管相关性蛋白2(microtubule-associated protein 2,MAP-2)单克隆抗体 (Sigma公司);兔抗大鼠细胞髓鞘碱性蛋白(myelin basic protein,MBP)单克隆抗体(Sigma公司);FITC 标记的山羊抗小鼠IgG抗体(美国Santa Cruz公司);包被用左旋氏多聚赖氨酸 (Poly-L-Lysine,Sigma公司);AnnexinV-PI凋亡试剂盒(美国BD公司);SABC小鼠/兔免疫组化染色试剂盒、双染试剂盒Histostain TM-DS kit(北京中山生物技术有限公司);ECL蛋白显影液试剂盒、Transwell培养板(美国Corning公司);Hoechst 33442免疫荧光一抗稀释液、免疫荧光二抗稀释液、青/链霉素溶液(×100)、即用型胰蛋白酶细胞消化液、抗荧光淬灭封片液(上海碧云天公司)。
1.1.3 实验动物 清洁级SD大鼠新生3d雌鼠3只,清洁级10月龄雌性SD大鼠18只,体质量(351±12)g,购自河北医科大学实验动物中心,许可证号:SCXK(冀)2013-1-003,合格证号:2016A018。
1.2 方法
1.2.1 大鼠含药血清的制备 18只10月龄SD大鼠,随机分为3组(每组6只):一组为服CRD药组,按1g/kg体质量灌服CRD,每天1次,连续3d。另一组为对照组,灌服同容量的生理盐水。再一组为服RD药组,按1g/kg灌服RD,每天1次,连续3d。第3次灌胃1.5h后,所有大鼠均在乙醚麻醉下自腹主动脉抽取血液,同组合并后离心获取血清,血清在56℃灭活30min,0.22 μm滤膜过滤除菌后,参照本实验室方法,按“通法方案”[8],分别制备 0.1 μmol/L、1μmol/L、10 μmol/L 低、中、高剂量浓度的CRD含药血清和 1 μmol/L剂量浓度的RD含药血清及生理盐水对照血清。
1.2.2 体外分离和培养大鼠BMSCs 参照本实验室全骨髓贴壁法分离BMSCs[9],从大鼠股骨骨髓中分离BMSCs,培养基由含100U/mL青霉素、100U/mL链霉素及10% 胎牛血清的DMEM组成,放置于含5%CO2、37℃恒温培养箱中,每隔2d更换培养液。待细胞铺满培养瓶后,进行细胞传代。每次传代用0.25%胰蛋白酶(0.1mL/cm2)消化2min,细胞传至第3代后,利用流式细胞仪检测分析细胞表面特异性标志物(CD29、CD34、CD90),并结合细胞形态学分析,证实所培养的细胞为大鼠BMSCs。
1.2.3 体外分离和培养大鼠NSCs 取SD新生雌鼠,颈椎脱臼法处死,浸泡在75%酒精中5min后断头,依次分离出全脑组织并将脑膜及残余血管剥除。用剪刀充分剪碎全脑组织,放入1mL即用型胰蛋白酶消化液,放置于恒温培养箱中,5min后加入NSCs培养液终止消化,转移至筛网,过滤为细胞悬液,转至离心管,1 000r/min离心5min。加入完全培养基,放置于含5%CO2、37℃恒温培养箱中,每隔2d采取半量换液法更换培养基1次,培养传代至第3代后,利用免疫细胞化学荧光检测NSCs特异性蛋白 (Nestin巢蛋白),证实所培养细胞为大鼠NSCs。NSCs移植前24h用10mg/L的5-溴-2-脱氧尿嘧啶(BrdU)标记NSCs细胞。
1.2.4 BMSCs-NSCs体外共培养体系的建立 参照本实验室方法[8],对96孔细胞培养板进行改装(图1)。在距培养孔底部2mm的地方打孔(直径 4mm),使相邻的4孔相通,中间加一层0.45 μm的隔膜,隔膜与培养板接触之处用质量分数3%的琼脂糖凝胶密封,防止左右两室的细胞混杂,只有培养上清可以经过隔膜相通。将制备好的培养板置于紫外线灯下照射消毒,备用。
将第3代BMSCs以1×106个/mL的细胞密度接种到 96孔细胞培养板的BMSCs培养室;在培养板的NSCs培养室中加入密度为1×103个/mL的第2代NSCs;加入培养基,漫过通道孔,使两侧培养上清相通;每小时将培养板倾斜1次,促进双侧上清交流,建立大鼠BMSCs与NSCs的共培养体系,共培养12d。
1.2.5 含药血清干预方法与分组 待上述BMSCs-NSCs的共培养体系细胞同步化后,实验共分5组,分别为:对照组(normal,加入与L-CRD组同质量浓度的生理盐水血清),CRD含药血清低剂量组 (LCRD,加入0.1 μmol/L的CRD含药血清)、CRD含药血清中剂量组(M-CRD,加入1 μmol/L的CRD含药血清)、CRD含药血清高剂量组 (H-CRD,加入10 μmol/L的CRD含药血清),RD含药血清组(RD,加入1 μmol/L的RD含药血清),每组均设10个平行培养孔,每孔加入DMEM培养液200 μL,每隔2d换液1次。

图1 BMSCs-NSCs体外共培养体系示意图
1.3 观察指标及检测方法
1.3.1 细胞分化检测 将各组BMSCs-NSCs的共培养体系中NSCs培养室的NSCs,分别于第3天至第12天用质量浓度为0.25g/L胰蛋白酶消化,1×105个/mL接种于经0.1%多聚赖氨酸包被的玻片,各组贴壁培养铺满细胞后,用PBS洗3次,常温下用免疫荧光染色固定液固定20min,0.1%Triton X-100中孵育20min,用正常山羊血清封闭液于37℃恒温培养箱中封闭1h,将免疫荧光一抗抗体MAP-2、MBP、GFAP、NSE 抗体 1∶100 稀释混合均匀后分别依次加入各培养孔内,在4℃冰箱条件下孵育过夜;后加入TRITC 标记山羊抗兔IgG(1∶100)及FITC标记的山羊抗小鼠IgG抗体(1∶100),于37℃恒温培养箱内避光孵育1h;Hoechst染色5min后PBS漂洗3次,每次5min。按照试剂盒说明书步骤分别进行BrdU和神经元特异性烯醇化酶(neuron specific enolase,NSE)、胶质细胞纤维酸性蛋白(GFAP)、神经元特异性标志物微管相关蛋白2(MAP-2)、少突胶质细胞特异性表达蛋白标志物(MBP)免疫荧光化学双染色,以确定神经元细胞、胶质细胞和少突胶质细胞。抗荧光淬灭封片液封片后用免疫荧光显微镜观察。阳性细胞为红色细胞核和蓝色细胞浆,2种特征均具备为双阳性细胞。倒置显微镜下每孔随机读取10个不同的视野,每组40个视野,采样计数平均每个视野阳性细胞数,结果以阳性表达细胞的百分比表示。以培养时间为横轴,细胞数为纵轴,描绘细胞分化曲线。
1.3.2 对NSCs存活率影响测定 将各组BMSCs-NSCs的共培养体系中NSCs培养室的NSCs计数后,取细胞悬液1mL,1 000r/min离心4min,去除上清液后加入100 μL的Binding Buffer,重悬细胞后,加入5 μL经荧光标记的Annexin-V试剂,充分混匀,避光条件下孵育20min,加入5 μL的PI试剂后避光下孵育5min,取400 μL的细胞重悬液,按照AnnexinV-PI细胞凋亡试剂盒步骤,流式细胞仪测定诱导凋亡后的NSCs的存活率。
1.4 统计学处理
2 结果
2.1 BMSCs-NSCs共培养的观察
M-CRD、H-CRD 组 BMSCs很快贴壁,BMSCs体积缩小并分化成带突起的神经元样细胞和胶质细胞,约2d可见有神经细胞从神经球中呈放射状伸出轴突,3d后在BMSCs表面的大部分神经球变成散在的单个细胞,向四周迁徙。L-CRD组、RD组第3天时才可见少量带突起的神经元样细胞和胶质细胞。Normal组中未见到细胞变形。
2.2 对NSCs分化的影响
2.2.1 CRD 含药血清对大鼠 BMSCs-NSCs 体外共培养NSE的影响 与Normal组相比,L-CRD组和RD含药血清组NSE的双阳性NSCs无显著性差异(P>0.05)。M-CRD 组、H-CRD 组 NSE 的双阳性NSCs在第7天分别与Normal组、RD含药血清组相比,均明显升高(P<0.01)。见图2。

图2 不同剂量组CRD含药血清对大鼠BMSCs-NSCs体外共培养NSE的影响
2.2.2 CRD 含药血清对大鼠 BMSCs-NSCs 体外共培养GFAP的影响 与Normal组相比,L-CRD组和RD含药血清组GFAP的双阳性NSCs无显著性差异(P>0.05)。M-CRD 组、H-CRD 组 GFAP 的双阳性NSCs在第7天分别与Normal组、RD含药血清组相比,均明显升高(P<0.01)。见图3。
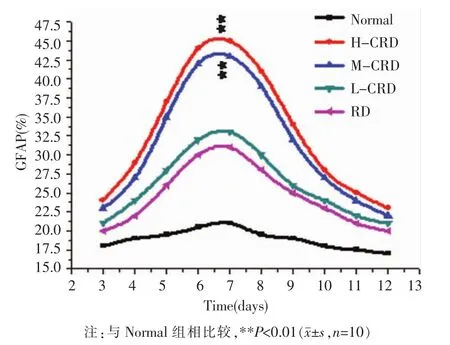
图3 不同剂量组CRD含药血清对大鼠BMSCs-NSCs体外共培养GFAP的影响
2.2.3 CRD 含药血清对大鼠 BMSCs-NSCs 体外共培养MAP2的影响 与Normal组相比,L-CRD组和RD含药血清组MAP2的双阳性NSCs无显著性差异(P>0.05)。M-CRD 组、H-CRD 组 MAP2 的双阳性NSCs在第7天分别与Normal组、RD含药血清组相比,均明显升高(P<0.01)。见图4。

图4 不同剂量组CRD含药血清对大鼠BMSCs-NSCs体外共培养MAP2的影响
2.2.4 CRD含药血清对大鼠 BMSCs-NSCs体外共培养MBP的影响 与Normal组相比,L-CRD组和RD含药血清组MBP的双阳性NSCs无显著性差异(P>0.05)。M-CRD 组、H-CRD 组 MBP 的双阳性NSCs在第7天分别与Normal组、RD含药血清组相比,均明显升高(P<0.01)。见图5。

图5 不同剂量组CRD含药血清对大鼠BMSCs-NSCs体外共培养MBP的影响
2.3 对NSCs存活率的影响
与Normal组相比,L-CRD组和RD含药血清组NSCs存活率无显著性差异(P>0.05)。M-CRD组、HCRD组NSCs存活率在第7天分别与Normal组、RD含药血清组相比,均明显升高(P<0.01)。见图6。

图6 不同剂量组CRD含药血清对大鼠BMSCs-NSCs体外共培养存活率的影响
3 讨论
神经元特异性烯醇化酶是烯醇化酶的一种同工酶,主要存在于大脑神经元和神经内分泌细胞内并参与糖酵解,是糖原酵解途径中甘油分解最后的酶,NSE是神经元损伤的标志物[10]。正常情况下,血液中的NSE含量比脑组织内低30倍。当脑组织由于缺血、中毒或外伤时,细胞膜完整性遭到破坏,NSE释放出来进入脑脊液,由于血脑屏障破坏而进入血液循环。NSE与学习、记忆及认知能力有关[11],认知障碍程度与血清NSE呈负相关[12]。
星形胶质细胞(astrocyte,AS)是大脑中数量众多的细胞,与中枢神经系统(central nervous system,CNS)的内环境稳定、突触传递等病理、生理过程密切相关[13],在神经元的发育、突触连接的形成中有重要作用[14]。胶质纤维酸性蛋白(GFAP)是星形胶质细胞的骨架蛋白及特异性标志物,反映细胞激活和胶质化程度,可作为脑损伤后星型胶质细胞活化及增殖的标志[15]。中枢神经系统受损时星形胶质细胞反应性增生,GFAP水平上调[16]。GFAP表达的增多有正、反两方面的作用:一方面活化的星型胶质细胞膜上有5-羟色胺、γ-氨基丁酸等受体,具有维持脑损伤后内环境的稳定、神经细胞的可塑性作用[17]:另一方面活化的星型胶质细胞可产生有神经毒性作用的细胞因子,释放细胞毒性物质和炎症介质,加重神经组织的损伤[18]。
神经元内存在两种高分子量的微管相关蛋白(MAPs),即 MAP1 和 MAP2,MAP2 主要存在于神经元的胞体和树突中,且在树突中的含量多于胞体,作为神经元的标志蛋白,MAP2是神经元细胞骨架蛋白,与微管蛋白形成微管,同肌动蛋白、微丝等相互作用构成细胞骨架[19],维持微管力学稳定,参与突起生长、胞浆蛋白运输、神经元塑形[20]。MAP2免疫活性下降可造成微管堆积,影响细胞骨架的完整,导致神经元死亡,MAP2是脑损伤的敏感标志[21]。MAP2 mRNA只存在于大脑灰质以及停止分化的迁移到大脑皮质区的神经元[22]。MAP2损失对神经元细胞产生严重的影响[19]。
髓鞘碱性蛋白(MBP)是中枢神经髓鞘膜的主要成分,MBP是少突胶质细胞和雪旺细胞合成的强碱性膜蛋白,在少突胶质细胞内以共价键结合于髓鞘质浆膜面,与细胞骨架、微管、微丝相连,维持中枢神经系统髓鞘结构和功能稳定,是急性脑损伤和脱髓鞘改变的特异性指标[23]。当脑损伤累及髓鞘时,MBP发生崩解,释放入脑脊液,导致血液中MBP水平升高,引起神经功能障碍。MBP水平特异地反映髓鞘脱失、神经组织损伤程度[24],作为判断颅脑损伤病情严重程度和评估预后的指标[25],MBP是中枢神经系统急性脱髓鞘的客观生化指标[26]。
细胞信息交流(即细胞通讯)有长距通讯和短距通讯两种方式,长距通讯以激素或生长因子为介质,通过血液循环和局部组织液的流动,将信息从一个细胞传递至另一个细胞;短距通讯在相邻的细胞间形成直接通道,信息物质进行相互交流。BMSCs有免疫特性,不仅能够逃避免疫识别,还有免疫抑制作用[27],可用于异体移植。BMSCs分泌多种神经营养因子[28],以旁分泌的方式促进内源性NSCs增殖、分化,促进轴突再生和再髓鞘化,促进神经损伤修复。本实验建立培养上清可以相互交流,但BMSCs与NSCs互不接触的共育体系呈左右两室平行结构,能在倒置显微镜下观察两种细胞的情况,可同时收集两室的BMSCs和NSCs进行定量指标的检测。本研究将BMSCs和NSCs共培养,结果显示BMSCs很快贴壁,约2d可见有神经细胞从神经球中呈放射状伸出轴突,3d后在BMSCs表面的大部分神经球变成散在的单个细胞,向四周迁徙。CRD含药血清提高了BMSCs促进 NSCs增殖和分化,其途径可能是促进BMSCs分泌某些蛋白质,通过微孔滤膜弥散到隔膜的另一侧,促进NSCs向神经元细胞或少突胶质细胞方向分化。
毛茛科植物大三叶升麻,具有“升清阳”的功效,升麻中所含的三萜皂苷升麻H-1(cimicifugoside H-1)可以抑制脑缺血时兴奋性氨基酸(Glu、Asp)的过度释放,并增加抑制性氨基酸(Gly、γ-GABA)的浓度,减少由于兴奋性氨基酸造成的神经细胞损伤[7]。本研究结果显示,CRD含药血清中、高剂量组分别和对照组、RD 含药血清组比较,NSE、GFAP、MAP-2、MBP双阳性NSCs差异有统计学意义,表明CRD含药血清促进NSCs分化成神经元和胶质细胞的比例增高,CRD含药血清浓度的高低决定了NSCs向神经元和胶质细胞方向分化的转归。详细机制有待于进一步研究。
[1]Kwon BK,Fisher CG,Dvorak MF,et al.Strategies to promote neural repair and regeneration after spinal cord injury[J].Spine(Phila Pa 1976),2005,30(17Suppl):S3-13.
[2]Miljkovic-Lolic M,Silbergleit R,Fiskum G,et a1.Neuroprotective effects of hyperbaric oxygen treatment in experimental focal cerebralischemia are associated with reduced brain leukocyte myeloperoxidase activity[J].Brain Res,2003,971(1):90-94.
[3]JiangY,JahagirdarBN,ReinhardtRL,etal.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-49.
[4]Ma K,Fox L,Shi G,et al.Generation of neural stem cell-like cells from bone marrow-derived human mesenchymal stem cells[J].Neurol Res,2011,33(10):1083-1093.
[5]Reeves A,Keirstead HS.Stem cell based strategies for spinal cord injury repair[J].Adv Exp Med Biol,2012,760:16-24.
[6]Ma W,Tavakoli T,Chen S,et a1.Reconstruction of functional cortical-like tissues from neural stem and progenitor cells[J].Tissue Eng Part A,2008,14(10):1673-1386.
[7]武密山,赵素芝,高维娟,等.升麻苷H-1对脑缺血大鼠纹状体氨基酸类神经递质含量的影响[J].中国病理生理学杂志,2016,32(5):831-835.
[8]武密山,赵素芝,任立中,等.密骨打老儿丸含药血清对共育体系中成骨细胞和破骨细胞功能的影响 [J].中国病理生理杂志,2013,29(5):913-917.
[9]武密山,赵素芝,任立中,等.川续断皂苷VI诱导大鼠骨髓间充质干细胞向成骨细胞方向分化的研究[J].中国药理学通报,2012,28(2):222-226.
[10]Komiya A,Yasuda K,Nozaki T,et a1.Small cell carcinoma of the prostate after high-dose-rate brachytherapy for low-risk prostatic adenocarcinoma[J].Oncol Lett,2013,5(1):53-56.
[11]Klijn CJ,Hankey GJ.Management of acute ischaemic stroke:new guidelines from the American Stroke Associationand European Stroke Initiative[J].Lancet Neuro1,2003,2(11):698-701.
[12]Chou ST,Ko LE,Lim PS,et a1.Effect of age and sex on plasma total homocysteine in Taiwanese subjects[J].Chin J Physiol,2000,43(4):159-164.
[13]Araque A.Astrocyte-neuron signaling in the brain-implications for disease[J].Curr Opin Investig Drugs,2006,7(7):619-624.
[14]Nimmerjahn A.Astrocytes going live:advances and challenges[J].J Physiol,2009,587(Pt 8):1639-1647.
[15]Kajihara H,Tsutsumi E,Kinoshita A,et a1.Activated astrocytes with glycogen accumulation in ischemic penumbra during the early stage of brain infarction:immunohistochemical and electron microscopic studies[J].Brain Res,2001,909(1/2):92-101.
[16]Martinian L,Boer K,Middeldorp J,et a1.Expression patterns of glial fibrillary acidic protein(GFAP)-delta in epilepsy-associatedlesional pathologies[J].Neuropathol Appl Neurobiol,2009,35(4):394-405.
[17]Valentim LM,Michalowski CB,Gottardo SP,et a1.Effects of transient cerebral ischemia on glial fibrillary acidic protein phosphorylation and immunocontentin rathippocampus[J].Neuroscience,1999,91(4):1291-1297.
[18]Koprowski H,Zheng YM,Heber-Katz E,et al.In vivo expression of inducible nitric oxide synthase in experimentally induced neurologicdiseases[J].Proc Natl Acad Sci USA,1993,90(7):3024-3027.
[19]Law AJ,Hutchinson LJ,Burnet PW,et a1.Antipsychotics increase microtubule-a ssociated protein 2 mRNA but not spinophilin mRNA in rat hippocampus and cortex[J].J Neurosci Res,2004,76(3):376-382.
[20]Yamaguchi S,Fujii-Taira I,Murakami A,et a1.Up-regulation of microtubule-associated protein 2accompanying the filial imprinting ofdomestic chicks(Gallus gallus domesticus)[J].Brain Res Bull,2008,76(3):282-288.
[21]Cheng Y,Deshmukh M,D’Costa A,et a1.Caspase inhibitor affords neuroprotection with delayed administration in a rat model ofneonatal hypoxic-ischemic brain injury[J].J Clin Invest,1998,101(9):1992-1999.
[22]Tucker RP,Garner CC,Matus A.In situ localization of microtubule-associated protein mRNA in the developing and adult rat brain[J].Neuron,1989,2(3):1245-1256.
[23]Inglis HR,Greer JM,McCombe PA.Gene expression in the spinal cord in female lewis rats with experimental autoimmuneencephalomyelitis induced with myelin basic protein[J].PLoS One,2012,7(11):e48555.
[24]Kuboyama K,Fujikawa A,Masumura M,et a1.Protein tyrosine phosphatase receptor type z negatively regulates oligodendrocyte differentiation and myelination[J].PLoS One,2012,7(11):e48797.
[25]Nawaz S,Kippert A,Saab AS,et al.Phosphatidylinositol 4,5-bisphosphate-dependent interaction of myelin basic protein with theplasma membrane in oligodendroglial cells and its rapid perturbation by elevated calcium[J].J Neurosci,2009,29(15):4793-4807.
[26]Wunderlich MT,Wallesch CW,Goertler M.Release of neurobiochemical markers of brain damage is related to the neurovascular statuson admission and the site of arterial occlusion in acute ischemic stroke[J].J Neurol Sci,2004,227(1):49-53.
[27]Shi M,Liu ZW,Wang FS.Immunomodulatory properties and therapeutic application of mesenchymal stem cells[J].Clin Exp Immunol,2011,164(1):1-8.
[28]JiangJ,LvZ,Gu Y,etal.Adultratmesenchymalstem cells differentiate into neuronal-like phenotype and express a variety of neuro-regulatory molecules in vitro[J].Neurosci Res,2010,66(1):46-52.
Effect of Rehmannia Decoction Contained Serum on NSCs of Rats in BMSCs and NSCs Co-culture System
WU Bowen1,WU Mishan1,2*,WANG Huina3,GUO Jindong1,GAO Weijuan1,2,WANG Ru1,HAN Hongwei1,SHI Xuliang1
(1.Hebei College of Chinese Medicine,Shijiazhuang,Hebei 050200,China;2.Hebei Key Laboratory of Chinese Medicine on Cardio-Cerebrovascular Disease,Shijiazhuang,Hebei 050091,China;3.Chengde Medical College,Chengde,Hebei 067000,China)
ObjectiveTo explore the effect of Cimicifuga heracleifolia Kom.as medicinal guiding of Rehmannia decoction(CRD)contained serum on survival and differentiation of neural stem cells (NSCs)in NSCs and bone marrow mesenchymal stem cells(BMSCs)co-culture system.MethodsFirstly,the modeling of BMSCs co-cultured with NSCs was set up,then CRD contained serum was put into this co-culture syste.The cells of 5-bromo-2-deoxyuridine (BrdU)and neuron-specific enolase(NSE),glial fibrillary acidic protein(GFAP),microtubule-associated protein(MAP2),myelin basic protein(MBP)were stained with double immunocytochemical staining method at 3rd dayof culture.The survival rate of NSCs was detected by the flow cytometry (FCM)and expression of NSCs was detected by immunocytochemistry and Western bolt.The effect of CRD contained serum on survival and differentiation of NSCs was analyzed.ResultsCompared with the normal saline group,higher concentration and middle concentration of CRD contained serum could significantly increased the survival rate of NSCs,and the NSE,GFAP,MAP-2and MBP activity on the 7th day in BMSCs and NSCs co-culture system(P<0.01).ConclusionCRD contained serum could promote the effective differentiation and increase the survival rate activity of NSCs and in BMSCs and NSCs co-culture system.
bone marrow mesenchymal stem cells; neural stem cells; medicinal guiding; Rehmannia decoction; drug serum;neuron-like cells
本文引用:武博文,武密山,王慧娜,郭金栋,高维娟,王 茹,韩红伟,师旭亮.地黄饮子含药血清对大鼠BMSCs与NSCs共培养影响转归的研究[J].湖南中医药大学学报,2017,37(10):1056-1062.
R285.5;R393
A
10.3969/j.issn.1674-070X.2017.010.003
2017-2-23
国家自然科学基金资助项目(81073074,30472200);河北省自然科学基金项目(H 2013206005);河北省高等学校科学技术研究重点项目(ZD2015053);河北省高等学校高层次人才科学研究项目(GCC2014013)。
武博文,女,学士,研究方向:心脑血管病的中医药治疗。
* 武密山,男,博士,教授,博士研究生导师,E-mail:wumishan@hebcm.edu.cn。
(本文编辑 杨 瑛)
