体外法研究纤维日粮的发酵特性及对猪氮排放相关指标的影响
2017-11-07朱丽媛卢庆萍夏冰刘正群孙永波张宏福
朱丽媛,卢庆萍,夏冰,刘正群,孙永波,张宏福
体外法研究纤维日粮的发酵特性及对猪氮排放相关指标的影响
朱丽媛,卢庆萍,夏冰,刘正群,孙永波,张宏福
(中国农业科学院北京畜牧兽医研究所/动物营养学国家重点实验室,北京 100193)
【】利用体外法探讨并比较不同纤维日粮的发酵特性及对猪氮排放相关指标的影响,为生猪生产中合理应用日粮纤维及减少氮排放的日粮配制提供试验依据。【】选择小麦、麦麸与燕麦麸3种原料,采用酶-重量法(AOAC Method 985.29)提取原料中的总日粮纤维组分,得到小麦纤维、麦麸纤维与燕麦麸纤维。以玉米-豆粕为基础,分别添加5%的提取纤维,形成3种纤维日粮:小麦纤维日粮(WF)、麦麸纤维日粮(WBF)与燕麦麸纤维日粮(OBF)。利用单胃动物仿生消化系统(SDS-Ⅱ)模拟猪胃-小肠消化;采集6头健康、体重接近的生长猪的新鲜粪便,混合均匀后与培养液按一定比例配制接种液,定量装入发酵瓶中模拟大肠发酵。日粮经胃-小肠仿生消化后,称取200 mg的消化产物于装有30 mL接种液的发酵瓶中,转入(39±0.25)℃培养箱中,分别在发酵4、12、24、36、48和72 h,取出对应发酵瓶,收集发酵残渣与发酵液,进行相关指标的检测。【】在体外大肠发酵阶段,不同纤维日粮组的干物质降解率(IVDMD)及发酵液短链脂肪酸(SCFA)含量、pH、氨氮(NH3-N)浓度、微生物蛋白(MCP)产量有显著差异(<0.05):(1)在发酵4与12 h,OBF组的IVDMD在3组中最高(0.01),其他时间点3组差异不显著(0.05)。在4 h,OBF组的IVDMD比WF组与WBF组分别高18.32%、15.21%(<0.01);在12 h,比WF组与WBF组分别高14.87%、10.06%(<0.01)。(2)在发酵24与36 h,OBF组发酵液总SCFA含量显著高于其他两组(<0.05),在72 h,OBF组与WBF组极显著高于WF组(<0.01),在4与12 h,OBF组有高于其他两组的趋势(=0.0599;=0.0504)。在24 h,OBF组发酵液总SCFA含量比WF组与WBF组分别高27.32%、17.11%(<0.05);在36 h,比WF组与WBF组分别高16.65%、25.96%(<0.05)。(3)在发酵4与12 h,OBF组发酵液pH在3组中最低(<0.01);在24、36与72 h,OBF组与WBF组显著低于WF组(<0.05)。(4)在发酵24与48 h,OBF组发酵液NH3-N浓度显著低于其他两组(<0.05),并在12 h,有低于其他两组的趋势(=0.0559)。在24 h,OBF组发酵液NH3-N浓度比WF组与WBF组分别低6.86%、4.59%(<0.05);在48 h,比WF组与WBF组分别低8.44%、7.09%(<0.05)。(5)在发酵4 h,OBF组发酵液MCP产量显著高于其他两组(<0.05),并分别在12、24 h与36、48 h,显著高于WF组与WBF组(<0.05)。在4 h,OBF组发酵液MCP产量比WF组与WBF组分别高69.85%、82.25%(<0.05)。【】体外条件下,燕麦麸纤维显著提高了日粮在发酵阶段的干物质降解率、发酵液总短链脂肪酸含量与微生物蛋白产量,并显著降低了发酵液pH与氨氮浓度。因此,相比小麦纤维与麦麸纤维,燕麦麸纤维在促进微生物发酵及氮减排方面具有更高的潜力。
日粮纤维;生长猪;体外发酵;发酵特性;氮排放相关指标
0 引言
【研究意义】养猪业带来的氮污染对环境、人畜健康及生产的危害逐渐受到广泛重视[1-2]。因尿氮比粪氮易分解释放氨气,所以研究氮减排的重心便集中在减少尿氮排放或者将尿氮转至粪便中[3]。大量体内研究已证实[4-6],猪日粮中添加日粮纤维(dietary fiber, DF)可以促进尿氮向粪氮的转移,DF在后肠内经微生物发酵产生短链脂肪酸(short-chain fatty acid, SCFA)为微生物供能,促进其生长,导致微生物对氨的需要量增多,尿素合成减少,而微生物蛋白(microbial protein, MCP)合成增加,并随粪便排出。但不同来源的纤维因自身理化性质的迥异,对宿主肠道微生物的刺激具有选择性,在微生物的作用下有不同的发酵模式,对氮排放的影响也必然存在差异[7]。随着纤维型饲料原料越来越被重视,在养猪业生产实际中,如何选择DF来源、充分利用其发酵性能成为一个关键问题,既在缓解饲料资源短缺、降低生产成本的同时还能有效实现氮减排。【前人研究进展】在猪营养相关研究中,体外法()因其快速、省力、易于标准化等特点受到关注。目前普遍使用的体外胃-小肠-大肠三步法因在大肠阶段未引入微生物发酵、不能发挥DF的发酵性能,而具有一定的局限性[8-10]。近几年国外学者将猪的新鲜粪便作为微生物来源,引入纤维日粮体外发酵研究中,实现对大肠微生物环境较大程度的模拟[11-12],但当前在国内研究中的应用仍然较少。纤维型饲料原料的化学组成复杂,DF在宿主肠道内的发酵情况受其他组分的综合影响[13]。【本研究切入点】为了去除其他组分的干扰,客观地反应DF组分的发酵特性,本研究选择小麦、麦麸与燕麦麸3种生产中常用的饲料原料,提取原料的总日粮纤维(total dietary fiber,TDF),分别配制成生长猪日粮,并利用单胃动物仿生消化系统(SDS-Ⅱ)对日粮进行猪胃-小肠模拟消化,之后对消化产物进行体外微生物发酵。【拟解决的关键问题】以探讨并比较不同纤维日粮的发酵特性及对氮排放相关指标的影响,为生猪生产中合理应用DF及减少氮排放的日粮配制提供试验依据。
1 材料与方法
1.1 试验时间、地点
试验于2016年1—6月在中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室进行。
1.2 试验日粮
选择小麦、麦麸与燕麦麸3种饲料原料,参照Prosky(AOAC Method 985.29)[14]酶-重量法去除蛋白与淀粉,提取原料的TDF,并对提取纤维的纤维含量进行测定,见表1。

表1 3种原料提取纤维的纤维含量
以玉米和豆粕为基础,分别添加5%的提取纤维(小麦纤维、麦麸纤维与燕麦麸纤维),形成3种日粮:小麦纤维日粮、麦麸纤维日粮与燕麦麸纤维日粮。日粮满足NRC(2012)20—50 kg生长猪营养需要量,其组成及营养水平如表2所示。
1.3 体外胃-小肠消化
体外条件下对各日粮进行猪的胃-小肠模拟消化。利用动物营养学国家重点实验室研发的单胃动物仿生消化系统(SDS-Ⅱ)完成,具体操作规程参见《单胃动物仿生消化系统操作手册(第二版)》[15],收集消化产物(即为发酵底物)备用。
1.4 体外发酵
1.4.1 发酵培养液 参照MENKE等方法配制[16],现用现配。培养液由蒸馏水、溶液A、溶液B、溶液C、刃天青溶液和还原剂溶液组成,具体组成见表3。在400 mL蒸馏水中加入0.1 mL溶液A、200 mL溶液B、200 mL溶液C和1 mL刃天青溶液(指示培养液厌氧状况,有氧时呈红色,厌氧时呈无色),通无氧CO2饱和后置于(39±0.25)℃恒温水浴锅中,在与粪便混合前1 h加入40 mL还原剂溶液,混匀并持续通入CO2。
1.4.2 发酵菌源 选择6头健康、体重接近(BW,(37.2±4.6)kg)杜×长×大三元杂交阉公猪(动物营养学国家重点实验室昌平试验基地)作为粪便供体动物。收集每头猪的新鲜粪便,直接保存于100 mL的塑料注射器中,推动活塞驱赶空气,放置于水浴(39±0.25)℃的保温瓶中,立即带回实验室。
1.4.3 接种液 将收集的粪便混匀,取28.5 g与预热至(39±0.25)℃的培养液210 mL充分混合(机械搅拌60 s)后,经4层纱布过滤,取滤液密封于适宜体积的玻璃瓶中,持续搅拌,并通入CO2使其保持在厌氧环境中。所有操作均于(39±0.25)℃恒温水浴锅中进行,尽量在最短时间内完成。
1.4.4 体外发酵设计 称取经胃和小肠消化后的残渣200 mg,分装于100 mL的玻璃发酵瓶中,加入30 mL接种液,持续冲入CO25 s后,立即盖上瓶塞,转入已预热至(39±0.25)℃的恒温培养箱中(SPX-250 B-2,上海福玛实验设备有限公司)培养,在发酵4、12、24、36、48和72 h后(各时间点设6个重复,另设3个空白用于校正数据),取出对应发酵瓶,收集发酵残渣和发酵液,进行相关指标的检测。
1.5 测定指标与方法
1.5.1 常规成分 日粮的干物质、能量、粗蛋白质、粗脂肪、中性洗涤纤维及粗灰分含量按照《常规饲料分析与检测技术》[17]方法测定。
1.5.2 纤维含量 采用PROSKY(AOAC Method 985.29)[14]酶-重量法测定日粮及提取纤维的可溶性日粮纤维(soluble dietary fiber,SDF)、不溶性日粮纤维(insoluble dietary fiber,IDF)及总日粮纤维(total dietary fiber,TDF)含量。

表2 试验日粮组成及营养水平(风干基础,%)
1)预混料为每千克日粮提供:维生素A,8 250 IU;维生素B1,1 mg;维生素B2,5 mg;维生素B5,40 mg;维生素B6,2 mg;维生素B12,0.025 mg;维生素D3,825 IU;维生素E,40 IU;维生素K3,4 mg,;生物素,0.20 mg;叶酸,2.0 mg;D-泛酸,15 mg;烟酸,35 mg;铜,50 mg;铁,80 mg;锰,25 mg;锌,100 mg;碘,0.50 mg;硒,0.15 mg。2)营养水平中除消化能为计算值外,其他均为实测值。
1)The premix provided the following per kg of diets:vitamin A, 8 250 IU; vitamin B1, 1 mg; vitamin B2,5 mg; vitamin B5, 40 mg; vitamin B6, 2 mg; vitamin B12, 0.025 mg; vitamin D3, 825 IU; vitamin E, 40 IU; vitamin K3,4 mg; biotin, 0.20 mg; folic acid, 2.0 mg; D-pantothenic acid, 15 mg; nicotinic acid, 35 mg; copper, 50 mg; iron, 80 mg; manganese, 25 mg; zinc, 100 mg; iodine, 0.50 mg; selenium, 0.15 mg.2)Nutrient levels are measured values, but the digestibility energy is calculated value
1.5.3 体外发酵阶段干物质降解率 (dry matter degradability during thefermentation,IVDMD)
IVDMD(%)=(日粮干物质重-发酵后残渣干物质重)/日粮干物质重×100。
1.5.4 发酵液短链脂肪酸含量、pH及氨氮浓度 发酵液短链脂肪酸含量采用气相色谱法[18](Agilent 7890B气相色谱仪,安捷伦科技有限公司)测定。
发酵结束后,立即使用pH酸度计(Sartorius PB-10)测定发酵液pH。
使用纳氏比色法(CM-02N台式氨氮水质测定仪,北京双晖京承电子产品有限公司)测定发酵液氨氮(NH3-N)浓度。
1.5.5 发酵液微生物蛋白浓度及产量 采用嘌呤法[19]测定发酵液微生物蛋白浓度。

表3 培养液组成
微生物蛋白产量(mg)=微生物蛋白浓度(mg·mL-1)×发酵液体积(mL)
1.6 数据处理
根据单因子完全随机设计,以SAS 9.2 MEANS模块对基本统计量进行分析,GLM模块对数据进行方差分析,均值通过Tukey法进行多重比较,<0.05为差异显著。
2 结果
2.1 日粮纤维对体外发酵阶段干物质降解率的影响
不同底物在体外发酵阶段的干物质降解率如表4所示。在发酵4与12 h,OBF组的IVDMD极显著高于其他两组(<0.01),其他时间点3组差异不显著。在4 h,OBF组的IVDMD比WF组与WBF组分别高18.32%、15.21%(<0.01);在12 h,比WF组与WBF组分别高14.87%、10.06%(<0.01)。

表4 日粮纤维对体外发酵阶段干物质降解率的影响
同行数据标不同小写字母表示差异显著(<0.05),相同字母或无字母表示差异不显著(>0.05)。下表同
In the same row, values with different small letter superscripts mean significant difference (<0.05) , and values with the same or no letter superscripts mean no significant difference (>0.05). The same as below
不同底物的IVDMD随发酵时间的变化情况如图1所示。各组底物的IVDMD在发酵4—24 h随发酵时间增加而极显著增加(<0.01),之后便缓慢增加,但差异不显著(>0.05)。
2.2 日粮纤维对体外发酵总短链脂肪酸含量的影响
不同纤维日粮体外发酵总短链脂肪酸含量有显著差异(<0.05,表5)。在发酵24 h与36 h,OBF组发酵液总SCFA含量显著高于其他两组(<0.05),在72 h,OBF组与WBF组极显著高于WF组(<0.01),在4与12 h,OBF组有高于其他两组的趋势(=0.0599;=0.0504)。在24 h,OBF组发酵液总SCFA含量比WF组与WBF组分别高27.32%、17.11%(<0.05);在36 h,比WF组与WBF组分别高16.65%、25.96%(<0.05)。
不同纤维日粮体外发酵总SCFA含量随发酵时间的变化情况如图2所示。随着发酵时间的延长,各组发酵液总SCFA含量表现为先升高后降低(<0.01),并在发酵48 h达到最大。

图1 体外发酵阶段干物质降解率随发酵时间的变化情况
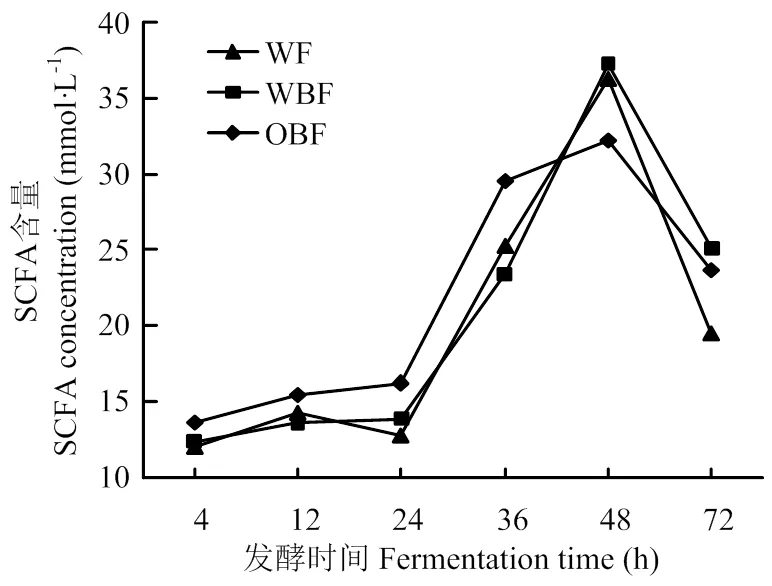
图2 发酵液总短链脂肪酸含量随发酵时间的变化情况

表5 日粮纤维对发酵液总短链脂肪酸含量的影响
2.3 日粮纤维对体外发酵pH的影响
不同纤维日粮体外发酵pH有显著差异(<0.05,表6)。在发酵4 h与12 h,OBF组发酵液pH极显著低于其他两组(<0.01);在24、36与72 h,OBF组与WBF组显著低于WF组(<0.05)。
不同纤维日粮体外发酵pH随发酵时间的变化情况如图3所示。在发酵4—36 h,随发酵时间的增加各组发酵液pH极显著降低(<0.01),之后便维持平稳(>0.05)。不同时间点各组发酵液pH介于6.79—6.96之间。
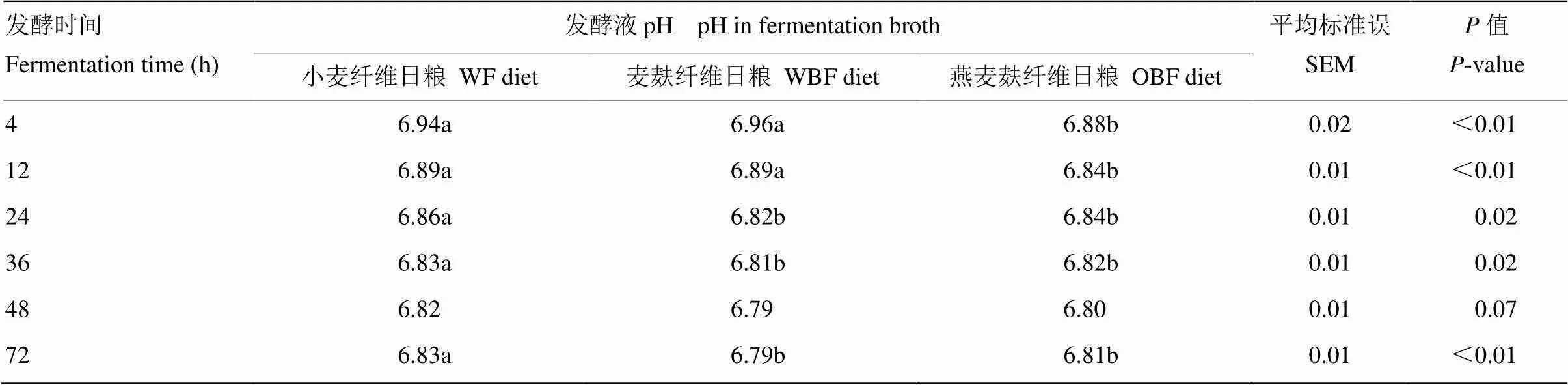
表6 日粮纤维对发酵液pH的影响

图3 发酵液pH随发酵时间的变化情况
2.4 日粮纤维对体外发酵氨氮浓度的影响
不同纤维日粮体外发酵氨氮浓度有极显著差异(<0.01表7)。在发酵24与48 h,OBF组发酵液NH3-N浓度显著低于其他两组(<0.05),并在12 h,有低于其他两组的趋势(=0.0559)。在24 h,OBF组发酵液NH3-N浓度比WF组与WBF组分别低6.86%、4.59%(<0.05);在48 h,比WF组与WBF组分别低8.44%、7.09%(<0.05)。
不同纤维日粮体外发酵NH3-N浓度随时间的变化情况如图4所示。随着发酵时间的增加,各组发酵液NH3-N浓度基本呈现出相同的变化,即先上升后降低再升高(<0.01),并在发酵72 h达到最高。
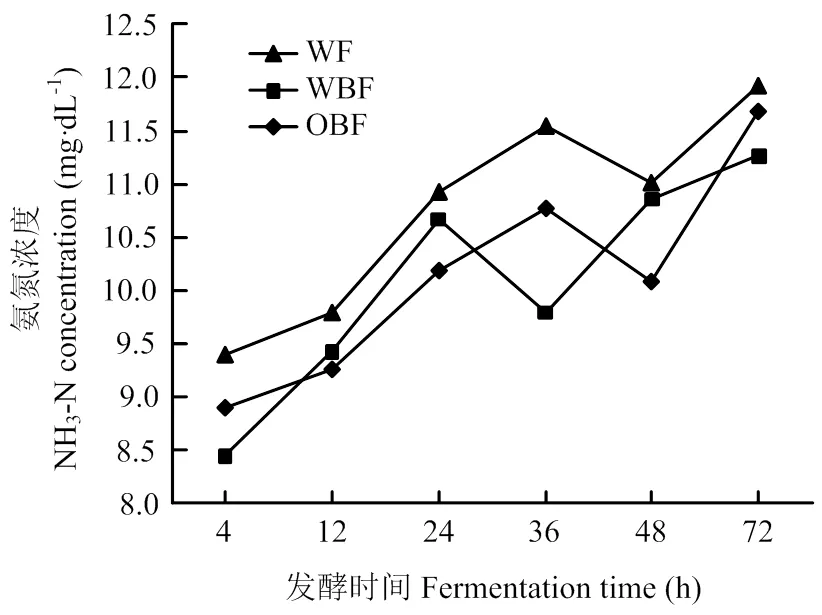
图4 发酵液氨氮浓度随发酵时间的变化情况

表7 日粮纤维对发酵液氨氮浓度的影响
2.5 日粮纤维对体外发酵微生物蛋白产量的影响
不同纤维日粮体外发酵微生物蛋白产量有显著差异(<0.05,表8)。在发酵4 h,OBF组发酵液MCP产量显著高于其他两组(<0.05),在12与24 h,OBF显著高于WF组(<0.05),在36与48 h,OBF组显著高于WBF组(<0.05)。在4 h,OBF组发酵液MCP产量比WF组与WBF组分别高69.85%、82.25%(<0.05)。
不同纤维日粮体外发酵MCP产量随发酵时间的变化情况如图5所示。在发酵4—48 h,各组发酵液MCP产量随发酵时间的增加而极显著增加(<0.01),之后基本不变(>0.05)。
3 讨论
日粮纤维在促进猪尿氮向粪氮转移上的效果越来越受到重视。笔者前期也做过研究,发现日粮中添加20%麦麸或燕麦麸后,生长猪尿液总氮与氨氮含量显著降低[20-21]。在此基础上,本试验采用体外研究手段,选择麦麸、燕麦麸及生产中常用的原料小麦,提取原料中的总日粮纤维,配制3种纤维日粮,体外条件下模拟其在猪消化道内的消化与发酵,以研究并比较纤维日粮的发酵特性及发酵过程中氮排放相关指标的变化情况。但目前相关体外研究中,评价纤维的发酵特性多集中为纤维原料,鲜少涉及以上3种纤维日粮,且结合研究氮排放相关指标的报道比较少[4,12,22-23]。因此,本研究对体外法、纤维日粮的发酵特性及氮排放相关指标的有机结合,为深入了解DF、DF在猪日粮中的合理应用及减少氮排放的日粮配制提供了新的思路。
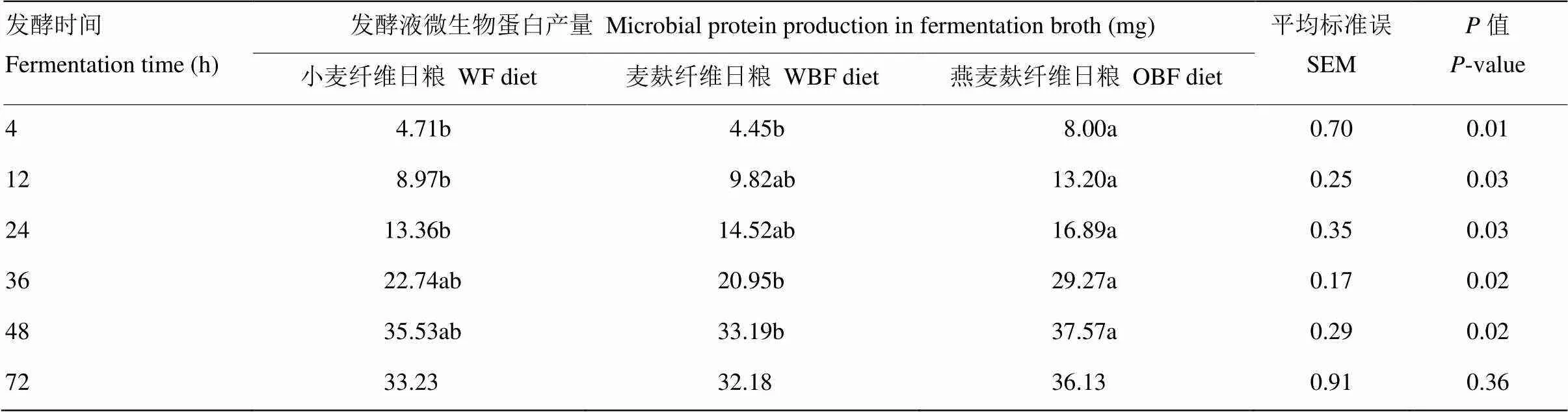
表8 日粮纤维对发酵液微生物蛋白产量的影响

图5 发酵液微生物蛋白产量随发酵时间的变化情况
3.1 对发酵起始阶段干物质降解有显著影响
DF是不能被胃与小肠内源消化酶分解,只能部分或全部由微生物发酵利用的碳水化合物的总称[24]。不同来源DF的可发酵性各异[11],对其他养分被微生物利用程度的影响也不尽相同。前人研究表明[20,25-26],SDF型纤维比IDF型纤维的可发酵性高,更易降解,并通过发酵供能及促进微生物生长等,进一步促进其他养分的酵解利用。IVDMD是反应底物DM在体外发酵阶段的降解率及被微生物利用的程度的直观指标,本试验中,在发酵起始阶段,DF对IVDMD有显著影响,且燕麦麸纤维组的IVDMD最高,这符合笔者的认识,燕麦麸纤维属SDF型纤维(SDF/ TDF=33.19%),而其他两种纤维为IDF型纤维,也与孟丽辉[20]的体内试验结果一致,即SDF含量最高日粮的后肠发酵率显著高于其他日粮。
此外,3种底物的IVDMD均随发酵时间的增加而增加,但从24 h开始增加缓慢,这可能是随着发酵进行,底物被大量消耗,发酵速率有所下降的缘故[27]。目前相关研究也以发酵期间产气量的多少来反映底物被微生物利用的程度[22-23],产气量随时间的变化趋势与本试验中IVDMD变化趋势基本一致,且AWATI指出[28]在发酵一定时间后产气量增加缓慢的原因:在发酵一定时间后,接种液中微生物区系已适应发酵底物,作为产气来源的物质已被大量消耗,产气量基本达到最大。
3.2 体外发酵总短链脂肪酸含量与pH的影响
SCFA是猪后肠微生物发酵DF的主要终产物,是估测后肠发酵的一个重要指标。在体内,后肠发酵产生的SCFA迅速被肠上皮细胞吸收,而体外发酵过程中不存在吸收过程,因此提供了一种值得信赖的测定SCFA含量的方法[29]。有研究证实,SCFA含量受DF来源及发酵率的影响,即当底物中可发酵DF含量越高,被微生物利用程度越高,SCFA含量也相继提高[30-31]。本研究中,在发酵前4个时间点,燕麦麸纤维组的总SCFA含量均高于其他两组,这与燕麦麸纤维组可发酵DF含量(SDF/TDF=18.19%)及IVDMD最高的试验结果切合。
随着发酵时间的延长,3组总SCFA含量在4—48 h不断增加,这是微生物不断发酵产酸而SCFA无法外流、吸收的结果,在48—72 h又降低,可能是由代谢产物积累使微生物增长变缓以及可发酵碳水化合物大量消耗引起。动物后肠内pH主要受SCFA含量、肠上皮对SCFA的吸收及食糜外流等的共同影响[27],显然,在体外发酵过程中,动物体内生理代谢过程并不存在,发酵液pH则主要被SCFA含量影响。本试验中,随着发酵时间的延长,发酵液pH变化与SCFA变化基本相对应,在发酵4—48 h,SCFA的大量积累导致pH不断下降,且在48—72 h,从数值上看,发酵液pH呈增加趋势,与前文所述SCFA含量下降吻合。
3.3 对体外发酵氨氮浓度与微生物蛋白产量的影响
NH3-N是底物中蛋白质发酵的产物,同时也是微生物维持生长及合成自身MCP的主要氮源,其浓度反映了蛋白质降解与合成间的平衡状况,可作为体外条件下预示氮排放潜力的重要指标[32]。同样地,BINDELLE等研究发现,体外发酵产生的MCP可被用来预测猪尿氮与粪氮的排放比例[11],之后JHA等[12]也在其研究中进行应用。
当底物的可发酵碳水化合物利用率低,微生物即开始利用蛋白质,发酵产NH3[33]。而许多体内试验显示,日粮中添加DF后,纤维发酵增加,蛋白质发酵减少,NH3产生减少[12,34]。NH3产生后,微生物利用其合成MCP,在氮源充足的情况下,MCP的合成效率又反过来由可发酵碳水化合物的发酵率及提供的可利用能量决定[19]。本研究中,在发酵多个时间点,燕麦麸纤维组发酵液NH3-N浓度均低于其他两组,对应地,MCP产量最高。综合前面分析,相比其他两组,燕麦麸纤维组无论是在SDF(SDF/TDF=18.19%)含量上,还是底物DM发酵率、SCFA(提供能量)产量上均显示出其突出的优势,进一步验证了前述观点。本试验同时发现,随着发酵进行,蛋白质发酵逐渐开始,不断产NH3,发酵液NH3-N浓度持续上升,之后微生物利用NH3合成MCP,导致NH3-N浓度在36 h或48 h下降,因体外发酵消除了肠壁对NH3-N的吸收及参与尿素循环的影响,且发酵液无法外流,因此,在发酵末NH3-N浓度又出现回升。相应地,随着发酵时间的增加,发酵液MCP产量显著增加,而72 h的MCP产量与48 h基本持平,这可能暗示着在48 h该体外发酵系统中微生物区系达到动态平衡[28]。
值得注意的是,本研究中,小麦纤维组与麦麸纤维组的部分指标(SCFA及pH)在发酵某时间点出现显著差异。麦麸是小麦籽实加工面粉后的副产品,也即麦麸纤维与小麦纤维在某种程度上具有一定的同源性。然而,二者的DF组成、各组分结构不同,由此对肠道菌群等的影响也不尽相同[35],因此,二者产生的差异可能与此有关,尚需进一步研究。
此外,在进行纤维日粮的体外消化时,研究者们越来越意识到,需在大肠阶段引入微生物发酵,只有这样才能对纤维日粮进行更理性客观的评价[20,31]。因受实际条件所限,相关研究通常使用新鲜粪便作为微生物来源。而具有不确定性的一点是,以粪便为微生物来源得出的结果,是否能够代表后肠微生物利用底物的能力[36]。同时,引入微生物后,如何使体外大肠环境与猪实际生理环境更加类似,仍是相关研究的重点。因此,使用体外法来模拟猪纤维日粮的后肠发酵,还需在选择微生物来源、更加贴近动物生理条件等方面做出改进,有待深入探究。
4 结论
体外条件下,燕麦麸纤维显著提高了日粮在发酵阶段的干物质降解率、发酵液总短链脂肪酸含量与微生物蛋白产量,并显著降低了发酵液pH与氨氮浓度。因此,相比小麦纤维与麦麸纤维,燕麦麸纤维在促进微生物发酵及氮减排方面具有更高的潜力。
[1] HE S, LI A, WANG L. Effect of sewage sludge and its biomass composting product on the soil characteristics and N2O emission from the tomato planting soil., 2016, 18(3): 501-508.
[2] PHILIPPE F X, CABARAUX J F, NICKS B. Ammonia emissions from pig houses: Influencing factors and mitigation techniques., 2011, 141(3): 245-260.
[3] HERNÁNDEZ F, MARTÍNEZ S, LÓPEZ C, MEGÍAS M D, LÓPEZ M, MADRID J. Effect of dietary crude protein levels in a commercial range, on the nitrogen balance, ammonia emission and pollutant characteristics of slurry in fattening pigs., 2011, 5(8): 1290-1298.
[4] JHA R, LETERME P. Feed ingredients differing in fermentable fibre and indigestible protein content affect fermentation metabolites and faecal nitrogen excretion in growing pigs., 2012, 6(4): 603-611.
[5] LYNCH M B, SWEENEY T, CALLAN J J, O’DOHERTY J V. Effects of increasing the intake of dietary β-glucans by exchanging wheat for barley on nutrient digestibility, nitrogen excretion, intestinal microflora, volatile fatty acid concentration and manure ammonia emissions in finishing pigs., 2007, 1(6): 812-819.
[6] AWATI A, WILLIAMS B A, BOSCH M W, GERRITS W J J, VERSTEGEN M W A. Effect of inclusion of fermentable carbohydrates in the diet on fermentation end-product profile in feces of weaning piglets., 2006, 84(8): 2133-2140.
[7] WILLIAMS B A, VERSTEGEN M W A, TAMMINGA S. Fermentation in the large intestine of single-stomached animals and its relationship to animal health., 2001, 14(2): 207-228.
[8] REGMI P R, SAUER W C, ZIJLSTRA R T. Prediction ofapparent total tract energy digestibility of barley in grower pigs using andigestibility technique., 2008, 86(10): 2619-2626.
[9] NOBLET J, PEYRAUD Y J. Prediction of digestibility of organic matter and energy in the growing pig from anmethod., 2007, 134(3): 211-222.
[10] 陈亮, 张宏福, 高理想, 赵峰. 仿生法评定饲料干物质消化率的影响因素. 中国农业科学, 2013, 46(15): 3199-3205.
CHEN L, ZHANG H F, GAO L X, ZHAO F. Factors affecting the measure of thedry matter digestibility of feeds using simulative digestion system., 2013, 46(15): 3199-3205. (in Chinese)
[11] BINDELLE J, BULDGEN A, DELACOLLETTE M, WAVREILLE J, AGNEESSENS R, DESTAIN J P, LETERME P. Influence of source and concentrations of dietary fiber ono nitrogen excretion pathways in pigs as reflected byfermentation and nitrogen incorporation by fecal bacteria., 2009, 87(2): 583-593.
[12] JHA R. Fiber fermentation in the pig intestine: Effect on metabolite production and nitrogen excretion[D]. Saskatoon, Canada: University of Saskatchewan, 2010.
[13] HOODA S, METZLER-ZEBELI B U, VASANTHAN T, ZIJLSTRA R T. Effects of viscosity and fermentability of dietary fibre on nutrient digestibility and digesta characteristics in ileal-cannulated grower pigs., 2011, 106(5): 664-674.
[14] PROSKY L, ASP N G, SCHWEIZER T F, DEVRIES J W, FURDA L. Determination of insoluble, soluble, and total dietary fiber in foods and food products: inter laboratory study., 1987, 71(5): 1017-1023.
[15] 赵峰, 张宏福, 张子仪. 单胃动物仿生消化系统操作手册. 2版. 北京: 中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室, 2011.
ZHAO F, ZHANG H F, ZHANG Z Y... Beijing: Institute of Animal Sciences, Chinese Academy of Agricultural Sciences/State Key Laboratory of Animal Nutrition, 2011. (in Chinese)
[16] MENKE K H, STEINGASS H. Estimation of the energetic feed value obtained from chemical analysis and gas production using rumen fluid., 1988, 28: 7-55.
[17] 张丽英. 饲料分析及饲料质量检测技术. 2版. 北京: 中国农业大学出版社, 2003: 48-83.
ZHANG L Y... Beijing: China Agricultural University Press, 2003: 48-83. (in Chinese)
[18] 王加启. 反刍动物营养学研究方法. 北京: 现代教育出版社, 2011: 139-141.
WANG J Q.Beijing: Modern Education Press, 2011: 139-141. (in Chinese)
[19] 刘晶. 饲料果胶对瘤胃微生物菌群结构和微生物蛋白合成的影响的研究[D]. 杭州: 浙江大学, 2014: 81-82.
LIU J. Effects of dietary pectin on microbial structure and microbial protein synthesis in the rumen[D]. Hangzhou: Zhejiang University, 2014: 81-82. (in Chinese)
[20] 孟丽辉. 生长猪纤维性饲料体内外消化率的评定及纤维来源对肠道消化功能的影响[D]. 北京: 中国农业科学院, 2015.
MENG L H. Evaluation of fibrous feeds’ digestibility in vivo/in vitro and the effect of fiber sources on intestinal digestive function for growing pigs[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015. (in Chinese)
[21] 朱丽媛, 卢庆萍, 庞敏, 孟丽辉, 张宏福, 马金霞. 麦麸、燕麦麸对生长猪氮排放的影响. 家畜生态学报, 2016, 37(9): 23-28.
ZHU L Y, LU Q P, PANG M, MENG L H, ZHANG H F, MA J X. Effect of wheat bran and oat bran on nitrogen excretion in growing pigs., 2016, 37(9): 23-28. (in Chinese)
[22] BINDELLE J, BULDGEN A, LAMBOTTE D, WAVREILLE J, LETERME P. Effect of pig faecal donor and of pig diet composition onfermentation of sugar beet pulp., 2007a, 132(3): 212-226.
[23] WILLIAMS B A, BOSCH M W, BOER H, VERSTEGEN M W, TAMMINGA S. Anbatch culture method to assess potential fermentability of feed ingredients for monogastric diets., 2005, 123: 445-462.
[24] WENK C. The role of dietary fibre in the digestive physiology of the pig., 2001, 90(1): 21-33.
[25] GOODLAD J S, MATHERS J C. Digestion by pigs of non-starch polysaccharides in wheat and raw peas () fed in mixed diets., 1991, 65(2): 259-270.
[26] URRIOL P E, SHURSON G C, STEIN H H. Digestibility of dietary fiber in distillers co-products fed to growing pigs., 2010, 88(7): 2373-2381.
[27] 娜仁花. 不同日粮对奶牛瘤胃甲烷及氮排放的影响研究. 北京: 中国农业科学院, 2010.
NA R H. Effects of diet composition on methane and nitrogen emissions from lactating cattle[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010.(in Chinese)
[28] AWATI A, KONSTANTINOV S R, WILLIAMS B A, AKKERMANS A D, BOSCH M W, SMIDT H, VERSTEGEN M W. Effect of substrate adaptation on the microbial fermentation and microbial composition of faecal microbiota of weaning piglets studied.e, 2005, 85(10): 1765-1772.
[29] ANGUITA M, CANIBE N, PÉREZ J F, JENSEN B B. Influence of the amount of dietary fiber on the available energy from hindgut fermentation in growing pigs: Use of cannulated pigs andfermentation., 2006, 84(10): 2766-2778.
[30] 程鹏辉, 廖新俤, 吴银宝. 利用猪粪液为菌源体外发酵产气法评价牧草纤维品质. 草业学报, 2007, 16(5): 61-69.
CHENG P H, LIAO X D, WU Y B. Studies on evaluation of fiber quality of fodder grass., 2007, 16(5): 61-69. (in Chinese)
[31] BINDELLE J, BULDGEN A, WAVREILLE J, AGNESSENS R, DESTAIN J P, WATHELET B, LETERME P. The source of fermentable carbohydrates influences theprotein synthesis by colonic bacteria isolated from pigs., 2007b, 1(8): 1126-1133.
[32] 庞德公, 杨红建, 曹斌斌, 武甜甜. 高精料全混合日粮中产朊假丝酵母添加水平对体外瘤胃发酵特性和纤维降解的影响. 动物营养学报, 2014, 26(4): 918-924.
PANG D G, YANG H J, CAO B B,WU T T. Effects of candida utilis supplemental level in high concentrate total mixed ration onruminal fermentation characteristics and fiber degradation., 2014, 26(4): 918-924. (in Chinese)
[33] WILLIAMS B A, MIKKELSEN D, LE PAIH L, GIDLEY M J.fermentation kinetics and end-products of cereal arabinoxylans and (1, 3; 1, 4)-β-glucans by porcine faeces., 2011, 53(1): 53-58.
[34] BIKKER P, DIRKZWAGER A, FLEDDERUS J, TREVISI P, IE HUEROU-LURON I, LALLES J P, AWATI A. The effect of dietary protein and fermentable carbohydrates levels on growth performance and intestinal characteristics in newly weaned piglets., 2006, 84(12): 3337-3345.
[35] 陈洪. 纤维源与其多聚糖组分对猪肠道粘膜生理和屏障功能的影响及调控机制[D]. 雅安: 四川农业大学, 2014.
CHEN H. Effect and the regulatory mechanism of dietary fiber and its polysaccharide composition on intestinal mucosal physiology and barrier function in pigs[D]. Ya’an: Sichuan Agricultural University, 2014. (in Chinese)
[36] 杨玉芬. 日粮纤维对于猪不同生长阶段消化生理和生产性能影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2001.
YANG Y F. Study on effect of dietary fiber on digestive physiology and performance of pigs in different growth period[D]. Hohhot: Inner Mongolia Agricultural University, 2001. (in Chinese)
(责任编辑 林鉴非)
the Fermentation Characteristics and Effects on Nitrogen Excretion Related Indicators of Different Fiber Diets using anMethod in Pigs
ZHU Liyuan, LU Qingping,XIA Bing, LIU Zhengqun, SUN Yongbo, ZHANG Hongfu
(Institute of Animal Science, Chinese Academy of Agricultural Sciences/State Key Laboratory of Animal Nutrition, Beijing 100193)
【】The present study was conducted to investigate and compare the fermentation characteristics and effects on nitrogen excretion related indicators of different fiber diets using anmethod in pigs. The study aimed to provide an experimental basis for the rational application of dietary fiber in pig production and for the preparation of diets to reduce nitrogen excretion. 【】Wheat fiber (WF), wheat bran fiber (WBF) and oat bran fiber (OBF) were purified from wheat, wheat bran and oat bran, respectively, using the enzyme-gravimetric method (AOAC Method 985.29). WF diet, WBF diet and OBF diet based on maize and soybean were formulated to contain 5% WF, WBF and OBF. The three fiber diets were undergone a stomach-small intestine digestion of pigs by simulative digestion system (SDS-II). A total of six growing pigs, which were in good health and had similar weight, were used to collect fresh feces. The mixed feces and culture solution were compounded in an appropriate proportion to prepare inocula which were quantitatively charged into fermentation flasks for simulating large intestine fermentation. After the stomach-small intestine digestion, the digestive products were pooled. 200 mg digestive products were added into a fermentation flask filled with 30 mL of inocula, placed in an incubator at (39±0.25)℃. The fermentation were stopped at 4, 12, 24, 36, 48 and 72 h of incubation. Then the fermentation residues and fermentation broth were collected, and the relevant indicators were determined.【】The results indicated that in the large intestine fermentation stage, there were significant differences in dry matter degradability during thefermentation (IVDMD) and total short-chain fatty acid (SCFA) concentration, pH, ammonia nitrogen (NH3-N) concentration and microbial protein (MCP) production in fermentation broth among the three fiber groups (<0.05): (1) At 4 h and 12 h, OBF group had the highest IVDMD among the three groups (<0.01), and no significant differences at other point in time(>0.05). At 4 h, the IVDMD of OBF group was 18.32% and 15.21% higher than WF group and WBF group, respectively (<0.01); at 12 h, OBF group was 14.87% and 10.06% higher than WF group and WBF group, respectively (<0.01). (2) As for total SCFA concentration in fermentation broth, at 24 h and 36 h, OBF group was significantly higher than other groups (<0.05); at 72 h, OBF group and WBF group were significantly higher than WF group (<0.01); at 4 h and 12 h, OBF group had a higher trend than other groups (=0.0599;=0.0504). At 24 h, the total SCFA concentration of OBF group was 27.32% and 17.11% higher than WF group and WBF group, respectively (<0.05); at 36 h, OBF group was 16.65% and 25.96% higher than WF group and WBF group, respectively (<0.05). (3) As for pH in fermentation broth, at 4 h and 12 h, OBF group had the lowest values among the three groups (<0.01); at 24 h, 36 h and 72 h, OBF group and WBF group were significantly lower than WF group (<0.05). (4) As for NH3-N concentration in fermentation broth, OBF group was significantly lower than other groups at 24 h and 48 h (<0.05) and had a lower trend at 12 h (=0.0559). At 24 h, the NH3-N concentration of OBF group was 6.86% and 4.59% lower than WF group and WBF group, respectively (<0.05); at 48 h, OBF group was 8.44% and 7.09% lower than WF group and WBF group, respectively (<0.05). (5) As for MCP production in fermentation broth, OBF group had the highest value among the three groups at 4 h (<0.05); at 12 h, 24 h and at 36 h, 48 h, respectively, OBF group was significantly higher than WF group and WBF group (<0.05). At 4 h, the MCP production of OBF group was 69.85% and 82.25% higher than WF group and WBF group, respectively (<0.05).【】In conclusion, oat bran fiber significantly increased IVDMD, total SCFA concentration and MCP production in fermentation broth, and significantly lowered pH and NH3-N concentration in fermentation broth. Thus, compared to wheat fiber and wheat bran fiber, oat bran fiber had a good potential in promoting microorganism fermentation and reducing nitrogen excretion.
dietary fiber; growing pig;fermentation; fermentation characteristics; nitrogen excretion related indicators
10.3864/j.issn.0578-1752.2017.19.018
2017-03-07;接受日期:2017-07-07
国家科技支撑计划项目(2012BAD39B01)、中国农业科学院创新团队(ASTIP-IAS07)
朱丽媛,E-mail:zhuliyuan23@163.com。通信作者卢庆萍,E-mail:luqingping@iascaas.net.cn
