红树蚬体内氧化逆境标志物对SCCPs暴露的响应
2017-11-07邢永泽陆宇哲杨明柳
邢永泽,农 莹,陆宇哲,杨明柳,阎 冰*
红树蚬体内氧化逆境标志物对SCCPs暴露的响应
邢永泽1,2,3,农 莹4,陆宇哲4,杨明柳1,阎 冰1*
(1.广西科学院广西红树林研究中心,广西红树林保护与利用重点实验室,广西北海536007;2.海洋环境与生态教育部重点实验室,山东青岛 266100;3.中国海洋大学环境科学与工程学院,山东青岛 266100;4.广西大学动物科学技术学院,广西南宁 530005)
实验室条件下,观测不同剂量-时间短链氯化石蜡(SCCPs)暴露下红树蚬()血液及鳃组织的4种氧化逆境标志物(SOD、CAT、GST酶活性及MDA含量)的响应特征.结果表明:在低浓度(0.5,1mg/L)和中浓度(5mg/L)胁迫组,血液和鳃组织SOD、GST酶基本表现为随胁迫时间延长,酶活性逐渐上升的趋势;高浓度(10,20mg/L)胁迫组SOD、GST酶在胁迫初期表现出很高的活性,之后逐渐下降.CAT酶在胁迫初期(1d)就表现出最高的酶活性,之后酶活性逐渐降低并最终受到抑制.低浓度胁迫组MDA含量呈现上升-下降-上升的趋势;中等浓度及以上胁迫组,MDA含量持续升高.抗氧化系统在低于5mg/L的SCCPs胁迫组能够有效发挥作用,而高于此浓度的胁迫组,抗氧化系统经过初期的应急反应后,随胁迫时间延长逐渐被破坏.本文还探讨了利用红树蚬作为指示生物的可行性.
红树蚬;短链氯化石蜡;氧化逆境标志物
短链氯化石蜡(short-chain chlorinated paraffins,SCCPs)是氯化石蜡家族中碳链长度为10~13个碳原子,含氯质量分数通常为30%~75%的一类复杂化合物[1].相对于中链氯化石蜡(碳链长度为14~17)和长链氯化石蜡(碳链长度为18~30),短链氯化石蜡因其更易从各类产品中释放入环境、更高的生物累积特性和更高的毒性而受到广泛关注[2].虽然中国没有直接生产SCCPs,但中国是氯化石蜡(CPs)生产第一大国,截至2015年,国内CPs总产能达160万t[3],氯化石蜡产品中不同程度的含有SCCPs成分.CPs在工业上用作阻燃剂、增塑剂、金属加工油和皮革处理剂等,其生产、存储、运输、使用以及废物的丢弃、燃烧和产品的填埋过程中造成SCCPs持续向环境中释放.因此,2012年工信部、科技部、财政部制定了《工业清洁生产推行“十二五”规划》(工信部联规[2012]29号),决定开展有毒有害原料(产品)替代,其中包括严格控制氯化石蜡生产原料中的短链氯化石蜡含量[4].
SCCPs所具有的POPs特性,使其广泛存在于不同环境介质中如水体[5]、土壤[6-7]、沉积物[8-9]、大气[10-11]及生物体[12].现有研究表明沉积物是SCCPs 重要的“汇”.在北美五大湖地区[13]、西班牙[14]、挪威[15]、捷克[16]以及日本[17]的河流沉积物中均发现不同浓度的SCCPs. Chen等在中国珠江三角洲河水底泥中测得SCCPs含量为320~6600ng/g(干重)[18],陈晨等[19]报道辽河口海域沉积物中SCCPs的浓度为64.9~1683.4ng/g (干重),并呈现离岸越远浓度越低的趋势,Zeng等[20]发现中国东海表层沉积物中的SCCPs浓度也呈现相似趋势,暗示河流排放是海洋中SCCPs的主要来源.目前国外水体中SCCPs—般在ng/L级别,国内某些地区已达到μg/L级别.Zeng等[21]测得北京高碑店湖SCCPs总浓度范围为172~176ng/L,污水处理厂进水口SCCPs浓度为4200~4700ng/L.海水中SCCPs浓度报道较少,于国龙[22]对辽宁普兰店湾的海水进行调查,测得SCCPs浓度为493.87~1490ng/L;Ma等[23]研究辽东湾海域海水中SCCPs的浓度在4.1~ 13.1ng/L,并认为海水中SCCPs的污染浓度与人类生产活动正相关.目前的毒理研究表明,SCCPs暴露对啮齿动物甲状腺、肝脏、肾脏具有毒性作用[24-25].刘丽华等[2]发现SCCPs在模式生物斑马鱼的早期发育阶段可引起一系列非致死效应和致死效应.Madeley 等[26]通过SCCPs对虹鳟鱼的毒性研究,认为SCCPs对水生生物的毒性可能需要很长一段时间才能表现出来.另有研究显示,大型蚤()、糠虾()等水生无脊椎动物对 SCCPs相对比较敏感[27-28],但SCCPs对海洋双壳贝类的毒性作用及基于此的氧化逆境标志物的响应仍未见相关报道.
红树林作为受海陆双重影响的重要生态系统,广泛分布于华南沿海,同时也是POPs污染物重要的“汇”.红树蚬()作为一种广布于红树林区的滤食性双壳贝类,是河口红树林生境中沉积物-水界面微环境的代表物种.因此,本课题组采用红树蚬作为受试生物,通过研究血液及鳃组织4种氧化逆境标志物的活性或含量,分析不同剂量-时间SCCPs暴露下红树蚬的氧化应激与损伤,探索SCCPs对红树林生态系统双壳贝类毒性效应及作用机制.
1 材料与方法
1.1 试验贝的采集与驯养
试验用红树蚬采集于广西北海市廉州湾草头村红树林区(21°33′28"N,109°9′22"E),经形态判别后挑选出大小相近的个体用于试验,经测定供试红树蚬个体鲜重(32.61±2.56)g/个,壳长(48.3± 4.2)mm,壳宽(24.56±3.8)mm,壳高(44.8±3.5)mm.在塑料筐中驯养5d,驯养密度为每升水2个贝,微充气,每天换水后投喂扁藻.试验用水为自来水与沙滤海水混合后经充分曝气的半自然海水,盐度为15±1,水质符合渔业水质标准(GB11607—1989).
1.2 胁迫处理
SCCPs(CAS85535-84-8)购自北京汤普森生物科技有限公司,氯含量(42±2)%.参照文献[29]及预试验结果,SCCPs对红树蚬最低影响浓度较高,二甲基亚砜(DMSO)对红树蚬无明显影响.因此试验设置SCCPs浓度为0.5,1,5,10, 20mg/L共5个胁迫组,1个水对照组和1个DMSO溶剂对照组(500mg/L).每组设2个平行样,每个平行样试验开始时共计32个贝,养殖密度为每升水2个贝,每天取样后完全换水并投喂扁藻.按照每个贝0.5L水计,维持SCCPs、DMSO浓度.24h不间断微充气.在胁迫试验的第0d、1d、3d、5d、7d和15d,以及解除胁迫的第3d(R3d)和第15d(R15d)分别取样,每组每次随机取8个贝,单独检测每个贝的各项氧化逆境标志物指标.恢复期间每天换水后只投喂扁藻.试验期间,盐度15±1,温度26~28℃,自然光照.
1.3 氧化逆境标志物的提取与检测
1.3.1 血样品制备 用1mL一次性注射器抽取红树蚬闭壳肌血液,注入对应编号离心管中,4°C,3000,离心5min,取上清液于深孔板中,用于测试抗氧化酶系指标和MDA含量.
1.3.2 鳃组织样品制备 取出鳃组织,用蒸馏水快速冲洗3次,吸干水分,称量0.3g,放入对应编号冻存管中,立即放入-80℃超低温冰箱保存待用.鳃组织冰浴下高速匀浆60s.0℃,16700,离心20min,取上清液,用于相关指标的测试.
1.3.3 标志物的检测 SOD活性测定采用羟胺发色法测定[30],CAT活性采用苯酚显色法测定[31],GST活性采用CDNB比色法测定[32],MDA采用改进的硫代巴比妥酸比色法测定[33],蛋白含量采用BCA法测定[34].
1.4 数据分析
试验数据采用SPSS19软件统计分析.采用单因素方差分析进行显著性检验,<0.05认为存在显著性差异,<0.01认为存在极显著差异.采用“标记字母法”显示显著性检验结果.
2 结果
2.1 红树蚬血液氧化逆境标志物对SCCPs的响应
空白对照组和DMSO组在胁迫及恢复阶段酶活性及MDA含量无显著差异(>0.05).
在胁迫阶段,0.5,1,5mg/L组,随着暴露时间延长,SOD酶活性整体呈现逐渐升高的趋势,但5mg/L组第15d时SOD酶活性开始下降(图1);去胁迫后SOD酶活性逐渐下降,其中0.5mg/L组酶活性能够恢复到对照组水平(>0.05),1,5mg/L组R15d时酶活性仍然高于对照组(<0.05). 10,20mg/L组,SOD酶活性初期(1d)即受到显著诱导(<0.01),之后随着暴露时间延长,酶活逐渐降低,15d时酶活性已低于对照组水平(<0.05);去胁迫后(R3d)酶活性仍持续下降,R15d时酶活性逐渐恢复到对照组水平(>0.05)
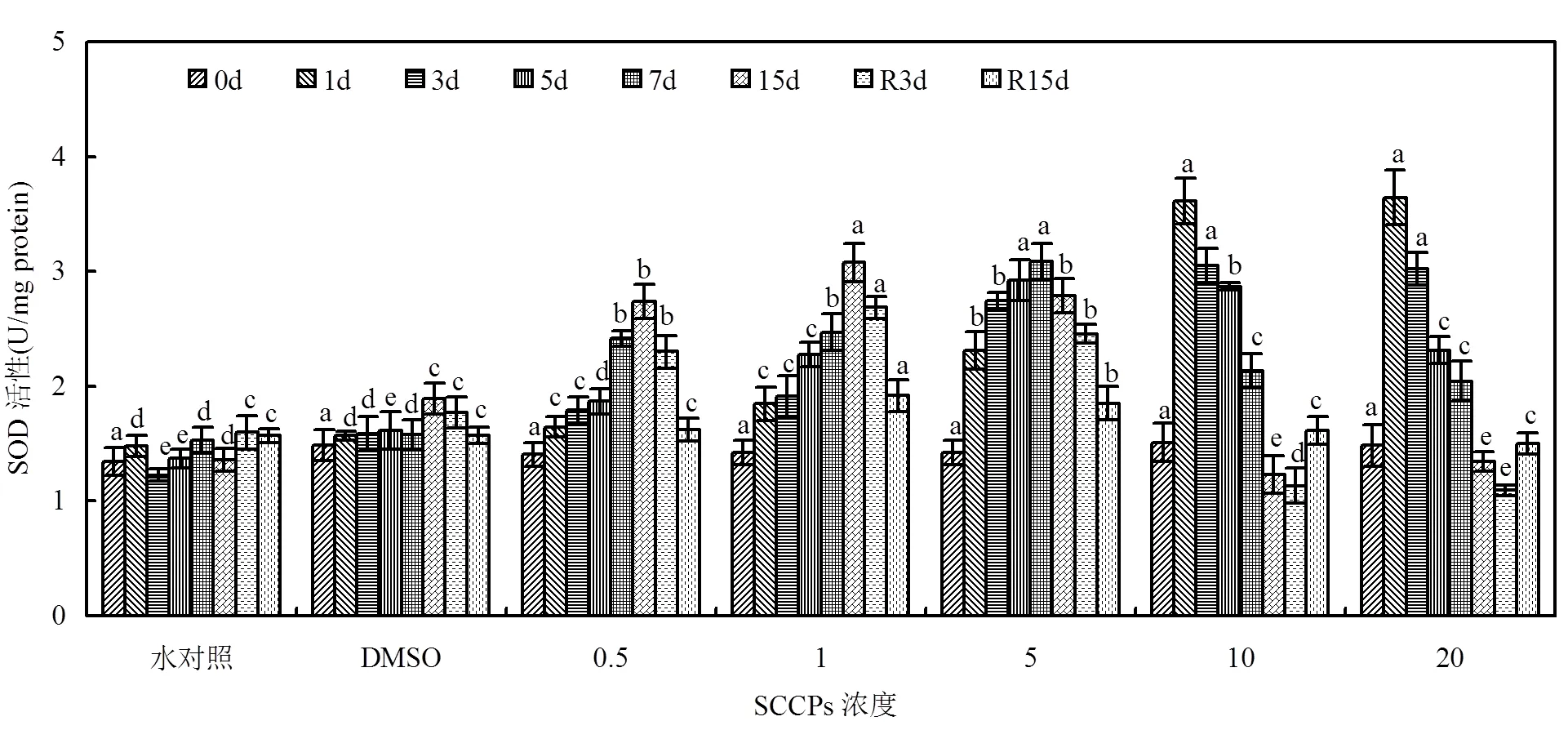
图1 不同SCCPs浓度下红树蚬血液SOD活性变化
同一天测定的数据上标的不同字母表示在0.05的水平上差异显著(=8)
对于CAT酶活性,暴露初期(1d)各胁迫组酶活性即受到显著诱导(<0.01),低浓度组受诱导程度高于高浓度组(图2). 0.5,1mg/L组酶活性在第3d达到最大值,随后酶活性呈单调递减趋势. 5mg/L及以上组酶活性在第1d达到最大值后随暴露时间延长呈逐渐降低的趋势,并最终低于对照组水平(<0.05).去胁迫后,0.5mg/L组酶活性逐渐接近对照组水平(<0.05);1,5,10mg/L胁迫组表现为上升-下降趋势;20mg/L胁迫组酶活性呈恢复性上升趋势.
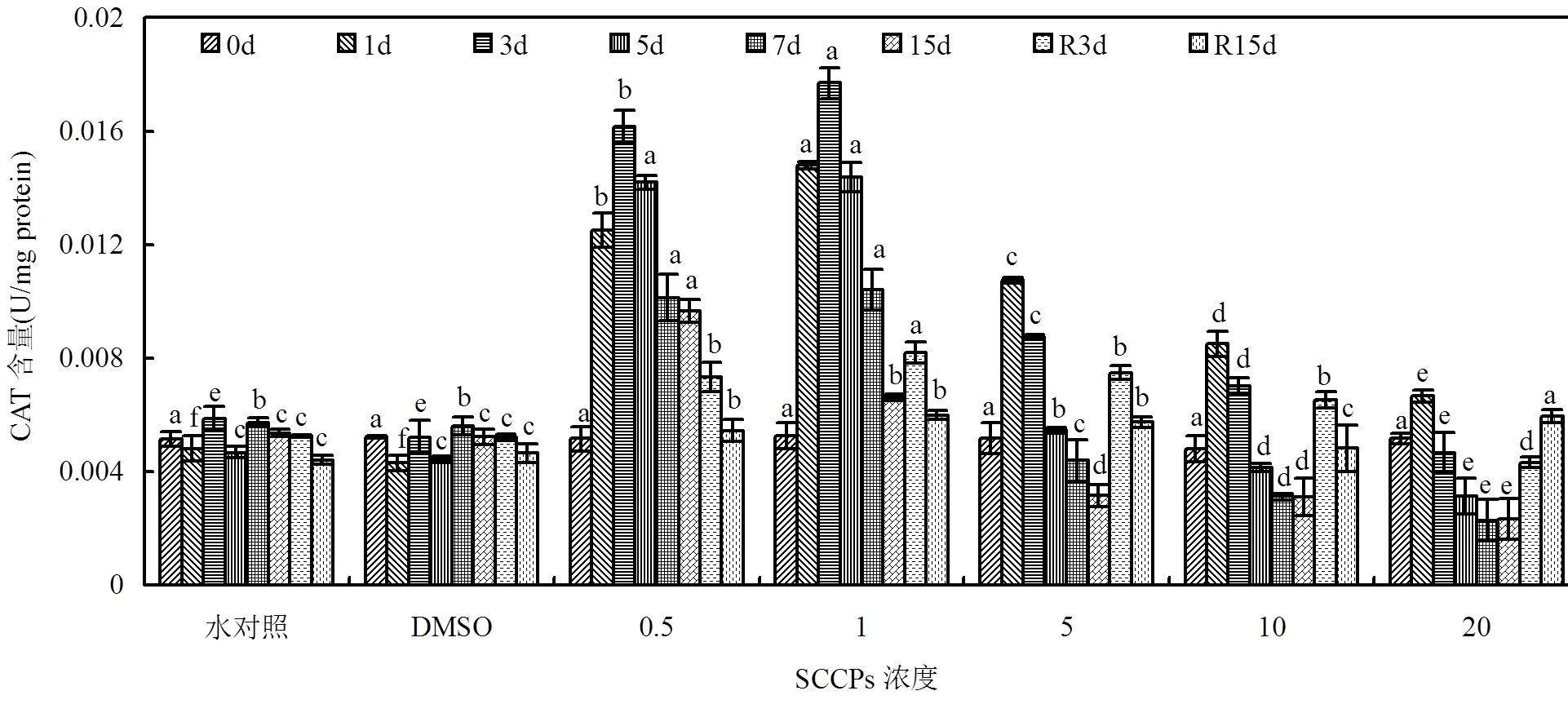
图2 不同SCCPs浓度下红树蚬血液CAT活性变化
同一天测定的数据上标的不同字母表示在0.05的水平上差异显著(=8)
GST酶活性在不同的剂量-时间区间表现出不同的响应特点(图3). 0.5mg/L组暴露初期酶活性略有下降(>0.05),从第3d起,酶活性逐渐升高;1mg/L组随暴露时间延长,酶活性逐渐升高.去胁迫后,上述2胁迫组酶活性逐渐下降,但未能恢复到对照组水平(<0.05). 5mg/L及以上组,暴露初期酶活性即显著升高,并随暴露时间延长,酶活性呈现上升-下降的趋势,最终低于对照组水平(<0.05);去胁迫后,各组酶活性均有所恢复,其中5mg/L组GST酶活性可以恢复到对照组水平(>0.05).
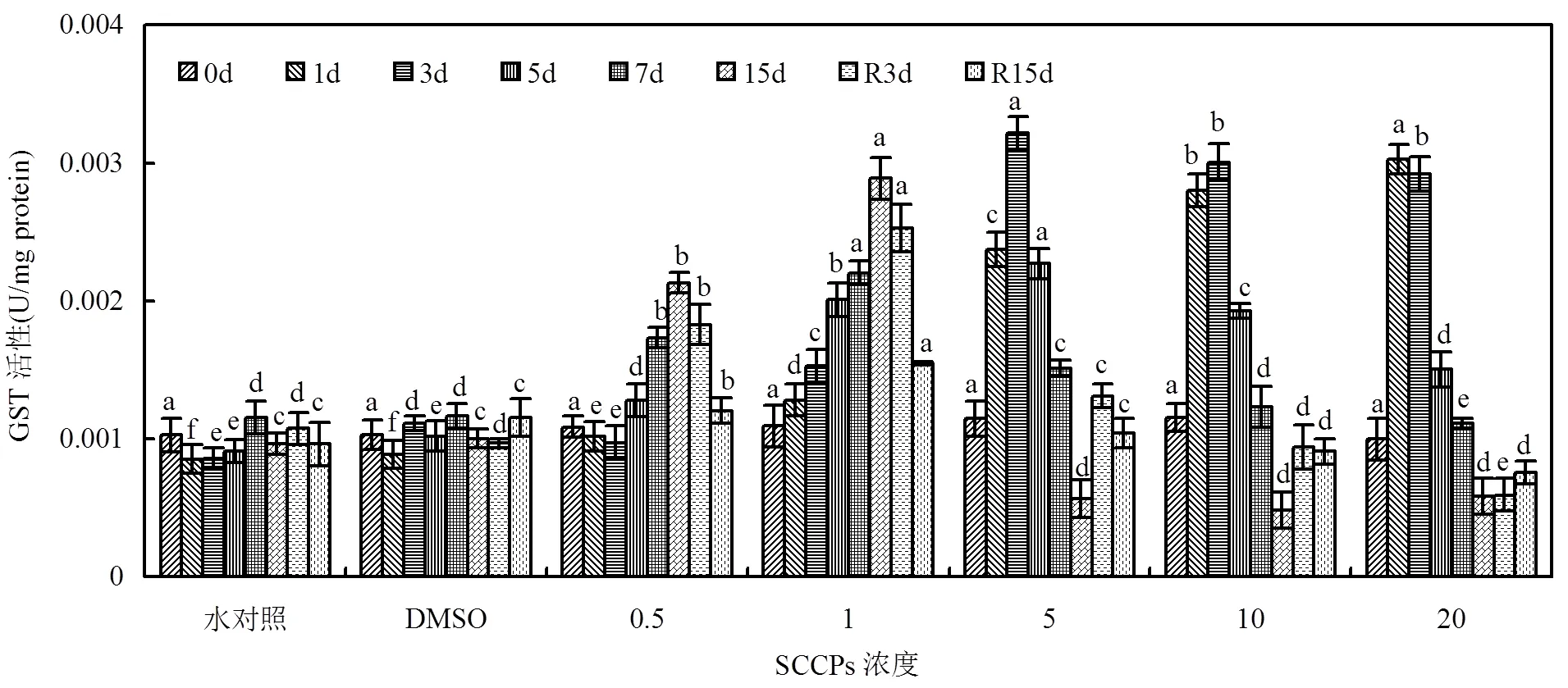
图3 不同SCCPs浓度下红树蚬血液GST活性变化
同一天测定的数据上标的不同字母表示在0.05的水平上差异显著(=8)
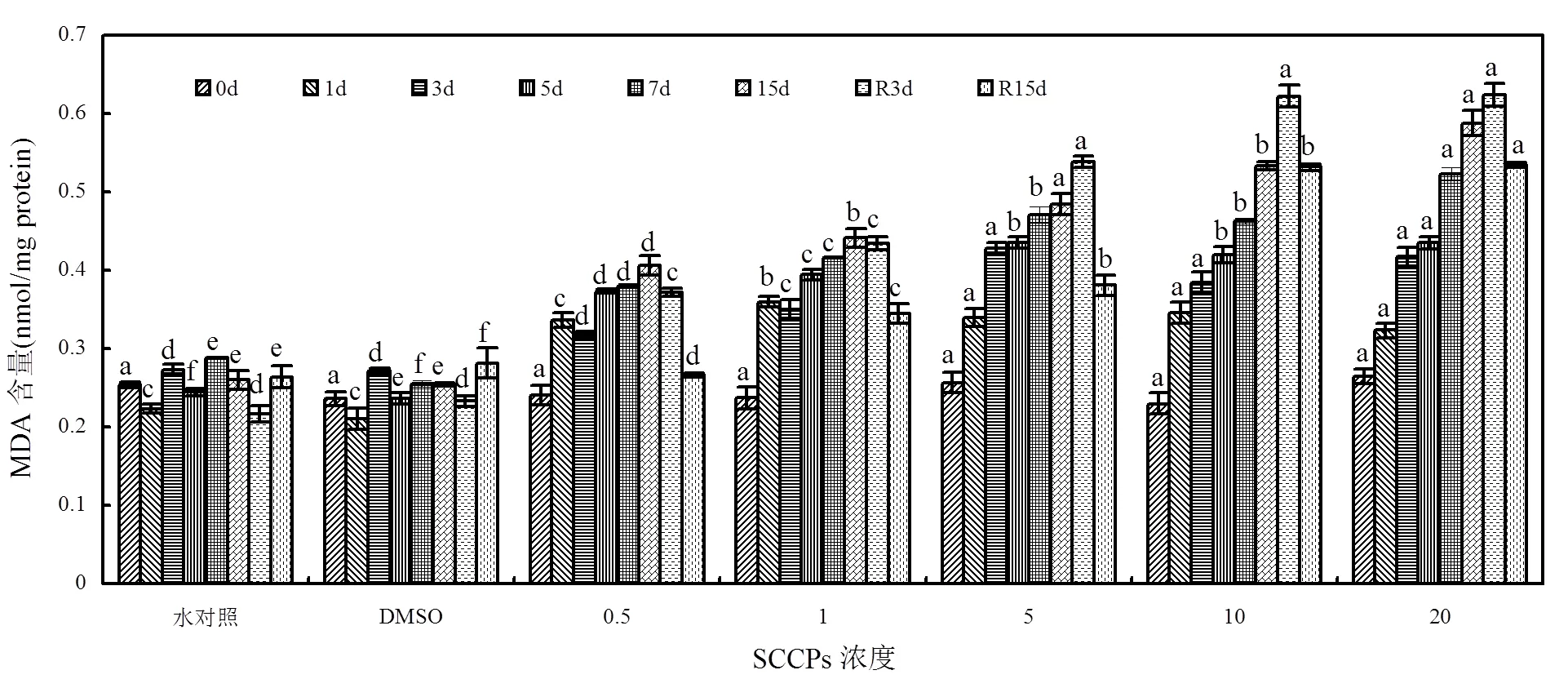
图4 不同SCCPs浓度下红树蚬血液MDA含量变化
同一天测定的数据上标的不同字母表示在0.05的水平上差异显著(=8)
各胁迫组MDA含量如图4所示,0.5,1mg/L组呈现上升-下降-上升的趋势;去胁迫后,MDA含量逐渐下降,但未能恢复到对照组水平(< 0.05).5mg/L及以上胁迫组随暴露时间延长MDA含量逐渐升高;去胁迫后,R3d时MDA含量仍略有提高,R15d时MDA含量虽呈下降趋势,但仍显著高于对照组水平(<0.05).
2.2 红树蚬鳃组织氧化逆境标志物对SCCPs的响应
空白对照组和DMSO组在胁迫及恢复阶段酶活性及MDA含量无显著差异(> 0.05).
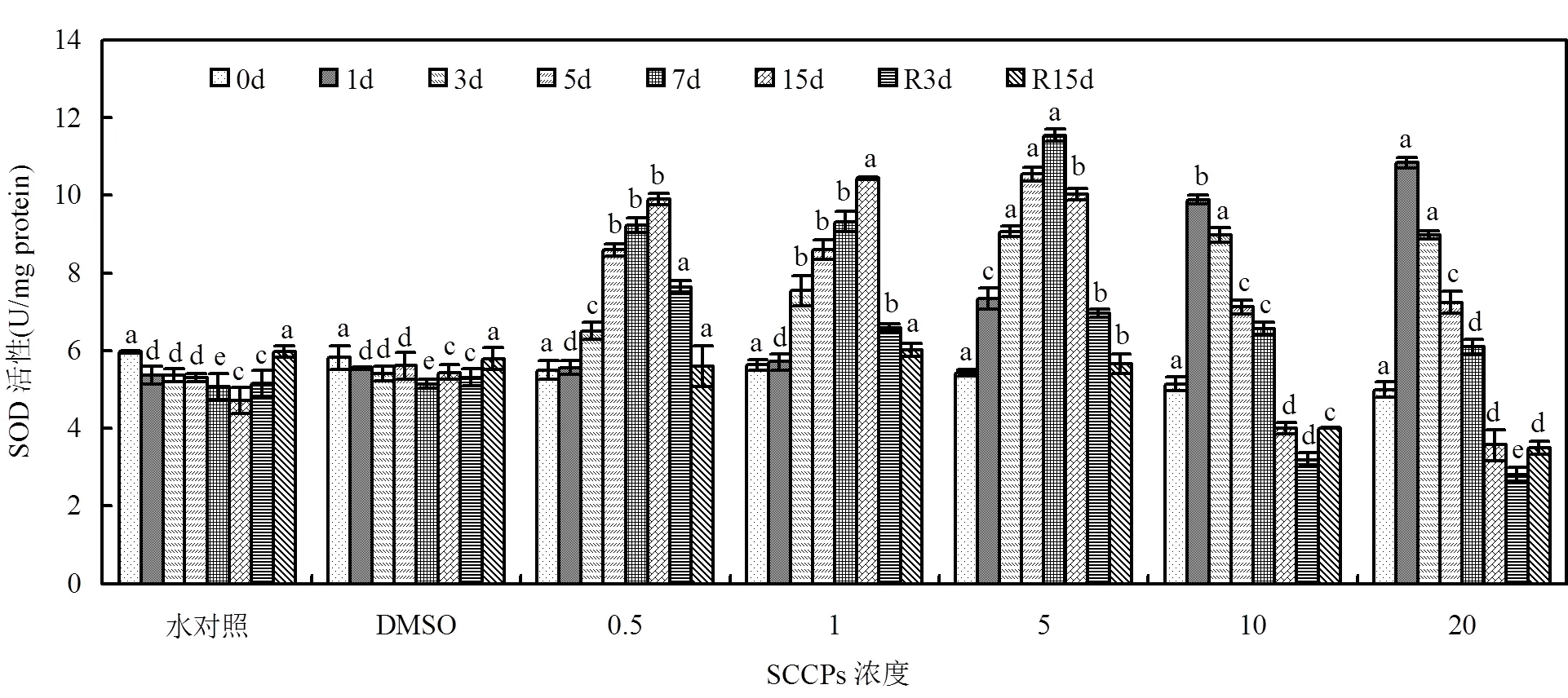
图5 不同SCCPs浓度下红树蚬鳃组织SOD活性变化
同一天测定的数据上标的不同字母表示在0.05的水平上差异显著(=8)
SOD酶活性在不同剂量-时间区间表现出不同的规律(图5).0.5,1mg/L组暴露初期SOD酶活性未有显著变化(>0.05),从第3d起,剂量-时间关系较为单调,呈现随时间变化逐渐上升的趋势.5mg/L组随暴露时间延长,SOD酶活性持续升高,7d达到最大值,随后酶活性开始下降. 10,20mg/L组酶活性暴露初期即达到最大值,随后酶活性逐渐降低,15d时已低于对照组水平(<0.01).去胁迫后,5mg/L以下胁迫组SOD酶活性逐渐降低到对照组水平(>0.05); 10, 20mg/L组酶活性R3d时继续下降,R15d时酶活性有所恢复,但未恢复到对照组水平(>0.05).
对于CAT酶,胁迫初期(1d)各组酶活性就达到最大值(图6).随暴露时间延长,酶活性呈明显的线性下降关系,其中10,20mg/L组在第15d时已显著低于对照组水平(<0.05).去胁迫后,各组酶活性均有所恢复,其中5mg/L以下组能够恢复到对照组水平(>0.05). 10mg/L组,CAT酶活性R3d时仍显著上升,R15d时酶活虽有所下降,但仍高于对照组水平(<0.05). 20mg/L组在胁迫结束后CAT酶活性虽有所恢复,但R15d时仍低于对照组水平(<0.05).
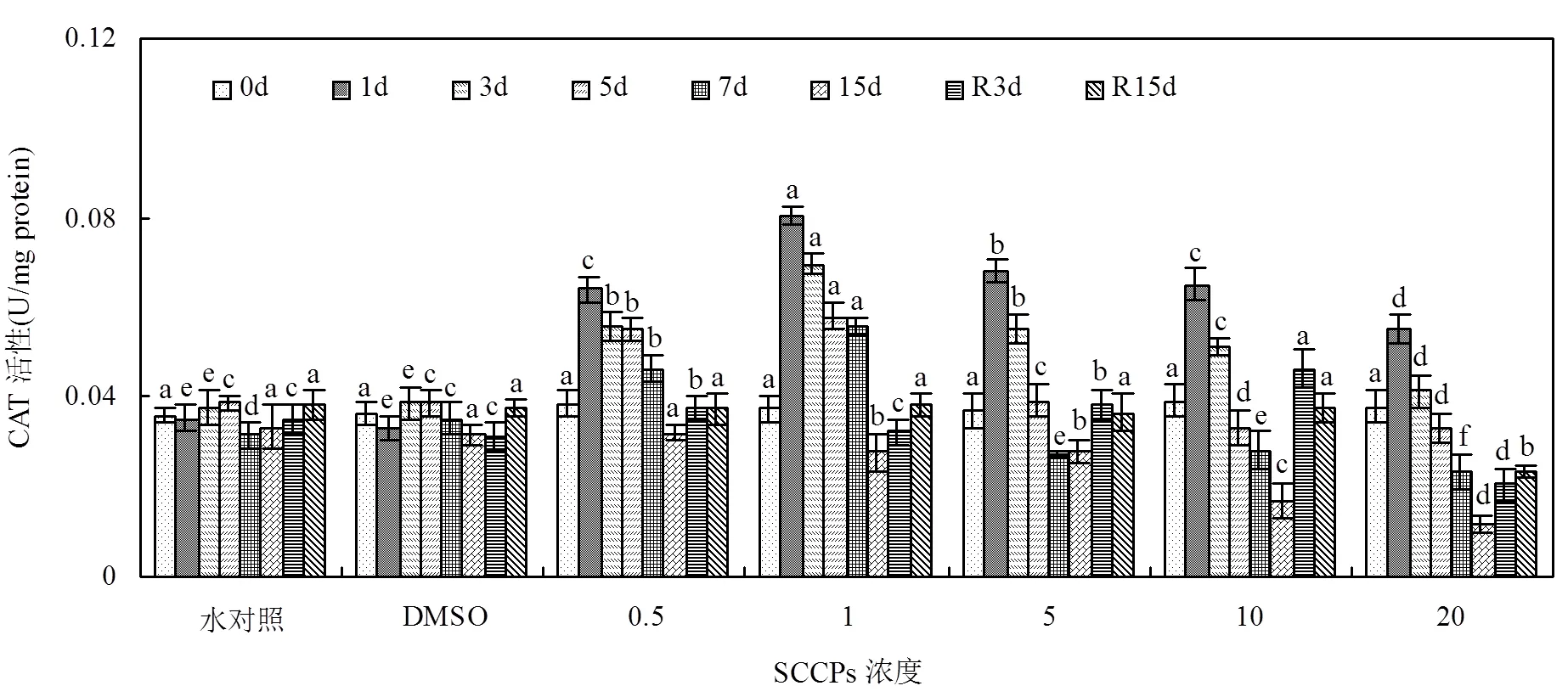
图6 不同SCCPs浓度下红树蚬鳃组织CAT活性变化
同一天测定的数据上标的不同字母表示在0.05的水平上差异显著(=8)
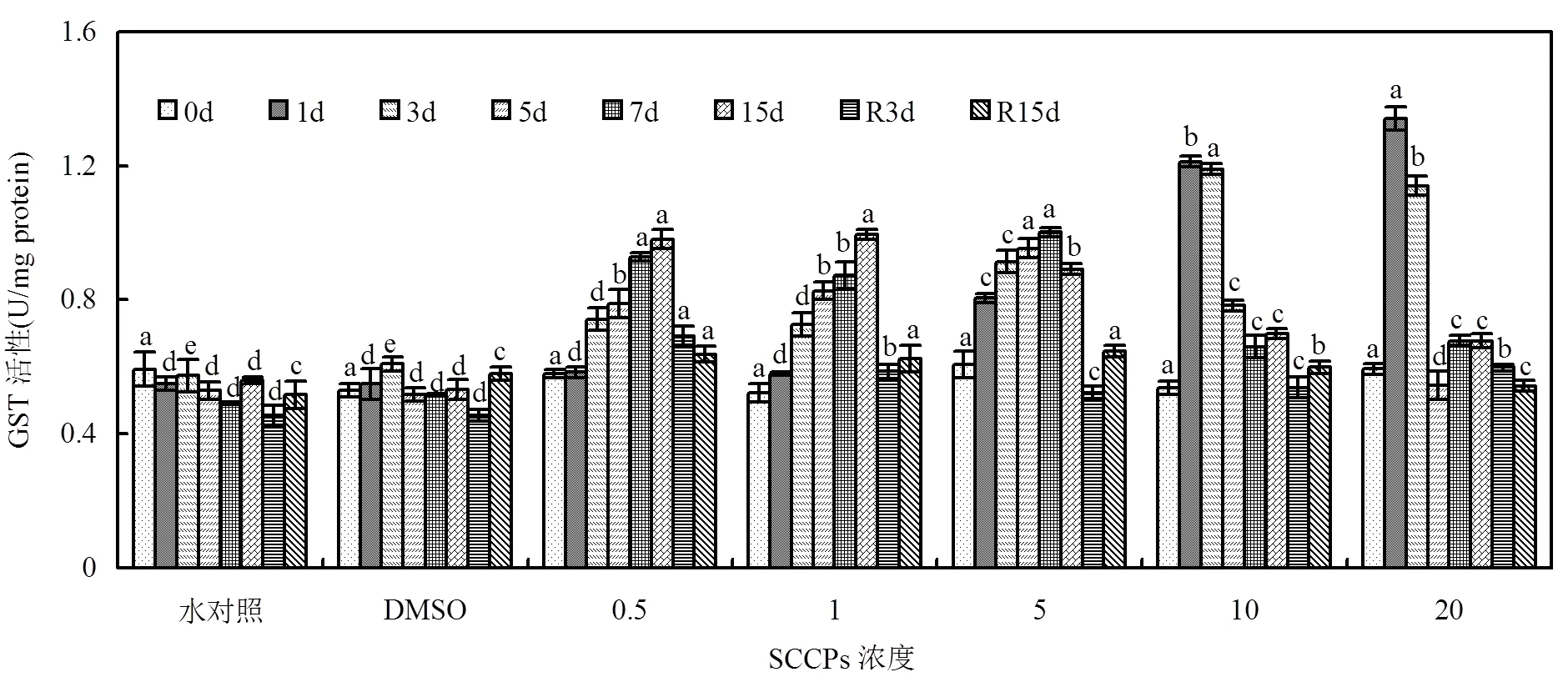
图7 不同SCCPs浓度下红树蚬鳃组织GST活性变化
同一天测定的数据上标的不同字母表示在0.05的水平上差异显著(=8)
各组GST酶活性如图7所示,0.5,1mg/L组暴露初期GST酶活性未有显著变化(>0.05),从第3d起呈现明显的线性上升趋势. 5mg/L组随时间延长,GST酶活性持续上升,7d达到最大值,15d时酶活性则有所下降. 10,20mg/L组酶活性暴露初期即达到最大值,第5d酶活性大幅度降低,胁迫后期酶活性略微上升.去胁迫后,各组恢复情况规律性不明显,其中0.5,20mg/L组GST酶活性呈现逐渐降低的趋势,中间浓度组GST酶活性均呈现先下降后上升的趋势.
各胁迫组MDA含量如图8所示,其中0.5, 1mg/L组MDA含量呈现升高-降低-升高的趋势,暴露初期(1d)MDA含量上升,随后MDA含量有所降低,第5d后继续升高. 5mg/L及以上胁迫组,MDA含量基本呈现单调上升的趋势.去胁迫后,0.5mg/L组MDA含量逐渐下降;其余胁迫组MDA含量在R3d时仍继续升高,R15d时MDA含量虽有所降低,但仍高于对照组水平(<0.05).
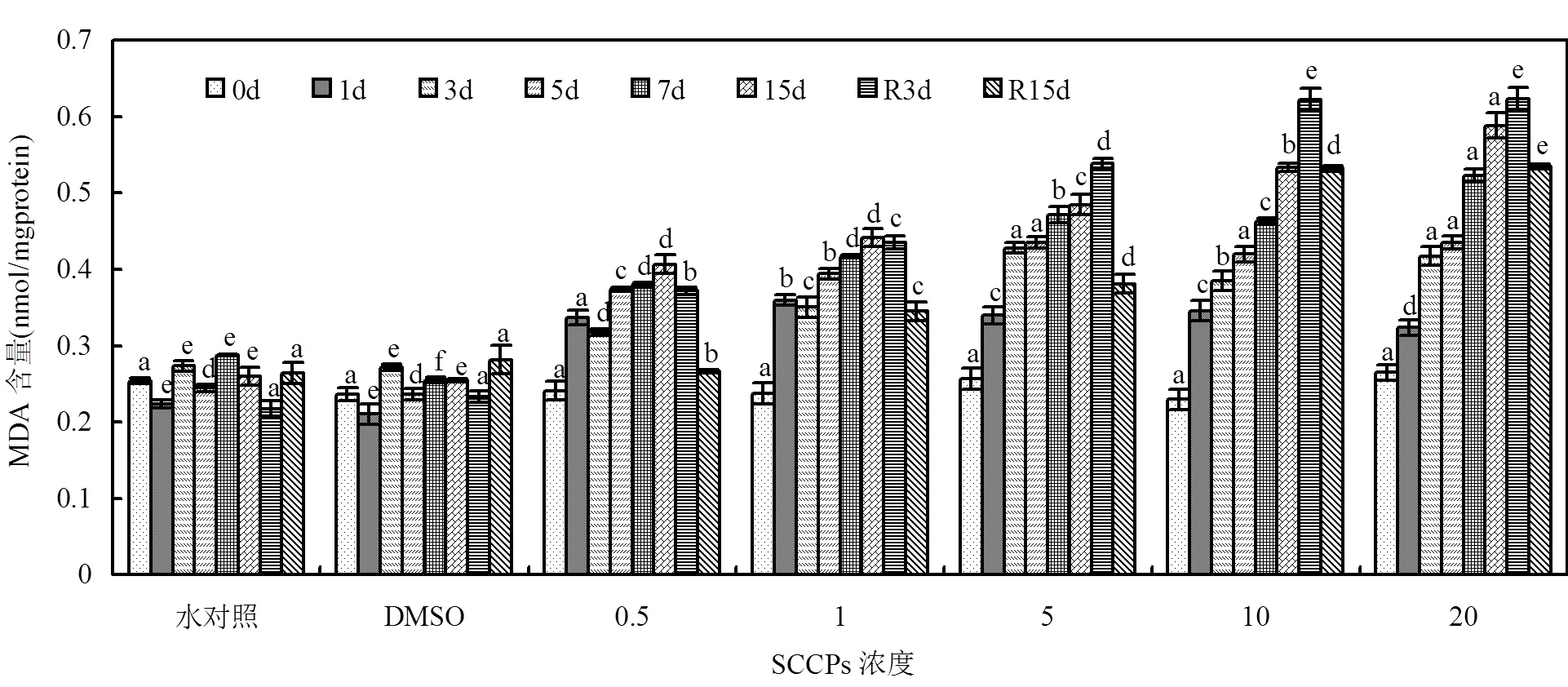
图8 不同SCCPs浓度下红树蚬鳃组织MDA含量变化
同一天测定的数据上标的不同字母表示在0.05的水平上差异显著(=8)
3 讨论
3.1 红树蚬抗氧化防御系统对SCCPs的响应
红树蚬作为双壳贝类,缺乏特异性免疫防御机制,其在受异物侵害时主要以血细胞为基础释放出抗毒性物质来清除逆境胁迫和杀灭病原微生物,而逆境胁迫主要为活性氧自由基[35]. SCCPs作为一种持久性有机污染物,被红树蚬吸收后会首先导致机体自由基生成量显著增加,诱导抗氧化酶的合成,使机体产生解毒反应.SOD和CAT是最先参与到这一过程的酶,是抗氧化防御系统的第一道防线.SOD将超氧阴离子(O2-)分解为H2O2和O2,CAT继续分解H2O2成H2O和O2,从而降低体内H2O2的浓度.而GST主要存在于细胞液中,是抗氧化防御系统第二道防线的代表.它不仅参与自由基的清除,也可清除脂质过氧化物,此外它也可防止外源性化学物质与生物大分子之间共价结合,起到解毒作用[36].本试验低浓度(0.5,1mg/L)胁迫组血液的SOD酶在胁迫初期(1d)先于鳃组织表现出活性.GST酶活性有一定滞后性,胁迫初期(1d)血液及鳃组织中GST酶活性均无明显变化,第3d时血液及鳃组织GST酶活性逐渐升高.低浓度(0.5,1mg/L)和中浓度(5mg/L)胁迫组血液和鳃组织的SOD、GST酶基本表现出随胁迫时间延长,酶活性逐渐上升的趋势;高浓度(10,20mg/L)胁迫组SOD、GST酶在开始表现出很高的活性之后逐渐下降.红树蚬体内SOD、GST酶活性在试验阶段表现出相似的变化趋势,这与17-雌二醇对双齿围沙蚕幼虫胁迫结果类似[37].低浓度(0.5,1mg/L)胁迫组血液CAT酶在胁迫初期(1d)酶活性显著上升,并在第3d达到最大值,鳃组织的CAT酶则从胁迫初期就表现出最高的酶活性,之后酶活性逐渐降低,并最终受到抑制.斑马鱼CAT酶对苯醚甲环唑胁迫也表现出相似的结果[38].试验中发现高浓度的SCCPs对CAT的诱导效果有限,反而低浓度胁迫诱导效果更明显.当红树蚬SOD、GST酶活性较低时,CAT酶会表现出一定的活性,以维持产生的氧自由基和抗氧化防御系统之间的平衡.何斌源等通过观察Cd对红树蚬胁迫也得到相似结果[39].有研究认为SOD催化O2-的歧化反应不是CAT底物H2O2的唯一来源, H2O2也可能来自氨基酸或细胞色素P450氧化酶的激活[40],这也许是CAT初期活性较高的原因.试验中发现在低、中浓度(£5mg/L),血液相对鳃组织抗氧化酶活性更加敏感,响应时间更短;高浓度两者则表现相近.这可能是因为血细胞同时兼容免疫-内分泌反应[41],所以中低浓度下反应较快.高浓度下,血液、鳃组织除免疫反应外,贝类神经系统也发挥重要作用,指导分泌应激激素使贝类免疫反应逐渐增强;陈慕雁[42]发现贝类应激激素具有明显的剂量依赖性.试验中,5mg/L是一个明显的分水岭,低于此浓度的SCCPs胁迫组更多表现为缓慢诱导作用,此时抗氧化系统能够有效发挥作用.而高于此浓度的胁迫组,抗氧化系统经过初期的应急反应后,随胁迫时间延长逐渐被破坏.
MDA是脂质过氧化的产物,对细胞膜有很强的破坏作用,其含量可反映机体内自由基产生量及对机体的影响程度. Bebianno 等提出高含量MDA是抗氧化防御机能丧失的结果[43].本试验MDA含量在血液和鳃组织中变化趋势相似.低浓度(0.5,1mg/L)胁迫时MDA含量与抗氧化酶活性呈负相关,在胁迫初期(1d)MDA含量升高,之后随着SOD、GST酶活性升高,MDA含量有所下降;随着胁迫时间延长及CAT酶活性下降,MDA含量再次小幅上升;去胁迫后,MDA含量即逐渐下降,推测是因为抗氧化系统为清除机体内的活性氧提供了有效保障.中等浓度(5mg/L)及以上胁迫组,MDA含量持续升高,R3d时MDA含量仍在升高,这显然是由于抗氧化系统遭到了破坏,导致机体内活性氧更迅速累积,从而加剧膜脂过氧化作用.
3.2 利用红树蚬作为指示生物的思考
红树林广泛接受径流、潮汐带来的污染物,已成为人类各种污染物的“汇”.红树蚬作为一种广泛分布于红树林区的双壳贝类,其滤食作用使其对沉积物-水界面微环境有较强的扰动作用,并促进了污染物吸收[44].一定浓度的污染物不仅不会造成其死亡,反而利于对生理生化指标的观察[39].研究表明红树蚬对Pb、Cu、Cd、Zn等重金属具有较强的主动富集能力,同时具有一定的耐受性[45].莫祖英[46]通过对PCBs胁迫下红树蚬转录组研究,发现其肌肉线粒体内与氧化磷酸化相关基因对PCBs敏感.王瑁等研究认为红树蚬主要取食沉积物表层凋落的红树植物碎屑,其中树皮和叶片的食物贡献率均为26%~50%[47].另有研究发现红树林湿地中残留落叶对PAHs具有较强的吸附作用,含量甚至高于其所在湿地的沉积物[48],对于活体红树植物,污染物则主要富集在树根或树干部位[49].上述结果暗示红树蚬可能是红树林内重金属、POPs等污染物进入食物链传递的重要节点.虽然红树蚬具有分布广泛、个体大小适中、全部处于野生状态且易于采集、抗病及适应能力强、剂量-效应关系明显等优点,但目前利用红树蚬作为指示生物也存在一些问题.
首先红树蚬在红树林区随高程变化呈阶梯分布,周浩郎等发现红树蚬多见于高潮带而鲜见于低潮带,其分布状况受沉积物紧实度和盐度制约[50].其次野外调查发现红树蚬()与歪红树蚬()在同一区域生长和分布,且形态极为相似,这对鉴别经验提出较高要求,此外鉴别过程中发现某些个体外形处于红树蚬与歪红树蚬中间形态,是否存在杂交现象目前还不清楚.最后,在自然环境中,生物体对污染压力的响应会受到季节、温度、营养条件等客观因素及繁殖期、疾病等主观因素影响,相对于文蛤、贻贝等广泛运用的指示生物,红树蚬生长发育、生理生化、不同层次标志物对海洋典型污染物响应等研究仍待完善.
4 结论
4.1 在低浓度(0.5,1mg/L)和中浓度(5mg/L)胁迫组,血液和鳃组织SOD、GST酶基本表现为随胁迫时间延长,酶活性逐渐上升的趋势;高浓度(10,20mg/L)胁迫组SOD、GST酶在胁迫初期表现出很高的活性,之后逐渐下降.CAT酶在胁迫初期表现出最高的酶活性,之后酶活性逐渐降低并最终受到抑制.
4.2 低、中浓度SCCPs(£5mg/L)胁迫下,血液的抗氧化酶活性相对于鳃组织更加敏感,响应时间更短;高浓度胁迫下两者表现相近.
4.3 MDA含量在血液和鳃组织中变化趋势相似,并与抗氧化酶活性呈负相关.MDA含量变化趋势表明抗氧化系统在低于5mg/L的SCCPs胁迫组能够有效发挥作用,而高于此浓度的胁迫组,抗氧化系统经过初期的应急反应后,随胁迫时间延长逐渐被破坏.
[1] Guo Z Y, Zhu H Y, Liang X G. Entransy: a physical quantity describing heat transfer ability [J]. International Journal of Heat and Mass Transfer, 2007,50(13): 2545-2556.
[2] 刘丽华,马万里,刘丽艳,等.短链氯化石蜡C10(50.2%Cl)对斑马鱼胚胎的发育毒性 [J]. 哈尔滨工业大学学报, 2016,4(8):127- 140.
[3] 石 萱.氯化石蜡如何破困局 [N]. 中国化工报, 2015-4-2(3).
[4] 沈 亮,罗 平,张宇峰.我国短链氯化石蜡产业现状及环境行为研究 [J]. 现代化工, 2016,36(3):1-6.
[5] Coelhan M. Levels of chlorinated paraffins in water [J]. Clean-Soil Air Water, 2010,38(5/6):452-456.
[6] Nicholls C R, Allchin C R, Law R J. Levels of short and medium chain length polychlorinated n-alkanes in environmental samples from selected industrial areas in England and Wales [J]. Environmental Pollution, 2001,114(4):415-430.
[7] Zeng L X, Wang T, Han W Y, et al. Spatial and vertical distribution of short chain chlorinated paraffins in soils from wastewater irrigated farmlands [J]. Environmental Science & Technology, 2011,45(6):2100-2106.
[8] Iozza S, Müller C E, Schmid P, et al. Historical profiles of chlorinated paraffins and polychlorinated biphenyls in a dated sediment core from Lake Thun (Switzerland) [J]. Environmental Science & Technology, 2008,42(4):1045-1050.
[9] Tomy G T, Stern G A, Lockhart W L, et al. Occurrence of C10- C13 polychlorinated n-alkanes in Canadian midlatitude and arctic lake sediments [J]. Environmental Science & Technology, 1999, 33(17):2858-2863.
[10] Barber J L, Sweetman A J, Thomas G O, et al. Spatial and temporal variability in air concentrations of short chain (C10-C13) and medium-chain (C14-C17) chlorinated n-alkanes measured in the UK atmosphere [J]. Environmental Science & Technology, 2005,39(12):4407-4415.
[11] Peters A J, Tomy G T, Jones K C, et al. Occurrence of C10-C13 polychlorinated n-alkanes in the atmosphere of the United Kingdom [J]. Atmospheric Environment, 2000,34(34):3085- 3090.
[12] Tomy G T, Muir D C G, Stern G A, et al. Levels of C10-C13 polychloro-n-alkanes in marine mammals from the Arctic and the St. Lawrence River estuary [J]. Environmental Science & Technology, 2000,34(9):1615-1619.
[13] Marvin C H, Painter S, Tomy G T, et al. Spatial and temporal trends in short-chain chlorinated paraffins in Lake Ontario sediments [J]. Environmental Science & Technology, 2003,37(20): 4561-4568.
[14] Castells P, Parera J, Santos F J, et al. Occurrence of polychlorinated naphthalenes, polychlorinated biphenyls and short-chain chlorinated paraffins in marine sediments from Barcelona (Spain) [J]. Chemosphere, 2008,70(9):1552-1562.
[15] Borgen A R, Schlabach M, Mariussen E. Screening of chlorinated paraffins in Norway [J]. Organohalogen Compounds, 2003,60: 331-334.
[16] Pribylova P, Klanova J, Holoubek I. Screening of short-and medium-chain chlorinated paraffins in selected riverine sediments and sludge from the Czech Republic [J]. Environmental pollution, 2006,144(1):248-254.
[17] Iino F, Takasuga T, Senthilkumar K, et al. Risk assessment of short-chain chlorinated paraffins in Japan based on the first market basket study and species sensitivity distributions [J]. Environmental Science & Technology, 2005,39(1):859-866.
[18] Chen M Y, LUO X J, Zhang X L, et al. Chlorinated paraffins in sediments from the pearl River Delta. South China: spatial and temporal distributions and implication for processes [J]. Environmental Science & Technology, 2011,45(23):9936-9943.
[19] 陈 晨,马新东,国 文,等.辽河口海域短链氯化石蜡污染特征及生物富集 [J]. 科学通报, 2014,59(7):578-585.
[20] Zeng L X, Zhao Z S, Li H J, et al. Distribution of short chain chlorinated paraffins in marine sediments of the East China Sea: Influencing factors, transport and implications [J]. Environmental Science Technology, 2012,46(18):9898-9906.
[21] Zeng L X, Wang T, Wang P, et al. Distribution and trophic transfer of short-chain chlorinated paraffins in an aquatic ecosystem receiving effluents from a sewage treatment plant [J]. Environmental Science & Technology, 2011,45(13):5529-5535.
[22] 于国龙.海洋环境中短链氯化石蜡的分析方法及应用研究 [D]. 大连:大连海事大学, 2012.
[23] Ma X D, Zhang H, Wang Z, et al. Bioacumulation and trophic transfer of short chain chlorinated paraffins in a marine food web from the Liaodog Bay, north China [J]. Environmental Science & Technology, 2014,48(10):5964-5971.
[24] Nilsen O G, Toftgard R, Glaumann H, et al. Effects of chlorinated paraffins on rat liver microsomal activites and morphology [J]. Archives of Toxicology, 1981,49(1):1-13.
[25] 李 勋,刘钰晨,陈敏杰.短链氯化石蜡急性暴露对SD雄性大鼠的组织病理学影响 [J]. 江汉大学学报, 2013,(41):5:20-25.
[26] Madeley J R, Maddock, B G. Toxicity of a chlorinated paraffin to rainbow trout over 60days. Chlorinated paraffin: 52% chlorination of intermediate chain length n-paraffins [R]. Brixham: Imperial Chemical Industries Ltd, Brixham Laboratory, 1983c.
[27] Thompson R S, Madeley J R. The acute and chronic toxicity of a chlorinated paraffin to Daphnia magna [R]. Devon: Imperial Chemical Industries PLC, 1983.
[28] Thompson R S, Madeley J R. The acute and chronic toxicity of a chlorinated paraffin to the mysid shrimp () [R]. Devon: Imperial Chemical Industries PLC, 1983.
[29] Brown D, Thompson R S. Phthalates and the aquatic environment: PartⅡThe bioconcentration and depuration of di-2-ethyl-hexyl phthalate (dehp) and di-isodecyl phthalate (didp) in mussel (mytilus-edulis) [J]. Chemosphere, 1982,11(4):427-435.
[30] 任立英,陈小刚,张 慧,等.羟胺发色法测定超氧化物歧化酶 [J]. 临床检验杂志, 1993,11(4):185-186.
[31] 刘砚韬,王振伟,张伶俐.过氧化氢酶活性测定的新方法 [J]. 华西药学杂志, 2013,28(4):403-405.
[32] 庞战军.自由基医学研究方法[M]. 北京:人民卫生出版社, 2000:147-202.
[33] 黄 虹.血清脂质过氧化代谢产物丙二醛测定方法的改进 [J]. 镇江医学院学报, 1999,9(3):457-458.
[34] Smith P K, Krohn R I, Hermanson G T, et al. Measurement of protein using bichinchoninic acid [J]. Analytical Biochemistry, 1985,150(1):76-85.
[35] 巩秀玉.壬基酚对波纹巴非蛤和菲律宾蛤仔的毒性效应[D]. 上海:上海海洋大学, 2012.
[36] 李 莹.三种典型有机污染物对鲫鱼抗氧化防御系统影响的研究[D]. 南京:南京大学, 2013.
[37] 董学兴,吕林兰,吕 富等.17β-雌二醇对双齿围沙蚕幼虫SOD、CAT和GST活性的影响[J]. 南方水产科学, 2014,10(6):83-87.
[38] 穆希岩,黄 瑛,沈公铭,等.苯醚甲环唑对斑马鱼抗氧化酶的影响 [J]. 中国环境科学, 2016,36(4):1242-1249.
[39] 赖廷和,何斌源,范航清等.重金属Cd胁迫对红树蚬的抗氧化酶、消化酶活性和MDA含量的影响[J]. 生态学报, 2011, 31(11):3044-3053.
[40] Peters L D, Porte C, Albaiges J, et al. 7-Ethoxyresorufin O-deethylase (EROD) and antioxidant enzyme activities in larvae of Sardine () from the north coast of Spain [J]. Marine Pollution Bulletion, 1994,28(5):299-304.
[41] Ottaviani E, Franceschi C. The invertebrate phagocytic immunocyte: clues to a common evolution of immune and neuroendocrine systems [J]. Immunology Today, 1997,18(4): 169-174.
[42] 陈慕雁.应激激素体外诱导对栉孔扇贝血细胞活性的影响[D]. 青岛:中国海洋大学, 2007.
[43] Bebianno M J, Serafim A, Camus L, et al. Antioxidant systems and lipid peroxidation infrom Mid- Atlantic Ridge hydrothermal vent fields [J]. Aquatic Toxicology, 2005,75(4):354–373.
[44] 江小桃.大亚湾养殖水域底栖生物生态修复技术的研究[D].广州:中国科学院南海海洋研究所, 2011.
[45] 何斌源,戴培建,范航清.广西英罗港红树林沼泽沉积物和大型底栖动物中重金属含量的研究 [J]. 海洋环境科学, 1996,15(1): 35-41.
[46] 莫祖英.多氯联苯(PCBs)胁迫下红树蚬转录组的初步研究 [D]. 桂林:广西师范大学, 2015.
[47] 王 瑁,高雪芹,丁弈朋,等.海南清澜港不同栖息位置红树林软体动物的食物来源 [J]. 湿地科学, 2015,13(2):171-174.
[48] 陆志强.多环芳烃对秋茄幼苗的生理生态效应及其在九龙江口红树林湿地的含量与分布[D]. 厦门:厦门大学, 2002.
[49] 张 军.典型红树林湿地中多环芳烃的含量、来源和迁移研究[D]. 厦门:厦门大学, 2006.
[50] 周浩郎,张俊杰,邢永泽,等.广西红树蚬的分布特征及影响因素分析[J]. 广西科学, 2014,21(2):147-152.
Response characteristics of oxidative stress biomarkers ofto exposure of SCCPs.
XING Yong-ze1,2,3, NONG Ying4, LU Yu-zhe4, YANG Ming-liu1, YAN Bing1*
(1.Guangxi Key Laboratory of Mangrove Conservation and Utilization, Guangxi Mangrove Research Center, Guangxi Academy of Sciences, Beihai 536007, China;2.Key Laboratory of Marine Environment and Ecology, Ministry of Education, Qingdao 266100, China;3.College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;4.College of Animal Science and Technology, Guangxi University, Nanning 530005, China)., 2017,37(10):3962~3971
This study aimed to investigate the response characteristics of 4 oxidative stress biomarkers, the activities of superoxide dismutase (SOD), catalase (CAT), glutathione-S-transferase (GST) and the level of malondialdehyde (MDA) in blood and gill tissue of theunder the condition of exposure to short-chain chlorinated paraffins (SCCPs) at different concentrations or with different exposure times.The results showed that SOD and GST activities in the blood and gill tissue increased along with the increase of exposure time under low stress (0.5mg/L, 1mg/L) or medium stress (5mg/L) of SCCPs. However, under high stress (10mg/L, 20mg/L), the activities of SOD and GST were high at the beginning of SCCPs exposure and then decreased gradually. CAT exhibited the highest activity at the initial stage (1d) of SCCPs exposure, and then its activity decreased gradually and finally was completely inhibited. In low stress group, the level of MDA appeared an up-down-up trend, however, in medium and high stress groups, the level of MDA increased continuously with the increase of exposure time. Taken together, the antioxidant system of thecould efficiently response to SCCPs when the concentration of SCCPs was lower than 5mg/L. However, when the concentration of SCCPs was higher than 5mg/L, after an initial emergency response, the antioxidant system was destroyed with the extending of exposure time. In addition, this study also explored the feasibility of usingas a bio-indicator for environment monitoring.
;short-chain chlorinated paraffins;oxidative stress biomarkers
X171
A
1000-6923(2017)10-3962-10
邢永泽(1983-),男,河北张家口人,助理研究员,中国海洋大学博士研究生,主要从事海洋生态毒理学研究.发表论文20篇.
2017-03-20
广西自然科学基金项目(2016GXNSFBA380033);广西科学院基本科研业务费资助(15YJ22HSL11)
*责任作者, 研究员, gxybing@outlook.com
