心叶烟中一类抗烟草普通花叶病毒病活性生物碱
2017-11-07周文兵计思贵李江舟崔永和张立猛
周文兵,计思贵,李江舟,崔永和,张立猛
(云南省烟草公司玉溪市公司,烟草行业病虫害生物防治工程研究中心,云南 玉溪 653100)
心叶烟中一类抗烟草普通花叶病毒病活性生物碱
周文兵,计思贵,李江舟,崔永和,张立猛*
(云南省烟草公司玉溪市公司,烟草行业病虫害生物防治工程研究中心,云南 玉溪 653100)
烟草普通花叶病毒(TMV)是烟草主要病害之一,利用色谱分离、纯化技术,采用活性追踪方法,对采自于云南省玉溪市的心叶烟(Nicotiana glutinosa L.)中的化学成分进行系统研究,从中分离得到了12个具有抗TMV活性的生物碱类化合物,其中3个为新化合物(1~3)[(S)-Nkolbisine-β-D-glucoside,(R)-Nkolbisine-β-D-glucoside,Lepabisine A],9个已知化合物(4~12)均为该属植物中首次分离得到。生物活性测定结果表明,该类生物碱能够钝化烟草普通花叶病毒并抑制其增殖。新化合物1对病毒抑制作用强于对照药物宁南霉素。该研究首次从烟草中发现具有抗TMV活性的一类生物碱类化合物,为进一步系统研究烟草内源性抗烟草花叶病毒病物质提供了科学依据。
生物碱;心叶烟;烟草普通花叶病毒(TMV);抑制活性
烟草普通花叶病毒(TMV)是世界上最先发现并确定的病毒,严重危害了烟叶的产量和质量,给烟农造成了巨大的经济损失[1]。由于植物病毒对寄主细胞具有绝对寄生性,病毒传播方式具有多样性,而植物缺乏完整的免疫系统,因而高效抗病毒剂的开发存在极大困难,至今尚未有理想的防治药剂[2]。目前采用的农业防治措施存在较大局限性,化学防治则易引发环保问题,于是人们把目光转向了抗TMV天然产物的研究与开发[3]。
烟草中的酚类物质对多种致病菌和病毒有较强的抑制和杀灭作用[4],从烟草中发掘高效、特异的内源性抗TMV化学防御物质用于烟草自身,不仅可以解决抗病毒药剂对寄主植物本身的毒害作用,也可以进一步扩宽烟草的使用空间。
本研究利用色谱分离、纯化技术,采用活性追踪的方法,对采自于云南省玉溪市的心叶烟中的化学成分进行抗TMV系统研究,为进一步开发利用烟草源抗性物质提供基础。
1 材料与方法
1.1 供试植物及药剂
心叶烟(Nicotiana glutinosa L.)种子由云南烟草农业科学研究院提供,田间植株采集于玉溪市马桥科研基地,全株自然阴干后粉碎过 40目筛,供提取活性成分使用。半叶枯斑法试验用烟株为无虫温室中漂浮育苗后移栽于高温灭菌土壤内,后挑选6~8片叶龄,且大小、质量相似的健康植株供试。
对照药剂:2%宁南霉素水剂(ningnanmycin AS),黑龙江强尔生化技术开发有限公司提供。
1.2 供试病毒
烟草普通花叶病毒(TMV)U1普通株系,由云南省烟草农业科学研究院提供。通过常规摩擦接种,使其在普通烟K326(Nicotianata tobacum K326)上繁殖,采用Gooding[5]的方法提纯。准确量取5 μL提纯的TMV,用0.01 mol/L的磷酸盐缓冲液(PB)稀释100倍,紫外分光光度计法测定其质量浓度为16 mg/mL。于-20 ℃冰箱中保存,临用前用 0.01 mol/L的PB稀释至32 μg/mL。
1.3 主要试剂和仪器
TECH X-4熔点仪。Horiba SEPA-300数字式旋光仪。Bio-Rad FTS-135红外光谱仪。Shimadzu UV-2401A紫外光谱仪。ESIMS和 EIMS在 VG Autospec-3000质谱仪上测定(以甘油或间硝基苄醇为底物)。HREIMS在API Qstar Pulsar质谱仪上测定。1D和2D NMR在Bruker AM-400、DRX-500或AV-600核磁共振仪上测定,TMS为内标。Agilent 1100分析或半制备型液相色谱仪,色谱柱为Zorbax Eclipse XDB-C18(Agilent,4.6 mm×150 mm,1 mL/min;9.4 mm×250 mm,2 mL/min),二极管阵列检测器(DAD)。柱层析硅胶(200~300目)和薄层层析硅胶板均为青岛裕民源硅胶试剂厂生产。反相填充材料 Lichroprep RP-18(40~63 μm)为 Merk公司生产或日本 Fuji公司生产。MCI填充材料MCI-gel CHP-20P为日本三菱公司生产。凝胶材料Sephadex LH-20为Pharmacia公司生产。生物碱显色剂为改良的碘化铋钾溶液。常规显色剂为碘蒸气和5%~10% H2SO4-EtOH溶液。
1.4 活性成分的提取、分离及结构鉴定
1.4.1 活性成分的提取 称取样品粗粉 10 kg,用甲醇(工业级)渗漏提取至提取液颜色较浅为止,合并滤液后减压浓缩得浸膏1.3 kg,于 4 ℃冰箱中保存备用。
1.4.2 活性成分的分离 将甲醇提取物利用蒸馏水悬浊,分别经石油醚、乙酸乙酯和正丁醇萃取,包括水相共得到4个极性部分。利用活体半叶枯斑法[6],对各组分进行抗 TMV活性测试,其中乙酸乙酯萃取部分表现出较强的抗TMV活性。将该部分采用正相硅胶柱层析分离,用氯仿-甲醇(0:1~8:2)进行梯度洗脱,得到组分 Fr.1~Fr.4,同样采用活体半叶枯斑法进行活性检测,发现Fr.2抗TMV活性最强。将Fr.2用小孔树脂(MCI)除去大部分色素后,经硅胶(200~300目)柱层析,以石油醚-丙酮(10:1~2:1)梯度洗脱得到3个部分Fr.2-1~Fr.2-3。采用活体半叶枯斑法进行活性检测,发现Fr.2-2抗TMV活性最强。Fr.2-2经反相RP-18色谱柱,以甲醇-水(30%~100%)梯度洗脱,再经制备和半制备分离纯化得到化合物1 (8 mg),2 (4 mg),3 (9 mg),4 (25 mg),5 (85 mg),6 (10 mg),7 (25 mg),8 (12 mg),9 (38 mg),10 (22 mg),11 (43 mg),12 (24 mg)。
1.4.3 结构鉴定 根据熔点、质谱及核磁共振氢谱及碳谱的检测结果,并结合相关文献解析得到化合物的结构。
1.5 活性测定
采用半叶枯斑法[6],在(22±1) ℃下进行,以健康、生长旺盛的 5~6叶期心叶烟为试验材料。化合物的供试浓度均为 1 mg/mL,以宁南霉素 20倍稀释液为对照。
1.5.1 体外钝化作用 钝化试验中,左半叶接种化合物或宁南霉素与病毒等体积混合液,右半叶接种蒸馏水与病毒等体积混合液(对照)。化合物和宁南霉素均稀释50倍,钝化时间均为1 h。每处理接种6片叶子,重复3次,3 d后统计枯斑数,计算抑制率。枯斑抑制率按照1.5.3中公式计算。
1.5.2 抑制TMV初侵染和增殖作用 初侵染试验中,各处理分别在施药24 h后接种病毒;增殖试验中,均在接种病毒后24 h施药。施药方式为涂抹法,左半叶涂抹供试药剂,右半叶为清水对照。每处理接种6片叶子,重复3次,3 d后统计枯斑数,计算抑制率。枯斑抑制率按照1.5.3中公式计算。
1.5.3 结果计算及统计方法 室内生测试验中,统计处理和对照的枯斑数,计算枯斑抑制率:
枯斑抑制率(%)=(对照枯斑数-处理枯斑数)/对照枯斑数×100
采用SPSS 13.0统计软件进行数据分析处理,用单因素方差分析统计各处理平均数的差异,LSD法比较各处理间的差异显著性。
2 结 果
2.1 活性成分的分离、纯化及结构鉴定
采用色谱技术从心叶烟中分离得到3个新化合物和 9个已知化合物,这些化合物鉴定如下:(S)-Nkolbisine-β-D-glucoside (1),(R)-Nkolbisine-β-D-glucoside (2),Lepabisine A (3),Skimmiamine (4)[7],(S)-Nkolbisine (5)[8],Nkolbisine (6)[9],Methylevoxine(7)[10],Haploperine (8)[8],Melineurine (9)[11],Evodine(10)[12],Evoxoidine (11)[13],Myrtifoline (12)[14],具体结构如图1(*表示新化合物)。
2.1.1 新化合物结构鉴定 化合物1为白色粉末,ESI+MS显示准分子离子峰510 [M+H]+,13C NMR谱显示24个碳信号(表1):4个甲基(δC25.8,26.4,60.0,62.1),2个亚甲基(δC62.5,71.2),10个次甲基(δC71.4,75.7,77.9,78.0,86.3,106.2,106.3,114.3,119.6,144.3),8个季碳(δC73.7,103.2,115.8,152.9,141.9,142.6,159.0,165.9),结合其二维核磁共振谱图数据,可以确定分子式为C24H31NO11,不饱和度为10。
由1H NMR谱δH4.55 (1H,d,7.8),3.24 (1H,m),3.28 (1H,m),3.33 (1H,m),3.28 (1H,m),3.68 (1H,dd,11.6,4.4),3.60 (1H,dd,11.6,4.4)及13C NMR 谱δC106.2 (d) 75.7 (d) 78.0 (d);71.4 (d);77.9 (d),62.5 (t)推测该化合物含糖,经比对发现该化合物糖部分化学位移值与葡萄糖基本一致,推测1可能是苷元与葡萄糖成苷。
将 1的苷元部分各化学位移值与(S)-Nkolbisine[8]的波谱数据进行比对,发现 1的苷元部分与(S)-Nkolbisine的数据基本吻合,但在C-2'处的化学位移值不同。应用 HMQC对碳氢数据归属后,在HMBC中可观察到H-Glc-1'(δH4.55,1H,d,J=7.8 Hz)与 C-2'(δC86.3)的相关信号(图 2)。
以上信息说明化合物1中的葡萄糖C-1与苷元的C-2'相连。这样就确定了该化合物的平面结构。
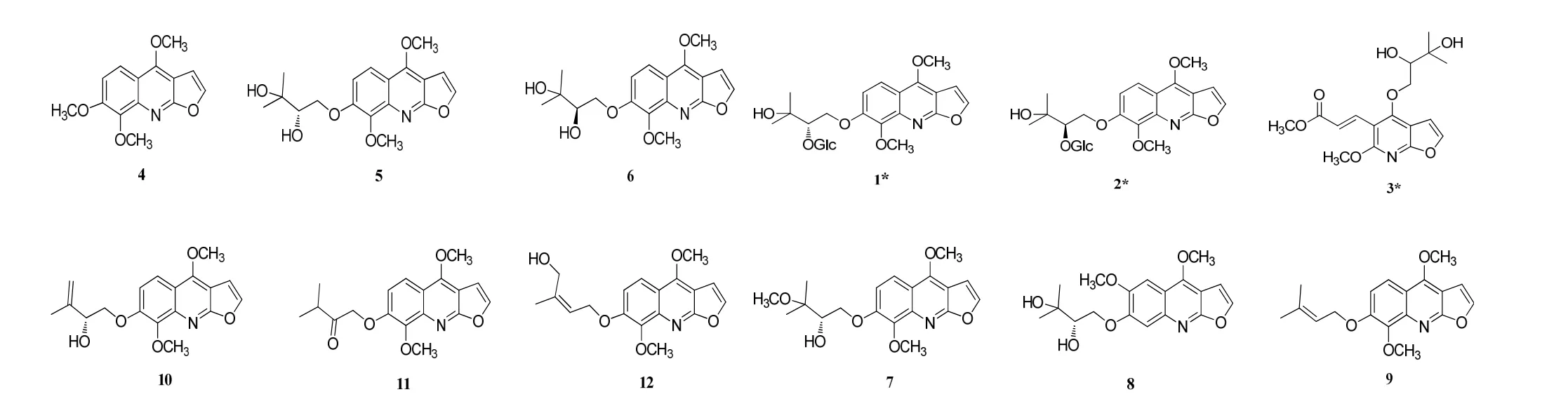
图1 化合物1~12的结构Fig. 1 Structures of 1-12

表1 化合物1和2 NMR数据(溶剂为 CD3OD)Table 1 NMR data of 1 and 2 (in CD3OD)
化合物 1经过水解后得到苷元部分和糖部分,经分离测定苷元 CD 数据[245 (Δε+4.51),220 (Δε+0.32) nm],发现与(S)-Nkolbisine[8]基本一致,说明二者构型相同,同时得到的糖在HPLC上保留时间与β-D型葡萄糖一致。至此确定了化合物1的结构(图 3),命名为(S)-Nkolbisine-β-D-glucoside。
把化合物2的NMR数据与化合物1进行比较发现两个化合物的数据基本一致,仅在连糖的2'位和糖的1位化学位移值存在较大差异。在1中2'位和糖的 1位上的碳氢化学位移值分别为δC86.3,106.2和δH3.90,4.55;而在2中2'位和糖的1位上的碳氢化学位移值则分别为δC83.9,103.6和δH4.12,4.83;说明化合物1和2的2'位构型不同,这样我们确定了化合物 2的结构,如图 3,命名为(R)-Nkolbisine-β-D-glucoside。
化合物 3为白色粉末,通过其高分辨质谱HREIMS m/z 351.1312 [M]+(C17H21NO7, 351.131 8),和一维和二维核磁共振谱图数据(表2),可以确定分子式为C17H21NO7,不饱和度为8。其13C NMR谱显示 17个碳信号:4个甲基(δC24.9,26.5,53.1,60.0),1个亚甲基(δC66.8),5个次甲基(δC77.0,106.9,123.2,138.9,146.7),7个季碳(δC72.5,110.3,120.4,160.5,164.0,167.1,167.4),从这些数据可知,该化合物骨架结构类似 Nkolbisine,但又有差异。
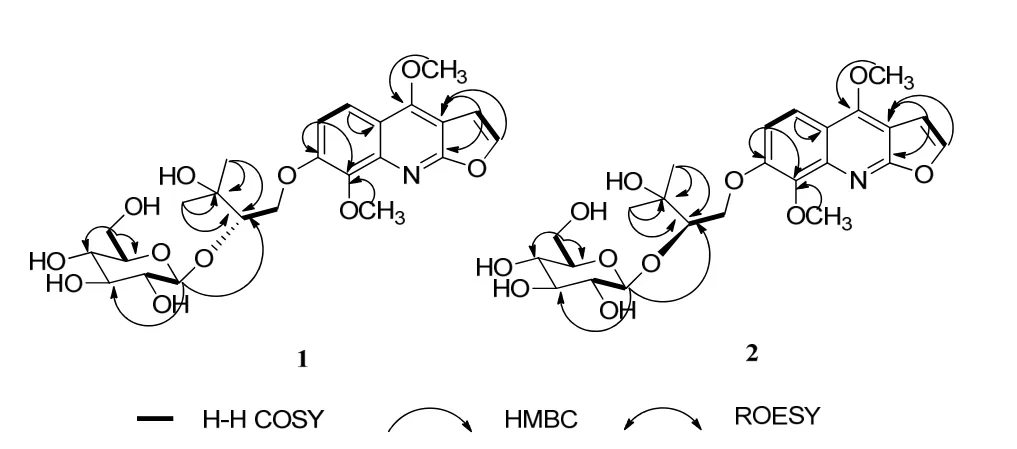
图2 化合物1和2的主要2D NMR相关信号Fig. 2 Key 1H-1H COSY () and HMBC (HC)correlations of 1 and 2
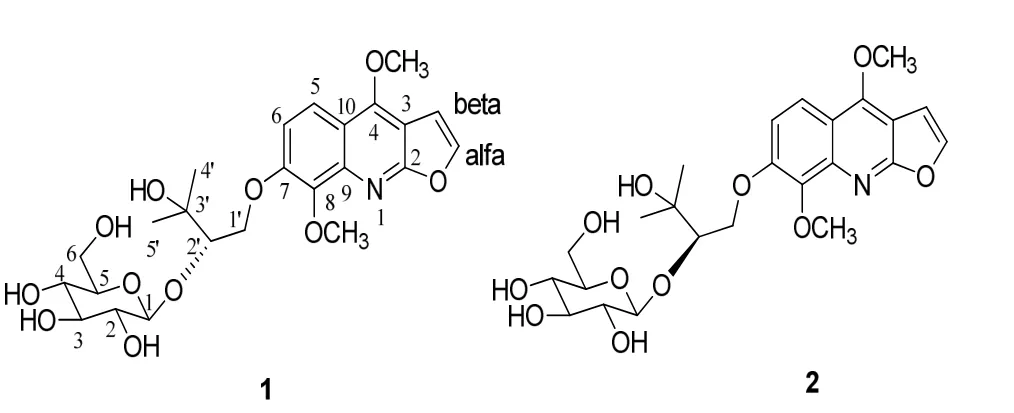
图3 化合物1和2的结构Fig. 3 Structures of 1and 2
通过 HMQC对碳氢数据进行归属,在1H-1H COSY中可以观察到H-2'(δH3.37,1H,dd,8.5,2.5)与 H-1'(δH3.90,1H,dd,11.5,8.5和4.20,1H,dd,11.5,2.5)的相关信号。另外在 HMBC中可以观察到H-4'和H-5'(δH1.10,3H,s和1.67,3H,s)与C-2'(δC77.0)和C-3',H-1'与C-4(δC167.1)的相关信号,说明异戊烯基的存在并连接在C-4位;在HMBC中还可以观察到H-7(δH7.19,1H,d,11.8)与 C-8(δC123.2),C-9(δC167.4),C-5(δC120.4),C-4(δC167.1),C-6(δC160.5)的相关信号;H-β(7.28,1H,d,2.6)与 C-2(δC164.0),C-3(δC110.3),C-α(δC146.7)的相关信号,根据这些信息基本可以确定该化合物的平面结构,如图4;根据H-7和H-8的耦合常数(11.8)可知该双键为E式。通过这些分析我们最后确定了3的结构,该化合物为一新化合物,命名为 lepabisine A。2.1.2 化合物理化数据 (1)(S)-Nkolbisine-β-D-glucoside:白色粉末,C24H31NO11。1H NMR (400 MHz, CD3OD) and13C NMR(100 MHz,CD3OD)(表 1),ESI+MS:510 [M+H]+,532 [M+Na]+,1041[2M+Na]+,ESI-MS:508 [M-H]-。
(2)(R)-Nkolbisine-β-D-glucoside:白色粉末,C24H31NO11。1H NMR (400 MHz, CD3OD) and13C NMR (100 MHz, CD3OD)(表 1);ESI+MS: 510[M+H]+,532 [M+Na]+,1041 [2M+Na]+,苷元 CD (c 0.08,MeOH):λ (Δε) 220 (0.32),245 (4.51)。
(3)Lepabisine A:白色粉末;[α]22.8D+0.6 (c 0.10,MeOH);UV (MeOH) λmax(logε) 204 (4.46),251(4.05) nm;CD (c 0.13, MeOH) λ (Δε) 195 (3.5),225 (-0.9),nm,IR (KBr) νmax3429,2954,1726,1638,1571,1376,1276,1171,1096,1053 cm-1;1H NMR(500 MHz,CD3OD) and13C NMR (100 MHz,CD3OD)(表 2);HREIMS m/z 351.1312 [M]+(calcd.for C17H21NO7,351.1318)。
化合物4-12理化数据见文献[7-14]。
2.2 各化合物生物活性测定
2.2.1 各化合物对TMV体外钝化作用 表3表明,部分化合物对TMV病毒粒子具有强烈的体外钝化活性,3个新化合物1~3和已知化合物4的抑制率均大于80%;在相同浓度和钝化时间下,化合物1和6表现出与宁南霉素相近的活性。
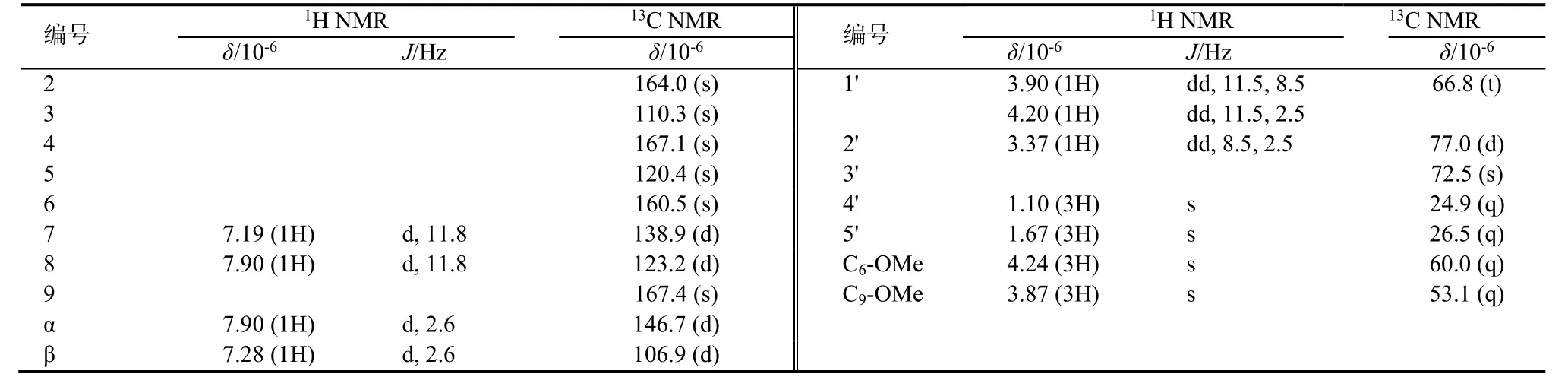
表2 化合物3的NMR数据(溶剂为 CD3OD)Table 2 NMR data of 3 (in CD3OD)
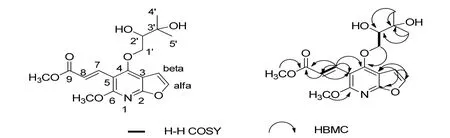
图4 化合物3的结构及其主要2D NMR相关信号Fig. 4 The structure and key 1H-1H COSY () and HMBC (H C) correlations of 3
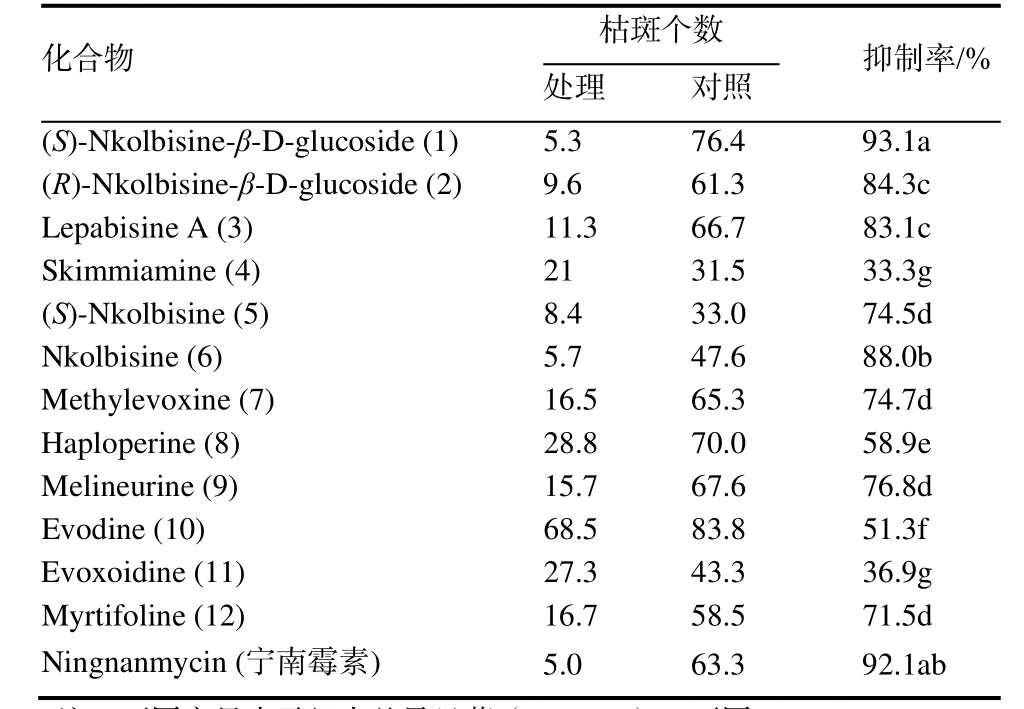
表3 各化合物对TMV的钝化作用Table 3 Inhibiting effects of compounds on TMV
2.2.2 各化合物对TMV初侵染的抑制作用 由表4可看出,部分化合物对 TMV初侵染表现出明显的抑制作用,施药24 h后接种,新化合物1和2及已知化合物 9处理对 TMV的抑制率分别达到了81.6%、84.1%和78.0%,显著高于同等浓度对照药剂宁南霉素处理。
2.2.3 各化合物对TMV复制增殖的抑制作用 从表5可以看出,部分化合物对TMV的复制增殖表现出较好的抑制作用。接种24 h后施药,化合物1和11对TMV的抑制率分别达到71.5%和75.9%,表现出与同等浓度宁南霉素相近的活性。
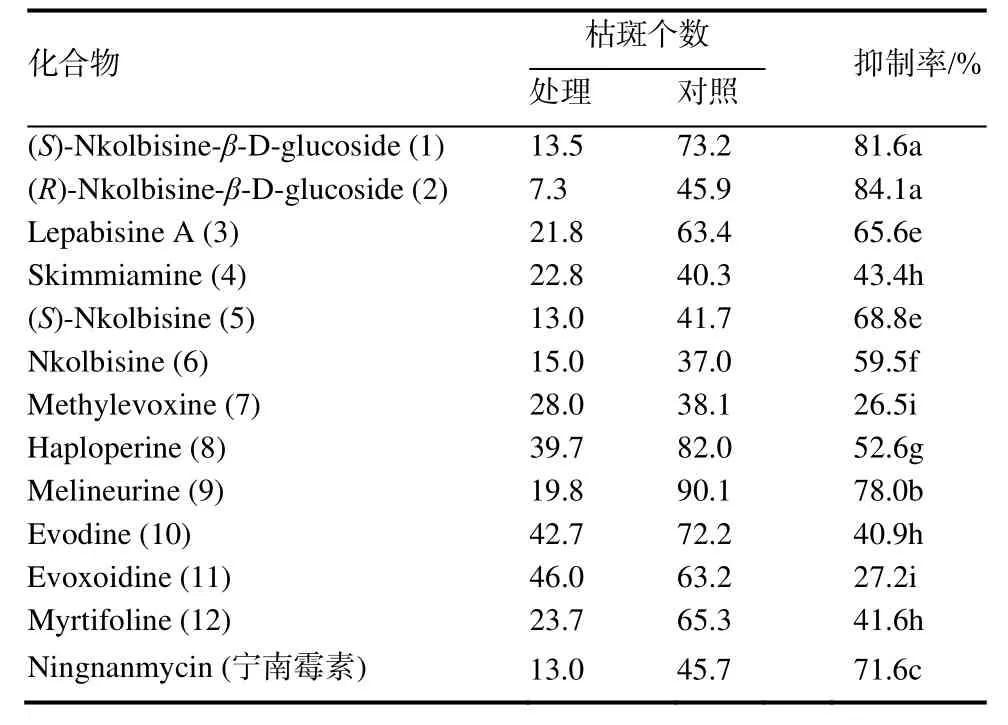
表4 各化合物对TMV初侵染的抑制作用Table 4 Protection effects of compounds on primary infection of TMV
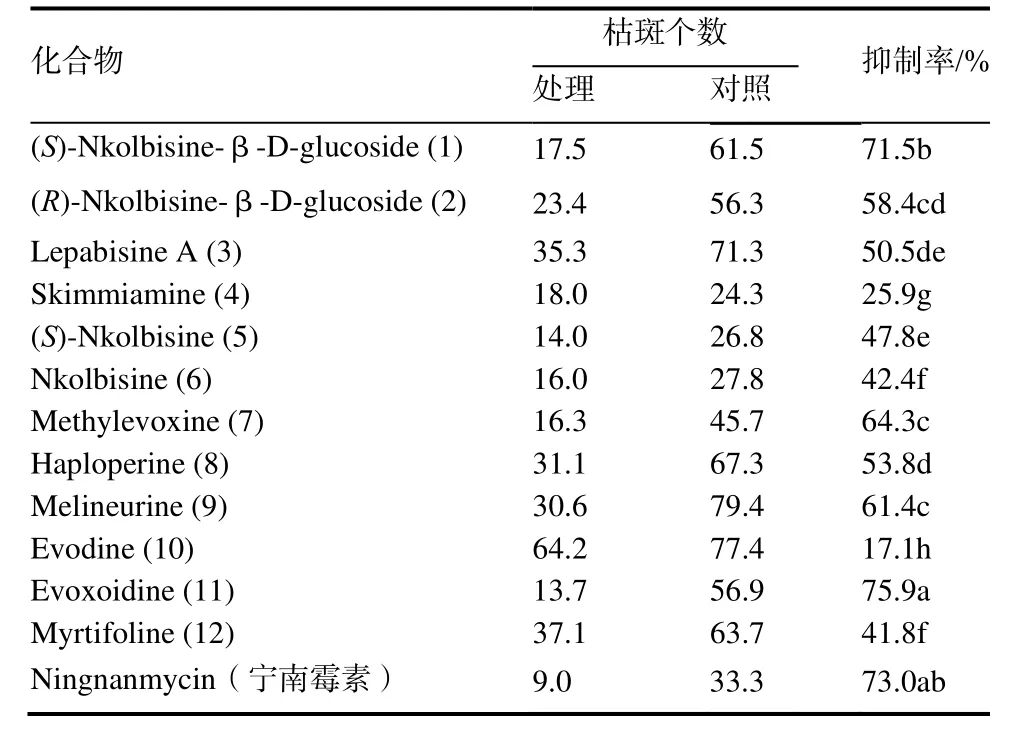
表5 各化合物对TMV复制增殖的抑制作用Table 5 Curative effects of compounds on TMV
3 讨 论
植物为了自身的生存,在与病原微生物的对抗中,通过多种代谢途径在体内形成一批具有抵抗病原物入侵功能的代谢产物,一般研究认为,这些代谢产物是调控植物抗病性的重要物质基础[15]。同时,由于这些代谢产物由植物自身合成,因此对自身的细胞毒性较小[16]。
国内外研究者对烟草中的代谢产物进行了大量研究,从中发现了具有抗病毒作用的活性物质。研究还发现,烟草中酚类化合物对清除自由基作用良好,并且富含抗氧化活性[17-18]。流行病学研究表明,抗氧化化合物一般都具有一定的抗病毒活性[19-20]。同时,学者还发现烟草中含量较高的绿原酸的水解产物咖啡酸具有抑制单纯疱疫病毒的功效[21]。德国Free大学EICH教授在研究植物次生代谢物作为抗逆转录病毒剂时,发现绿原酸及其衍生物具有较好的抗艾滋病毒(HIV)活性[21]。这些研究是烟草次生代谢产物在人体医学上的应用,而对烟草中具有抵抗病原物入侵功能的代谢产物研究甚少。本研究首次从植物防御角度对心叶烟的防御物质进行了系统研究,并从中分离得到了一类具有抗烟草普通花叶病毒活性的生物碱,为烟草中抗烟草普通花叶病毒代谢产物的研究提供了物质基础。
4 结 论
本研究利用活性追踪法对心叶烟中的抗烟草普通花叶病毒活性物质进行了研究,从中分离得到了 12个对烟草普通花叶病毒具有较强抗性的一类生物碱,其中3个为新化合物。用半叶枯斑法测定12个化合物对TMV的抑制作用表明,12个化合物均具有一定的钝化作用和抑制病毒侵染作用,其中新化合物1对TMV的活体钝化作用、初侵染、复制增殖的抑制率分别为93.06%、81.55%和71.54%,钝化作用和初侵染抑制作用均强于对照宁南霉素,显示了心叶烟中的小分子化合物良好的抗TMV活性。但对其药剂配制及田间防效还需要进一步研究。
[1] 耿召良,商胜华,陈兴江,等. 植物源抗烟草花叶病毒天然产物研究进展[J]. 中国烟草科学,2011,32(1):84-91.
[2] 许良忠,郭玉晶,张书圣. 植物病毒病化学防治研究进展[J]. 青岛化工学院学报,2000,21(4):293-297.[3] 郭亮,蔡海林,何命军,等. 植物源活性天然提取物抗烟草花叶病毒的研究进展[J]. 湖南农业科学,2012(23):77-79,83.
[4] 周恒,许自成,赵会纳,等. 烟草多酚类物质的研究进展[J]. 浙江农业科学,2009,1(5):949-953.
[5] GOODING G V, HEBERT T T. A simple technique for purifi cation of tobacco mosaic virus in large quantities[J].Phytopathology, 1967, 57(11): 1285.
[6] 田波,裴美云. 植物病毒研究方法(上册)[M]. 北京:科学出版社,1987.
[7] MUHAMMAD S A, MUHAMMAD K P,MUHAMMAD S, et al. HAPLOPHY-A and B: the alkaloidal constituents of Haplophyllum acutifolium [J].Phytochemistry, 2001, 57: 1277-1280.
[8] WANSI J D, MESAIK M A, CHIOZEM D D, et al.Oxidative burst inhibitory and cytotoxic indoloquinazoline and furoquinoline alkaloids from Oricia suaveolens[J]. Journal of natural products, 2008,71: 1942-1945.
[9] 况成裕,姜立会,丁双婷,等. 见血飞的化学成分研究[J]. 食品与药品,2013,15(2):110-112.
[10] AKHMEDZHANOVA V I, BESSONOVA I A,YUNUSOV S Y. Alkaloids of Haplophyllum perforatum[J]. Chemistry of natural compounds, 1976, 12(3):282-288.
[11] FRANCOIS T, GENEVIEVE B, MICHEL K. Synthesis of Melineurine and Evellerine [J]. Journal of natural products, 1983, 46: 132-134.
[12] WU T S. Baiyumine-A and -B, two acridone alkaloids from Citrus grandis[J]. Phytochemistry, 1987, 26:873-875.
[13] AKHMEDZHANOVA V I, BESSONOVA I A,YUNUSOV S Y. Quinoline alkaloids of haplophyllum [J].Khimiya prirodnykh soedinenii, 1977, 2: 289-290.
[14] BILGE S, MUTLUGIL A, NOYANALPAN N, et al.Alkaloids from haplophyllum myrtifolium boiss [J].Journal of faculty of pharmacy of Gazi University, 1990,7: 17-24.
[15] 覃瀚仪,李魏,戴良英. 植物代谢产物在抗病反应中的功能研究进展[J]. 中国农学通报,2015,31(18):256-259.
[16] DIXON R A. Natural products and plant disease resistance[J]. Nature, 2001, 411(6839): 843-847.
[17] VELIOGLU Y S, MAZZA G, GAO L, et al. Antioxidant activity and total phenolics in selected fruits, vegetables,and grain products [J]. Journal of agricultural and food Chemistry, 1998, 46(10): 4113-4117.
[18] ZHENG W, WANG S Y. Antioxidant activity and phenolic compounds in selected herbs[J]. Journal of agricultural and food chemistry, 2001, 49(11):5165-5170.
[19] OWEN R W, GIACOSA A, HULL W E. The antioxidant/anticancer potential of phenolic compounds isolated from olive oil[J]. European journal of cancer,2000, 36(10): 1235-1247.
[20] SALA A, REDO M D, GINER R M, et al.Anti-inflammatory and antioxidant properties of Helichrysum italicum[J]. Journal of pharmacy and pharmacology, 2002, 54(3): 365-371.
[21] 高锦明,张鞍灵,张康健,等. 绿原酸分布、提取与生物活性研究综述[J]. 西北林学院学报,1999,14(2):73-82.
Study on the Anti-TMV Activity of the Alkaloids from Nicotiana Glutinosa
ZHOU Wenbing, JI Sigui, LI Jiangzhou, CUI Yonghe, ZHANG Limeng*
(Application Technology of Biological Control for Tobacco Diseases and Insect Pests Engineering Research Center of China Tobacco,Yunnan Tobacco Company, Yuxi Branch, Yuxi, Yunnan 653100, China)
Tobacco mosaic virus (TMV) is one of the main diseases of tobacco. The study aims to investigate the anti-TMV activity of chemical compound from tobacco by using Bioassay-guided Method and provide the basis for anti-viral biological pesticides from tobacco. The constituent of anti-TMV activity was isolated from Nicotiana glutinosa in Yuxi by bioassay. A kind of alkaloids that include three new compounds (1-3) [(S)-Nkolbisine-β-D-glucoside, (R)-Nkolbisine-β-D-glucoside, Lepabisine A] and nine known ones (4-12), were isolated from the whole-plant of Nicotiana glutinosa by various chromatographies such as silica gel, Sephadex LH-20, RP-18 column chromatography and HPLC. Their structures were elucidated by spectroscopic methods, including extensive 1D and 2D NMR techniques. These compounds were also evaluated for their anti-tobacco mosaic virus (anti-TMV) activity. The results revealed that compounds 1 exhibited high anti-TMV activity with inhibition rate of 93.1%, 81.6% and 71.5%, respectively.The rates are higher than those of positive control. The other compounds also showed potential anti-TMV activity. This is the first report on the defense chemicals in tobacco, and provides scientific basis for the next systemic research.
alkaloid; Nicotiana glutinosa; tobacco mosaic virus (TMV); inhibitory activity
S435.72
1007-5119(2017)05-0001-07 DOI:10.13496/j.issn.1007-5119.2017.05.001
中国烟草总公司云南省烟草公司科技计划项目“烟草内源性抗烟草花叶病成分研究”(2015YN11)
周文兵(1983-),男,博士,农艺师,主要从事烟草药用化学成分研究。E-mail:yaowufx2001@163.com*通信作者,E-mail:zlm.d@163.com
2017-05-03
2017-08-25
