益气活血法对MNNG诱导萎缩性胃炎癌前病变大鼠hedgehog信号通路的调控作用
2017-11-03赵唯含史瑞谭祥陈晨毛堂友李军祥
赵唯含 史瑞 谭祥 陈晨 毛堂友 李军祥
·论著·
益气活血法对MNNG诱导萎缩性胃炎癌前病变大鼠hedgehog信号通路的调控作用
赵唯含 史瑞 谭祥 陈晨 毛堂友 李军祥
目的探讨益气活血法对萎缩性胃炎癌前病变大鼠hedgehog信号通路的调控影响。方法雄性Wistar大鼠随机分为空白组、模型组、黄芪组、三七组、黄芪三七组、Purmorphamine组、环巴明组及叶酸组,运用MNNG负荷多因素法制备萎缩性胃炎癌前病变模型。应用HE染色评价胃黏膜病理损伤,应用Western Blot、RT-PCR和量子点介导的免疫荧光化学法分别检测各组大鼠胃组织hedgehog信号通路的蛋白和基因表达水平。结果与空白组相比,模型组大鼠血清PGⅠ/PGⅡ和GAS含量显著降低(P<0.01),Shh、Ptch基因及蛋白含量均明显下调(P<0.05,P<0.01),Smo蛋白表达减弱(P<0.01)。与模型组相比,三七组、黄芪三七组及Purmorphamine组PGⅠ/PGⅡ明显升高(P<0.01),黄芪组、三七组及黄芪三七组GAS含量显著升高(P<0.05)。三七组、黄芪三七组及叶酸组Shh蛋白表达明显升高(P<0.05),三七组和Purmorphamine组Ptch蛋白表达增多(P<0.05),黄芪组、三七组、黄芪三七组和Purmorphamine组Smo蛋白表达显著增强(P<0.05,P<0.01)。结论益气活血法可激活hedgehog信号通路,对萎缩性胃炎癌前病变大鼠胃黏膜病变起到改善作用。
萎缩性胃炎癌前病变; 益气活血法; hedgehog信号通路; 黄芪; 三七
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是消化系统常见疾病,以胃脘部疼痛胀满多见,世界卫生组织在1978年提出CAG与胃癌的发生发展密切相关[1]。Correa发生模式[2]是目前普遍认可的胃癌发展模式。目前临床上常把CAG伴肠上皮化生、上皮内瘤变称之为慢性萎缩性胃炎癌前病变或胃癌前期病变(precancerous lesions of gastric cancer,PLGC)[3]。笔者前期研究发现:益气活血法能有效降低胃黏膜肌层增厚,抑制肠化生,具有显著的抗炎及胃黏膜保护作用。本实验拟通过观察益气活血法对MNNG诱导的PLGC大鼠hedgehog信号通路的影响,进一步明确其作用机制。
1 材料与方法
1.1实验动物
健康雄性Wistar大鼠80只,体重(160±20) g,SPF级,由北京华阜康生物科技股份有限公司提供,动物许可证编号:SCXK(京)20090007,饲养于中国中医科学院中药研究所SPF级动物饲养间,12小时光照/黑夜循环,相对恒温(25℃),恒湿(75%)。
1.2试剂与药物
MNNG溶液(日本TCI公司);无水乙醇(湖北兴银河化工有限公司);盐酸雷尼替丁胶囊(浙江瑞新药业股份有限公司);PGE1酶联免疫试剂盒(武汉优尔生科技股份有限公司,批号:SEA165Ra),PGE2酶联免疫试剂盒(武汉优尔生科技股份有限公司,批号:SEA166Ra),GAS酶联免疫试剂盒(美国abcam,批号:ab133049)。黄芪(北京同仁堂),由北京中医药大学中药学院加工成浸膏;三七粉(北京同仁堂);Purmorphamine(上海浩然生物有限公司);环巴明(美国Sigma);叶酸片(天津飞鹰制药有限公司)。
1.3实验动物分组及给药
PLGC大鼠采用MNNG负荷乙醇、雷尼替丁、饥饱失常法造模[4]。大鼠每日自由饮用浓度为120 μg/mL的MNNG溶液,每天灌胃浓度为0.03 g/kg的盐酸雷尼替丁溶液。同时每周禁食1次,每次禁食16小时,禁食第二天不予雷尼替丁灌胃,代之以体积分数45%的乙醇(1 mL/只),连续造模16周。MNNG配置时需避光,现用现配,配好后装入用黑胶布包裹的避光饮水瓶内供模型组大鼠每天自由饮用。设10只空白组,造模大鼠随机分为模型组、黄芪组、三七组、黄芪三七组、Purmorphamine组、环巴明组、叶酸组,每组10只。黄芪组予黄芪浸膏灌胃,剂量3.5 g/(kg·d);三七组予三七粉冲剂灌胃,剂量0.7 g/(kg·d);黄芪三七组予黄芪三七溶液灌胃,其中黄芪3.5 g/(kg·d)、三七0.7 g/(kg·d);Purmorphamine组予Purmorphamine水溶液灌胃,剂量1.6 mg/(kg·d);环巴明组予环巴明水溶液灌胃,剂量0.5 mg/(kg·d);空白组和模型组予去离子水灌胃2 mL/天灌胃,共治疗8周。
1.4标本的采集
待取材大鼠提前1天禁食水,采用10%水合氯醛麻醉,腹主动脉取血,取到的动脉血置于离心管中室温静置1小时以上,常温3000 r/min离心10分钟,取上清,-80℃保存。取出胃组织,展开冲洗,观察胃黏膜形态结构,胃窦部取材,部分用4%多聚甲醛固定。部分置入冻存管中,-80°保存。
1.5Elisa法检测血清PGⅠ、PGⅡ及GAS含量
按照说明书要求双抗体两步夹心酶联免疫吸附法(ELISA)测定大鼠血清胃蛋白酶原Ⅰ(pepsinogen Ⅰ,PGⅠ),胃蛋白酶原Ⅱ(pepsinogen Ⅱ,PGⅡ)和血清胃泌素(Gastrin,GAS)水平,并计算PGⅠ/PGⅡ比值。
1.6Western-blot检测胃组织Shh、Ptch的蛋白表达
加入液氮,研磨组织,提取组织蛋白,蛋白定量后煮沸,上样,凝胶电泳后转膜,一抗稀释,将封闭膜放入一抗中,4℃过夜;洗净未结合的一抗,然后放入二抗中,室温静置2小时后曝光。蛋白图像分析用labwork分析软件分析灰度值。
1.7RT-PCR检测胃组织Shh mRNA、Ptch mRNA表达
把组织放入研钵中,研磨成粉末状,采用Trizol试剂法提取总RNA,再逆转录为cDNA。再将此设为模板,利用特异性引物合成PCR产物。引物序列及产物大小见表1。相对定量数据处理使用2-△△Ct法。

表1 引物序列及产物大小
1.8量子点介导的免疫荧光法检测胃黏膜组织Smo蛋白的表达
石蜡切片脱蜡、水化、微波抗原修复、TBS洗涤,封闭缓冲液37 ℃湿盒孵育60分钟,滴加Smo抗体,37℃孵育2小时,TBS-T漂洗5分钟/次×3次,封闭缓冲液37 ℃湿盒孵育20分钟,滴加QDs-SA标记的二抗,37 ℃湿盒孵育30分钟,TBS-T漂洗5分钟/次×3次,滴加缓冲甘油封片剂封片。荧光显微镜下观察,切片经BX51荧光显微镜及DP72相机(日本奥林巴斯光学工业有限公司)拍照。
1.9统计学处理
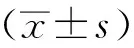
2 结果
2.1各组大鼠胃黏膜组织肉眼及病理观察
空白组大鼠胃黏膜表面颜色红润,结构正常,未见明显萎缩及肠化;模型组大鼠颜色较空白组发白,部分大鼠可见糜烂及溃疡形成,胃黏膜有明显肠上皮化生,固有层腺体减少,排列不规则;各治疗组大鼠较模型组有不同程度的改善,以Purmorphamine组为最佳。见图1。

注:A:空白组;B:MNNG模型组;C:黄芪组;D:三七组;E:黄芪三七组;F:Purmorphamine组;G:环巴明组;H:叶酸组
图1 各组大鼠胃组织染色观察(×100)
2.2各组大鼠血清PGⅠ/PGⅡ及GAS水平的比较
与空白组比较,模型组大鼠血清PGⅠ/PGⅡ和GAS含量显著降低(P<0.01);与模型组比较,三七组、黄芪三七组及Purmorphamine组PGⅠ/PGⅡ显著升高(P<0.01),GAS含量在黄芪组、三七组及黄芪三七组升高明显(P<0.01)。见表2。
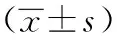
表2 各组大鼠血清PGⅠ/PGⅡ及GAS水平比较
注: 与模型组比较,aP<0.05;与空白组比较,bP<0.05。
2.3各组大鼠胃组织Shh、Ptch蛋白表达的比较
与空白组相比,模型组大鼠胃组织Shh、Ptch蛋白含量显著降低(P<0.01),与模型组比较,三七组、黄芪三七组及叶酸组Shh、Ptch蛋白表达明显升高(P<0.05)。三七组和Purmorphamine组Ptch蛋白表达明显升高(P<0.05)。见表3、图2。
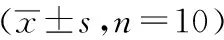
表3 各组大鼠Shh、Ptch蛋白表达
注: 与模型组比较,aP<0.05,bP<0.01;与空白组比较,cP<0.05,dP<0.01。

注: A:空白组;B:MNNG模型组;C:黄芪组;D:三七组;E:黄芪三七组;F:Purmorphamine组;G:环巴明组;H:叶酸组
图2 各组大鼠胃组织Shh、Ptch的蛋白表达条带
2.4各组大鼠胃组织Shh、Ptch基因表达的比较
与空白组比较,模型组大鼠Shh mRNA和Ptch mRNA含量显著降低(P<0.05),与模型组比较,三七组Shh mRNA含量显著升高(P<0.05),黄芪组、三七组、黄芪三七组和Purmorphamine组Ptch mRNA含量显著升高(P<0.05)。见表4。
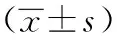
表4 对大鼠胃组织Shh mRNA及Ptch mRNA表达的影响
注: 与模型组比较,aP<0.05,bP<0.01;与空白组比较,cP<0.05,dP<0.01。
2.5各组大鼠Smo蛋白表达情况
与空白组相比较,模型组Smo蛋白表达显著减少(P<0.01);与模型组比较,黄芪组、三七组、黄芪三七组,Purmorphamine组Smo蛋白明显增多(P<0.05,P<0.01),以Purmorphamine组增多最为明显。见图3、表5。

注: A:空白组;B:MNNG模型组;C: 黄芪组;D:三七组;E:黄芪三七组;F:Purmorphamine组;G:环巴明组;H:叶酸组
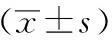
图3 各组大鼠Smo的表达情况(×200)
注: 与模型组比较,aP<0.05,bP<0.01;与空白组比较,cP<0.05,dP<0.01。
3 讨论
慢性萎缩性胃炎癌前病变多病程较长,病情迁延难愈,临床症状常见胃脘胀满、隐痛,痛处固定不移,少气乏力,舌质淡黯或有瘀斑,脉细涩;胃镜下可见胃黏膜红白相间,以白为主,黏膜下血管增生显著,黏膜呈颗粒或结节状。因为血管腔狭窄使局部血流变少,胃黏膜缺血缺氧,易于癌变[5]。故临床认为本病为本虚标实证,病机为脾虚血瘀,益气活血法为治疗PLGC的主要治法。中药黄芪和三七是益气健脾及活血化瘀的代表药,两药配伍是益气活血法的代表[6]。
hedgehog信号通路几乎涉及哺乳动物发育的所有过程,目前关于其与肿瘤的调控研究较为透彻,在消化系统疾病中,已经证实了hedgehog通路的激活是肿瘤发生的一个因素[7]。笔者前期研究发现在幽门弹簧植入术诱导的萎缩性胃炎大鼠模型中,hedgehog信号通路呈抑制状态,以黄芪、三七为代表的益气活血法可激活hedgehog信号通路,进一步起到胃黏膜保护作用[8]。Shh作为hedgehog通路的信号肽之一,是其中表达最为广泛,且研究最为深入的,在中枢神经发育和胚胎发育期发挥了分裂素、分化因子等作用[9]。Shiotani等[9]研究发现Shh在萎缩性胃炎及胃癌前病变的标本中表达较浅表性胃炎明显下降。Shh的下游跨膜受体为Patched(Ptch)和Smoothened(Smo)。Ptch为12次跨膜蛋白,Smo为7次跨膜蛋白,结构上与G蛋白偶联受体家族高度相似。一般情况下,Ptch和Smo结合在一起,两者均没有活性,当Hh蛋白被释放后,与Ptch结合,此时Ptch将解除对Smo的抑制,Smo进而将信号向下传导,激活下游的转录因子[10],引发细胞内信号下传。
本次实验采用MNNG负荷乙醇、雷尼替丁、饥饱失常法构建萎缩性胃炎癌前病变大鼠模型,16周后血清示PGⅠ/PGⅡ及GAS较正常组显著降低,病理示模型组大鼠胃黏膜见不同程度的萎缩,可见明显肠上皮化生,证明萎缩性胃炎癌前病变模型构建成功。阳性对照药选择了临床常用的叶酸片,叶酸是维生素B的一种,可以促进细胞分裂,并促进蛋白质、氨基酸以及核酸的合成,与维生素B12一起促进红细胞的成熟,在某些与炎症相关的疾病的预防和控制中有一定的疗效,可用于治疗PLGC[11]。为了明确黄芪三七对CAG大鼠hedgehog通路的调控影响,另设了Purmorphamine组和环巴明组作为对照。Purmorphamine与Smo结合后可改变Smo的空间构象,继而激活Shh通路下游分子[12],因此purmorphamine可以作为hedgehog信号通路的特异性激活剂。环巴明(cyclopamine)是一种甾体生物碱,能通过直接结合Smo来抑制hedgehog信号通路的激活,是hedgehog信号通路的阻断剂[13]。
本次实验发现在MNNG诱导的萎缩性胃炎癌前病变模型中,hedgehog信号通路正调节因子Shh、Ptch、Smo均表达下降,说明在本模型中,hedgehog信号通路处于抑制状态。与前期进行的CAG大鼠中hedgehog信号通路表达研究对比,PLGC对该通路的抑制作用更强,考虑这与其病理变化多为肠上皮化生及异型增生有关。有文献报道[14],在慢性浅表性胃炎-慢性萎缩性胃炎-癌前病变中,Shh的表达逐渐降低,这与本次实验结论相符。本次实验证实Purmorphamine作为激动剂可明显改善hedgehog信号通路各因子表达,尤其对PLGC大鼠的病理损伤有较好的修复作用。同时中药治疗组中三七组和黄芪三七组对于各指标的改善具有较好的疗效,证明活血法及益气活血法对于萎缩性胃炎癌前病变效果良好,也符合中医理论认为CAG初起在气,久病由血及络的病机认识。
综上,笔者推测以中药黄芪、三七为代表的益气活血法能够起到改善萎缩性胃炎癌前病变的作用,其具体机制可能为通过激活hedgehog信号通路,进一步改善胃黏膜萎缩,抑制肠上皮化生,进而起到保护胃黏膜、抑制癌变的作用。
[1] 杨印智,王继栓,王晓琴,等.慢性萎缩性胃炎的诊断与中医药治疗[J].现代中西医结合杂志,2014,23(24):2686-2687.
[2] Correa P, Shiao YH.Phenotypic and genomic events in gastric carcinogenesis[J]. Cancer Res, 1994,5(4):1941.
[3] 郑保平.慢性萎缩性胃炎及其癌前病变的病机和证治探讨[J].江苏中医药,2010,42(1):8-9.
[4] 李俊青.参七消痞颗粒对MNNG负荷多因素致大鼠慢性萎缩性胃炎的干预作用及机制探讨[D].北京:北京中医药大学,2013.
[5] 赵晓丹,孙静晶,周斌.慢性萎缩性胃炎中医证型分布规律[J].环球中医药,2015,8(1):18-21.
[6] 李军祥,张玉禄,朱陵群,等.益气活血法对大鼠萎缩性胃炎癌前病变差异基因表达谱的影响[J].世界华人消化杂志,2008,16(29):3261-3268.
[7] Martin J, Donnelly JM, Houghton J, et al.The role of sonic hedgehog reemergence during gastric cancer[J].Dig Dis Sci, 2010, 55(6):1516-1524.
[8] 赵唯含,高康丽,李宁飞,等. 黄芪、三七及其配伍对慢性萎缩性胃炎大鼠胃组织Hedgehog信号通路的调节作用[J]. 中华中医药杂志,2016,31(5):1951-1955.
[9] shiotani. S evidence that loss of sonic hedgehog is an indicator of an helicopter pylori-induced atrophic gastritis progressing to gastric cancer[J]. AM.J.Gastroenterol.2005, 100(3):581-587.
[10] Bijlsma MF, Spek CA, Zivkovic D, et al. Repression of smoothened by patched-dependent (pro-)vitamin D3 secretion[J]. PLoS Biol,2006,4(8): e232.
[11] 俞卫宁,俞萍.叶酸、维生素B1、吗丁啉联合治疗萎缩性胃炎疗效观察[J].中国社区医师,2011,13(25):75.
[12] Faghihi F, Baghaban Eslaminejad M, Nekookar A, et al. The effect of purmorphamine and sirolimus on osteogenic differentiation of human bone marrow-derived mesenchymal stem cells[J]. Biomed Pharmacother, 2013, 67(1):31-38.
[13] Wu JY, Xu XF, Xu L,et al. Cyclopamine blocked the growth of colorectal cancer SW116 cells by modulating some target genes of Gli1 in vitro[J]. Hepatogastroenterology, 2011, (58):1511-1518.
[14] Martin J, Donnelly JM, Houghton J, et al.The role of sonic hedgehog reemergence during gastric cancer[J].Dig Dis Sci, 2010, 55(6):1516-1524.
Regulationeffectsofinvigoratingqiandactivatingbloodtherapyonthehedgehogsignalpathwayinratswithprecancerouslesionsofatrophicgastritis
ZHAOWeihan,SHIRui,TANXiang,etal.DepartmentofGastroenterology,thehospitalofShanxiUniversityofChineseMedicine,Shanxi712000,China
Correspondingauthor:LIJunxiang,E-mail:lijunxiang1226@163.com
ObjectiveTo evaluate the effects of invigoratingqiand activating blood therapy on hedgehog signal pathway in rats with precancerous lesions of atrophic gastritis.MethodsThe model was established by MNNG, male wistar rats were randomly divided into control group, model group, Astragalus group, Panax notoginseng group, Astragalus plus Panax notoginseng group, Purmorphamine group, cyclopamine group and folic acid group. HE was used to evaluate the pathological injury of stomach. The mRNA and protein expression levels of hedgehog signal pathway were detected by RT-PCR, Western Blot analysis and immunofluorescence.ResultsCompared with the control group, GAS and PG I /PG II level were reduced in model group(P<0.01), the mRNA and protein expression levels of Shh and Ptch were obviously down-regulated (P<0.05,P<0.01); the expression of Smo protein was decreased(P<0.01). Compared with the model group, the level of PG I /PG II was increased in the Panax notoginseng group, Astragalus plus Panax notoginseng group and Purmorphamine group(P<0.01), the level of GAS was increased in the Astragalus group, Panax notoginseng group and Astragalus plus Panax notoginseng group(P<0.05). The protein of Shh was increased in the Panax notoginseng group, Astragalus plus Panax notoginseng group and folic acid group(P<0.05). The protein of Ptch was markedly up-regulated in Panax notoginseng group and Purmorphamine group(P<0.05). The expression of Smo was significantly increased in Astragalus group, Panax notoginseng group and Astragalus plus Panax notoginseng group and Purmorphamine group(P<0.05,P<0.01).ConclusionInvigoratingqiand activating blood therapy can activate hedgehog signal pathway, and can improve the gastric mucosal lesion in precancerous lesion of atrophic gastritis.
Precancerous lesions of atrophic gastritis; Invigoratingqiand activating blood therapy; Hedgehog signal pathway; Astragalus; Panax notoginseng
R285.5
A
10.3969/j.issn.1674-1749.2017.11.005
2017-04-04)
(本文编辑: 禹佳)
国家自然科学基金(81373585)
712000 陕西中医药大学附属医院消化一科(赵唯含);北京中医药大学东方医院消化内科[史瑞、谭祥(硕士研究生)、陈晨(硕士研究生)、毛堂友(博士研究生)、李军祥]
赵唯含(1988- ),女,博士,讲师。研究方向:中医药防治胃肠疾病的研究。E-mail: weihanzhaodoc@163.com
李军祥(1964- ) ,博士,主任医师,博士生导师。研究方向: 中医药防治慢性肝胆和胃肠道疾病。E-mail:lijunxiang1226@163.com
