基于FvCB模型的叶片光合生理对环境因子的响应研究进展
2017-11-02唐星林曹永慧顾连宏周本智
唐星林,曹永慧,顾连宏,周本智,*
1 中国林业科学研究院亚热带林业研究所,杭州 311400 2 国家林业局钱江源森林生态系统定位观测研究站,杭州 311400 3 美国橡树岭国家实验室环境科学部,USA TN 37831
基于FvCB模型的叶片光合生理对环境因子的响应研究进展
唐星林1,2,曹永慧1,2,顾连宏3,周本智1,2,*
1 中国林业科学研究院亚热带林业研究所,杭州 311400 2 国家林业局钱江源森林生态系统定位观测研究站,杭州 311400 3 美国橡树岭国家实验室环境科学部,USA TN 37831
为提高叶片光合速率并更好地理解叶片光合生理对环境因子变化的响应机制,FvCB模型(C3植物光合生化模型)常用于分析不同环境条件下CO2响应曲线并预测叶片活体内光合系统的内在变化状况。系统介绍了FvCB模型的建立、发展过程和拟合方法等基本理论,综述了该模型在叶片光合生理对光、CO2、水、温度和N营养等环境因子变化的响应机制中的应用研究。为进一步完善FvCB模型并更好地理解叶片活体内光合系统对环境因子变化的响应机制,未来拟加强以下研究:1)羧化速率与光合电子传递速率之间的联系;2)叶肉导度的具体组分及其对FvCB模型参数估计的影响;3)叶片气孔导度和叶肉导度对环境因子变化的调控机制。
C3植物;光合作用;FvCB光合模型;光合生理;环境因子
1980年,Farquhar等根据Rubisco酶动力学反应和RuBP再生反应化学计量学,提出C3植物光合生化模型(简称FvCB模型)[1]。它可以模拟叶片内部的光合生化反应,并通过分析不同环境条件下的CO2响应曲线获得光合参数,预测叶片活体光合系统的内在变化状况[2- 3]。FvCB模型已广泛应用于叶片光合生理对光照、温度、水分、CO2浓度和N营养等环境因子变化的响应机制等方面的研究。它还有助于建立作物产量预测模型[4]、全球碳循环模型[5]、气孔模型[6]、C4植物模型[7]等。最新的研究发现叶肉导度(gm)可以分为细胞壁导度、细胞膜导度、细胞质导度、叶绿体膜导度、叶绿体基质等组分,并进一步改进FvCB模型理论,但叶肉导度的具体路径非常复杂。另外,大量研究表明环境因子可能通过控制水通道蛋白基因的表达来调控叶肉细胞内CO2的转运过程,但该研究仍缺乏直接的实验证据。
国内光合模型的相关研究多采用光合数学模型来描述光合速率与环境因子间的数量关系[8- 9],并反映光合速率等随环境因子的变化情况,但却难以反映叶片内部的光合生化反应状况。而FvCB模型可以揭示不同环境条件下叶片活体内部光合系统的变化状况,是光合生理生态研究中的重要工具。尽管国外已经开展了大量FvCB模型及其应用相关研究,但国内该领域的研究还相对较少,对该模型的基本理论及应用还缺乏深入和系统的认识,仅有的一些研究也大多只局限于温室茄子和光合生化模型模拟分析等[10]。本文将从FvCB模型的建立出发,分析FvCB模型的理论和发展过程,探讨该模型在植物光合作用和环境因子关系研究中的应用,并提出FvCB模型及其应用中存在的问题及可能的发展方向,以促进国内相关研究的深入开展。
1 C3植物FvCB模型理论
在碳反应中,CO2、O2和核酮糖- 1,5-二磷酸(RuBP)等在Rubisco酶催化下发生羧化反应和氧化反应。当CO2浓度较低时,底物RuBP浓度过量,Rubisco酶催化活性达到最大,光合速率受Rubisco酶活性的限制,即Rubisco酶活性限制阶段;随着CO2浓度升高,底物RuBP再生速率小于其消耗速率,使RuBP浓度不足而限制光合速率,即RuBP再生速率限制阶段[1]。由于前两个限制阶段不能解释一定环境条件下叶片净光合速率不随CO2和O2浓度变化而改变的现象,Sharkey发现光合速率还可能受磷酸丙糖转运速率的限制(即TPU限制)[11]。随着FvCB模型和CO2扩散路径等相关研究的深入,人们发现光合速率还受CO2从胞间向Rubisco羧化位点扩散阻力的限制,即叶肉导度限制[12]。由于,温度对光合生化反应过程有直接影响,FvCB模型的温度相关性研究也非常重要。在模型拟合方面,由于FvCB模型包括3个公式完全不同的子模型并且子模型间的转换点无法确定,模型的拟合过程变得非常复杂。
1.1 Rubisco酶活性限制阶段
Farquhar等认为在高光强和低CO2下,光合作用受Rubisco酶活性大小的限制,并根据Rubisco酶动力学理论和光合碳反应的化学计量学提出Rubisco酶活性限制阶段的子模型[1]。
首先是Rubisco酶动力学理论。Laing提出当RuBP浓度过量时羧化反应和氧化反应的Rubisco酶动力学公式[13]

(1)

(2)
式中,Vc为羧化速率、Vo为氧化速率、Vcmax为最大羧化速率、Vomax为最大氧化速率、Kc为CO2米氏常数、Ko为O2米氏常数、Cc为Rubisco酶羧化位点CO2浓度、O为Rubisco酶羧化位点O2浓度。公式2除以公式1得Vo与Vc的比值(Φ)[13]

(3)
其次是碳反应化学计量学。如图1,碳反应主要包括光合碳还原循环(PCR)和光呼吸循环(PCO)。在Rubisco酶的催化下,1mol CO2与1mol RuBP发生羧化反应生成2mol 3-磷酸甘油酸(PGA),1mol O2和1mol RuBP发生氧化反应生成1mol磷酸乙醇酸(PGIA)和1mol PGA,其中,1mol PGIA发生氧化反应生成1mol甘氨酸(Gly)并释放0.5mol CO2。由此,净光合速率(A)[1]为:
A=Vc-0.5Vo-Rd
(4)
式中,Rd为光下暗呼吸速率。其中,Rd是指在光照条件下线粒体呼吸作用释放的CO2,与PCO循环无关。

图1 Rubisco酶羧化反应和氧化反应简图[1]Fig.1 Simplified photosynthetic carbon reduction and photorespiratory carbon oxidationΦ: 氧化速率与羧化速率的比值 Ratio of Rubisco carboxylase rates to Rubisco oxygenase rates; RuBP: 核酮糖- 1,5-二磷酸 Ribulose- 1,5-bisphosphate; PGA: 3-磷酸甘油酸 3-phosphoglycerate; PGIA: 磷酸乙醇酸 Phosphoglycolate; Gly: 甘氨酸还原态的铁氧还蛋白 Reduced ferredoxin
公式3代入公式4[11]得:
A=(1-0.5Φ)Vc-Rd
(5)
当A和Rd均为0时,叶绿体内的CO2浓度被称为缺乏暗呼吸的CO2补偿点[14],记为Γ*,由公式5和公式3得:
Γ*=VomaxKcO/2VcmaxKo
(6)
公式6代入公式3得:
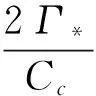
(7)
公式7代入公式5得:

(8)
当光合作用受Rubisco酶活性限制时,Vc由公式1给出,代入公式8得:
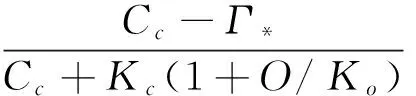
(9)
式中,Ac为Rubisco酶活性限制阶段的净光合速率。公式9为FvCB模型中Rubisco酶活性限制阶段的子模型。
1.2 RuBP再生速率限制阶段
如图1,在碳反应中, Gly和PGA被光反应提供的同化力还原成RuBP,其中,NADPH和ATP等同化力是通过光合电子传递生成的。Farquhar等认为在低光强和高CO2的条件下,光合作用会受RuBP再生速率限制,并根据RuBP再生过程中NADPH的需求量(由光反应提供)建立Vc和光合电子传递速率(J)之间的联系,提出RuBP再生速率限制阶段的子模型[1]。
首先是Vc和NADPH消耗速率之间的联系。在碳反应中(如图1),1mol RuBP发生羧化反应生成2mol PGA;1mol RuBP发生氧化反应生成1.5mol PGA。因此,PGA的生成速率(VPGA)[1]为:
VPGA=2Vc+1.5Vo
(10)

(11)

结合公式4、公式10和公式11得:
VNADPH=(2+2Φ)Vc
(12)
其次是J与NADPH生成速率之间的联系。在光反应中,1mol NADP+接受2mol e-和1mol H+生成1mol NADPH[1],因此,J为:
J=2VNADPH
(13)
由公式12和公式13得:
J=4+4ΦVc
(14)
公式7代入公式14得:
J=(4+8Γ*/Cc)Vc
(15)
由公式15变换得:
Vc=J/(4+8Γ*/Cc)
(16)
第三是J和最大电子传递速率(Jmax)之间的联系。J主要由有效光辐射和植物特性决定。一般用非直角双曲线函数来描述J和Jmax之间的关系[16]:

(17)
式中,σ为叶片吸收常数、I为入射光辐射、θ为曲率。参数σ主要受叶片对入射光辐射的吸收比例和叶片吸收的有效辐射在光系统I和光系统II之间分配比例的影响。Jmax由叶绿体类囊体膜上电子载体的组成成分决定。
当光合作用受J限制时,Vc由公式16给出,代入公式8得:

(18)
式中,Aj为RuBP再生速率限制阶段的净光合速率。公式18为FvCB模型RuBP再生速率限制阶段的子模型。
1.3 磷酸丙糖转运限制
在碳反应中,叶绿体内生成的磷酸丙糖(TP)在叶绿体膜上的磷酸丙糖/无机磷转运蛋白的作用下与细胞质内的无机磷酸(Pi)交换,再在细胞质内合成蔗糖并释放Pi。Sharkey发现在一定条件下,叶绿体内TP的转运速率会小于其生成速率,同时Pi的转运速率也会小于叶绿体内Pi的消耗速率;叶绿体内TP的积累和Pi的不足会限制光合作用,即TPU限制[8]。Rubisco酶氧化反应虽然会影响RuBP的再生速率,但不会影响TP的生成速率,又1mol TP含有3mol碳原子。因此,在TPU限制阶段,TP的生成速率必须小于或等于1/3倍CO2固定速率,否则叶绿体内自由Pi的下降会限制光合作用[11],净光合速率为
Ap=3Tp-Rd
(19)
式中,Ap为TPU限制阶段的净光合速率、Tp为磷酸丙糖的最大转运速率。
在高CO2浓度、低光强和低温条件下,净光合速率反而会随O2浓度增加而增大,随CO2浓度增加而减少。由于公式19无法解释该现象,Sharkey等认为这些现象与碳反应中甘油酸盐的代谢过程有关[11,17]。光呼吸循环在细胞质内生成的甘油酸盐最终会返回叶绿体内。Harley和Sharkey发现在TPU阶段,只有部分甘油酸盐返回到叶绿体内[18],并根据碳反应中Pi的化学计量学进一步完善TPU阶段的子模型。根据碳反应中Pi的化学计量学,叶绿体内Pi的净消耗速率等于Vc/3-Vo/6[11]。当光合作用受Pi浓度限制时,Pi的净消耗速率等于Pi的转入速率,而Pi的转入速率又等于Tp,即:

(20)
在光呼吸循环中,每个氧化反应会消耗半个Pi并生成半个甘油酸盐。假设有a倍的甘油酸盐(0 (21) 公式4代入公式21得: (22) 求解公式22,又Vc>0得: (23) 当光合作用受TP转运速率限制时,Vc由公式23给出,代入公式8得: (24) 公式24为FvCB光合模型TPU阶段的子模型。当a=0时,公式24可简化为公式19。 1.4 叶肉导度 1980年,Farquhar等认为叶肉细胞对CO2扩散的阻力很小,在FvCB模型中可以忽略不计,即Cc等于胞间CO2浓度(Ci)[1]。随着研究的深入,人们发现叶肉细胞对CO2扩散的阻力是光合作用的一个重要限制因子[9]。一般把CO2从胞间到Rubisco酶羧化位点扩散的导度称为叶肉导度,记为gm: (25) 为估计参数gm,需结合公式25和FvCB模型的3个子模型推导出A关于Ci的函数表达式。根据公式25计算出Cc,再分别代入公式9、公式18和公式24得改进后的FvCB模型。 首先是Rubisco酶限制阶段。由公式25和公式9得Ac关于Ci的函数[19]: (26) 求解公式26并取正解得: (27) 其次是RuBP再生速率限制阶段。由公式25和公式18得Aj关于Ci的函数[19]: (28) 求解公式28并取正解得: (29) 第三是TPU限制阶段。由公式25和公式24得AP关于Ci的函数[20]: (30) b=3Tp-Rd+[Ci-1+3αΓ*]gm c={3Ci-Γ*Tp-[Ci-1+3αΓ*]Rd}gm (31) 公式27、公式29和公式31为加入gm参数后改进的FvCB模型。 1.5 参数拟合 在模型拟合中,一般假定所有C3植物有相等的Rubisco酶动力学常数(Kc和Ko),叶绿体内O2浓度等于空气O2浓度。由于FvCB模型本身存在超参数现象,一般把Γ*作为输入常数[20]。根据公式27、公式29、公式31,FvCB模型拟合CO2响应曲线可以获得Vcmax、Jmax、Tp、a等阶段特异性参数和gm、Rd等共同参数,而拟合的关键点是3个子模型分界点Ci的确定。一般,把Rubisco酶活性限制阶段到RuBP再生速率限制阶段转换点的Ci记为Ci_CJ;RuBP再生速率限制到TPU限制转换点的Ci记为Ci_JP。根据分界点Ci确定方法的不同,可以把现有的拟合方案大致分为3类[17]。第1类方案认为Ci_CJ在20—40Pa的范围内变化[21- 22],并且TPU限制阶段在田间试验中很少出现。第2类方案利用CO2响应曲线中的全部数据同时来拟合FvCB模型[23-24]。第3类方案认为FvCB模型是变点模型,并采用特有的拟合方法进行模型拟合[20]。第1类方案的拟合过程相对简单,但有很多潜在的问题。首先,共同参数的取值不好确定。对2个子模型分别进行拟合,会获得2组不相等的gm和Rd参数,实践中一般取平均值。其次,转换点Ci_CJ的不确定性。大量研究表明Ci_CJ随物种和环境条件的不同而不同[21,25],并且Ci_CJ的错误会影响参数拟合的准确性[21]。第2类方案虽然克服了人为确定Ci_CJ的缺点,但其拟合获得的最佳阶段分配组合可能不符合Rubisco酶活性限制、RuBP再生速率限制和TPU限制的实际顺序。第3类方案不仅克服3个阶段人为划分的缺点,而且符合3个阶段的实际顺序,是较好的拟合方法,但是,其计算过程复杂,难以普遍使用。 1.6 参数的温度相关性 根据FvCB模型的温度相关性,不同温度下Kc、Ko和Γ*等参数的取值不同。为此,一般把25℃下的Kc、Ko和Γ*等参数值作为标准(如表1),并根据参数的温度相关性函数来计算某测量温度下的参数值[26]。实践中,一般用阿伦尼乌斯方程来建立参数与温度间的函数关系: PT=P(25℃)e{[T-25]E/[298R(273+T)]} (32) 式中,T为测量温度、P(T)为测量温度T下的参数(Kc、Ko和Γ*)、P(25℃)为25℃下的参数、E为活化能、R为通用的气体常数。 表1 25℃下的Kc、Ko、Γ*、E等参数[26] 经过30多年的发展,FvCB模型已基本完善,并通过大量实验的验证。但在RuBP再生速率限制阶段中,光合电子传递全为线性电子传递的假设及ATP需求的忽略[1]会影响FvCB模型及其参数估计的准确性。由于gm的组分非常复杂,而FvCB模型把gm作为一个复合参数进行估计,这也会影响模型参数估计的准确性。由于FvCB模型可以不进行叶片离体实验,而根据简单的气体交换数据获得叶片Vcmax、Jmax、Tp、gs、gm等光合生理生化信息[3],它在植物光合生理与环境因子相互关系的研究中有广泛的应用。接下来将对FvCB模型在叶片光合生理对环境因子响应的应用研究进展进行论述。 FvCB模型结合叶片Rubisco酶、细胞色素f(cyt f)和ATP合成酶等生理指标可以揭示叶片活体光合系统对光照、CO2浓度、温度、水分和N养分等环境因子变化的响应机制,其中,Vcmax反映光合系统中Rubisco酶最大羧化能力、Jmax反映光合电子传递链的最大电子传递能力、Tp反映磷酸丙糖的合成能力、gs和gm反映CO2扩散阻力对光合作用的限制。 2.1 光照 在不同环境光强下,叶片的形态和生化成分发生改变[27- 28],其光合机构也会发生变化。大量研究表明阳生叶片的细胞色素f(cyt f)、ATP合成酶、Rubisco酶等含量均大于阴生叶片[29-31],导致阳生叶片Vcmax和Jmax参数均显著大于阴生叶片[32-33],由此,阳生叶片的光合能力显著大于阴生叶片。Hanba等发现阳生叶片的气孔密度显著大于阴生叶片[31],这可能导致阳生叶片的gs显著大于阴生叶片[32,34]。Piel等发现阳生叶片gm有效路径的长度显著小于阴生叶片[32]。另外,有研究表明槭树和水青冈阳生叶片中单位面积叶绿体暴露在胞间的面积(Sc)显著大于阴生叶片[32,34]。这两个因素可能导致阳生叶片的gm显著大于阴生叶片。 虽然瞬时光强对叶片Vcmax和Jmax参数没有显著影响,但对CO2扩散阻力有显著的影响。研究表明gs与瞬时光强呈正相关[35- 36]。有人认为叶片光合系统与保卫细胞之间可能存在信号传递[35- 36],使叶片可以通过改变气孔的张开程度来平衡gs与光合速率的大小。有研究发现水稻[35]、桉树[36]、烟草[22]和班克木[37]等叶片的gm随测量光强增大而增加,但小麦和烟草叶片的gm在不同瞬时光强下保持稳定不变[38-39]。Douthe等认为不同物种光合特性的差异可能导致gm随瞬时光强的响应情况不同[36]。另外,水通道蛋白基因的表达速率随光强的增加而加快[40- 41],而水通道蛋白的含量与CO2的跨膜转运过程直接相关[42- 43],所以,光强的瞬时变化可能通过调控水通道蛋白基因的表达来改变gm。 2.2CO2浓度 在长期高CO2浓度下,植物叶片的结构和成分会发生变化,从而影响其光合作用[44]。长期高CO2浓度下生长的植株叶片Rubisco酶含量及活性和叶片N含量均显著小于正常CO2浓度下生长的植株[45- 46]。而叶片N含量可以影响光合系统中Rubisco酶含量及活性、光捕获组分、光合电子传递链组分的功能[47- 48],进而影响叶片的光合能力,从而使得长期高CO2浓度下生长植株的叶片Vcmax[45]和Jmax[49- 50]等均显著小于在正常CO2浓度下生长的植株。长期高CO2浓度下生长的植株gs[44- 45]和gm[50]均小于在正常CO2浓度下生长的植株。研究发现在长期高CO2处理后,植株叶片的气孔特性和表皮细胞密度发生改变[51- 52],这可能使得gs减小。Kürschner等发现长期高CO2浓度下生长的植株叶片厚度大于正常条件下生长的植株[53],而叶片厚度的增大可能会增大gm的有效路径,导致gm减小。 CO2浓度的短期变化不影响叶片的Vcmax和Jmax参数,但对CO2扩散阻力有显著影响。Flexas等发现gs与CO2浓度的短期变化呈负相关关系[22],对此,一般有3种解释:1)Hedrish等发现叶片质外体中的pH值和膜电位[54]会随CO2浓度的增加而发生改变,并伴随着气孔关闭,从而导致gs变小。2)CO2浓度的大小会影响叶肉细胞中苹果酸的释放,苹果酸又可以调控保卫细胞质膜中阴离子的释放代谢,从而调控气孔行为[55]。3)CO2浓度变化还可能通过ATP调节机制[56]对gs进行调控。大量研究表明gm与CO2浓度呈负相关关系[22,36,57],但也有部分研究表明gm与CO2浓度不相关[58- 59]。对此,一般有2种解释:1)由于水通道蛋白基因的表达速率受CO2浓度变化的影响[60],gm对CO2浓度短期变化的快速响应可能受水通道蛋白的调节。2)Sharkey发现叶绿体的变形可能会减小叶肉导度[61]。而且Tholen认为叶绿体的移动对gm有显著的影响[62]。由此可知,叶绿体的行为可能与不同CO2浓度下gm的快速调控有关。 2.3 温度 FvCB模型常用于研究温度(不对植物产生损伤)对叶片光合系统内在变化状况的影响。有研究发现Rubisco酶羧化能力、光合电子传递能力和CO2扩散过程均随温度的变化而改变。由于Rubisco酶及其激活酶活性均随温度的增加而增大(10—40℃),Kc、Ko、Vcmax会随温度的增加而增大[63- 64]。Bernacchi等用指数函数来描述Vcmax的温度相关性[64]。光系统II(PSII)电子传递速率、光系统I(PSI)和光系统II(PSII)间的电子传递速率(质体醌PQ和质体蓝素PC)[65- 66]和循环电子传递速率[63,67]均随温度的增加而增大,从而导致Jmax随温度的增加而增大[68]。温度不仅影响叶片的光合能力,而且影响CO2的扩散阻力。尽管gs与温度变化不相关[69- 70],但gm会随温度的增加而增大[35,70]。Evans等认为Sc、细胞壁厚度(Tcell_wall)、细胞液和叶绿体膜厚度等细胞结构特点会影响gm[71],而von Caemmerer等发现CO2的质膜渗透性和CO2扩散的液相路径长度也受温度的影响[70]。由此可以推测温度可能通过改变叶肉细胞结构来调控gm。另外,Kuwagata等发现水通道蛋白基因的表达速度会随温度的增加而增大[72],所以,温度还可能通过控制水通道蛋白基因的表达速率来调控gm。 2.4 干旱或盐胁迫 干旱和盐胁迫可以直接导致植物缺水[73],进而影响植物光合作用。有研究表明干旱或盐胁迫尽管对Vcmax和Jmax参数没有显著影响[74- 75],但对CO2的扩散阻力有显著影响[76]。在干旱或盐胁迫条件下,植株为减少蒸腾作用,叶片气孔会关闭。另外,在盐胁迫条件下,盐离子会在叶片保卫细胞内积累进而干扰气孔功能[77- 78],导致气孔关闭。因此,在干旱或盐胁迫条件下植株叶片gs显著小于在正常条件下生长的植株[79- 80]。大量研究表明在干旱或盐胁迫条件下生长的植株叶片gm显著小于在正常条件下生长植株的叶片[74,79-80]。长期干旱或盐胁迫显著减少了表皮细胞和叶肉细胞的断面面积、宽度和半径[81-82],从而使gm减小。另外,由于水通道蛋白基因的表达速率受干旱或盐胁迫的影响[83],干旱或盐胁迫可能通过控制水通道蛋白基因的表达来调控gm。 2.5 叶片N含量 由于叶肉细胞光合系统中的Rubisco酶、光捕获组分(叶绿素和相关蛋白)和cty f等均含有大量的N元素[84],叶片N含量对光合作用有显著影响。FvCB模型常用于研究叶片N含量对叶片光合系统内在变化状况的影响。大量研究表明叶片Rubisco酶含量与叶片N含量呈正相关[35,85],而叶片Rubisco酶含量及活性决定Vcmax的大小,从而使得叶片Rubisco酶的羧化能力与叶片N含量呈正相关[47- 48]。Nakano等发现叶绿素和Cyt f等含量均与叶片N含量呈正相关[47],从而使得Jmax与叶片N含量呈正相关[84,86]。叶片N含量不仅影响光合能力,还影响CO2的扩散阻力。有研究表明叶片N含量与gs呈正相关[35]。虽然已知gs与气孔特点(大小和密度)、气孔张开程度有关,但气孔对叶片N含量变化的具体响应机制还不清楚。大量研究表明叶片N含量与gm呈正相关[35,87]。大量研究表明Tcell_wall、单位叶面积叶肉细胞接触胞间间隙的面积(Sm)、Sc等细胞结构特点与gm直接相关[71,88]。Xiong等研究发现Sc会随叶N含量的增加而增大[35]。Yong还发现叶绿体的尺寸与叶片N含量呈正相关[89]。由此可知,叶片N含量可能通过改变叶片结构来调控gm。另外,由于叶片N含量的增加可以促进水通道蛋白的基因表达[90],不同叶片N含量还可能通过控制水通道蛋白的表达来调控gm。 目前关于植物光合生理与环境因子的关系已有大量研究,但这些研究多停留在单因子水平,更没有考虑相互作用的生物因素与环境因素协同作用对植物光合生理的影响。同时,尽管人们已经提出多种假设来解释光合生理反应随环境因子变化的响应机制,但尚缺乏直接的实验证据。因此,结合植物生理分子实验与FvCB模型进行综合分析是研究不同环境因子下植物光合生理响应机制的有效途径。 FvCB模型光合参数的准确估计不仅有利于正确理解植物光合生理对环境变化的响应机理,而且可以更精确地估计作物产量和全球气候变暖情况[91]。光合电子传递、碳反应ATP需求和叶肉细胞内CO2的具体扩散路径等方面的假设影响FvCB模型理论及参数估计的准确性,从而制约相关领域的研究。此外,尽管科学家已经开展了大量植物光合作用对环境条件变化响应等方面的研究,但是,在光合作用对环境因子变化的响应机制的研究中仍然存在很多问题。为此,未来需加强以下几个方面的研究。 1)羧化速率与光合电子传递速率间的联系 羧化速率与光合电子传递速率间的联系直接影响到RuBP再生速率限制阶段的子模型,进而影响Jmax、Vcmax、Tp、Rd、gm等参数估计的准确性。在RuBP再生速率限制阶段,Farquhar等忽略了假电子传递、循环电子传递以及碳反应的ATP需求,并根据碳反应的NADPH消耗速率与J相等来获得RuBP再生速率限制阶段的子模型[1]。尽管人们已经开展J和NADPH/ATP生成速率等相关的研究[92],但J与ATP生成速率之间的关系比较复杂,目前仍未研究清楚[2]。因此,未来应该加强光合电子传递、NADPH/ATP代谢化学计量学等方面研究,以正确地建立Vc与J间的联系。 2)叶肉细胞内CO2的扩散阻力 Sun等发现gm对Vcmax、Jmax、Tp等的参数估计有很大的影响[93]。目前,人们认为细胞壁、细胞膜、细胞质、叶绿体膜和叶绿体基质均对CO2的扩散有限制作用。并且,线粒体呼吸作用和光呼吸释放的CO2有一部分会被光合作用重新固定。这部分CO2需通过线粒体膜、细胞质、叶绿体膜和叶绿体基质最终到达Rubisco酶羧化位点[94],这使得CO2的扩散路径变得非常复杂。目前,有研究已经把gm区分为细胞壁阻力和叶绿体膜阻力[12,95],但gm各组分的估计还有待进一步的研究。因此,未来可以结合细胞显微结构观察、叶肉细胞内CO2扩散同位素跟踪技术和FvCB模型对gm各组分的参数估计进行研究。 3)gs和gm对环境因子变化的具体调控机制 大量研究表明gs[34,36,70,79]和gm[31,35,36,39]随环境因子的变化而改变。尽管人们已经提出多种与气孔相关的调控机制,但其具体调控机制还不清楚,未来的研究可结合气孔调控相关生理指标测量、光合机构信号传导和FvCB模型等3方面的实验对气孔的调控机制进行深入研究。目前,人们已经提出细胞结构特点、水通道蛋白和叶绿体行为等几种假说来解释gm的调控机制,但缺乏直接的实验证据。因此,未来的研究要重点研究不同环境条件下叶片细胞结构、水通道蛋白代谢和叶绿体行为的改变情况,并结合FvCB模型来研究gm的调控机制。而gm的相关研究需多领域的科学家共同参与 [1] Farquhar G D, von Caemmerer S, Berry J A. A biochemical model of photosynthetic CO2assimilation in leaves of C3species. Planta, 1980, 149(1): 78- 90. [2] von Caemmerer S. Steady-state models of photosynthesis. Plant, Cell and Environment, 2013, 36(9): 1617- 1630. [3] Long S P, Bernacchi C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error. Journal of Experimental Botany, 2003, 54(392): 2393- 2401. [4] Zhu X G, Portis A R Jr, Long S P. Would transformation of C3crop plants with foreign Rubisco increase productivity? A computational analysis extrapolating from kinetic properties to canopy photosynthesis. Plant, Cell and Environment, 2004, 27(2): 155- 165. [5] Sellers P J, Randall D A, Collatz G J, Berry J A, Field C B, Dazlich D A, Zhang C, Collelo G D, Bounoua L. A revised land surface parameterization (SiB2) for atmospheric GCMs. Part I: model formulation. Journal of Climate, 1996, 9(4): 676- 705. [6] Collatz G J, Ribas-Carbo M, Berry J A. Coupled photosynthesis-stomatal conductance model for leaves of C4plants. Australian Journal of Plant Physiology, 1992, 19(5): 519- 538. [7] von Caemmerer S, Furbank R T. The modeling of C4photosynthesis//Sage R, Monson R, eds. The Biology of C4Photosynthesis. New York: Academic Press, 1999: 169- 207. [8] 黄红英, 窦新永, 孙蓓育, 邓斌, 吴国江, 彭长连. 两种不同生态型麻疯树夏季光合特性的比较. 生态学报, 2009, 29(6): 2861- 2867. [9] 王海珍, 韩路, 徐雅丽, 牛建龙. 胡杨异形叶光合作用对光强与CO2浓度的响应. 植物生态学报, 2014, 38(10): 1099- 1109. [10] 高志奎, 高荣孚, 何俊萍, 王梅, 钟传飞. 温室茄子(SolanummelongenaL.)光合数学模型与光合生化模型模拟分析. 生态学报, 2007, 27(6): 2265- 2271. [11] Sharkey T D. Photosynthesis in intact leaves of C3plants: physics, physiology and rate limitations. The Botanical Review, 1985, 51(1): 53- 105. [12] Flexas J, Ribas-Carbó M, Diaz-Espejo A, Galmés J, Medrano H. Mesophyll conductance to CO2: current knowledge and future prospects. Plant, Cell and Environment, 2008, 31(5): 602- 621. [13] Laing W A, Ogren W L, Hageman R H. Regulation of soybean net photosynthetic CO2fixation by the interaction of CO2, O2, and ribulose- 1,5-diphosphate carboxylase. Plant Physiology, 1974, 54(5): 678- 685. [14] Farquhar G D, von Caemmerer S. Modelling of photosynthetic response to environmental conditions//Lange O L, Nobel P S, Osmond C B, Ziegler H, eds. Physiological Plant Ecology II. Berlin Heidelberg: Springer, 1982: 549- 587. [15] Keys A J, Bird I F, Cornelius M J, Lea P J, Wallsgrove R M, Miflin B J. Photorespiratory nitrogen cycle. Nature, 1978, 275(5682): 741- 743. [16] Farquhar G D, Wong S C. An empirical model of stomatal conductance. Australian Journal of Plant Physiology, 1984, 11(3): 191- 210. [17] Sharkey T D, Vassey T L. Low oxygen inhibition of photosynthesis is caused by inhibition of starch synthesis. Plant Physiology, 1989, 90(2): 385- 387. [18] Harley P C, Sharkey T D. An improved model of C3photosynthesis at high CO2: reversed O2sensitivity explained by lack of glycerate reentry into the chloroplast. Photosynthesis Research, 1991, 27(3): 169- 178. [19] Ethier G J, Livingston N J. On the need to incorporate sensitivity to CO2transfer conductance into the Farquhar-von Caemmerer-Berry leaf photosynthesis model. Plant, Cell and Environment, 2004, 27(2): 137- 153. [20] Gu L H, Pallardy S G, Tu K, Law B E, Wullschleger S D. Reliable estimation of biochemical parameters from C3leaf photosynthesis-intercellular carbon dioxide response curves. Plant, Cell and Environment, 2010, 33(11): 1852- 1874. [21] Manter D K, Kerrigan J.A/Cicurve analysis across a range of woody plant species: influence of regression analysis parameters and mesophyll conductance. Journal of Experimental Botany, 2004, 55(408): 2581- 2588. [22] Flexas J, Diaz-Espejo A, Galmés J, Kaldenhoff R, Medrano H, Ribas-Carbo M. Rapid variations of mesophyll conductance in response to changes in CO2concentration around leaves. Plant, Cell and Environment, 2007, 30(10): 1284- 1298. [23] Dubois J J B, Fiscus E L, Booker F L, Flowers M D, Reid C D. Optimizing the statistical estimation of the parameters of the Farquhar-von Caemmerer-Berry model of photosynthesis. New Phytologist, 2007, 176(2): 402- 414. [24] Yin X Y, Struik P C, Romero P, Harbinson J, Evers J B, van der Putten P E L, Vos J. Using combined measurements of gas exchange and chlorophyll fluorescence to estimate parameters of a biochemical C3photosynthesis model: a critical appraisal and a new integrated approach applied to leaves in a wheat (Triticumaestivum) canopy. Plant, Cell and Environment, 2009, 32(5): 448- 464. [25] Wullschleger S D. Biochemical limitations to carbon assimilation in C3plants---a retrospective analysis of theA/Cicurves from 109 species. Journal of Experimental Botany, 1993, 44(5): 907- 920. [26] von Caemmerer S. Biochemical Models of Leaf Photosynthesis. Collingwood: CSIRO Publishing, 2000: 44- 45. [27] Niinemets Ü, Kull O, Tenhunen J D. An analysis of light effects on foliar morphology, physiology, and light interception in temperate deciduous woody species of contrasting shade tolerance. Tree Physiology, 1998, 18(10): 681- 696. [28] Terashima I, Araya T, Miyazawa S I, Sone K, Yano S. Construction and maintenance of the optimal photosynthetic systems of the leaf, herbaceous plant and tree: an eco-developmental treatise. Annals of Botany, 2005, 95(3): 507- 519. [29] Hikosaka K, Terashima I, Katoh S. Effects of leaf age, nitrogen nutrition and photon flux density on the distribution of nitrogen among leaves of a vine (IpomoeatricolorCav.) grown horizontally to avoid mutual shading of leaves. Oecologia, 1994, 97(4): 451- 457. [30] Makino A, Sato T, Nakano H, Mae T. Leaf photosynthesis, plant growth and nitrogen allocation in rice under different irradiances. Planta, 1997, 203(3): 390- 398. [31] Hanba Y T, Kogami H, Terashima I. The effect of growth irradiance on leaf anatomy and photosynthesis inAcerspecies differing in light demand. Plant, Cell and Environment, 2002, 25(8): 1021- 1030. [32] Piel C, Frak E, Le Roux X, Genty B. Effect of local irradiance on CO2transfer conductance of mesophyll in walnut. Journal of Experimental Botany, 2002, 53(379): 2423- 2430. [33] Schultz H R. Extension of a Farquhar model for limitations of leaf photosynthesis induced by light environment, phenology and leaf age in grapevines (VitisviniferaL. cvv. White Riesling and Zinfandel). Functional Plant Biology, 2003, 30(6): 673- 687. [34] Warren C R, Löw M, Matyssek R, Tausz M. Internal conductance to CO2transfer of adultFagussylvatica: variation between sun and shade leaves and due to free-air ozone fumigation. Environmental and Experimental Botany, 2007, 59(2): 130- 138. [35] Xiong D L, Liu X, Liu L M, Douthe C, Li Y, Peng S B, Huang J L. Rapid responses of mesophyll conductance to changes of CO2concentration, temperature and irradiance are affected by N supplements in rice. Plant, Cell and Environment, 2015, 38(12): 2541- 2550. [36] Douthe C, Dreyer E, Epron D, Warren C R. Mesophyll conductance to CO2, assessed from online TDL-AS records of13CO2discrimination, displays small but significant short-term responses to CO2and irradiance inEucalyptusseedlings. Journal of Experimental Botany, 2011, 62(15): 5335- 5346. [37] Hassiotou F, Ludwig M, Renton M, Veneklaas E J, Evans J R. Influence of leaf dry mass per area, CO2, and irradiance on mesophyll conductance in sclerophylls. Journal of Experimental Botany, 2009, 60(8): 2303- 2314. [38] Tazoe Y, von Caemmerer S, Badger M R, Evans J R. Light and CO2do not affect the mesophyll conductance to CO2diffusion in wheat leaves. Journal of Experimental Botany, 2009, 60(8): 2291- 2301. [39] Yamori W, Evans J R, von Caemmerer S. Effects of growth and measurement light intensities on temperature dependence of CO2assimilation rate in tobacco leaves. Plant, Cell and Environment, 2010, 33(3): 332- 343. [40] Cochard H, Venisse J S, Barigah T S, Brunel N, Herbette S, Guilliot A, Tyree M T, Sakr S. Putative role of aquaporins in variable hydraulic conductance of leaves in response to light. Plant Physiology, 2007, 143(1): 122- 133. [41] Voicu M C, Cooke J E K, Zwiazek J J. Aquaporin gene expression and apoplastic water flow in bur oak (Quercusmacrocarpa) leaves in relation to the light response of leaf hydraulic conductance. Journal of Experimental Botany, 2009, 60(14): 4063- 4075. [42] Terashima I, Ono K. Effects of HgCl2on CO2dependence of leaf photosynthesis: evidence indicating involvement of aquaporins in CO2diffusion across the plasma membrane. Plant and Cell Physiology, 2002, 43(1): 70- 78. [43] Flexas J, Ribas-Carbó M, Hanson D T, Bota J, Otto B, Cifre J, McDowell N, Medrano H, Kaldenhoff R. Tobacco aquaporin NtAQP1 is involved in mesophyll conductance to CO2invivo. The Plant Journal, 2006, 48(3): 427- 439. [44] Ainsworth E A, Long S P. What have we learned from 15 years of free-air CO2enrichment (FACE)? A meta-analytic review of the responses of photosynthesis, canopy properties and plant production to rising CO2. The New Phytologist, 2005, 165(2): 351- 371. [45] Harley P C, Thomas R B, Reynolds J F, Strain B R. Modelling photosynthesis of cotton grown in elevated CO2. Plant, Cell and Environment, 2006, 15(3): 271- 282. [46] Stitt M, Krapp A. The interaction between elevated carbon dioxide and nitrogen nutrition: the physiological and molecular background. Plant, Cell and Environment, 1999, 22(6): 583- 621. [47] Nakano H, Makino A, Mae T. The effect of elevated partial pressures of CO2on the relationship between photosynthetic capacity and N content in rice leaves. Plant Physiology, 1997, 115(1): 191- 198. [48] Makino A, Nakano H, Mae T. Responses of ribulose- 1,5-bisphosphate carboxylase, cytochromef, and sucrose synthesis enzymes in rice leaves to leaf nitrogen and their relationships to photosynthesis. Plant Physiology, 1994, 105(1): 173- 179. [49] Curtis P S. A meta-analysis of leaf gas exchange and nitrogen in trees grown under elevated carbon dioxide. Plant, Cell and Environment, 1996, 19(2): 127- 137. [50] Singsaas E L, Ort D R, Delucia E H. Elevated CO2effects on mesophyll conductance and its consequences for interpreting photosynthetic physiology. Plant, Cell and Environment, 2004, 27(1): 41- 50. [51] Ferris R, Nijs I, Behaeghe T, Impens I. Elevated CO2and temperature have different effects on leaf anatomy of perennial ryegrass in spring and summer. Annals of Botany, 1996, 78(4): 489- 497. [52] Masle J. The effects of elevated CO2concentrations on cell division rates, growth patterns, and blade anatomy in young wheat plants are modulated by factors related to leaf position, vernalization, and genotype. Plant Physiology, 2000, 122(4): 1399- 1415. [53] Kürschner W M, Stulen I, Wagner F, Kuiper P J C. Comparison of palaeobotanical observations with experimental data on the leaf anatomy of durmast oak [Quercuspetraea(Fagaceae)] in response to environmental change. Annals of Botany, 1998, 81(5): 657- 664. [54] Hedrich R, Neimanis S, Savchenko G, Felle H H, Kaiser W M, Heber U. Changes in apoplastic pH and membrane potential in leaves in relation to stomatal responses to CO2, malate, abscisic acid or interruption of water supply. Planta, 2001, 213(4): 594- 601. [55] Hedrich R, Marten I, Lohse G, Dietrich P, Winter H, Lohaus G, Heldt H W. Malate-sensitive anion channels enable guard cells to sense changes in the ambient CO2concentration. The Plant Journal, 1994, 6(5): 741- 748. [56] Buckley T N, Mott K A, Farquhar G D. A hydromechanical and biochemical model of stomatal conductance. Plant, Cell and Environment, 2003, 26(10): 1767- 1785. [57] Flexas J, Barbour M M, Brendel O, Cabrera H M, Carriquí M, Díaz-Espejo A, Douthe C, Dreyer E, Ferrio J P, Gago J, Gallé A, Galmés J, Kodama N, Medrano H, Niinemets Ü, Peguero-Pina J J, Pou A, Ribas-Carbó M, Tomás M, Tosens T, Warren C R. Mesophyll diffusion conductance to CO2: an unappreciated central player in photosynthesis. Plant Science, 2012, 193- 194: 70- 84. [58] von Caemmerer S, Evans J R. Determination of the average partial pressure of CO2in chloroplasts from leaves of several C3plants. Australian Journal of Plant Physiology, 1991, 18(3): 287- 305. [59] Loreto F, Harley P C, Di Marco G, Sharkey T D. Estimation of mesophyll conductance to CO2flux by three different methods. Plant Physiology, 1992, 98(4): 1437- 1443. [60] Alguacil M D M, Kohler J, Caravaca F, Roldán A. Differential effects ofPseudomonasmendocinaandGlomusintraradiceson lettuce plants physiological response and aquaporin PIP2 gene expression under elevated atmospheric CO2and drought. Microbial Ecology, 2009, 58(4): 942- 951. [61] Sharkey T D, Vassey T L, Vanderveer P J, Vierstra R D. Carbon metabolism enzymes and photosynthesis in transgenic tobacco (NicotianatabacumL.) having excess phytochrome. Planta, 1991, 185(3): 287- 296. [62] Tholen D, Boom C, Noguchi K O, Ueda S, Katase T, Terashima I. The chloroplast avoidance response decreases internal conductance to CO2diffusion inArabidopsisthalianaleaves. Plant, Cell and Environment, 2008, 31(11): 1688- 1700. [63] Sage R F, Kubien D S. The temperature response of C3and C4photosynthesis. Plant, Cell and Environment, 2007, 30(9): 1086- 1106. [64] Bernacchi C J, Singsaas E L, Pimentel C, Portis A R Jr, Long S P. Improved temperature response functions for models of Rubisco-limited photosynthesis. Plant, Cell and Environment, 2001, 24(2): 253- 259. [65] Yamasaki T, Yamakawa T, Yamane Y, Koike H, Satoh K, Katoh S. Temperature acclimation of photosynthesis and related changes in photosystem II electron transport in winter wheat. Plant Physiology, 2002, 128(3): 1087- 1097. [66] Yamori W, Noguchi K, Kashino Y, Terashima I. The role of electron transport in determining the temperature dependence of the photosynthetic rate in spinach leaves grown at contrasting temperatures. Plant and Cell Physiology, 2008, 49(4): 583- 591. [67] Sharkey T D. Effects of moderate heat stress on photosynthesis: importance of thylakoid reactions, rubisco deactivation, reactive oxygen species, and thermo tolerance provided by isoprene. Plant, Cell and Environment, 2005, 28(3): 269- 277. [68] Bernacchi C J, Pimentel C, Long S P.Invivotemperature response functions of parameters required to model RuBP-limited photosynthesis. Plant, Cell and Environment, 2003, 26(9): 1419- 1430. [69] Warren C R, Dreyer E. Temperature response of photosynthesis and internal conductance to CO2: results from two independent approaches. Journal of Experimental Botany, 2006, 57(12): 3057- 3067. [70] von Caemmerer S, Evans J R. Temperature responses of mesophyll conductance differ greatly between species. Plant, Cell and Environment, 2014, 38(4): 629- 637. [71] Evans J R, Kaldenhoff R, Genty B, Terashima I. Resistances along the CO2diffusion pathway inside leaves. Journal of Experimental Botany, 2009, 60(8): 2235- 2248. [72] Kuwagata T, Ishikawa-Sakurai J, Hayashi H, Nagasuga K, Fukushi K, Ahamed A, Takasugi K, Katsuhara M, Murai-Hatano M. Influence of low air humidity and low root temperature on water uptake, growth and aquaporin expression in rice plants. Plant and Cell Physiology, 2012, 53(8): 1418- 1431. [73] Chaves M M, Maroco J P, Pereira J S. Understanding plant responses to drought-from genes to the whole plant. Functional Plant Biology, 2003, 30(3): 239- 264. [74] Flexas J, Barón M, Bota J, Ducruet J M, GalléA, Galmés J, Jiménez M, Pou A, Ribas-Carbó M, Sajnani C, Tomàs M, Medrano H. Photosynthesis limitations during water stress acclimation and recovery in the drought-adaptedVitishybrid Richter- 110 (V.berlandieri×V.rupestris). Journal of Experimental Botany, 2009, 60(8): 2361- 2377. [75] James R A, von Caemmerer S, Condon A G, Zwart A B, Munns R. Genetic variation in tolerance to the osmotic stress component of salinity stress in durum wheat. Functional Plant Biology, 2008, 35(2): 111- 123. [76] Flexas J, Bota J, Loreto F, Cornic G, Sharkey T D. Diffusive and metabolic limitations to photosynthesis under drought and salinity in C3Plants. Plant Biology, 2004, 6(3): 269- 279. [77] Gibberd M R, Turner N C, Storey R. Influence of saline irrigation on growth, ion accumulation and partitioning, and leaf gas exchange of carrot (DaucuscarotaL.). Annals of Botany, 2002, 90(6): 715- 724. [78] James R A, Rivelli A R, Munns R, von Caemmerer S. Factors affecting CO2assimilation, leaf injury and growth in salt-stressed durum wheat. Functional Plant Biology, 2002, 29(12): 1393- 1403. [79] Perez-Martin A, Michelazzo C, Torres-Ruiz J M, Flexas J, Fernández J E, Sebastiani L, Diaz-Espejo A. Regulation of photosynthesis and stomatal and mesophyll conductance under water stress and recovery in olive trees: correlation with gene expression of carbonic anhydrase and aquaporins. Journal of Experimental Botany, 2014, 65(12): 3143- 3156. [80] Chen T W, Kahlen K, Stützel H. Disentangling the contributions of osmotic and ionic effects of salinity on stomatal, mesophyll, biochemical and light limitations to photosynthesis. Plant, Cell and Environment, 2015, 38(8): 1528- 1542. [81] Hu Y C, Fromm J, Schmidhalter U. Effect of salinity on tissue architecture in expanding wheat leaves. Planta, 2005, 220(6): 838- 848. [82] Tosens T, Niinemets Ü, Vislap V, Eichelmann H, Díez P C. Developmental changes in mesophyll diffusion conductance and photosynthetic capacity under different light and water availabilities inPopulustremula: how structure constrains function. Plant, Cell and Environment, 2012, 35(5): 839- 856. [83] Kawase M, Hanba Y T, Katsuhara M. The photosynthetic response of tobacco plants overexpressing ice plant aquaporin McMIPB to a soil water deficit and high vapor pressure deficit. Journal of Plant Research, 2013, 126(4): 517- 527. [84] Walcroft A S, Whitehead D, Silvester W B, Kelliher F M. The response of photosynthetic model parameters to temperature and nitrogen concentration inPinusradiataD. Don. Plant, Cell and Environment, 1997, 20(11): 1338- 1348. [85] Yamori W, Nagai T, Makino A. The rate-limiting step for CO2assimilation at different temperatures is influenced by the leaf nitrogen content in several C3crop species. Plant, Cell and Environment, 2011, 34(5): 764- 777. [86] Sage R F, Sharkey T D, Pearcy R W. The effect of leaf nitrogen and temperature on the CO2response of photosynthesis in the C3dicot MChenopodiumalbumL. Australian Journal of Plant Physiology, 1990, 17(2): 135- 148. [87] Warren C R. The photosynthetic limitation posed by internal conductance to CO2movement is increased by nutrient supply. Journal of Experimental Botany, 2004, 55(406): 2313- 2321. [88] Muir C D, Hangarter R P, Moyle L C, Davis P A. Morphological and anatomical determinants of mesophyll conductance in wild relatives of tomato (Solanumsect.Lycopersicon, sect.Lycopersicoides; Solanaceae). Plant, Cell and Environment, 2014, 37(6): 1415- 1426. [89] Li Y, Gao Y X, Xu X M, Shen Q R, Guo S W. Light-saturated photosynthetic rate in high-nitrogen rice (OryzasativaL.) leaves is related to chloroplastic CO2concentration. Journal of Experimental Botany, 2009, 60(8): 2351- 2360. [90] Guo S W, Kaldenhoff R, Uehlein N, Sattelmacher B, Brueck H. Relationship between water and nitrogen uptake in nitrate- and ammonium-suppliedPhaseolusvulgarisL. plants. Journal of Plant Nutrition and Soil Science, 2007, 170(1): 73- 80. [91] Sun Y, Gu L H, Dickinson R E, Norby R J, Pallardy S G, Hoffman F M. Impact of mesophyll diffusion on estimated global land CO2fertilization. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(44): 15774- 15779. [92] Yin X, van Oijen M, Schapendonk A H C M. Extension of a biochemical model for the generalized stoichiometry of electron transport limited C3photosynthesis. Plant, Cell and Environment, 2004, 27(10): 1211- 1222. [93] Sun Y, Gu L H, Dickinson R E, Pallardy S G, Baker J, Cao Y H, Damatta F M, Dong X J, Ellsworth D, Van Goethem D, Jensen A M, Law B E, Loos R, Vitor Martins S C, Norby R J, Warren J, Weston D, Winter K. Asymmetrical effects of mesophyll conductance on fundamental photosynthetic parameters and their relationships estimated from leaf gas exchange measurements. Plant, Cell and Environment, 2014, 37(4): 978- 994. [94] Tholen D, Éthier G, Genty B. Mesophyll conductance with a twist. Plant, Cell and Environment, 2014, 37(11): 2456- 2458. [95] Tholen D, Ethier G, Genty B, Pepin S, Zhu X G. Variable mesophyll conductance revisited: theoretical background and experimental implications. Plant, Cell and Environment, 2012, 35(12): 2087- 2103. Advancesinphoto-physiologicalresponsesofleavestoenvironmentalfactorsbasedontheFvCBmodel TANG Xinglin1,2, CAO Yonghui1,2, GU Lianhong3, ZHOU Benzhi1,2,* 1ResearchInstituteofSubtropicalForestry,ChineseAcademyofForestry,Hangzhou311400,China2QianjiangyuanForestEcosystemResearchStation,StateForestryAdministration,Hangzhou311400,China3EnvironmentalSciencesDivision,OakRidgeNationalLaboratory,OakRidge,TN37831,USA Biochemical models of leaf photosynthesis are invaluable tools for exploring the photo-physiological responses to environmental factors and identify potential targets to improve the efficiency of CO2fixation. The FvCB model can be used to fit CO2response curves developed under different environmental conditions and predict underlying photosynthetic biochemistry. However, to do this successfully it is important to improve chloroplast electron transport modeling, and gain a better understanding of internal CO2diffusion limitations and elucidate the mechanisms of stomatal (gs) and mesophyll (gm) conductance responses to environmental factors. The FvCB model and its application in determining the photo-physiological responses to environmental factors, such as light, CO2, water, temperature, and N nutrition have been reviewed in this paper. To improve the veracity of the parameter estimations and reveal the mechanism of photo-physiological responses to environmental factors, the following studies should be emphasized in the future: 1) the relationship between the carboxylation rate of Rubisco and chloroplast electron transport rate; 2) the CO2diffusion limitations in mesophyll cells and its effect on parameter estimations; and 3) the regulation ofgsandgmresponses to different environmental conditions. C3plants; photosynthesis; FvCB model; photosynthetic physiology; environmental factors 国家林业局948项目(2014- 4- 57);浙江省自然科学基金项目(LY13C160002);中央级公益性科研院所基本科研业务费专项资金(RISF2013002)资助 2016- 07- 16; < class="emphasis_bold">网络出版日期 日期:2017- 05- 27 *通讯作者Corresponding author.E-mail: benzhi_zhou@126.com 10.5846/stxb201607161450 唐星林,曹永慧,顾连宏,周本智.基于FvCB模型的叶片光合生理对环境因子的响应研究进展.生态学报,2017,37(19):6633- 6645. Tang X L, Cao Y H, Gu L H, Zhou B Z.Advances in photo-physiological responses of leaves to environmental factors based on the FvCB model.Acta Ecologica Sinica,2017,37(19):6633- 6645.












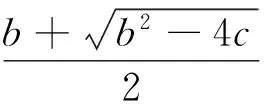

2 FvCB模型在叶片光合生理对环境因子响应的应用研究进展
3 研究展望
