半干旱草地长期封育进程中针茅植物根系格局变化特征
2017-11-02苏纪帅井光花程积民张金娥
苏纪帅,赵 洁,井光花,魏 琳,刘 建,程积民,,3,*,张金娥
1 西北农林科技大学动物科技学院,杨凌 712100 2 中国科学院水利部水土保持研究所,杨凌 712100 3 西北农林科技大学水土保持研究所,杨凌 712100 4 固原市园林管理所,固原 756000
半干旱草地长期封育进程中针茅植物根系格局变化特征
苏纪帅1,赵 洁1,井光花2,魏 琳2,刘 建1,程积民1,2,3,*,张金娥4
1 西北农林科技大学动物科技学院,杨凌 712100 2 中国科学院水利部水土保持研究所,杨凌 712100 3 西北农林科技大学水土保持研究所,杨凌 712100 4 固原市园林管理所,固原 756000
以云雾山不同封育年限草地针茅植物根系和土壤为研究对象,对其根系特征、土壤特性及两者关系进行研究,以探讨分析封育对针茅根系格局的影响。结果表明:(1)针茅植物根系生物量、根长密度、根表面积和根体积在封育初期轻微下降,之后缓慢上升,并在封育30 a草地得到显著增加。(2)随封育年限增加,各根系指标在3种针茅物种间的组成格局具有类似变化规律,具体表现为:长芒草在放牧草地所占比例最高,之后逐渐降低,并在封育30 a草地消失;大针茅所占比例呈先升后降变化规律,并在封育22 a草地达到最大值;甘青针茅仅出现于封育30 a草地,且占据优势地位。(3)大针茅和甘青针茅0—0.6 mm径级根系比例高于大针茅,使其根系直径显著低于大针茅,比根长和比根面积显著高于大针茅;此外,长芒草根组织密度显著高于长芒草和甘青针茅。(4)长期封育在显著提高土壤水分、养分含量和土壤氮磷比的同时显著降低土壤碳氮比,但对微生物生物量碳、氮无明显影响。(5)针茅根系特征与土壤指标的关联性分析显示针茅根系受土壤氮资源的显著影响。
封育;针茅;根系形态特征;物种组成格局
过度放牧和不合理垦伐活动使得全国90%的草地处于不同退化程度[1- 2]。围栏封育因其经济性和简易操作性被广泛用于退化草地的恢复管理中[3-4]。封育初期,草地植被盖度、植株密度、地上和根系生物量显著增加,并伴随植物群落结构的变化[5-6]。封育后植被生物量的增加使得植物输入土壤的有机物量有所提高,土壤理化性质得到改善,具体表现在土壤碳、氮含量和储量的提高,并伴随土壤水分、有效养分含量的增加[7- 8];同时封育对土壤生物群落结构特征的变化产生一定的影响[9-10]。然而研究表明长期封育不利于草地多样性的维持和植物群落的自我更新进程[11-12]。
50%—90%的草地生态系统以植物根系、根茎和地上茎叶基部的形式存在于土壤中[13]。研究表明,封育草地根系生物量集中分布在0—30 cm土层,并随土层深度增加呈指数规律减少[10]。与地上单一光资源相比,地下土壤养分资源具有鲜明的时空异质性[14- 16]。植物根系形态特征(根长、根面积、比根长和比根面积)及其在面临土壤养分异质性时的根系可塑性强度决定着其地上生长表现[17- 19],进而影响该种植物在群落中的优势地位。此外,植物根系形态可塑性受土壤养分水平的影响[20]。
针茅群落为宁夏固原云雾山草地优势群落,植被调查显示草地封育初期优势种为长芒草(Stipabungeana,),其在封育后期逐渐被同属植物大针茅(S.grandis)、甘青针茅(S.przewalskyi)所取代[21]。目前该区研究多集中于3种针茅的地上部分的生物学特征,且现有根系研究多停留于群落水平,鲜少在物种水平对植被根系进行研究。植物根系对封育措施所引发的土壤特性波动的响应在针茅群落优势种更替进程中扮演何种角色,人们尚不清楚。因此,本文以云雾山不同封育年限草地针茅植物为研究对象,在物种水平研究其地下根系特征及周围土壤特性随封育年限的变化,旨在从根系角度探讨针茅植物物种更替发生的原因,为该区草地的恢复与利用提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于宁夏回族自治区固原市东北部的云雾山国家级自然保护区,面积6660 hm2。该区部分草地自1982年起实施围栏封育措施,至今封育时间长达35 a。研究区海拔1800—2100 m,年均温7.01℃,无霜期137 d。年均降雨量425.42 mm,60%—75%集中于7—9月,年蒸发量为1017—1739 mm。土壤类型主要为山地灰褐土。研究区植被群落由297种植物组成,主要优势植物为长芒草、大针茅、甘青针茅、白莲蒿(Artemisiasacrorum)和百里香(Thymusmongolicus)[22]。
1.2 试验设计与样品野外采样
2012年8月中旬,分别选择放牧草地[5](中度放牧,4只羊/hm2)、封育5 a、9 a、22 a和30 a草地为研究地点,并以放牧草地为对照(封育年限为0),采用空间替代时间方法,研究封育对针茅根系的影响。在采取封育措施前,研究地点均处于极重度放牧状态(> 50只羊/hm2)。中度放牧草地通过铁丝围栏控制样地面积和羊只数量来实现。研究地点立地条件相似,详见表1。在每种草地类型下,设置3个小区(30 m×30 m),每个小区内随机设置3个0.5 m×0.5 m的样方,取样深度为30 cm,采用挖掘法收集样方内针茅根系,轻微抖掉大块土壤和其他植物根系后,对针茅根土混合样品进行编号,带回实验室,置于4℃保存。

表1 样地基本信息
GE: Grazing exclusion
在每个小区的每个样方周围用不锈钢土钻(直径为5 cm)随机采集3处0—20 cm深度土壤,之后混合为一个土壤样品。一部分土样过2 mm筛用于移除植物根系,并保存于4℃以进行土壤pH,有效氮和微生物生物量碳氮指标测定;剩余土样风干后研磨过1 mm和0.25 mm筛用于测定土壤有机碳、全氮、全磷、速效磷等指标。同时,在每个小区每个样方周围挖一个0.5 m长×0.3 m宽×0.3 m深的土壤剖面,用环刀和铝盒采集0—20 cm土壤样品用于土壤容重和含水量测定。
1.3 样品室内处理与测定
1.3.1 根系指标测定
将针茅根土混合样品置于水中浸泡20 min以去除大块土壤,之后在自来水下缓慢冲洗以去除粘附在根表面的土壤颗粒和植物残体。依据根系所连接的地上部分的植株种类和根系颜色、直径、分枝、质地等特征区分3种针茅根系[23-24]。同一样方内的同种针茅根系视作一个根系样品进行相关指标测定。根系置于透明塑料根盘内,在300 dpi分辨率下扫描(Epson扫描仪,型号10000XLPro,加拿大)获取根系图像,之后利用WinRhizoPro软件(型号V2012b,加拿大)在0.1 mm径级间隔水平对根系图像进行分析以获得根系长度、面积和体积等指标。扫描后的根系样品于65℃烘干至恒重以获得根系样品质量。具体根系指标计算如下:
根系生物量(g/m2)= 根系质量/根系采集体积
根长密度(m/m3)=根系长度/根系采集体积
根系面积(cm2/m3)=根系面积/根系采集体积
比根长(m/g)=根系长度/根系质量
比根面积(cm2/g)=根系面积/根系质量
根组织密度(g/cm3)=根系质量/根系体积
其中,根系采集体积为0.5 m×0.5 m×0.3 m = 0.075 m3
1.3.2 土壤指标测定
土壤含水量和土壤容重采用烘干法测定;土壤pH采用电位法测定;土壤有机碳采用重铬酸钾氧化法-外加热法测定;土壤全氮采用凯氏定氮法测定;土壤全磷和速效磷采用钼锑抗比色法测定;土壤铵态氮和硝态氮采用KCl浸提-流动分析测定,土壤微生物碳和氮采用氯仿熏蒸法测定[25-26]:
土壤碳氮比=土壤有机碳含量/土壤全氮含量
土壤氮磷比=土壤全氮含量/土壤全磷含量
微生物生物量碳氮比=微生物生物量碳含量/微生物生物量氮含量
1.4 数据分析
在SPSS 18.0软件中,利用单因素ANOVA分析比较不同封育年限草地针茅根系特征、土壤特性及3种针茅根系特征的差异,采用Duncan新复极差法检验差异显著性,显著性水平设定为P<0.05。在Canoco 4.5 软件中,利用RDA分析针茅根系特征与土壤指标之间的关联性,并在前向选择中利用蒙特卡洛检验检测土壤指标在解释根系特征变异方面的显著性,显著性水平设定为P<0.05。
2 结果与分析
2.1 草地针茅植物根系特征及其物种组成格局随封育年限的变化
2.1.1 不同封育年限草地针茅植物根系特征
由图1可知,随封育年限不断增加,针茅植物根系的生物量、根长密度、根系面积和根系体积具有类似变化规律,具体表现为针茅植物根系特征指标在草地封育5 a后有所降低(P>0.05),之后随封育年限增加呈现缓慢上升趋势,并在封育30 a草地得到显著增加(P<0.05),其中针茅根系生物量由放牧草地的48.79 g/m2提高至91.37g/m2,根长密度由放牧草地的0.90(103m/m3)提高至2.15(103m/m3),根系面积由放牧草地的13.53(103cm2/m3)提高至29.09(103cm2/m3),根系体积由放牧草地的208.50(cm3/m3)提高至425.91(cm3/m3)。与放牧草地相比,封育5 a草地较低的根系特征指标可能源于植物通过增加向地上部分的物质分配比例以竞争光资源和占据因放牧排除后产生的地上空间资源[3, 27],相比之下,放牧草地中草食动物的采食作用使得针茅植物产生较多根系用于土壤养分获取以实现植株地上部分的补偿性生长。在草地长期封育进程中,针茅植物自身庞大、分散的根系保障其对土壤水分和养分的竞争能力强于非禾草植物,使其在长期封育进程中取代其他植物成为可能,这可能也是封育30 a草地根系特征指标得到显著增加的原因所在。

图1 不同封育年限草地针茅植物根系特征Fig.1 Root traits of Stipa plants in grasslands with different grazing exclusion time同一指标不同小写字母表示存在显著性差异(P<0.05)
2.1.2 不同封育年限草地针茅植物根系物种组成格局
不同封育年限草地针茅植物根系层的物种组成存在较大差异,其中封育时间不超过22 a的草地针茅植物根系由长芒草和大针茅构成,封育30 a草地针茅植物根系则由大针茅和甘青针茅构成,即长芒草未在封育30 a草地出现,而甘青针茅仅出现于封育30 a草地。图2显示,针茅根系生物量、根长密度、根系面积和根系体积的物种组成变化随封育年限增加具有相似规律,具体表现为长芒草组成比例在放牧草地中最高,之后随封育年限增加不断降低,并在封育30 a草地消失;大针茅组成比例不断增加,在封育22 a草地达到峰值,之后在封育30 a草地迅速下降至放牧草地水平;甘青针茅在封育30 a草地迅速扩殖,并占据优势地位。草地长期封育进程中3种针茅优势度的更替现象,可能与封育进程中植物间资源竞争类型的转变及3种针茅自身的生物学特性密不可分。

图2 不同封育年限草地针茅植物根系物种组成格局Fig.2 Speices compositional pattern of Stipa root traits in grasslands with different grazing exclusion time
2.1.3 3种针茅植物根系径级分配格局比较
由图3可知,长芒草和甘青针茅根系特征具有类似的径级分配格局,且其不同于大针茅根系的径级分配格局,具体表现为长芒草和甘青针茅在≤ 0.6 mm径级的根系长度、面积和体积比例高于大针茅,大针茅在> 0.7 mm的根系长度、面积和体积所占比例均高于长芒草和甘青针茅。长芒草和甘青针茅拥有较高比例的细直径根系,这可能暗示其对土壤资源的探索和获取能力高于大针茅。
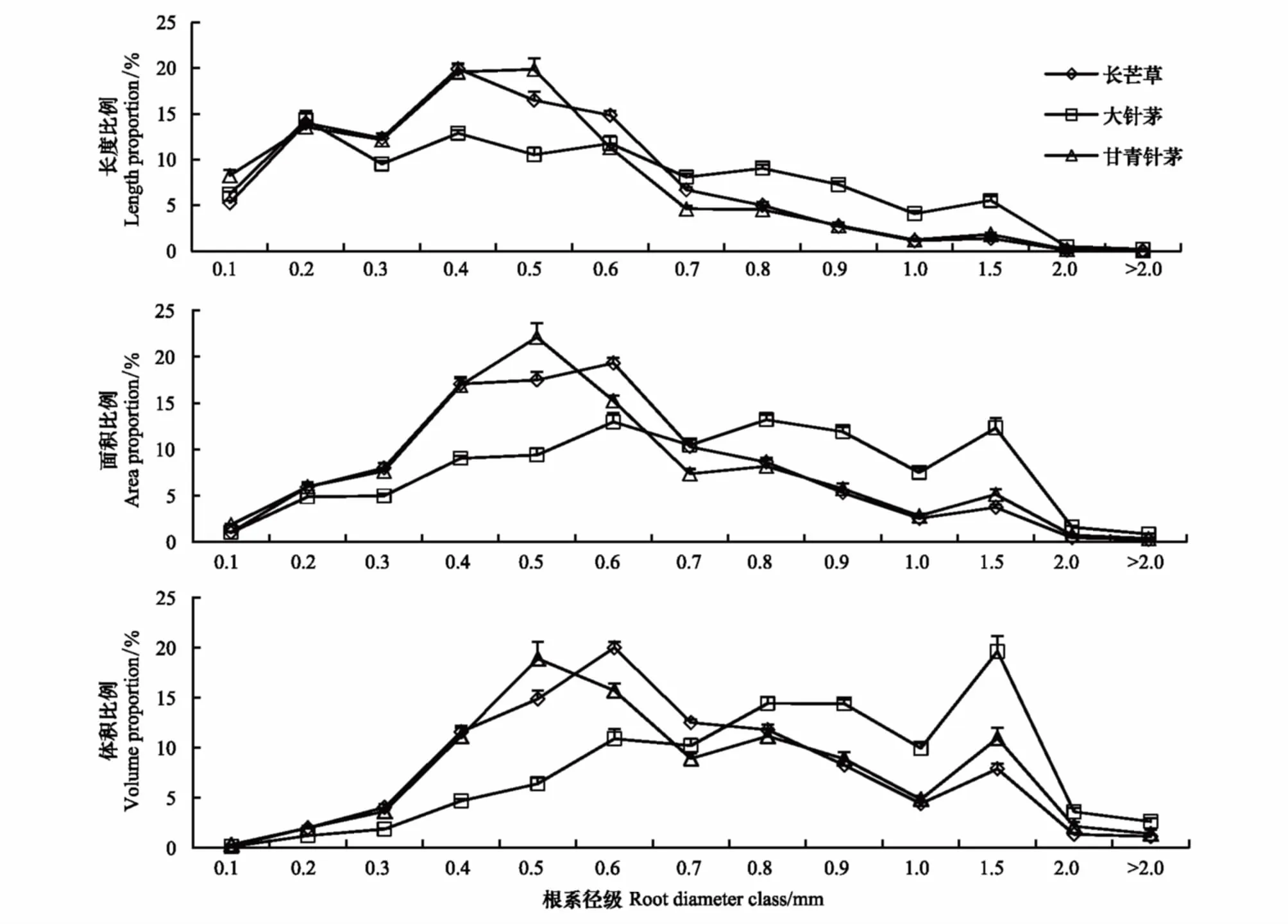
图3 三种针茅植物根系径级分配格局Fig.3 Distribution pattern of root traits in root diameter classes in three Stipa plants
由表2可知,除根组织密度外,长芒草和甘青针茅植物根系特征无明显差异,但其根系直径均显著低于大针茅(P<0.05),比根长和比根面积则均显著高于大针茅(P<0.05)。根组织密度表现为长芒草显著高于大针茅和甘青针茅,大针茅和甘青针茅之间无明显差异。

表2 三种针茅植物根系特征
SRL: specific root length, SRS: specific root surface area, RTD: root tissue density;同列不同小写字母表示存在显著性差异(P<0.05)
2.2 不同封育年限草地0—20 cm土壤特性
不同土壤指标随封育年限的变化规律有所不同(表3)。与放牧草地相比,封育措施提高草地土壤含水量、有机碳、全氮、全磷、速效磷和硝态氮含量及土壤氮磷比的同时降低土壤碳氮比和微生物碳氮比,且封育措施的影响在封育30 a后达到显著性水平(P<0.05)。封育草地与放牧草地的土壤容重、pH、微生物生物量碳、微生物生物量氮和土壤铵态氮含量均无明显差异(P>0.05)。
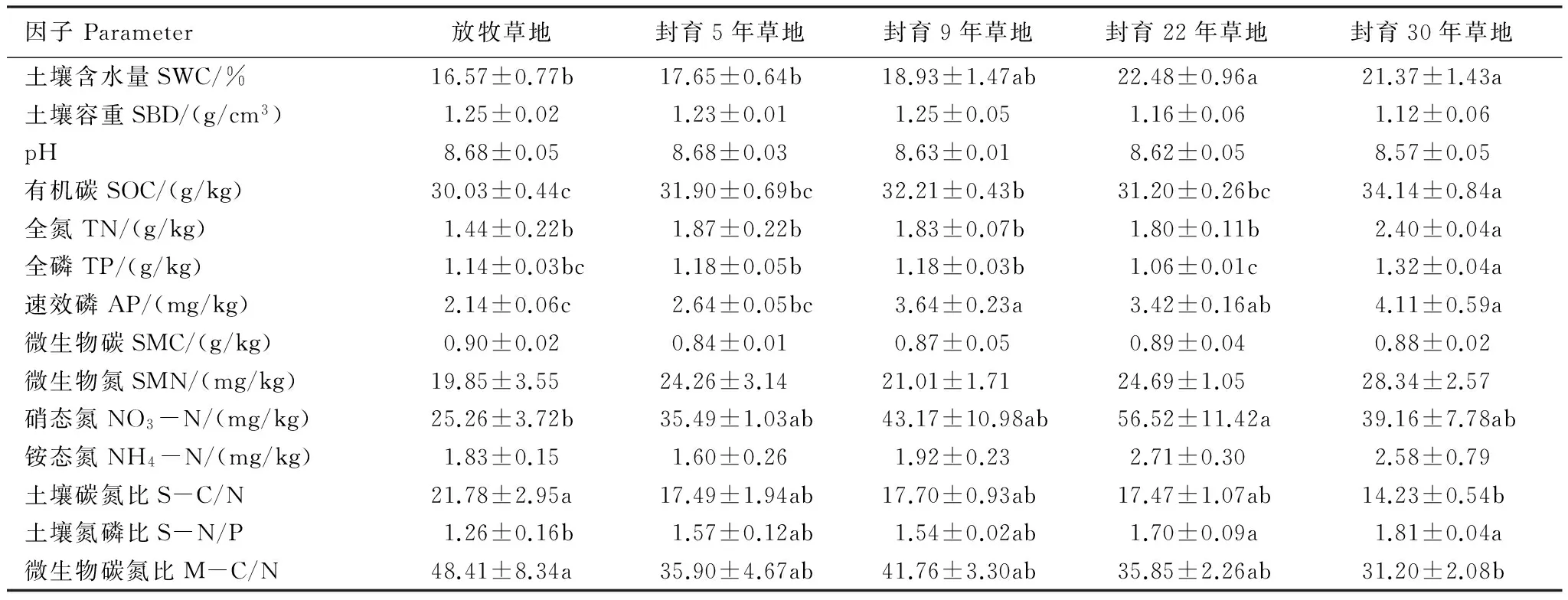
表3 不同封育年限草地0—20cm土壤特性
SWC: soil water content; SBD: soil bulk density; SOC: soil organic carbon; TN: total soil nitrogen; TP: total soil phosphorus; AP: available soil phosphorus; SMC: soil microbial carbon; SMN: soil microbial nitrogen; 同行不同小写字母表示存在显著性差异(P<0.05)
2.3 针茅植物根系特征与土壤特性的关联性分析
针茅植物根系特征与土壤特性之间的RDA分析结果(图4)表明,针茅根系各项指标间(生物量、根长密度、根系面积和根系体积)呈正相关性,且其与土壤全氮含量极显著正相关(P<0.01),与土壤铵态氮显著正相关(P<0.05)。此外,针茅根系特征受土壤含水量和土壤速效磷的正向促进作用,受土壤pH的负向影响。
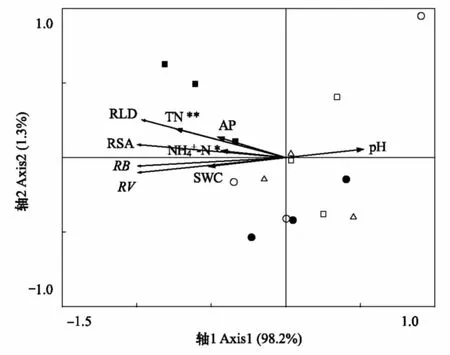
图4 针茅植物根系特征与土壤特性的冗余分析 Fig.4 Redundancy analysis between root traits of Stipa plant and soil properties考虑结果呈现性与查看性,图中仅列出解释作用较大的前5项土壤因子;*和**表示土壤因子对根系特征变异的解释显著性分别在P<0.05和P<0.01水平;○ 为放牧草地样点,□为封育5a草地样点,△为封育9a草地样点,●为封育22a草地样点,■为封育30a草地样点
3 讨论
3.1 封育对针茅根系特征和土壤特性的影响
围栏封育通过排除草食动物的取食作用提高植物地上生产力,进而增加植物输向根系的有机物量,使得根系生物量增加[7,27]。本研究中的针茅植物根系生物量在封育初期呈轻微下降,可能是由于针茅作为适口性优良的牧草,其在草食动物排除后迅速增加了向地上部分的生物量分配比例,以尽快获取地上空间资源和光资源[3,28]。草地长期封育过程中,针茅作为丛生型禾草,拥有庞大和分散的根系,其比根长和比根面积远高于非禾草植物根系[29],且其根系可塑性较高,倾向在养分富集斑块生产更多根系[30],意味着针茅对土壤资源的获取和竞争能力均强于非禾草植物,加之长期封育草地中显著改善的土壤特性,使得针茅根系生物量在长期封育草地中得到显著提高,并伴随根长密度、根表面积和根体积的显著提高。此外,RDA分析结果表明针茅根系与土壤氮资源之间存在显著正关联,封育30 a草地土壤氮资源的显著增加有利于根系各项指标的显著增加,且针茅根系指标的显著增加与其优势种甘青针茅的根系特征密不可分。基于地上植物群落的植被调查结果显示,不同封育年限草地中3种针茅地上生态位存在种间差异,具体表现为随封育年限增加,长芒草生态位宽度呈现“降-升-降”动态变化,并消失于封育30 a样地;大针茅生态位宽度呈“升-降-升”变化规律;甘青针茅仅出现于封育30 a样地,且其生态位宽度小于大针茅[21]。本研究中基于根系调查的物种组成与地上针茅物种组成具有相同性,但针茅根系特征随草地封育年限的波动幅度小于地上部分;同时不同于地上部分,封育30 a草地甘青针茅根系比例高于大针茅,这与3种针茅自身生物学特性有关。
与前人研究结果类似[5, 8],本文结果表明长期封育显著提高了土壤水分和养分含量。土壤含水量的增加主要源于封育后增加的地上植被盖度和地表凋落物对表层土壤水分蒸发的抑制作用。同时凋落物分解过程中向土壤释放C、N等养分,其中土壤生物(土壤线虫、弹尾虫等)在分解初期起主导作用,土壤湿度和土壤微生物则主导后期分解格局[31]。因此,土壤含水量的增加对土壤C、N含量的提高具有促进效应。由于研究土样采于土壤表层(0—20 cm),其水分和养分资源丰富,使得其微生物生物量碳、氮含量未随封育年限而发生明显变化。但他人研究表明,植物可通过有机物输入质量和数量的改变影响土壤真菌群落[32],并通过土壤养分释放和矿化过程影响细菌群落[33],且植物根系生物量的分布格局、根系特征及其对养分的需求均会对微生物群落及其活动产生影响[34-35]。由于土壤氮含量增加幅度超过土壤有机碳和土壤全磷,使得土壤碳氮比显著降低,氮磷比显著增加,同理可知微生物碳氮比降低原因。
3.2 3种针茅更替现象的原因探讨
植被调查结果显示,3种针茅地上生物学特性差异明显,其中长芒草为矮小型株丛,分蘖数量居中,高度最低;大针茅为高大紧密型株丛,分蘖数量最少,高度最高;甘青针茅为大型密集株丛,分蘖数量最多,高度居中[21]。
由于云雾山草原地处半干旱区,长期放牧后的草地存在大量裸露地表,表层土壤水分蒸发强烈,使得水分成为封育初期限制植物生长的环境因子。与大针茅相比,长芒草较小的植株尺寸决定了其较低的土壤水分和养分需求,且自身较高的比根长和比根面积保证长芒草可从土壤中获取足够的养分用于植株生长与繁殖。长芒草较高的根组织密度暗示其较长的根系使用寿命,这无疑降低了长芒草在获取土壤资源时的碳成本。另有研究表明,长芒草幼苗抗旱性强于大针茅幼苗[36];此外,长芒草还可通过叶鞘基部的珠芽方式进行短暂休眠以躲避恶劣环境,上述特征均保障了长芒草在封育初期草地的成功建植和发展。随着封育时间增加,土壤生境得到极大改善,植物间竞争由地下转向地上部分[28]。此时,大针茅植株高度优势使其在优先截获光资源的同时减弱植株矮小的长芒草的光合作用,大针茅植物优势度随封育时间增加而逐渐提高,长芒草则呈衰退趋势,并最终在封育30 a草地消失。在封育30 a草地迅速崛起的甘青针茅可能主要通过不断增加其株丛尺寸以降低大针茅地上部分的遮光影响,同时其较高的根系生物量、比根长和比根面积等指标保障其优先占用土壤资源,以降低大针茅对土壤资源的获取量,进而抑制大针茅植株生长。
除3种针茅自身差异外,广布于封育草地的他种植物如白莲蒿具有强烈化感作用[37-38],其对3种针茅的差异性影响可能对针茅物种更替产生一定推动作用。同时,3种针茅植物生长特性、自身和彼此之间的植物-土壤反馈作用均有待进一步研究,以全面分析3种针茅更替产生的原因,并对现有针茅群落的后续演替方向做出预测。
4 结论
放牧草地封育初期,针茅植物主要进行地上部分生长,故其根系生物量及根系形态特征无明显变化,随封育年限增加,草地土壤水肥条件得到明显改善,使得针茅根系生物量和形态特征得到显著提高。3种针茅更替发生的原因推测如下:长芒草因其较强的耐旱性和较低的水分和养分需求,在放牧草地和封育初期草地的恶劣生长环境成为优势物种,之后随着草地封育进程中土壤水肥条件的改善,大针茅从植物间地上竞争中获利成为优势物种,最后甘青针茅则利用其高生产力特征和植物间根系竞争取代大针茅,有成为长期封育草地针茅群落优势物种的趋势。
[1] Wu G L, Du G Z, Liu Z H, Thirgood S. Effect of fencing and grazing on a Kobresia-dominated meadow in the Qinghai-Tibetan Plateau. Plant and Soil, 2009, 319(1/2): 115- 126.
[2] 陈佐忠, 汪诗平. 中国典型草原生态系统. 北京: 科学出版社, 2000.
[3] 闫玉春, 唐海萍, 辛晓平, 王旭. 围封对草地的影响研究进展. 生态学报, 2009, 29(9): 5039- 5046.
[4] 何念鹏, 韩兴国, 于贵瑞. 长期封育对不同类型草地碳贮量及其固持速率的影响. 生态学报, 2011, 31(15): 4270- 4276.
[5] Jing Z B, Cheng J M, Su J S, Bai Y, Jin J W. Changes in plant community composition and soil properties under 3-decade grazing exclusion in semiarid grassland. Ecological Engineering, 2014, 64: 171- 178.
[6] 陈芙蓉, 程积民, 刘伟, 朱仁斌, 杨晓梅, 赵新宇, 苏纪帅. 不同干扰对黄土区典型草原物种多样性和生物量的影响. 生态学报, 2013, 33(9): 2856- 2866.
[7] Qiu L P, Wei X R, Zhang X C, Cheng J M. Ecosystem carbon and nitrogen accumulation after grazing exclusion in semiarid grassland. PLoS One, 2013, 8(1): e55433.
[8] 白于, 苏纪帅, 程积民. 黄土区不同封育时期天然草地的根系生物量分布. 草业科学, 2013, 30(11): 1824- 1830.
[9] 邹雨坤, 张静妮, 陈秀蓉, 杨殿林, 张天瑞, 文都日乐, 王丽. 三种利用方式对羊草草原土壤氨氧化细菌群落结构的影响. 生态学报, 2012, 32(10): 3118- 3127.
[10] Jing Z B, Cheng J M, Jin J W, Su J S, Bai Y. Revegetation as an efficient means of improving the diversity and abundance of soil eukaryotes in the Loess Plateau of China. Ecological Engineering, 2014, 70: 169- 174.
[11] 赵菲, 谢应忠, 马红彬, 沈艳. 封育对典型草原植物群落物种多样性及土壤有机质的影响. 草业科学, 2011, 28(6): 887- 891.
[12] 李俊琴. 多年封育对半干旱区草场植物多样性的影响. 水土保持研究, 2015, 22(6): 224- 228.
[13] Pärtel M, Hiiesalu I, Öpik M, Wilson S D. Below-ground plant species richness: new insights from DNA-based methods. Functional Ecology, 2012, 26(4): 775- 782.
[14] Gross K L, Peters A, Pregitzer K S. Fine root growth and demographic responses to nutrient patches in four old-field plant species. Oecologia, 1993, 95(1): 61- 64.
[15] Fransen B, de Kroon H, Berendse F. Root morphological plasticity and nutrient acquisition of perennial grass species from habitats of different nutrient availability. Oecologia, 1998, 115(3): 351- 358.
[16] Jackson R B, Caldwell M M. The scale of nutrient heterogeneity around individual plants and its quantification with geostatistics. Ecology, 1993, 74(2): 612- 614.
[17] Jackson R B, Caldwell M M. Geostatistical patterns of soil heterogeneity around individual perennial plants. Journal of Ecology, 1993, 81(4): 683- 692.
[18] Hutchings M J, de Kroon H. Foraging in plants: the role of morphological plasticity in resource acquisition. Advances in Ecological Research, 1994, 25: 159- 238.
[19] Li H B, Ma Q H, Li H G, Zhang F S, Rengel Z, Shen J B. Root morphological responses to localized nutrient supply differ among crop species with contrasting root traits. Plant and Soil, 2014, 376(1/2): 151- 163.
[20] Claassen V P, Marler M. Annual and perennial grass growth on nitrogen-depleted decomposed granite. Restoration Ecology, 1998, 6(2): 175- 180.
[21] 史晓晓, 程积民, 于飞, 朱仁斌, 赵新宇. 云雾山天然草地30年恢复演替过程中优势草种生态位动态. 草地学报, 2014, 22(4): 677- 684.
[22] 朱仁斌, 程积民, 刘永进, 李维军, 魏琳. 宁夏云雾山自然保护区种子植物区系研究. 草地学报, 2012, 20(3): 439- 443.
[23] Leva P E, Aguiar M R, Oesterheld M. Underground ecology in a Patagonian steppe: root traits permit identification of graminoid species and classification into functional types. Journal of Arid Environments, 2009, 73(4/5): 428- 434.
[24] Pohl M, Stroude R, Buttler A, Rixen C. Functional traits and root morphology of alpine plants. Annals of Botany, 2011, 108(3): 537- 545.
[25] Brookes P C, Landman A, Pruden G, Jenkinson D S. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil. Soil Biology and Biochemistry, 1985, 17(6): 837- 842.
[26] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C. Soil Biology and Biochemistry, 1987, 19(6): 703- 707.
[27] Liu Y S, Pan Q M, Liu H D, Bai Y F, Simmons M, Dittert K, Han X G. Plant responses following grazing removal at different stocking rates in an Inner Mongolia grassland ecosystem. Plant and Soil, 2011, 340(1/2): 199- 213.
[28] Pan Q M, Bai Y F, Wu J G, Han X G. Hierarchical plant responses and diversity loss after nitrogen addition: testing three functionally-based hypotheses in the Inner Mongolia grassland. PLoS One, 2011, 6(5): e20078.
[29] Glimskär A. Estimates of root system topology of five plant species grown at steady-state nutrition. Plant and Soil, 2000, 227(1/2): 249- 256.
[30] Fransen B, Blijjenberg J, de Kroon H. Root morphological and physiological plasticity of perennial grass species and the exploitation of spatial and temporal heterogeneous nutrient patches. Plant and Soil, 1999, 211(2): 179- 189.
[31] García-Palacios P, Shaw E A, Wall D H, Hättenschwiler S. Temporal dynamics of biotic and abiotic drivers of litter decomposition. Ecology Letters, 2016, 19(5): 554- 563.
[32] Lange M, Habekost M, Eisenhauer N, Roscher C, Bessler H, Engels C, Oelmann Y, Scheu S, Wilcke W, Schulze E D, Gleixner G. Biotic and abiotic properties mediating plant diversity effects on soil microbial communities in an experimental grassland. PLoS One, 2014, 9(5): e96182.
[33] Fornara D A, Tilman D, Hobbie S E. Linkages between plant functional composition, fine root processes and potential soil N mineralization rates. Journal of Ecology, 2009, 97(1): 48- 56.
[34] Legay N, Grassein F, Binet M N, Arnoldi C, Personeni E, Perigon S, Poly F, Pommier T, Puissant J, Clément J C, Lavorel S, Mouhamadou B. Plant species identities and fertilization influence on arbuscular mycorrhizal fungal colonisation and soil bacterial activities. Applied Soil Ecology, 2016, 98: 132- 139.
[35] Okubo A, Matsusaka M, Sugiyama S. Impacts of root symbiotic associations on interspecific variation in sugar exudation rates and rhizosphere microbial communities: a comparison among four plant families. Plant and Soil, 2016, 399(1/2): 345- 356.
[36] 于鲁宁, 程积民, 李媛, 陈芙蓉, 魏琳. 干旱胁迫对3种针茅种子萌发期抗旱性影响的研究. 水土保持通报, 2012, 32(3): 33- 36, 61- 61.
[37] 王辉, 谢永生, 杨亚利, 揣峻峰. 云雾山铁杆蒿茎叶浸提液对封育草地四种优势植物的化感效应. 生态学报, 2011, 31(20): 6013- 6021.
[38] 王辉, 谢永生, 程积民, 摄晓燕. 基于生态位理论的典型草原铁杆蒿种群化感作用. 应用生态学报, 2012, 23(3): 673- 678.
RootpatternofStipaplantsinsemiaridgrasslandafterlong-termgrazingexclusion
SU Jishuai1, ZHAO Jie1, JING Guanghua2, WEI Lin2, LIU Jian1, CHENG Jimin1,2,3,*, ZHANG Jin′e4
1CollegeofAnimalScienceandTechnology,NorthwestAgricultureandForestryUniversity,Yangling712100,China2InstituteofSoilandWaterConservation,ChineseAcademyofSciencesandMinistryofWaterResources,Yangling712100,China3InstituteofSoilandWaterConservation,NorthwestAgricultureandForestryUniversity,Yangling712100,China4LandscapeAdministrationBureauinGuyuanCity,Guyuan756000,China
We selected five grassland sites with different grazing exclusion times (0, 5, 9, 22, and 30 years) on Yunwu Mountain as the study sites, where the roots ofStipaplants in the 0—30 cm soil layer and soil of the 0—20 cm soil layer were collected. Roots were washed and identified to the species level based on attached aboveground parts and root color, texture, and branching. Root samples of the same species were scanned using an Epson Scanner to obtain images for analysis of root morphological traits using WinRhizoPro software. Root length, surface area, and volume were analyzed at 0.1 mm intervals in root diameter, the measurements of which could be used for calculations of specific root length (SRL), specific root surface area (SRS), and root tissue density (RTD). Soil samples were analyzed to determine soil moisture, soil bulk density, soil pH, soil organic carbon, total soil nitrogen, total soil phosphorous, available soil nitrogen, available soil phosphorus, microbial biomass carbon, and microbial biomass nitrogen. One-way analysis of variance was conducted to determine the effect of grazing exclusion time onStiparoot traits, and to determine differences in the roots of differentStipaspecies. Redundancy analysis was conducted to determine soil variables that best explain the variations inStiparoot traits. The main results were as follows. (1) The root biomass, root length density, root surface area, and root volume ofStipaplants showed a slight decrease at the beginning of grazing exclusion, but thereafter gradually increased and showed significant increases in grassland with grazing exclusion for 30 years. (2) All of the root trait indexes showed similar species compositional changes with grazing exclusion time. Specifically, the proportion ofStipabungeanawas the highest in grazed grassland, then gradually declined with grazing exclusion time, and disappeared after 30 years′ grazing exclusion; the proportion ofStipagrandisinitially increased, peaked in grasslands after 20 years′ grazing exclusion, and then sharply decreased to the initial status; andStipaprzewalskyiappeared only in grassland with 30 years′ grazing exclusion and became the dominantStipaspecies. (3) Compared with the roots ofS.grandis, the roots ofS.bungeanaandS.przewalskyiwere thinner and had higher SRL and SRS, mainly resulting from a larger proportion of root traits in the 0—0.6 mm root diameter class. Besides, root tissue density ofS.bungeanawas higher than that ofS.grandisandS.przewalskyi.(4) Long-term grazing exclusion significantly increased soil water content, total soil nitrogen, total soil phosphorus, soil nitrate nitrogen, and available soil phosphorus, and showed limited impacts on soil bulk density, soil pH, soil ammonium nitrogen, soil microbial biomass carbon, and soil microbial biomass nitrogen. With significantly increased total soil nitrogen, long-term grazing exclusion significantly decreased the ratio of soil carbon to nitrogen and significantly increased the ratio of soil nitrogen to phosphorus. (5) Redundancy analysis showed positive correlations among root biomass, root length density, root surface area, and root volume, and total soil nitrogen and ammonium nitrogen were significant factors explaining variations in the root traits ofStipaplants after grazing exclusion. Furthermore, root traits were positively affected by soil water content and available soil phosphorus, and were negatively affected by soil pH. In conclusion, inherent differences in the root traits of threeStipaspecies and changes in soil properties collectively drove the root trait patterns ofStipaplants in semiarid grassland after long-term grazing exclusion in this area.
grazing exclusion;Stipaplants; root morphological trait; species compositional pattern
国家“十三五”重点研发计划(2016YFC0500704);中国科学院野外站联盟项目(KFJ-SW-YW028-07);中国科学院战略性先导科技专项(XDA05050202);国家自然科学基金重点项目(41230852);中国科学院重点部署项目(KJZD-EW-TZ-G10);农业部“现代农业产业技术体系建设专项资金资助”(CARS- 35- 40)
2016- 06- 26; < class="emphasis_bold">网络出版日期
日期:2017- 05- 27
*通讯作者Corresponding author.E-mail: gyzcjm@ms.iswc.ac.cn
10.5846/stxb201606261251
苏纪帅,赵洁,井光花,魏琳,刘建,程积民,张金娥.半干旱草地长期封育进程中针茅植物根系格局变化特征.生态学报,2017,37(19):6571- 6580.
Su J S, Zhao J, Jing G H, Wei L, Liu J, Cheng J M, Zhang J E.Root pattern ofStipaplants in semiarid grassland after long-term grazing exclusion.Acta Ecologica Sinica,2017,37(19):6571- 6580.
